Этилат натрия

| |

| |
| Имена | |
|---|---|
| Другие имена
Этанолат натрия, этилат натрия ( устар .)
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 3593646 | |
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.004.989 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| CH3CH2CH3CH2ONa | |
| Молярная масса | 68.051 g·mol −1 |
| Появление | Белый гигроскопичный порошок. |
| Плотность | 0,868 г/см 3 (из 21%-ного раствора в этаноле) |
| Температура плавления | 260 ° С (500 ° F; 533 К) |
| Реагирует | |
| Растворимость | этанол и метанол |
| Кислотность ( pKa ) | 15.5 [1] |
| Опасности | |
| СГС Маркировка : | |
  
| |
| Опасность | |
| Х228 , Х251 , Х302 , Х314 | |
| P210 , P235+P410 , P240 , P241 , P260 , P264 , P270 , P280 , P301+P312 , P301+P330+P331 , P303+P361+P353 , P304 +P340 , P305+P351+P338 , П310 , П321 , П330 , П363 , П370+П378 , П405 , П407 , П413 , П420 , П501 | |
| NFPA 704 (огненный алмаз) | |
| Паспорт безопасности (SDS) | Оксфордский паспорт безопасности материалов |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Этилат натрия, также называемый этанолятом натрия , представляет собой ионное органическое соединение с формулой CH3CH2ONa CH2ONa, C 2 H 5 O Na или NaOEt (Et = этил ). Это белое твердое вещество, хотя нечистые образцы кажутся желтыми или коричневыми. Он растворяется в полярных растворителях, таких как этанол . Обычно его используют в качестве прочной основы . [2]
Подготовка
[ редактировать ]Сообщалось о нескольких процедурах получения безводного твердого вещества. Вместо этого материал обычно готовят в растворе этанола. Он коммерчески доступен и в виде раствора в этаноле. Его легко получить в лаборатории обработкой металлического натрия абсолютным этанолом : [3]
- 2 CH 3 CH 2 OH + 2 Na → 2 CH 3 CH 2 ONa + H 2
Реакция гидроксида натрия с безводным этанолом страдает от неполного превращения в этоксид, но все же может привести к образованию сухого NaOEt путем осаждения ацетоном. [4] или путем сушки с использованием дополнительного количества NaOH. [5] .
Структура
[ редактировать ]Кристаллическая структура этоксида натрия установлена методом рентгеновской кристаллографии . Он состоит из слоев чередующихся Уже + и ТО − центры с неупорядоченными этильными группами, покрывающими верхнюю и нижнюю часть каждого слоя. Слои этила укладываются друг к другу, образуя пластинчатую структуру . Реакция натрия и этанола иногда образует другие продукты, например дисольват. СН 3 СН 2 ОНa·2 СН 3 СН 2 ОН . Определена его кристаллическая структура, хотя строение других фаз в Система CH 3 CH 2 ONa/CH 3 CH 2 OH остается неизвестной. [6]
 |
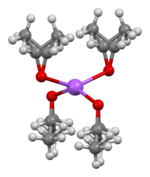 |

|
| шариковая модель укладки слоев в кристаллической структуре CH3CH2CH3CH2ONa |
координационная геометрия Na | координационная геометрия в точке O |
Реакции
[ редактировать ]Этилат натрия обычно используется в качестве основания при конденсации Кляйзена. [7] и синтез малонового эфира . [8] Этилат натрия может либо депротонировать α-положение молекулы сложного эфира , образуя енолят , либо молекула сложного эфира может подвергаться нуклеофильному замещению, называемому переэтерификацией . Если исходным материалом является этиловый эфир, переэтерификация не имеет значения, поскольку продукт идентичен исходному материалу. На практике сольватирующая смесь спирт/алкоксид должна соответствовать алкоксикомпонентам реагирующих сложных эфиров, чтобы минимизировать количество различных продуктов.
Многие алкоксиды получают метатезисом солей из этоксида натрия.
Стабильность
[ редактировать ]Этилат натрия склонен к реакции как с водой, так и с углекислым газом в воздухе . [9] Это приводит к деградации хранящихся образцов с течением времени, даже в твердой форме. Внешний вид разложившихся образцов может быть неочевидным, но образцы этоксида натрия при хранении постепенно темнеют. Сообщалось, что даже недавно полученные коммерческие партии этилата натрия демонстрируют различные уровни разложения и являются основным источником невоспроизводимости при использовании в реакциях Сузуки . [9]
-
Новая бутылка этоксида натрия от Sigma-Aldrich.
-
Только что открытый контейнер с этоксидом натрия демонстрирует изменение цвета, вызванное разложением при хранении в присутствии кислорода и углекислого газа.
Во влажном воздухе, CH 3 CH 2 ONa быстро гидролизуется до гидроксида натрия (NaOH). Преобразование не очевидно и типичные образцы CH 3 CH 2 ONa загрязнены NaOH.
В свободном от влаги воздухе твердый этоксид натрия может образовывать этилкарбонат натрия в результате фиксации углекислого газа из воздуха. Дальнейшие реакции приводят к разложению на множество других солей натрия и диэтилового эфира . [9]
Эту нестабильность можно предотвратить, храня этилат натрия в инертной атмосфере (например, Н2 . )
Безопасность
[ редактировать ]Этилат натрия является сильным основанием и поэтому вызывает коррозию.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ константа диссоциации этанола, указанная в 87-м издании Справочника CRC по химии и физике.
- ^ К. Синклер Уитакер; Д. Тодд Уитакер (2001). «Этилоксид натрия». В Шаретте, Андре Б. (ред.). Энциклопедия реагентов для органического синтеза . Джон Уайли и сыновья . дои : 10.1002/047084289X.rs070 . ISBN 978-0-470-84289-8 .
- ^ К.С. Марвел, Э.Э. Дрегер (1926). «Этилацетопируват». Органические синтезы . 6 : 40. дои : 10.15227/orgsyn.006.0040 .
- ^ US1978647A , Олсон, Эдгар Т. и Твининг, Ральф Х., «Способ получения алкоголятов щелочных металлов», выпущено 30 октября 1934 г.
- ^ US2796443A , Мейер, Роберт Х. и Джонсон, Артур К., «Способ получения безводных алкоголятов щелочных металлов», выпущен 18 июня 1957 г.
- ^ М. Беске; Л. Тэпмейер; М.Ю. Шмидт (2020). «Кристаллическая структура этоксида натрия (C 2 H 5 ONa), раскрытая через 180 лет». хим. Коммун. 56 (24): 3520–3523. дои : 10.1039/C9CC08907A . ПМИД 32101200 . S2CID 211523921 .
- ^ Клейден, Джонатан; Гривз, Ник; Уоррен, Стюарт (2012). Органическая химия (2-е изд.). Нью-Йорк: Издательство Оксфордского университета. п. 645. ИСБН 978-0-19-927029-3 .
- ^ Ван, Зеронг (15 сентября 2010 г.). Комплексные органические реакции и реагенты . Джон Уайли. стр. 1811–1815. ISBN 978-0-471-70450-8 .
- ^ Перейти обратно: а б с Ветман, Роберт; Дероса, Джозеф; Тран, Ван; Кан, Тэхо; Аполинар, Омар; Авраам, Ануджи; Кляйнманс, Роман; Вишневский, Стивен; Кумбс, Джон; Энгл, Кири (19 августа 2020 г.), Недооцененный источник проблем воспроизводимости при кросс-сочетании: твердофазное разложение первичных алкоксидов натрия на воздухе , Американское химическое общество (ACS), doi : 10.26434/chemrxiv.12818234. v1 , S2CID 242420220


