Теллурид водорода
 Жидкий теллурид водорода в пробирке | |
 | |
 Земля, ты Водород, Н | |
| Имена | |
|---|---|
| Название ИЮПАК теллурид водорода | |
| Другие имена гидротеллуровая кислота теллейн гидрид теллура теллурид диводорода теллуран | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.073 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Н 2 Те | |
| Молярная масса | 129.6158 g mol −1 |
| Появление | бесцветный газ |
| Запах | Острый, напоминает гниющий чеснок или лук-порей. |
| Плотность | 3,310 г/л, газ 2,57 г/см 3 (−20 °C, жидкость) |
| Температура плавления | -49 ° C (-56 ° F; 224 К) [1] |
| Точка кипения | -2,2 ° C (28,0 ° F; 270,9 К) (нестабильно выше -2 ° C) |
| 0,70 г/100 мл | |
| Кислотность ( pKa ) | 2.6 |
| Конъюгатная кислота | Теллуроний |
| Сопряженная база | Теллурайд |
| Структура | |
| согнутый | |
| Термохимия | |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | 0,7684 кДж/г |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | токсичный |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другие анионы | Н 2 О Ч 2 С Н 2 Се Н 2 По |
Другие катионы | Na2На2Те Ag 2 Te К 2 Те рубля 2 Те Чт 2 Те |
Родственные соединения | теллуровая кислота теллуристая кислота стибин |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
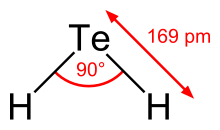
Теллурид водорода — неорганическое соединение формулы H 2 Te . и Халькогенид водорода простейший гидрид теллура — бесцветный газ. Хотя газ нестабилен в окружающем воздухе, он может существовать достаточно долго, чтобы его можно было легко обнаружить по запаху гниющего чеснока при чрезвычайно низких концентрациях; или отвратительным запахом гниющего лука-порея в несколько более высоких концентрациях. Большинство соединений со связями Te–H ( теллуролы ) нестабильны по отношению к потере H 2 . H 2 Te химически и структурно похож на селеноводород , оба являются кислыми. Угол H–Te–H составляет около 90°. Летучие соединения теллура часто имеют неприятный запах, напоминающий гниющий лук-порей или чеснок. [2]
Синтез
[ редактировать ]Разработаны электролитические методы. [3]
H 2 Te можно также получить гидролизом теллуридных производных электроположительных металлов. [4] Типичным гидролизом является гидролиз теллурида алюминия :
- Al 2 Te 3 + 6 H 2 O → 2 Al(OH) 3 + 3 H 2 Te
Другие соли Te 2− такие как MgTe и теллурид натрия, также можно использовать. Na 2 Te можно получить реакцией Na и Te в безводном аммиаке . [5] Промежуточное соединение гидролиза HTe −
, также можно выделить в виде солей. NaHTe можно получить восстановлением теллура NaBH.
4 . [5]
Теллурид водорода невозможно эффективно получить из входящих в него элементов, в отличие от H 2 Se. [3]
Характеристики
[ редактировать ]ЧАС
2 Te — эндотермическое соединение, разлагающееся на элементы при комнатной температуре:
- ЧАС
2 Те → Ч
2 +
Свет ускоряет разложение. Он нестабилен на воздухе, окисляется до воды и элементарного теллура: [6]
- 2 часа
2 Те + О
2 → 2 ч
2 О + 2 Те
Она почти такая же кислая, как фосфорная кислота ( K a = 8,1×10 −3 ), имеющий K значение примерно 2,3×10 −3 . [6] Реагирует со многими металлами с образованием теллуридов. [7]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Лиде, Дэвид Р., изд. (2006). Справочник CRC по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press . ISBN 0-8493-0487-3 .
- ^ Гринвуд, Нью-Йорк; и Эрншоу, А. (1997). Химия элементов (2-е изд.), Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4 .
- ^ Перейти обратно: а б Ф. Фехер, «Теллурид водорода» в Справочнике по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, Нью-Йорк. Том. 1. С. 438.
- ^ Шрайвер, Аткинс. Неорганическая химия, пятое издание. WH Freeman and Company, Нью-Йорк, 2010 г.; стр. 407.
- ^ Перейти обратно: а б Никола Петрьяни; Хелио А. Стефани (2007). Теллур в органическом синтезе . Лучшие синтетические методы (2-е изд.). Академическая пресса. п. 6. ISBN 978-0-08-045310-1 .
- ^ Перейти обратно: а б Эгон Виберг; Арнольд Фредерик Холлеман (2001). Нильс Виберг (ред.). Неорганическая химия . Перевод Мэри Иглсон. Академическая пресса. п. 589. ИСБН 0-12-352651-5 .
- ^ Генри Энфилд Роско; Карл Шорлеммер (1878). Трактат по химии . Том. 1. Эпплтон. стр. 367–368.
