Экскаваторы
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Экскаваторы | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.159.079 |
ПабХим CID |
|
Панель управления CompTox ( EPA ) | |
| Характеристики | |
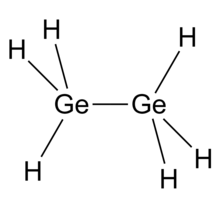
| Ге 2 Н 6 | |
| Молярная масса | 151.328 g/mol |
| Появление | Бесцветный газ |
| Плотность | 1,98 кг/м 3 [1] |
| Температура плавления | -109 ° C (-164 ° F; 164 К) |
| Точка кипения | 29 ° C (84 ° F; 302 К) |
| нерастворимый | |
| Опасности | |
| СГС Маркировка : | |
   | |
| Опасность | |
| Х220 , Х302 , Х312 , Х315 , Х319 , Х330 , Х335 | |
| P210 , P260 , P261 , P264 , P270 , P271 , P280 , P284 , P301+P312 , P302+P352 , P304+P340 , P305+P351+P338 , P310 , P312 , P320 , P321 , П330 22 , П332 , +П313 , P337+P313 , P362 , P363 , P377 , P381 , P403 , P403+P233 , P405 , P501 | |
| Родственные соединения | |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Дигерман представляет собой неорганическое соединение с химической формулой Ge 2 H 6 . Один из немногих гидридов германия , представляет собой бесцветную жидкость. Его молекулярная геометрия аналогична этану . [2]
Синтез
[ редактировать ]Дигермейн был впервые синтезирован и исследован в 1924 году Деннисом, Кори и Муром. Их метод включает гидролиз германида магния с помощью соляной кислоты. [3] Многие свойства дигерманов и тригерманов GeH 3 GeH 2 GeH 3 были определены в следующем десятилетии с помощью электронографических исследований. [4] Дальнейшие исследования этого соединения включали изучение различных реакций, таких как пиролиз и окисление.
Дигерман получают вместе с германом восстановлением диоксида германия борогидридом натрия . Хотя основной продукт является германом , в дополнение к следам тригермана образуется поддающееся количественному определению количество дигермана. [5] Он также возникает при гидролизе сплавов магния и германия. [6]
Реакции
[ редактировать ]В реакциях дигермана наблюдаются некоторые различия между аналогичными соединениями элементов 14 группы углерода и кремния. Однако некоторые сходства все же наблюдаются, особенно в отношении реакций пиролиза.
Окисление . дигермана происходит при более низких температурах, чем моногермана Было показано, что продукт реакции, оксид германия, в свою очередь действует как катализатор реакции. Это иллюстрирует фундаментальное различие между германием и другими элементами 14-й группы, углеродом и кремнием (диоксид углерода и диоксид кремния не обладают одинаковыми каталитическими свойствами). [7]
- 2 Ge 2 H 6 + 7 O 2 → 4 GeO 2 + 6 H 2 O
В жидком аммиаке дигерман диспропорционируется . Аммиак действует как слабоосновный катализатор. Продуктами реакции являются водород, герман и твердый полимерный гидрид германия. [8]
пиролиз Предполагается, что дигермана состоит из нескольких стадий:
- Ge 2 H 6 → 2 GeH 3
- GeH 3 + Ge 2 H 6 → GeH 4 + Ge 2 H 5
- Ge 2 H 5 → GeH 2 + GeH 3
- GeH 2 → Ge + H 2
- 2 GeH 2 → GeH 4 + Ge
- n GeH 2 → (GeH 2 ) n
Было обнаружено, что этот пиролиз более эндотермичен, чем пиролиз дисилана. Эта разница объясняется большей прочностью связи Ge-H по сравнению со связью Si-H. Как видно из последней реакции описанного выше механизма, пиролиз дигермана может индуцировать полимеризацию GeH 2 , где Группа GeH 3 действует как распространитель цепи, и выделяется газообразный молекулярный водород. [9] Дегидрирование дигермана на золоте приводит к образованию германиевых нанопроволок . [10]
Дигермейн является предшественником GeH 3 -GH 2 -E-CF 3 , где E представляет собой либо серу , либо селен . Эти трифторметилтио ( -S-CF 3 ) и трифторметилселено ( Производные −Se−CF 3 ) обладают заметно более высокой термической стабильностью, чем сам дигерман. [11]
Приложения
[ редактировать ]Digermane имеет ограниченное количество применений; Герман сам по себе является предпочтительным летучим гидридом германия. Как правило, дигерман в основном используется в качестве предшественника германия для использования в различных приложениях. Дигерман можно использовать для осаждения Ge-содержащих полупроводников методом химического осаждения из паровой фазы . [12]
Ссылки
[ редактировать ]- ^ Хейнс, Уильям М., изд. (2016). Справочник CRC по химии и физике (97-е изд.). Бока-Ратон, Флорида: CRC Press . стр. 4–61. ISBN 9781498754293 .
- ^ Полинг, Лайнус; Лаубенгайер, AW; Хоард, Дж. Л. (1938). «Электронографическое исследование дигерманов и тригерманов». Журнал Американского химического общества . 60 (7): 1605–1607. дои : 10.1021/ja01274a024 .
- ^ Деннис, LM; Кори, РБ; Мур, RW (1924). «Германий. VII. Гидриды германия». Дж. Ам. хим. Соц . 46 (3): 657–674. дои : 10.1021/ja01668a015 .
- ^ Полинг, Л.; Лаубенгайер, AW; Хоард, Дж. Л. (1938). «Электронографическое исследование дигермана и тригермана». Дж. Ам. хим. Соц . 60 (7): 1605–1607. дои : 10.1021/ja01274a024 .
- ^ Джолли, Уильям Л.; Дрейк, Джон Э. (1963). Гидриды германия, олова, мышьяка и сурьмы . Неорганические синтезы. Том. 7. С. 34–44. дои : 10.1002/9780470132388.ch10 . ISBN 9780470132388 . S2CID 227343469 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Эмелеус, HJ; Гарднер, Э.Р. «Окисление моногермана и дигермана». Дж. Хим. Соц . 1938 : 1900–1909. дои : 10.1039/jr9380001900 .
- ^ Дрейфус, Р.М.; Джолли, WL (1968). «Диспропорционирование дигермана в жидком аммиаке» . Неорганическая химия . 7 (12): 2645–2646. дои : 10.1021/ic50070a037 .
- ^ Джонсон, Огайо (1951). «Германцы и их органопроизводные». хим. Преподобный . 48 (2): 259–297. дои : 10.1021/cr60150a003 . ПМИД 24540662 .
- ^ Гамальский, А.Д.; Терсофф, Дж.; Шарма, Р.; Дукати, К. ; Хофманн, С. (2010). «Образование метастабильного жидкого катализатора во время субэвтектического роста германиевых нанопроволок». Нано Летт . 10 (8): 2972–2976. Бибкод : 2010NanoL..10.2972G . дои : 10.1021/nl101349e . ПМИД 20608714 .
- ^ Холмс-Смит, доктор медицинских наук; Стобарт, СР (1979). «Трифторметилтио и трифторметилселенопроизводные германа и дигермана». Неорг. Хим . 18 (3): 538–543. дои : 10.1021/ic50193a002 .
- ^ Се, Дж.; Чизмашья, АВГ; Толле, Дж.; Д'Коста, VR; Менендес, Дж.; Коувентакис, Дж. (2010). «Синтез, область стабильности и фундаментальные свойства полупроводников Si-Ge-Sn, выращенных непосредственно на платформах Si (100) и Ge (100)». Химия материалов . 22 (12): 3779–3789. дои : 10.1021/см100915q .