Гидрид магния
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гидрид магния | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.028.824 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
| Характеристики | |
| МгХ 2 | |
| Молярная масса | 26.3209 g/mol |
| Появление | белые кристаллы |
| Плотность | 1,45 г/см 3 |
| Температура плавления | 327 ° C (621 ° F; 600 К) разлагается. |
| разлагается | |
| Растворимость | нерастворим в эфире |
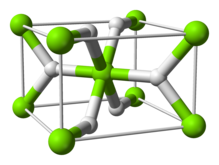
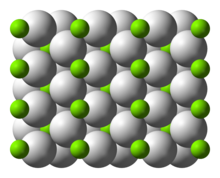
| Структура | |
| четырехугольный | |
| Термохимия | |
Теплоемкость ( С ) | 35,4 Дж/моль К |
Стандартный моляр энтропия ( S ⦵ 298 ) | 31,1 Дж/моль К |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -75,2 кДж/моль |
Свободная энергия Гиббса (Δ f G ⦵ ) | -35,9 кДж/моль |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | пирофорный [1] |
| Родственные соединения | |
Другие катионы | Гидрид бериллия Гидрид кальция Гидрид стронция Гидрид бария |
| Моногидрид магния Mg 4 H 6 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гидрид магния – химическое соединение с молекулярной формулой MgH 2 . Он содержит 7,66% по массе водорода и был изучен как потенциальная среда для хранения водорода. [2]
Подготовка
[ редактировать ]В 1951 году впервые сообщалось о получении из элементов прямого гидрирования металлического Mg при высоком давлении и температуре (200 атмосфер, 500 °C) с MgI 2 : катализатором [3]
- Mg + H2 → MgH2
производство при более низкой температуре из Mg и H 2 с использованием нанокристаллического Mg, полученного в шаровых мельницах . Было исследовано [4] Другие препараты включают:
- гидрирование антрацена магния в мягких условиях: [5]
- Mg(антрацен) + H2 → MgH2
- реакция диэтилмагния с алюмогидридом лития [6]
- продукт комплексного MgH 2 , например MgH 2 ·THF, в результате реакции фенилсилана и дибутилмагния в эфирных или углеводородных растворителях в присутствии THF или TMEDA в качестве лиганда. [1]
Структура и связь
[ редактировать ]Форма α-MgH 2 при комнатной температуре имеет рутиловую структуру. [7] Существует как минимум четыре формы высокого давления: γ-MgH 2 со α-PbO 2 , структурой [8] кубический β-MgH 2 Pa-3 с пространственной группой , [9] ромбический HP1 с Pbc2 1 и ромбический HP2 с пространственной группой Pnma. пространственной группой [10] нестехиометрический MgH (2-δ) , но, по-видимому, он существует только для очень маленьких частиц. Кроме того , был охарактеризован [11]
(Объемный MgH 2 по существу стехиометричен, поскольку он может вмещать только очень низкие концентрации вакансий H [12] ).
Связь в рутильной форме иногда описывается как частично ковалентная по природе, а не чисто ионная; [13] Определение плотности заряда методом синхротронной рентгеновской дифракции показывает, что атом магния полностью ионизирован и имеет сферическую форму, а гидрид-ион удлинен. [14] Молекулярные формы гидрида магния, MgH, MgH 2 , Mg 2 H, Mg 2 H 2 , Mg 2 H 3 и Mg 2 H 4 , идентифицированные по их колебательным спектрам, были обнаружены в матрично изолированных образцах при температуре ниже 10 К, образовавшихся после лазерная абляция магния в присутствии водорода. [15] Молекула Mg 2 H 4 имеет мостиковую структуру, аналогичную димерному гидриду алюминия Al 2 H 6 . [15]
Реакции
[ редактировать ]MgH 2 легко реагирует с водой с образованием газообразного водорода:
- MgH 2 + 2 H 2 O → 2 H 2 + Mg(OH) 2
При 287 °C он разлагается с образованием H 2 при давлении 1 бар. [16] Требуемая высокая температура рассматривается как ограничение при использовании MgH 2 в качестве обратимой среды для хранения водорода: [17]
- MgH 2 → Mg + H 2
Ссылки
[ редактировать ]- ^ Jump up to: а б Михальчик, Майкл Дж (1992). «Синтез гидрида магния реакцией фенилсилана и дибутилмагния». Металлоорганические соединения . 11 (6): 2307–2309. дои : 10.1021/om00042a055 .
- ^ Богданович, Борислав (1985). «Каталитический синтез литий- и магнийорганических соединений, а также гидридов лития и магния - применение в органическом синтезе и хранении водорода». Angewandte Chemie International Edition на английском языке . 24 (4): 262–273. дои : 10.1002/anie.198502621 .
- ^ Эгон Виберг; Хайнц Гельцер; Ричард Бауэр (1951). «Синтез гидрида магния из элементов» ( PDF) . Журнал Nature Research B (на немецком языке). 6б :394.
- ^ Залуска, А; Залуски, Л; Стрём-Олсен, Дж. О. (1999). «Нанокристаллический магний для хранения водорода». Журнал сплавов и соединений . 288 (1–2): 217–225. дои : 10.1016/S0925-8388(99)00073-0 .
- ^ Богданович, Борислав; Ляо, Ши Цзянь; Швикарди, Манфред; Сикорский, Питер; Сплитофф, Бернд (1980). «Каталитический синтез гидрида магния в мягких условиях». Международное издание «Прикладная химия» на английском языке . 19 (10): 818. doi : 10.1002/anie.198008181 .
- ^ Барбарас, Гленн Д.; Диллард, Клайд; Финхольт, А.Е.; Вартик, Томас; Вильцбах, К.Э; Шлезингер, HI (1951). «Получение гидридов цинка, кадмия, бериллия, магния и лития с использованием литий-алюминийгидрида1». Журнал Американского химического общества . 73 (10): 4585. doi : 10.1021/ja01154a025 .
- ^ Захариасен, WH; Холли, CE; Стампер, Дж. Ф. (1963). «Нейтронографическое исследование дейтерида магния» . Акта Кристаллографика . 16 (5): 352. дои : 10.1107/S0365110X63000967 .
- ^ Борц, М; Бертевиль, Б; Беттгер, Г; Ивон, К. (1999). «Структура фазы высокого давления γ-MgH2 методом нейтронной порошковой дифракции». Журнал сплавов и соединений . 287 (1–2): L4–L6. дои : 10.1016/S0925-8388(99)00028-6 .
- ^ Ваджистон, П; Равиндран, П; Хаубак, Британская Колумбия; Фьельвог, Х; Кжекшус, А; Фурусет, С; Ханфланд, М. (2006). «Структурная устойчивость и фазовые переходы под давлением в MgH2». Физический обзор B . 73 (22): 224102. Бибкод : 2006PhRvB..73v4102V . дои : 10.1103/PhysRevB.73.224102 .
- ^ Мориваки, Тору; Акахама, Юичи; Кавамура, Харуки; Накано, Сатоши; Такемура, Кеничи (2006). «Структурный фазовый переход MgH2 рутильного типа при высоких давлениях». Журнал Физического общества Японии . 75 (7): 074603. Бибкод : 2006JPSJ...75g4603M . дои : 10.1143/JPSJ.75.074603 .
- ^ Шиммель, Х. Гийс; Юот, Жак; Шапон, Лоран С; Тичелаар, Франс Д; Малдер, Фокко М (2005). «Водородный цикл ниобия и ванадия, катализируемый наноструктурированным магнием». Журнал Американского химического общества . 127 (41): 14348–54. дои : 10.1021/ja051508a . ПМИД 16218629 .
- ^ Грау-Креспо, Р.; К.С. Смит; Т.С. Фишер; НХ де Леу; У. В. Вагмаре (2009). «Термодинамика водородных вакансий в MgH 2 на основе расчетов из первых принципов и великоканонической статистической механики». Физический обзор B . 80 (17): 174117. arXiv : 0910.4331 . Бибкод : 2009PhRvB..80q4117G . дои : 10.1103/PhysRevB.80.174117 . S2CID 32342746 .
- ^ Коттон, Ф. Альберт ; Уилкинсон, Джеффри ; Мурильо, Карлос А.; Бохманн, Манфред (1999), Передовая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Норитаке, Т; Товата, С; Аоки, М; Сено, Ю; Хиросе, Ю; Нишибори, Э; Таката, М; Саката, М (2003). «Измерение плотности заряда в MgH2 методом синхротронной рентгеновской дифракции». Журнал сплавов и соединений . 356–357: 84–86. дои : 10.1016/S0925-8388(03)00104-X .
- ^ Jump up to: а б Ван, Сюэфэн; Эндрюс, Лестер (2004). «Инфракрасные спектры молекул, комплексов гидрида магния и твердого дигидрида магния». Журнал физической химии А. 108 (52): 11511. Бибкод : 2004JPCA..10811511W . дои : 10.1021/jp046410h .
- ^ Маколифф, TR (1980). Водород и энергетика (иллюстрированное изд.). Спрингер. п. 65. ИСБН 978-1-349-02635-7 . Выдержка со страницы 65
- ^ Шлапбах, Луи; Зюттель, Андреас (2001). «Материалы для хранения водорода для мобильных устройств» (PDF) . Природа . 414 (6861): 353–8. Бибкод : 2001Natur.414..353S . дои : 10.1038/35104634 . ПМИД 11713542 . S2CID 3025203 .