Оксалат магния
 | |
| Имена | |
|---|---|
| Название ИЮПАК оксалат магния | |
| Систематическое название ИЮПАК оксалат магния | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.008.121 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ |
|
| Число | 2811 [4] |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| |
| Молярная масса |
|
| Появление | белое твердое вещество [2] |
| Плотность | 2,45 г/см 3 [5] |
| Температура плавления | от 420 до 620 ° C (от 788 до 1148 ° F; от 693 до 893 К) 150 ° C (302 ° F; 423 К) (дигидрат) оба разлагаются. [8] |
| 0,038 г/100 г H 2 O (безводный и дигидрат) [2] | |
Произведение растворимости ( K sp ) | 8.5 × 10 −5 для MgC 22О 4 [7] |
| Растворимость | нерастворим в органических веществах |
| Давление пара | 2.51 × 10 −6 мм рт.ст. [3] |
| Термохимия | |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -1269,0 кДж моль −1 [2] |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Раздражающий |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Непригодный |
| Непригодный | |
| Родственные соединения | |
Родственные соединения | Оксид магния |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
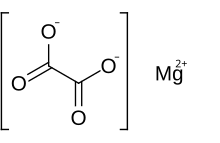
Оксалат магния представляет собой органическое соединение , содержащее магния катион с зарядом 2+, связанный с оксалат- анионом . Он имеет химическую формулу MgC 2 O 4 . Оксалат магния представляет собой белое твердое вещество, которое бывает в двух формах: безводной форме и дигидратной форме, в которой две молекулы воды образуют комплекс со структурой. Обе формы практически нерастворимы в воде и нерастворимы в органических растворах.
Естественное явление
[ редактировать ]Оксалат магния был обнаружен в природе возле мельницы Джонстон, которая расположена недалеко от Инша на северо-востоке Шотландии. Этот природный оксалат магния называется глушинскитом и встречается на границе раздела лишайник/камень на серпентините в виде кремово-белого слоя, смешанного с гифами лишайникового гриба. Сканирующая электронная микрофотография взятых образцов показала, что кристаллы имели пирамидальную структуру как с изогнутыми, так и с полосатыми гранями. Размер этих кристаллов колебался от 2 до 5 мкм. [9]
Синтез и реакции
[ редактировать ]Оксалат магния можно синтезировать путем объединения соли или иона магния с оксалатом.
- мг 2+ + С 2 О 4 2− → MgC 2 O 4
Конкретным примером синтеза может быть смешивание Mg(NO 3 ) 2 и КОН и последующее добавление этого раствора к диметилоксалату (COOCH 3 ) 2 . [10]
При нагревании оксалат магния разлагается. Сначала дигидрат разлагается при 150 ° C до безводной формы.
- MgC 2 O 4 •2H 2 O → MgC 2 O 4 + 2 H 2 O
При дополнительном нагревании безводная форма будет разлагаться на оксид магния и оксиды углерода при температуре от 420 до 620 °C. Сначала окись углерода и карбонат магния образуются . Затем окись углерода окисляется до диоксида углерода , а карбонат магния далее разлагается на оксид магния и диоксид углерода. [8]
- MgC 2 O 4 → MgCO 3 + CO
- СО + 1/2 О 2 → СО 2
- MgCO 3 → MgO + CO 2
Дигидрат оксалата магния также использовался при синтезе наноразмерных частиц оксида магния, которые имеют большее соотношение поверхности к объему, чем традиционно синтезированные частицы, и оптимальны для различных применений, например, в катализе . Используя золь-гель синтез , который включает объединение соли магния, в данном случае оксалата магния, с гелеобразователем, можно получить наноразмерные частицы оксида магния. [11]
Здоровье и безопасность
[ редактировать ]Оксалат магния вызывает раздражение кожи и глаз. При вдыхании он раздражает легкие и слизистые оболочки . Оксалат магния не имеет известных хронических эффектов или канцерогенных эффектов. Оксалат магния негорюч и стабилен, но в условиях пожара выделяет токсичные пары. По данным OSHA, оксалат магния считается опасным. [4] [12]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с «Краткая информация о соединениях оксалатов» . Проверено 16 ноября 2012 г.
- ^ Jump up to: а б с д и ж г Справочник CRC по химии и физике (93-е изд.). 2012–2013 гг.
- ^ Jump up to: а б «Химическая формула оксалата магния, химическая формула CAS 547-66-0» . Проверено 16 ноября 2012 г.
- ^ Jump up to: а б «Оксалат магния» . Архивировано из оригинала 20 февраля 2014 года . Проверено 16 ноября 2012 г.
- ^ Jump up to: а б «Оксалат магния» . Проверено 16 ноября 2012 г.
- ^ «Оксалат магния» . Проверено 16 ноября 2012 г.
- ^ Эйлер. «Таблица K sp : Константы произведения растворимости при температуре около 25 ° C» . chm.uri.edu . Проверено 10 июня 2021 г.
- ^ Jump up to: а б Гадала, Ахмед (1984). «Кинетика разложения гидратированных оксалатов кальция и магния на воздухе». Термохимика Акта . 74 (1–3): 255–272. дои : 10.1016/0040-6031(84)80027-1 .
- ^ Уилсон, М; Д. Джонс; DJ Рассел (1980). «Глушинскит, природный оксалат магния». Минералогический журнал . 43 (331): 837–840. Бибкод : 1980MinM...43..837W . дои : 10.1180/minmag.1980.043.331.02 . S2CID 128418178 .
- ^ Масуда, Ёсио (1987). «Кинетика термической дегидратации дигидрата оксалата магния в проточной атмосфере сухого азота». Дж. Физ. Хим . 91 (26): 6543–6547. дои : 10.1021/j100310a024 .
- ^ Мастули, Мохд; Рошида Русди; Энни Махат; Норазира Саат; Норлида Камарулзаман (2012). «Золь-гель синтез высокостабильного наноразмерного MgO из дигидрата оксалата магния». Передовые исследования материалов . 545 : 137–142. дои : 10.4028/www.scientific.net/amr.545.137 . S2CID 97071145 .
- ^ «Паспорт безопасности материала оксалат магния» . Проверено 16 ноября 2012 г.
