оксалат аммония
| |
| Имена | |
|---|---|
| Название ИЮПАК
оксалат аммония
| |
| Систематическое название ИЮПАК
Этандиоат аммония | |
| Другие имена
оксалат диаммония
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.012.912 |
ПабХим CID
|
|
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
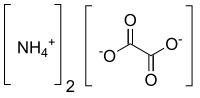
| [NH 4 ] 2 C 2 O 4 | |
| Молярная масса | 124.096 g·mol −1 |
| Появление | Бесцветное или белое кристаллическое вещество |
| Плотность | 1,5 г/см 3 [1] |
| Температура плавления | 70 С (158 Ф, 343,15 К) |
| 5,20 г/(100 мл) (25 °С) [1] | |
| Опасности | |
| СГС Маркировка : | |
| Х302 , Х312 , Х319 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Оксалат аммония представляет собой химическое соединение с химической формулой [ Н Н 4 ] 2 С 2 О 4 . Его формулу часто записывают как (NH 4 ) 2 C 2 O 4 или (КУН 4 ) 2 . Это аммониевая соль кислоты щавелевой . Состоит из катионов аммония ( [НХ 4 ] + ) и оксалат- анионы ( С 2 О 2- 4 ). Строение оксалата аммония: ([NH 4 ] + ) 2 [С 2 О 4 ] 2− . Оксалат аммония иногда поставляется в виде моногидрата ( [NH 4 ] 2 C 2 O 4 ·H 2 O ). В стандартных условиях это бесцветная или белая соль, не имеющая запаха и нелетучая. Встречается во многих растениях и овощах.
Позвоночные
[ редактировать ]Он вырабатывается в организме позвоночных путем метаболизма глиоксиловой кислоты или аскорбиновой кислоты . Он не метаболизируется, но выводится с мочой. [2] Он входит в состав некоторых типов камней в почках . [3] [4] Он также содержится в гуано .
Минералогия
[ редактировать ]Оксаммит – это природная минеральная форма оксалата аммония. Этот минерал чрезвычайно редок. Это органический минерал, полученный из гуано . [5]
Химия
[ редактировать ]Оксалат аммония используется в качестве аналитического реагента и общего восстановителя. [2] Он и другие оксалаты используются в качестве антикоагулянтов для сохранения крови вне организма. [ нужна ссылка ]
Науки о Земле
[ редактировать ]Кислый оксалат аммония (оксалат аммония, подкисленный до pH 3 щавелевой кислотой ) обычно используется в химическом анализе почвы для извлечения железа и алюминия из плохо кристаллических минералов (таких как ферригидрит ), минералов, содержащих железо(II) (таких как магнетит ) и органическое вещество. [6] [ нужна страница ]
Ссылки
[ редактировать ]- ^ Jump up to: а б Джон Рамбл (18 июня 2018 г.). Справочник CRC по химии и физике (99-е изд.). ЦРК Пресс. стр. 4–41. ISBN 978-1138561632 .
- ^ Jump up to: а б Национальный центр биотехнологической информации. База данных соединений PubChem; CID 14213 (по состоянию на 15 ноября 2016 г.).
- ^ Международная фармакопея , стр. 1292, Том 1, Всемирная организация здравоохранения, 2006 г. ISBN 92-4-156301-X .
- ^ Н. Г. Коли, «Сопутствующие науки в работах Голдинга Берда (1814–1854)» , История медицины , выпуск 4, том 13 , октябрь 1969, стр. 372.
- ^ "Дом" . Mindat.org .
- ^ Рэймент, Джордж; Лайонс, Дэвид (2011). Химические методы почвы - Австралазия . Издательство CSIRO. ISBN 9780643101364 .