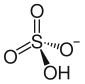
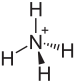бисульфат аммония
| |||
 | |||
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Гидросульфат аммония | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.029.332 | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| (NH 4 )HSO 4 | |||
| Молярная масса | 115.11 g/mol | ||
| Появление | Белый твердый | ||
| Плотность | 1,78 г/см 3 | ||
| Температура плавления | 147 ° С (297 ° F; 420 К) | ||
| Очень растворим | |||
| Растворимость в других растворителях | Растворим в метаноле нерастворим в ацетоне | ||
| Опасности | |||
| NFPA 704 (огненный алмаз) | |||
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов | ||
| Родственные соединения | |||
Другие анионы | Тиосульфат аммония Сульфит аммония Сульфат аммония Персульфат аммония | ||
Другие катионы | Бисульфат натрия Калия бисульфат | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Бисульфат аммония , также известный как гидросульфат аммония , представляет собой белое кристаллическое твердое вещество формулы ( NH 4 )HSO 4 . Эта соль является продуктом полунейтрализации серной кислоты аммиаком .
Производство
[ редактировать ]Его обычно собирают как побочный продукт «пути ацетонциангидрина» к товарному химическому веществу метилметакрилата . [1]
Его также можно получить гидролизом сульфаминовой кислоты в водном растворе, в результате чего получается соль высокой чистоты:
- H 3 NSO 3 + H 2 O → (NH 4 )HSO 4
Он также возникает при термическом разложении сульфата аммония :
- (NH 4 ) 2 SO 4 → (NH 4 )HSO 4 + NH 3
Приложения
[ редактировать ]Его можно дополнительно нейтрализовать аммиаком с образованием сульфата аммония, ценного удобрения . Его можно использовать как более слабую альтернативу серной кислоте, хотя бисульфат натрия встречается гораздо чаще.
Естественное явление
[ редактировать ]Родственное соединение формулы (NH 4 ) 3 H(SO 4 ) 2 встречается как редкий минерал летовицит , известный в условиях угольных пожаров. [2] [3]
Ссылки
[ редактировать ]- ^ Уильям Бауэр-младший «Метакриловая кислота и ее производные» в Энциклопедии промышленной химии Ульмана, 2002, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a16_441 .
- ^ «Летовиците» .
- ^ «Список минералов» . 21 марта 2011 г.