Церийно-аммиачная селитра
 | |
| Имена | |
|---|---|
| Название ИЮПАК Диаммоний-церий(IV) нитрат | |
| Другие имена Церийно-аммиачная селитра МОЖЕТ Гексанитратоцерат(IV) диаммония | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.037.100 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| [NH 4 ] 2 [Се(NO 3 ) 6 ] | |
| Молярная масса | 548.218 g·mol −1 |
| Появление | оранжево-красные кристаллы |
| Температура плавления | От 107 до 108 ° C (от 225 до 226 ° F; от 380 до 381 К) |
| 141 г/100 мл (25 °С) 227 г/100 мл (80 °С) | |
| Структура | |
| Моноклиника | |
| икосаэдрический | |
| Опасности | |
| СГС Маркировка : | |
  [1] [1] | |
| Опасность | |
| Х272 , Х302 , Х315 , Х319 , Х335 | |
| П220 , П261 , П305+П351+П338 | |
| Родственные соединения | |
Родственные соединения | Нитрат аммония Оксид церия(IV) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Церийно-аммиачная селитра (CAN) представляет собой неорганическое соединение с формулой (NH 4 ) 2 [Ce(NO 3 ) 6 ] . Эта оранжево-красная водорастворимая церия соль является специализированным окислителем в органическом синтезе и стандартным окислителем в количественном анализе .
Приготовление, свойства и структура
[ редактировать ]Анион [Се(NO 3 ) 6 ] 2− образуется путем растворения Ce 2 O 3 в горячей и концентрированной азотной кислоте ( ДЕНЬ 3 ). [2]
Соль состоит из аниона гексанитратоцерата(IV). [Се(NO 3 ) 6 ] 2− и пара аммония катионов НХ + 4 . Ионы аммония не участвуют в окислительных реакциях этой соли. В анионе каждая нитратная группа хелатирует атом церия бидентатным образом, как показано ниже:
Анион [Се(NO 3 ) 6 ] 2− имеет Th (идеализированный Oh ) молекулярную симметрию . Ядро CeO 12 определяет икосаэдр . [4]
Этот 4+ является сильным одноэлектронным окислителем . По окислительно-восстановительному потенциалу ( E ° ≈ 1,61 В по отношению к NHE ) он является еще более сильным окислителем, чем Cl 2 ( Е ° ≈ 1,36 В ). Лишь немногие реагенты длительного хранения являются более сильными окислителями. В окислительно-восстановительном процессе Ce(IV) превращается в Ce(III), одноэлектронное изменение, о котором свидетельствует изменение цвета раствора с оранжевого на бледно-желтый (при условии, что субстрат и продукт не сильно окрашены).
Приложения в органической химии
[ редактировать ]В органическом синтезе CAN полезен в качестве окислителя многих функциональных групп ( спиртов , фенолов и простых эфиров ), а также связей C–H, особенно бензильных. Алкены подвергаются динитроксилированию, хотя результат зависит от растворителя. Хиноны производятся из катехинов и гидрохинонов , и даже нитроалканы окисляются. [5] [6]
CAN обеспечивает альтернативу реакции Нефа ; например, для синтеза кетомакролида , где обычно возникают осложняющие побочные реакции с использованием других реагентов. Окислительному галогенированию может способствовать CAN в качестве окислителя in situ для бензилбромирования, а также йодирования кетонов и урацила производных .
Для синтеза гетероциклов
[ редактировать ]Каталитические количества водного CAN позволяют эффективно синтезировать производные хиноксалина . Хиноксалины известны своим применением в качестве красителей, органических полупроводников и агентов, расщепляющих ДНК. Эти производные также являются компонентами антибиотиков, таких как эхиномицин и актиномицин . Трехкомпонентная реакция анилинов с алкилвиниловыми эфирами, катализируемая CAN , обеспечивает эффективное вступление в 2-метил-1,2,3,4-тетрагидрохинолины и соответствующие хинолины, полученные их ароматизацией .
В качестве реагента для снятия защиты
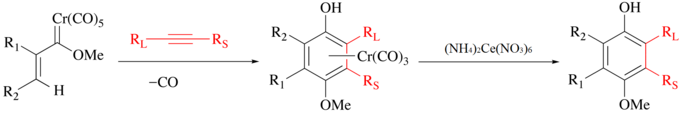
[ редактировать ]CAN традиционно используется для высвобождения органических лигандов из карбонилов металлов . В процессе металл окисляется, выделяется CO, а органический лиганд высвобождается для дальнейших манипуляций. [7] Например, в реакции Вульфа-Детца алкин, окись углерода и карбен хрома объединяются с образованием полусэндвич-комплекса хрома. [8] [9] а фенольный лиганд можно выделить путем мягкого окисления CAN.
CAN используется для расщепления пара -метоксибензиловых и 3,4-диметоксибензиловых эфиров, которые являются защитными группами для спиртов. [10] [11] -метоксибензилового эфира требуются два эквивалента CAN Для каждого эквивалента пара . Спирт высвобождается, и пара -метоксибензиловый эфир превращается в пара -метоксибензальдегид. Сбалансированное уравнение выглядит следующим образом:
- 2 [NH 4 ] 2 [Ce(NO 3 ) 6 ] + H 3 COC 6 H 4 CH 2 OR + H 2 O → 4 NH + 4 + 2 Ce 3+ + 12 НЕТ − 3 + 2 Н + + Н 3 КОК 6 Н 4 ЧО + ХОР
Другие приложения
[ редактировать ]CAN также является компонентом хрома травителя , [12] материал, который используется при производстве фотошаблонов и жидкокристаллических дисплеев . [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Sigma-Aldrich Co. , Нитрат аммония-церия (IV) . Проверено 13 мая 2015 г.
- ^ Смит, Г. Фредерик (июнь 1963 г.). «Улучшенное приготовление гексанитратоцерата (IV) аммония и процедура рутинного аналитического тестирования для подтверждения чистоты первичного эталонного стандарта» . Таланта . 10 (6): 709–710. дои : 10.1016/0039-9140(63)80093-4 .
- ^ «Запись CSD 1598999, Запись ICSD 22219, H 8 CeN 8 O 18 » . Кембриджская структурная база данных : Структуры доступа . Кембриджский центр кристаллографических данных . Проверено 5 ноября 2021 г.
- ^ Перейти обратно: а б Томас А. Бейнеке; Дж. Дельгаудио (1968). «Кристаллическая структура цериево-аммиачной селитры». Неорг. Хим . 7 (4): 715–721. дои : 10.1021/ic50062a020 . ОСТИ 4799348 .
- ^ Наир, Виджай; Дипти, Ани (2007). «Нитрат аммония церия (IV) универсальный одноэлектронный окислитель». Химические обзоры . 107 (5): 1862–1891. дои : 10.1021/cr068408n . ПМИД 17432919 .
- ^ Шридхаран, Веллайсами; Менендес, Х. Карлос (2010). «Нитрат церия (IV) аммония как катализатор в органическом синтезе». Химические обзоры . 110 (6): 3805–3849. дои : 10.1021/cr100004p . ПМИД 20359233 .
- ^ Л. Бренер, Дж. С. Маккеннис и Р. Петтит «Циклобутадиен в синтезе: эндо -трицикло [4.4.0.0 2,5 ]дека-3,8-диен-7,10-дион» Org. Synth. 1976, 55, 43. дои : 10.15227/orgsyn.055.0043
- ^ Уотерс, М.; Вульф, WD (2008). «Синтез фенолов и хинонов с помощью карбеновых комплексов Фишера». Органические реакции . 70 (2): 121–623. дои : 10.1002/0471264180.или070.02 .
- ^ Дётц, К.Х. (1983). «Образование углерод-углеродной связи посредством карбонильно-карбеновых комплексов» . Чистая и прикладная химия . 55 (11): 1689–1706. дои : 10.1351/pac198355111689 . S2CID 95165461 .
- ^ Бунс, Герт-Ян; Хейл, Карл Дж. (2000). Органический синтез с углеводами (1-е изд.) Шеффилд, Англия: Sheffield Academic Press. стр.33
- ^ Коценски, Филипп Дж. (1994). Группы защиты Штутгарт, Нью-Йорк Георг Тиме Верлаг. стр. 8–9, 52–54
- ^ Уокер, Перрин; Уильям Х. Тарн (1991). Справочник CRC по травителям металлов . стр. 287–291 . ISBN 0-8493-3623-6 .