Дихромат аммония
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Дихромат аммония | |
| Другие имена Бихромат аммония Пирохромат аммония | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.221 |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1439 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
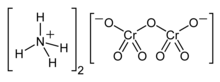
| ( NH4 ) Cr2O2Cr2O7 | |
| Молярная масса | 252.07 g/mol |
| Появление | Оранжево-красные кристаллы |
| Запах | без запаха |
| Плотность | 2,115 г/см 3 |
| Температура плавления | 180 ° C (356 ° F; 453 К) разлагается. |
| 18,2 г/100 мл (0 °С) 35,6 г/100 мл (20 °С) 40 г/100 мл (25 °С) 156 г/100 мл (100 °С) | |
| Растворимость | нерастворим в ацетоне растворим в этаноле |
| Структура | |
| моноклинический | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Очень токсично, взрывоопасно, окисляющее, канцерогенно, мутагенно, опасно для окружающей среды. |
| СГС Маркировка : | |
      [1] [1] | |
| H272 , H301 , H312 , H314 , H317 , H330 , H334 , H340 , H350 , H360 , H372 , H410 [1] | |
| П201 , П220 , П260 , П273 , П280 , П284 [1] | |
| NFPA 704 (огненный алмаз) | |
| 190 ° С (374 ° F; 463 К) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 20–250 мг/кг |
| Паспорт безопасности (SDS) | КМГС 1368 |
| Родственные соединения | |
Другие катионы | Дихромат калия Дихромат натрия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Дихромат аммония — неорганическое соединение формулы ( NH 4 ) 2 Cr 2 O 7 . В этом соединении, как и во всех хроматах и дихроматах, хром находится в степени окисления +6 , широко известной как шестивалентный хром . Это соль, состоящая из ионов аммония и дихромат- ионов.
Дихромат аммония иногда называют Везувианским огнем из-за его использования при демонстрации настольных «вулканов». [2] Однако эта демонстрация стала непопулярной в школах из-за канцерогенной природы соединения. Он также использовался в пиротехнике и на заре фотографии .
Характеристики
[ редактировать ]При комнатной температуре и давлении соединение существует в виде оранжевых кислых кристаллов, растворимых в воде и спирте . Он образуется при действии хромовой кислоты на гидроксид аммония с последующей кристаллизацией. [3]
Кристалл (NH 4 ) 2 Cr 2 O 7 (C2/c, z = 4) содержит ион аммония одного типа, в узлах симметрии C 1 (2,3). Каждый НХ +
Центр 4 неравномерно окружен восемью атомами кислорода на расстояниях N—O от ок. от 2,83 до ок. 3,17 Å, типичный для водородных связей . [4]
Использование
[ редактировать ]Он использовался в пиротехнике и на заре фотографии, а также в литографии , в качестве источника чистого азота в лаборатории и в качестве катализатора . [5] Его также используют в качестве протравы для красящих пигментов, при производстве ализарина , хромовых квасцов , при дублении кожи и очистке нефти. [3]
Фоточувствительные пленки, содержащие ПВС , дихромат аммония и люминофор, наносят методом центрифугирования в виде водных суспензий при производстве люминофорного растра телевизионных экранов и других устройств. Бихромат аммония действует как фотоактивный центр. [6]
Реакции
[ редактировать ]Настольные вулканы и термическое разложение
[ редактировать ]
Демонстрация вулкана включает в себя воспламенение груды соли, что инициирует следующее экзотермическое преобразование: [8]
- (Нью-Хэмпшир
4 )
2 Кр
22О
7 ( с ) → Кр
22О
3 ( с ) + Н
2 ( г ) + 4 Н
2 O ( г ) (Δ H = −429,1 ± 3 ккал/моль)
Как и нитрат аммония , он термодинамически нестабилен. [9] [10] Реакция его разложения после начала завершается, образуя объемистый темно-зеленый порошкообразный оксид хрома (III) . Не весь дихромат аммония разлагается в этой реакции. Когда зеленый порошок помещают в воду, из оставшегося дихромата аммония получается желто-оранжевый раствор.
Наблюдения, полученные с помощью микроскопии сравнительно большого увеличения при кинетическом исследовании термического разложения бихромата аммония, позволили доказать, что распад соли протекает с участием промежуточной жидкой фазы, а не твердой фазы. Характерное потемнение (NH
4 )
2 Кр
22О
7 как следствие начала разложения можно объяснить диссоциативной потерей аммиака, сопровождающейся прогрессирующей конденсацией анионов до Cr.
33О 2−
10 , Кр
4 Ох 2−
13 и т. д., в конечном итоге давая CrO
3 . КрО
3 был идентифицирован как возможный расплавленный промежуточный продукт, участвующий в (NH
4 )
2 Кр
22О
7 разложение. [11]
Реакции окисления
[ редактировать ]Дихромат аммония является сильным окислителем и реагирует, часто бурно, с любым восстановителем . Чем сильнее восстановитель, тем бурнее реакция. [9] Его также использовали для ускорения окисления спиртов и тиолов . Бихромат аммония в присутствии Mg(HSO 4 ) 2 и влажного SiO 2 может действовать как очень эффективный реагент для окислительного сочетания тиолов в условиях отсутствия растворителя. Реакции дают достаточно хорошие выходы в относительно мягких условиях. [12] Соединение также используется при окислении алифатических спиртов до соответствующих им альдегидов и кетонов в смеси ZrCl 4 /мокрый SiO 2 в условиях отсутствия растворителя, опять же с относительно высокими выходами. [13] [14]
Безопасность
[ редактировать ]Дихромат аммония, как и все соединения хрома (VI), высокотоксичен и является доказанным канцерогеном. [15] Это также сильный раздражитель.
Инциденты
[ редактировать ]В запечатанных контейнерах дихромат аммония может взорваться при нагревании. [9] В 1986 году двое рабочих погибли и еще 14 получили ранения на предприятии Diamond Shamrock Chemicals в Аштабуле, штат Огайо , когда 2000 фунтов (910 кг) дихромата аммония взорвались во время его сушки в нагревателе. [16]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Sigma-Aldrich Co. , Дихромат аммония . Проверено 20 июля 2013 г.
- ^ «Вулкан дихромата аммония» . Химия оживает! . Дж. Хим. Образование. (неактивная ссылка 29 марта 2021 г.)
- ^ Перейти обратно: а б Сокращенный химический словарь Ричарда Дж. Льюиса Хоули . Wiley & Sons, Inc: Нью-Йорк, 2007 г. ISBN 978-0-471-76865-4
- ^ Керестури, Г.; Кноп, О. (1982). «Инфракрасные спектры иона аммония в кристаллах. Часть XII. Низкотемпературные переходы в дихромате аммония, (NH 4 ) 2 Cr 2 O 7 ». Может. Дж. Хим. 60 (15): 1972–1976. дои : 10.1139/v82-277 .
- ^ Прадьот Патнаик. Справочник неорганических химикатов . МакГроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ Хавард, Дж. М.; Шим, С.Ю.; Пт; острый; Чет, Дж. М. (1999). «Разработка фоторезистов с пониженным воздействием на окружающую среду. 1. Водорастворимые резисты на основе фотосшивки поливинилового спирта». хим. Матер. 11 (3): 719–725. дои : 10.1021/cm980603y .
- ^
Запланировано и выполнено Мариной Стояновской, Михой Буклески и Владимиром Петрушевским, химический факультет ФНСМ, сс. Университет Кирилла и Мефодия , Скопье, Македония. - ^ Нойгебауэр, Калифорния; Маргрейв, JL (1957). «Теплообразование дихромата аммония». Дж. Физ. хим. 61 (10): 1429–1430. дои : 10.1021/j150556a040 .
- ^ Перейти обратно: а б с Янг, Эй Джей (2005). «CLIP, Информационный профиль химической лаборатории: дихромат аммония» . Дж. Хим. Образование. 82 (11): 1617. doi : 10.1021/ed082p1617 .
- ^ ГАП Далгаард; AC Хэзелл; Р. Г. Хэзелл (1974). «Кристаллическая структура дихромата аммония (NH 4 ) 2 Cr 2 O 7 » . Acta Chemica Scandinavica . А28 : 541–545. doi : 10.3891/acta.chem.scand.28a-0541 .
- ^ Голви, Эндрю К.; Пеппль, Ласло; Раджам, Сундара (1983). «Механизм плавления термического разложения дихромата аммония». Дж. Хим. Соц., Фарадей Транс. 1 . 79 (9): 2143–2151. дои : 10.1039/f19837902143 .
- ^ Ширини, Ф.; и др. (2003). «Окисление тиолов без растворителя (NH 4 ) 2 Cr 2 O 7 в присутствии Mg(HSO 4 ) 2 и влажного SiO 2 » . Журнал химических исследований . 2003 : 28–29. дои : 10.3184/030823403103172823 . S2CID 197126514 .
- ^ Ширини, Ф.; и др. (2001). «ZrCl 4 /мокрый SiO 2 способствует окислению спиртов под действием (NH 4 ) 2 Cr 2 O 7 в растворе и без растворителя» . Дж. Хим. Исследования (S) . 2001 (11): 467–477. дои : 10.3184/030823401103168541 . S2CID 197118772 .
- ^ Ф. Ширини; М.А. Зольфигол; FOO† и М. Халеги (2003). «Окисление спиртов с использованием (NH 4 ) 2 Cr 2 O 7 в присутствии хлорида кремния/влажного SiO 2 в растворе и в условиях отсутствия растворителя» . Бык. Корейская хим. Соц. 24 (7): 1021–1022. дои : 10.5012/bkcs.2003.24.7.1021 .
- ^ Волкович, В.А.; Гриффитс, Т.Р. (2000). «Каталитическое окисление аммиака: блестящий эксперимент» . Журнал химического образования . 77 (2): 177. Бибкод : 2000ЖЧЭд..77..177В . дои : 10.1021/ed077p177 .
- ^ Даймонд, С. (19 января 1986 г.). «Химический взрыв в Огайо». Нью-Йорк Таймс . п. 22.
