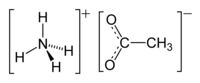
Ацетат аммония
| |

| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
Этаноат аммония
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.010.149 |
| Номер ЕС |
|
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 3077 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 2 Н 7 Н О 2 | |
| Молярная масса | 77.083 g·mol −1 |
| Появление | Белые твердые кристаллы, расплывающиеся |
| Запах | Немного напоминает уксусную кислоту |
| Плотность | 1,17 г/см 3 (20 °С) [1] 1,073 г/см 3 (25 °С) |
| Температура плавления | 113 ° С (235 ° F, 386 К) [4] |
| 102 г/100 мл (0 °С) 148 г/100 мл (4 °С) [1] 143 г/100 мл (20 °С) 533 г/100 мл (80 °С) | |
| Растворимость | Растворим в спирте , SO 2 , ацетоне , нашатырном спирте. [2] |
| Растворимость в метаноле | 7,89 г/100 мл (15 °С) [3] [1] 131,24 г/100 г (94,2 °С) [2] |
| Растворимость в диметилформамиде | 0.1 g/100 g [2] |
| Кислотность ( pKa ) | 9.9 |
| Основность (p K b ) | 33 |
| -41.1·10 −6 см 3 /моль | |
| Вязкость | 21 |
| Структура | |
| орторомбический | |
| Термохимия | |
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
−615 кДж/моль [2] |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
Раздражающий |
| СГС Маркировка : [3] | |

| |
| Предупреждение | |
| Х303 , Х316 , Х320 , Х333 | |
| П281 , П335 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 136 ° С (277 ° F, 409 К) [3] |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза )
|
386 мг/кг (мыши, внутривенно) [2] |
| Паспорт безопасности (SDS) | Джей Ти Бейкер |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Ацетат аммония , также известный как спирт Миндереруса в водном растворе, представляет собой химическое соединение с формулой NH 4 CH 3 CO 2 . Это белое гигроскопичное твердое вещество, которое может быть получено в результате реакции аммиака и уксусной кислоты . Он доступен коммерчески. [5]
История
[ редактировать ]Синоним «Дух Миндерера» назван в честь Р. Миндерера, врача из Аугсбурга . [6]
Использование
[ редактировать ]Это основной предшественник ацетамида : [7]
- NH 4 CH 3 CO 2 → CH 3 C(O)NH 2 + H 2 O
Его также используют как мочегонное средство. [5]
Буфер
[ редактировать ]Как соль слабой кислоты и слабого основания аммония ацетат часто используется с уксусной кислотой для создания буферного раствора . Ацетат аммония летуч при низких давлениях. По этой причине его использовали для замены клеточных буферов, содержащих нелетучие соли, при подготовке образцов для масс-спектрометрии. [8] По этой причине он также популярен в качестве буфера для подвижных фаз для ВЭЖХ с ELSD и детектированием на основе CAD . Другие летучие соли, которые использовались для этого, включают формиат аммония .
При растворении ацетата аммония в чистой воде pH полученного раствора обычно составляет 7, поскольку равные количества ацетата и аммония нейтрализуют друг друга. Однако ацетат аммония представляет собой двухкомпонентную буферную систему, которая буферизует при pH около 4,75 ± 1 (ацетат) и pH 9,25 ± 1 (аммоний), но не имеет значительной буферной емкости при pH 7, вопреки распространенному заблуждению. [9]
Другой
[ редактировать ]- биоразлагаемый антиобледенитель.
- катализатор конденсации Кнёвенагеля и источник аммиака в реакции Борха в органическом синтезе .
- реагент, осаждающий белок при диализе для удаления загрязнений посредством диффузии.
- реагент в сельскохозяйственной химии для определения ЕКО почвы ( катионообменной емкости ) и определения доступного калия в почве, где ион аммония действует как катион-заменитель калия.
- часть метода Кэлли по сохранению свинцовых артефактов
Пищевая добавка
[ редактировать ]Ацетат аммония также используется в качестве пищевой добавки в качестве регулятора кислотности; Номер INS 264. Разрешен для использования в Австралии и Новой Зеландии. [10]
Производство
[ редактировать ]Ацетат аммония получают нейтрализацией уксусной кислоты карбонатом аммония насыщением ледяной уксусной кислоты аммиаком или . [11] Получение кристаллического ацетата аммония затруднено из-за его гигроскопичности.
Ссылки
[ редактировать ]- ^ Jump up to: а б с Прадьот, Патнаик (2003). Справочник неорганических химикатов . McGraw-Hill Companies, Inc. ISBN компании 0-07-049439-8 .
- ^ Jump up to: а б с д и «Ацетат аммония» .
- ^ Jump up to: а б с д «Паспорт безопасности ацетата аммония» (PDF) . tedia.com . Компания Tedia Inc. 12 августа 2011 г. Проверено 10 июня 2014 г.
- ^ Дэвидсон, Артур В.; Макаллистер, Уолтер Х. (1930). «Растворы солей в чистой уксусной кислоте. Ii. Растворимость ацетатов1». Журнал Американского химического общества . 52 (2): 507–519. дои : 10.1021/ja01365a010 . ISSN 0002-7863 .
- ^ Jump up to: а б Осия Чунг; Робин С. Танке; Дж. Пол Торренс. «Уксусная кислота». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a01_045.pub2 . ISBN 978-3527306732 .
- ^ «Дух Миндереруса» . TheFreeDictionary.com . Проверено 7 июня 2023 г.
- ^ Коулман, Г.Х.; Альварадо, AM (1923). «Ацетамид» . Органические синтезы . 3 :3 ; Сборник томов , т. 1, с. 3 .
- ^ Берман, Елена С.Ф.; Фортсон, Сьюзен Л.; Чекки, Кайл Д.; Ву, Лиган; Фелтон, Джеймс С.; Куанг Джен, Дж. Ву; Кулп, Кристен С. (2008). «Подготовка одиночных клеток для визуализации/профилирования масс-спектрометрии» . J Am Soc Масс-спектр . 19 (8): 1230–1236. дои : 10.1016/j.jasms.2008.05.006 . ПМИД 18565760 .
- ^ Конерманн, Ларс (2017). «Разрешение распространенному заблуждению: ацетат аммония как «буфер» с нейтральным pH для масс-спектрометрии с электрораспылением» . Американское общество масс-спектрометрии . 28 (9): 1827–1835. Бибкод : 2017JASMS..28.1827K . дои : 10.1007/s13361-017-1739-3 . ПМИД 28710594 . S2CID 25294943 . Проверено 25 октября 2022 г.
- ^ Кодекс пищевых стандартов Австралии и Новой Зеландии «Стандарт 1.2.4 – Маркировка ингредиентов» . Проверено 27 октября 2011 г.
- ^ Брант, Уильям (1914). Практический трактат по производству уксуса . Ланкастер, Пенсильвания: Генри Кэри Бэрд и компания, стр. 316–317 .
