Ацетат железа(III)
Эта статья требует внимания эксперта в области химических веществ . Конкретная проблема заключается в следующем: растворим ли ацетат железа (III) на самом деле или нет? смотрите на странице обсуждения Подробности ( август 2024 г. ) |
| |
| |
| Имена | |
|---|---|
| Название ИЮПАК
ацетат железа(III)
| |
| Другие имена
основной ацетат железа(III), оксиацетат железа(III), ацетат железа(III)
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Характеристики | |
| С 14 Н 27 Fe 3 О 18 | |
| Молярная масса | 650.9 g/mol |
| Появление | коричневато-красный порошок |
| нерастворимый | |
| Растворимость | растворим в этаноле [ 2 ] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
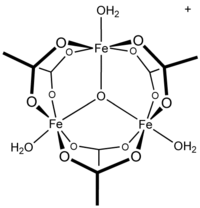
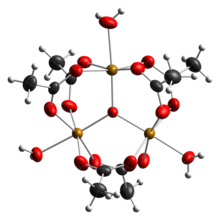
Ацетат железа представляет собой ацетатную соль координационного комплекса [Fe 3 O(OAc) 6 (H 2 O) 3 ] + (ОАк − это СН 3 СО 2 − ). Обычно соль известна как «основной ацетат железа». [ 3 ] Образование красно-коричневого комплекса когда-то использовалось как тест на ионы трехвалентного железа . [ 4 ]
Структура и синтез
[ редактировать ]Основной ацетат железа образуется при обработке водных растворов источников железа(III) ацетатными солями. [ 5 ] Типичным предшественником является свежеосажденный оксид/гидроксид железа, не содержащий галогенидов. [ 6 ]
Ранние работы показали, что катион трехъядерный. [ 7 ] Центры Fe эквивалентны, каждый из них имеет октаэдрическую форму и связан с шестью кислородными лигандами, включая тройной мостиковый оксид в центре равностороннего треугольника. [ 8 ] Это соединение было ранним примером молекулярного комплекса железа с оксидным лигандом. Катион обладает идеализированной D3h симметрией .
Реакции
[ редактировать ]Концевые аква-лиганды триметаллического каркаса могут быть заменены другими лигандами, такими как пиридин и диметилформамид . Известно множество различных солей, заменяющих анион, например [Fe 3 (μ 3 -O)(OAc) 6 (H 2 O) 3 ]Cl. Восстановление катиона дает нейтральное производное смешанной валентности, содержащее один трехвалентный и два трехвалентных центра. [ 3 ] Известны смешанные металлы, такие как [Fe 2 CoO(OAc) 6 (H 2 O) 3 ]. [ 9 ]
Родственные соединения
[ редактировать ]Хром(III), рутений(III), ванадий(III), марганец(III) и родий(III) образуют аналогичные соединения. [ 10 ] Ацетат железа (III) (без оксо-лиганда) заявлен как соединение красного цвета, образующееся в результате реакции ацетата серебра и хлорида железа (III) . [ 11 ]
Использование
[ редактировать ]Материалы, полученные путем нагревания железа, уксусной кислоты и воздуха, условно называемые основными ацетатами железа, используются в качестве красителей и протравителей . [ 3 ]
Ацетатом железа часто наносят кистью необработанную древесину, чтобы придать ей состаренный вид. [ нужна ссылка ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Лиде, Дэвид Р., изд. (2006). Справочник CRC по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press . стр. 4–63. ISBN 0-8493-0487-3 .
- ^ «Ацетат железа(III)» . КонецMemo . Проверено 18 апреля 2015 г.
- ^ Перейти обратно: а б с Дж., Берджесс; М.В., Твигг (2005). Р. Брюс, король; Дж., Уайли (ред.). Энциклопедия неорганической химии (2-е изд.). Нью-Йорк: Уайли. ISBN 978-0-470-86078-6 .
- ^ Х., Брирли; Ф., Ибботсон (1902). Анализ материалов сталелитейных заводов . Лондон; Нью-Йорк: Лонгманс, Грин. Архивировано из оригинала 18 апреля 2015 года.
- ^ В., Саймон (март 2007 г.). Руководство по химии . п. 474. ИСБН 978-1406733358 .
- ^ Х. Люкс (1963). «Основной ацетат железа (III)». В Георге Брауэре (ред.). Справочник по препаративной неорганической химии . п. 1508.
- ^ Вейнланд, Р.; Динкелакер, П. (июль 1909 г.). «О солях гексацетато(формато)-трихромного основания. II» . Отчеты Немецкого химического общества . 42 (3): 2997–3018. дои : 10.1002/cber.19090420318 .
- ^ Фиггис, Б.Н.; Робертсон, Великобритания (13 февраля 1965 г.). «Кристалл-молекулярная структура и магнитные свойства Cr 3 (CH 3 . COO) 6 OCl.5H 2 O". Nature . 205 (4972): 694–695. Bibcode : 1965Natur.205..694F . doi : 10.1038/205694a0 . S2CID 4283321. . В этой статье описывается изоструктура соединений хрома и железа
- ^ Блейк, Энтони Б.; Явари, Ахмад; Хэтфилд, Уильям Э.; Сетулекшми, Китай (1985). «Магнитные и спектроскопические свойства некоторых гетеротрехъядерных основных ацетатов хрома (III), железа (III) и ионов двухвалентных металлов». Журнал Химического общества, Dalton Transactions (12): 2509. doi : 10.1039/DT9850002509 .
- ^ Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Пол, Рам С.; Нарула, Рамеш К.; Васишт, Шам К. (декабрь 1978 г.). «Ацетаты железа (III)». Химия переходных металлов . 3 (1): 35–38. дои : 10.1007/BF01393501 . S2CID 94447648 .