Ацетат кадмия
| |
| Имена | |
|---|---|
| Название ИЮПАК
Ацетат кадмия
| |
| Другие имена
Диацетат кадмия
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.008.049 |
| Номер ЕС |
|
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ |
|
| Число | 2570 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| Cd(CH 3 COO) 2 (безводный) Cd(CH 3 COO) 2 ·2H 2 O (дигидрат) | |
| Молярная масса | 230,500 г/моль (безводный) 266,529 г/моль (дигидрат) |
| Появление | бесцветные кристаллы (безводные) белые кристаллы (дигидрат) |
| Запах | уксусная кислота |
| Плотность | 2,341 г/см 3 (безводный) 2,01 г/см 3 (дигидрат) |
| Температура плавления | 255 ° C (491 ° F; 528 K) (безводный) дигидрат разлагается при 130 ° C. [1] |
| растворимый (безводный), хорошо растворимый (дигидрат) | |
| Растворимость | растворим в метаноле , этаноле (безводном) растворим в этаноле (дигидрат) |
| -83.7·10 −6 см 3 /моль | |
| Структура | |
| моноклинический | |
| Опасности | |
| СГС Маркировка : | |
  
| |
| Предупреждение | |
| Х302 , Х312 , Х332 , Х410 | |
| P261 , P264 , P270 , P271 , P273 , P280 , P301+P312 , P302+P352 , P304+P312 , P304+P340 , P312 , P322 , P330 , P363 , P391 , P501 | |
| NFPA 704 (огненный алмаз) | |
| NIOSH (пределы воздействия на здоровье в США): | |
ПЭЛ (допустимо)
|
[1910.1027] СВВ 0,005 мг/м 3 (как компакт-диск) [2] |
РЕЛ (рекомендуется)
|
Что [2] |
IDLH (Непосредственная опасность)
|
Са [9 мг/м 3 (как компакт-диск)] [2] |
| Родственные соединения | |
Другие анионы
|
Фторид кадмия Хлорид кадмия Бромид кадмия Йодид кадмия |
Другие катионы
|
Ацетат цинка Ацетат ртути(II) Ацетат серебра |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
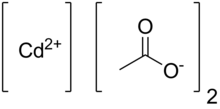
Ацетат кадмия представляет собой химическое соединение с формулой Cd(O 2 CCH 3 ) 2 (H 2 O) 2 . Соединение продается как в безводной форме, так и в виде дигидрата , оба из которых имеют белый или бесцветный цвет. Только дигидрат был подтвержден рентгеновской кристаллографией .
Приготовление, реакции и использование
[ редактировать ]Он образуется при обработке оксида кадмия кислотой уксусной : [3] [4]
- CdO + 2 CH 3 CO 2 H + H 2 O → Cd(O 2 CCH 3 ) 2 (H 2 O) 2
Его также можно получить обработкой нитрата кадмия уксусным ангидридом . [5]
Ацетат кадмия имеет мало применений. В результате реакции с селенидом триоктилфосфина его часто использовали в качестве предшественника селенида кадмия и родственных ему полупроводников. [6]
Структура дигидрата
[ редактировать ]
В отличие от координационной геометрии цинка в дигидрате диацетата цинка , кадмий имеет семь координат в Cd(O 2 CCH 3 ) 2 (H 2 O) 2 . [7] Это координационный полимер , состоящий из ацетатных лигандов, соединяющих центры кадмия.
Безопасность
[ редактировать ]Соединения кадмия отнесены МАИР к канцерогенам группы 1 .
Ссылки
[ редактировать ]- ^ Лиде, Дэвид Р. (1998). Справочник по химии и физике (87 изд.). Бока-Ратон, Флорида: CRC Press. п. 447. ИСБН 0-8493-0594-2 .
- ^ Jump up to: а б с Карманный справочник NIOSH по химическим опасностям. «#0087» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Ганголли, С. (1999). Словарь веществ и их эффектов . Лондон: Королевское химическое общество. стр. 12–13. ISBN 9780854048137 . Проверено 29 марта 2009 г.
- ^ Патнаик, Прадьот (2003). Справочник неорганических химических соединений . МакГроу-Хилл Профессионал. стр. 143–144. ISBN 0-07-049439-8 . Проверено 29 марта 2009 г.
- ^ Ф. Вагенкнехт; Р. Джуза (1963). «Ацетат кадмия». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 2. Нью-Йорк, Нью-Йорк: Академик Пресс. п. 1105.
- ^ Гарсиа-Родригес, Рауль; Хендрикс, Марк П.; Коссарт, Брэнди М.; Лю, Хайтао; Оуэн, Джонатан С. (2013). «Реакции конверсии предшественников нанокристаллов халькогенида кадмия». Химия материалов . 25 (8): 1233–1249. дои : 10.1021/см3035642 .
- ^ Харрисон, В.; Троттер, Дж. (1972). «Кристаллическая и молекулярная структура дигидрата диацетата кадмия». Журнал Химического общества, Dalton Transactions (8–9): 956. doi : 10.1039/dt9720000956 .
