Йодид кадмия

| |
| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
Йодид кадмия(II)
| |
| Другие имена
Дииодид кадмия
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.294 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| КДИ 2 | |
| Молярная масса | 366.22 g/mol |
| Появление | кристаллы от белого до бледно-желтого цвета |
| Плотность | 5,640 г/см 3 , твердый |
| Температура плавления | 387 ° С (729 ° F, 660 К) |
| Точка кипения | 742 ° C (1368 ° F; 1015 К) |
| 787 г/л (0 °С) 847 г/л (20 °С) 1250 г/л (100 °С) | |
| Растворимость | растворим в этаноле , ацетоне , эфире и аммиаке. |
| -117.2·10 −6 см 3 /моль | |
| Структура | |
| Тригональный , hP3 , пр. группа P 3 м1, №164 | |
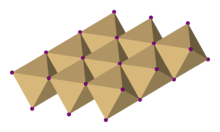
| октаэдрический | |
| Опасности | |
| СГС Маркировка : | |
  
| |
| Опасность | |
| Х301 , Х331 , Х351 , Х373 , Х410 | |
| P260 , P280 , P301+P330+P331 , P304+P340 , P310 , P311 , P403+P233 | |
| NFPA 704 (огненный алмаз) | |
| NIOSH (пределы воздействия на здоровье в США): | |
ПЭЛ (допустимо)
|
[1910.1027] СВВ 0,005 мг/м 3 (как компакт-диск) [1] |
РЕЛ (рекомендуется)
|
Что [1] |
IDLH (Непосредственная опасность)
|
Са [9 мг/м 3 (как компакт-диск)] [1] |
| Родственные соединения | |
Другие анионы
|
фторид кадмия хлорид кадмия бромид кадмия |
Другие катионы
|
йодид цинка йодид ртути(II) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Йодид кадмия — неорганическое соединение формулы CdI 2 . Это белое гигроскопичное твердое вещество. Его также можно получить в виде моно- и тетрагидрата. [2] У него мало приложений. Он примечателен своей кристаллической структурой , типичной для соединений формы MX 2 с сильными поляризационными эффектами.
Подготовка
[ редактировать ]Йодид кадмия получают добавлением металлического кадмия или его оксида, гидроксида или карбоната к иодистоводородной кислоте . Также соединение можно получить нагреванием кадмия с йодом. [2]
Приложения
[ редактировать ]Исторически йодид кадмия использовался в качестве процесса высокотемпературной изомеризации дикалийфталата Хенкеля — катализатора с получением терефталата . Затем соль обрабатывали уксусной кислотой с получением ацетата калия и коммерчески ценной терефталевой кислоты . [3]
Хотя метод Хенкеля неэкономичен по сравнению с производством терефталевой кислоты из п -ксилола , он был предложен в качестве потенциального пути получения терефталевой кислоты из фурфурола . Поскольку существующий био-ПЭТ по-прежнему зависит от нефти как источника п -ксилола, процесс Хенкеля теоретически может предложить полностью биопластичный путь получения полиэтилентерефталата . [4]
Кристаллическая структура
[ редактировать ]
В йодиде кадмия йодид -анионы образуют гексагональную плотноупакованную структуру, в то время как катионы кадмия заполняют все октаэдрические позиции в чередующихся слоях. Полученная структура представляет собой слоистую решетку. Такая же основная структура встречается во многих других солях и минералах . Йодид кадмия имеет в основном ионную связь , но частично ковалентный характер. [5]
Кристаллическая структура йодида кадмия является прототипом, на котором можно рассматривать кристаллические структуры многих других соединений. Соединения с любой из следующих характеристик имеют тенденцию принимать структуру CdI 2 : [ нужна ссылка ]
- Иодиды умеренно поляризующих катионов ; бромиды и хлориды сильнополяризующихся катионов
- Гидроксиды дикатионов, т.е. соединения общей формулы M(OH) 2
- Сульфиды , селениды и теллуриды ( халькогениды ) тетракатионов, т.е. соединения общей формулы MX 2 , где X = S, Se, Te
Ссылки
[ редактировать ]- ^ Jump up to: а б с Карманный справочник NIOSH по химическим опасностям. «#0087» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б Ф. Вагенкнехт; Р. Джуза (1963). «Йодид кадмия». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 2. Нью-Йорк, Нью-Йорк: Академик Пресс. п. 1096.
- ^ Соломон, И.; Айзенберг, В. (1976). Утилизация побочных продуктов переработки угля. Ежеквартальный отчет, 27 декабря 1975 г. - 27 марта 1976 г. (Отчет). дои : 10.2172/7186862 .
- ^ Тачибана, Юя; Кимура, Саори; Касуя, Кен-Ичи (2015). «Синтез и проверка терефталевой кислоты биологического происхождения из фурфурола» . Научные отчеты . 5 : 8249. Бибкод : 2015NatSR...5E8249T . дои : 10.1038/srep08249 . ПМК 4316194 . ПМИД 25648201 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 1211–1212. ISBN 978-0-08-037941-8 .
