Тетраиодид титана
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Йодид титана(IV) | |
| Другие имена Тетраиодид титана | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.028.868 |
| Номер ЕС |
|
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| TiI 4 | |
| Молярная масса | 555.485 g/mol |
| Появление | красно-коричневые кристаллы |
| Плотность | 4,3 г/см 3 |
| Температура плавления | 150 ° С (302 ° F; 423 К) |
| Точка кипения | 377 ° С (711 ° F; 650 К) |
| гидролиз | |
| Растворимость в других растворителях | растворим в CH 2 Cl 2 CHClCHCl3 КС 2 |
| Структура | |
| кубический ( а = 12,21 Å) | |
| четырехгранный | |
| 0 Д | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | бурный гидролиз коррозионный |
| СГС Маркировка : [1] | |
 | |
| Опасность | |
| H314 | |
| P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P405 , P501 | |
| Родственные соединения | |
Другие анионы | Бромид титана(IV) Хлорид титана(IV) Фторид титана(IV) |
Другие катионы | Тетраиодид кремния Йодид циркония(IV) Йодид гафния(IV) |
Родственные соединения | Йодид титана(III) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Тетраиодид титана неорганическое соединение формулы — TiI 4 . Это черное летучее твердое вещество, о котором впервые сообщил Рудольф Вебер в 1863 году. [2] Это промежуточный продукт в процессе Ван Аркеля-де Бура очистки титана.
Физические свойства
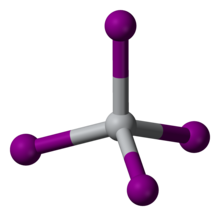
[ редактировать ]TiI 4 — редкий молекулярный бинарный йодид металла, состоящий из изолированных молекул тетраэдрических центров Ti(IV). Расстояния Ti-I составляют 261 пм . [3] Учитывая его молекулярный характер, TiI 4 можно перегонять без разложения при одной атмосфере; это свойство является основой его использования в процессе Ван Аркеля – де Бура. Разница в температуре плавления между TiCl 4 (т.пл. -24°С) и TiI 4 (т.пл. 150°С) сравнима с разницей температур плавления CCl 4 (т.пл. -23°С) и CI 4 (т.пл. 168°С). В), что отражает более прочную межмолекулярную ван-дер-ваальсову связь в йодидах.
Существуют две полиморфные модификации TiI 4 , одна из которых хорошо растворима в органических растворителях. В менее растворимой кубической форме расстояния Ti-I составляют 261 пм . [3]
Производство
[ редактировать ]Хорошо известны три метода:1) Из элементов, обычно с использованием трубчатой печи при температуре 425 °C: [4]
- Ти + 2 I 2 → TiI 4
Эту реакцию можно обратить вспять, чтобы получить пленки металлического титана высокой чистоты. [5]
2) Реакция обмена тетрахлорида титана и HI.
- TiCl 4 + 4 HI → TiCl 4 + 4 HCl
3) Оксид-йодидный обмен из йодида алюминия .
- 3 TiO 2 + 4 AlI 3 → 3 TiI 4 + 2 Al 2 O 3
Реакции
[ редактировать ]Подобно TiCl 4 и TiBr 4 , TiI 4 образует аддукты с основаниями Льюиса и также может восстанавливаться. Когда восстановление проводят в присутствии металлического Ti, получают полимерные производные Ti(III) и Ti(II), такие как CsTi 2 I 7 и цепочечный CsTiI 3 соответственно. [6]
TiI 4 проявляет широкую реакционную способность по отношению к алкенам и алкинам, приводя к образованию йодорганических производных. Он также влияет на соединение пинакола и другие реакции образования связей CC. [7]
Ссылки
[ редактировать ]- ^ «Тетраиодид титана» . pubchem.ncbi.nlm.nih.gov . Проверено 12 декабря 2021 г.
- ^ Вебер, Р. (1863). «Об изомерных модификациях титановой кислоты и о некоторых соединениях титана» . Анналы физики . 120 (10): 287–294. Бибкод : 1863АнП...196..287Вт . дои : 10.1002/andp.18631961003 .
- ^ Перейти обратно: а б Торнквист, внеочередное общее собрание; Либби, ВФ (1979). «Кристаллическая структура, растворимость и электронный спектр тетраиодида титана». Неорганическая химия . 18 (7): 1792–1796. дои : 10.1021/ic50197a013 .
- ^ Лоури, Р.Н.; Фэй, RC (1967). «Иодид титана (IV)». Неорганические синтезы . Том. 10. С. 1–6. дои : 10.1002/9780470132418.ch1 . ISBN 978-0-470-13241-8 .
- ^ Блюменталь, ВБ; Смит, Х. (1950). «Тетраиодид титана, получение и рафинирование». Промышленная и инженерная химия . 42 (2): 249. doi : 10.1021/ie50482a016 .
- ^ Йонген, Л.; Глогер, Т.; Бикхейзен, Дж.; Мейер, Г. (2005). «Двухвалентный титан: галогениды ATiX 3 (A = K, Rb, Cs; X = Cl, Br, I)». Журнал неорганической и общей химии . 631 (2–3): 582. doi : 10.1002/zaac.200400464 .
- ^ Симидзу, М.; Хачия, И. (2014). «Хемоселективное восстановление и йодирование с использованием тетраиодида титана» . Буквы тетраэдра . 55 (17): 2781–2788. дои : 10.1016/j.tetlet.2014.03.052 .