Тетраиодид теллура
 | |
| Имена | |
|---|---|
| Другие имена йодид теллура(IV) | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.282 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Я 4 | |
| Молярная масса | 635.218 g/mol |
| Появление | черные кристаллы |
| Плотность | 5,05 г/см 3 , твердый |
| Температура плавления | 280 ° С (536 ° F; 553 К) |
| Структура | |
| орторомбический | |
| Опасности | |
| СГС Маркировка : [1] | |
  | |
| Опасность | |
| Х302 , Х312 , Х314 , Х332 | |
| P260 , P261 , P264 , P270 , P271 , P280 , P301+P312 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P312 , P304+P340 , P305+P351+P 338 , П310 , П312 , П322 , П330 , П363 , П405 , П501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
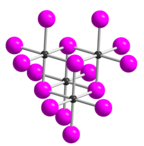
Тетраиодид теллура ( Te I 4 ) — неорганическое химическое соединение . Он имеет тетрамерную структуру, которая отличается от тетрамерных твердых форм TeCl 4 и TeBr 4 . [2] В TeI 4 атомы Te координированы октаэдрически, а ребра октаэдров общие. [2]
Подготовка
[ редактировать ]Тетраиодид теллура можно получить взаимодействием Te и иодметана CH 3 I. [2] В парах TeI 4 диссоциирует: [3]
- ТЭИ 4 → ТЭИ 2 + И 2
Его также можно получить путем взаимодействия теллуровой кислоты с йодоводородом . [4]
- Te(OH) 6 + HI → TeI 4 + I 2 + 6 H 2 O
Его также можно получить путем реакции элементов, в результате которой также могут образовываться дииодид теллура и моноиодид теллура , в зависимости от условий реакции: [5]
- Те + 2 I 2 → ТеI 4
- ТЭИ 4 → ТЭИ 2 + И 2
Характеристики
[ редактировать ]Тетрайодид теллура представляет собой твердое вещество серо-железного цвета, которое медленно разлагается в холодной воде и быстро в теплой воде с образованием диоксида теллура и йодистого водорода . [6] Он стабилен даже во влажном воздухе и разлагается при нагревании с выделением йода. Он растворим в иодоводородной кислоте с образованием H[TeI 5 ] и мало растворим в ацетоне . [4]
Тетраиодид теллура является проводником в расплавленном состоянии, диссоциируя на ионы TeI 3 + и я − . В растворителях с донорными свойствами, таких как ацетонитрил CH 3 CN, которые делают раствор проводящим: , образуются ионные комплексы [3]
- TeI 4 + 2 CH 3 CN → (CH 3 CN) 2 TeI 3 + + я −
Известны пять модификаций тетраиодида теллура, все из которых состоят из тетрамерных молекул. [7] Форма δ является наиболее термодинамически стабильной формой. Структурно это производное (а также формы α, β и γ) от формы ε.
Ссылки
[ редактировать ]- ^ «Теллур тетрайодид» . pubchem.ncbi.nlm.nih.gov . Проверено 13 декабря 2021 г.
- ^ Jump up to: а б с Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Jump up to: а б Неорганическая химия , Эгон Виберг, Арнольд Фредерик Холлеман, Elsevier, 2001 г. ISBN 0-12-352651-5
- ^ Jump up to: а б Справочник по препаративной неорганической химии. 1 (3-е, исправленное изд.). Штутгарт: Энке. 1975. с. 435. ИСБН 978-3-432-02328-1 .
- ^ Хаген, AP (17 сентября 2009 г.). Неорганические реакции и методы. Образование связей с галогенами (Часть 1) . Джон Уайли и сыновья. ISBN 978-0-470-14538-8 .
- ^ Йодид теллура (IV), 99% (в пересчете на металлы) в AlfaAesar, доступ 17 декабря 2013 г. ( PDF ) (требуется JavaScript). [ мертвая ссылка ]
- ^ Ридель, Эрвин; Джаниак, Кристоф (2011). Неорганическая химия: дополнительный материал онлайн . Исследования (8-е изд.). Берлин: де Грюйтер. ISBN 978-3-11-022567-9 .