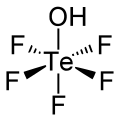
Тефлиевая кислота
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Пентафторортотеллуровая кислота | |||
| Другие имена Тефлиевая кислота | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.161.534 | ||
ПабХим CID | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| ХОТеФ 5 | |||
| Молярная масса | 239.60 g·mol −1 | ||
| Появление | бесцветное твердое вещество | ||
| Температура плавления | 39,1 ° C (102,4 ° F; 312,2 К) | ||
| Точка кипения | 59,7 ° С (139,5 ° F; 332,8 К) | ||
| Кислотность ( pKa ) | 8,8 (в Ac 2 O ) [1] | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | коррозионный, токсичный | ||
| СГС Маркировка : | |||
 | |||
| Опасность | |||
| H314 | |||
| P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P405 , P501 | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Тефлиевая кислота представляет собой химическое соединение с формулой Х О Те Ф 5 . Эта сильная кислота родственна ортотеллуровой кислоте . Те(ОН) 6 . Тефлиевая кислота имеет слегка искаженную октаэдрическую молекулярную геометрию .
Подготовка
[ редактировать ]Тефлиевую кислоту случайно открыли Энгельбрехт и Сладкий. Их синтез не дал ожидаемого теллурилфторида. TeO 2 F 2 , а смесь летучих теллурических соединений, содержащая ХОТеФ 5 : [2]
- BaTeO 4 + 10 FSO 2 OH → HOTeF 5 (25%)
Тефлиновую кислоту также можно получить из фторсульфоновой кислоты и теллурата бария: [3]
- 5 ФСО 2 ОН + Ба 2+ [ТеО 2 (ОН) 4 ] 2− → HOTeF 5 + 4 H 2 SO 4 + BaSO 4
Это также первый продукт гидролиза гексафторида теллура :
- TeF 6 + H 2 O → HOTeF 5 + HF
Тефлатес
[ редактировать ]
Сопряженное основание тефлиевой кислоты называется тефлат-анионом. Ф 5 ТеО − (не путать с трифлатом ). Известно множество тефлатов, одним из примеров является B(OTeF 5 ) 3 , который можно подвергнуть пиролизу с образованием ангидрида кислоты. О(ТеF 5 ) 2 . [3]
- 2 B(OTeF 5 ) 3 → 2 B(OTeF 5 ) 2 F + O(TeF 5 ) 2
Известно, что тефлат-анион устойчив к окислению. Это свойство позволило получить несколько весьма необычных видов, таких как гексатефлаты. M(OTeF 5 ) − 6 (в котором M = As, Sb, Bi). Ксенон образует катион Хе(ОТеФ 5 ) + . [4]
Ссылки
[ редактировать ]- ^ Перрин, Д.Д., изд. (1982) [1969]. Константы ионизации неорганических кислот и оснований в водных растворах . Химические данные ИЮПАК (2 nd ред.). Оксфорд: Пергамон (опубликовано в 1984 г.). Запись 220. ISBN. 0-08-029214-3 . LCCN 82-16524 .
- ^ Энгельбрехт, А.; Сладкий Ф. «Пентафтор-ортотеллюрзаура», HOTeF 5 " Angewandte Chemie 1964. ( 76 ) 9 , 379-380, два : 10.1002/ange.19640760912 .
- ^ Jump up to: а б Холлеман, А.Ф.; Виберг, Э. «Неорганическая химия» Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5 .
- ^ Мерсье, HPA; Сандерс, JCP; Шробильген, Г.Дж. «Гексакис(пентафтороксотеллурат)пниктат(V) Анионы, M(OTeF 5 ) - 6 (M = As, Sb, Bi): серия очень слабо координирующих анионов», Журнал Американского химического общества , том 116, 2921, (1994). два : 10.1021/ja00086a025 .
Дальнейшее чтение
[ редактировать ]- РБ Кинг; Неорганическая химия элементов основных групп , издательство VCH, Нью-Йорк, 1994.