Буоксид титана
 структура газовой фазы
| |
| Имена | |
|---|---|
| Название ИЮПАК
Буоксид титана(IV)
| |
| Другие имена | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.024.552 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Число | 2920 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 16 Н 36 О 4 Ти | |
| Молярная масса | 340.32164 |
| Появление | БЕСЦВЕТНАЯ ДО СВЕТЛО-ЖЕЛТОЙ ЖИДКОСТИ |
| Запах | слабый, похожий на алкоголь [ 1 ] |
| Плотность | 0,998 г/см 3 [ 1 ] |
| Температура плавления | -55 °С [ 1 ] |
| Точка кипения | 312 °С [ 1 ] |
| разлагается [ 1 ] | |
| Растворимость | большинство органических растворителей, кроме кетонов [ 1 ] |
Показатель преломления ( n D )
|
1.486 [ 1 ] |
| Термохимия | |
Теплоемкость ( С )
|
711 Дж/(моль К) [ 2 ] |
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
-1670 кДж/моль [ 2 ] |
| Опасности | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза )
|
3122 мг/кг (крыса, перорально) и 180 мг/кг (мыши, внутривенно). [ 1 ] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
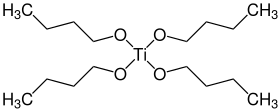
Бутоксид титана представляет собой алкоксид металла с формулой Ti(OBu) 4 ( Bu = –CH 2 CH 2 CH 2 CH 3 ). Это бесцветная жидкость без запаха, хотя состаренные образцы могут иметь желтоватый оттенок. Вследствие гидролиза образцы имеют слабый спиртоподобный запах. Он растворим во многих органических растворителях. [ 1 ] [ 3 ] Разложение в воде неопасно, поэтому бутоксид титана часто используют в качестве жидкого источника диоксида титана, что позволяет наносить покрытия TiO 2 различных форм и размеров вплоть до наномасштаба. [ 4 ] [ 5 ]
Бутоксид титана часто используется для приготовления материалов и катализаторов на основе оксида титана. [ 6 ] [ 7 ] [ нужна ссылка ]
Структура и синтез
[ редактировать ]
Как и большинство алкоксидов титана (исключение: изопропоксид титана ), Ti(OBu) 4 не является мономером, а существует в виде кластера (см. этоксид титана ). Тем не менее его часто изображают как простой мономер. [ нужна ссылка ]
Его получают обработкой тетрахлорида бутанолом титана :
- TiCl 4 + 4 HOBu → Ti(OBu) 4 + 4 HCl
Для завершения реакции требуется основание. [ нужна ссылка ]
Реакции
[ редактировать ]Как и другие алкоксиды титана, бутоксид титана обменивает алкоксидные группы:
- Ti(OBu) 4 + HOR → Ti(OBu) 3 (OR) + HOBu
- Ti(OBu) 3 (OR) + HOR → Ti(OBu) 2 (OR) 2 + HOBu
и т. д. По этой причине бутоксид титана несовместим со спиртовыми растворителями.
Аналогично обмену алкоксидов, бутоксид титана легко гидролизуется. Детали реакции сложны, но общий процесс можно суммировать с помощью этого сбалансированного уравнения.
- Ti(OBu) 4 + 2 H 2 O → TiO 2 + 4 HOBu
Были пойманы и охарактеризованы разнообразные оксо-алкоксо-промежуточные соединения. [ 8 ] Пиролиз также дает диоксид:
- Ti(OBu) 4 → TiO 2 + 2 Bu 2 O
Бутоксид титана реагирует с алкилциклосилоксанами. С окатаметилциклотетрасилоксаном производит дибутоксидиметилсилан, 1,5-дибутоксигексаметилтрисилоксан, 1,7-дибутоксиоктаметилтетрасилоксан, 1,3-дибутокситетраметилдисилоксан и полимеры. Вместе с гексаметилциклотрисилоксаном он также дает дибутоксидиметилсилан. [ 9 ]

Безопасность
[ редактировать ]LD50 составляет 3122 мг/кг (крыса, перорально) и 180 мг/кг (мыши, внутривенно). [ нужна ссылка ]
Буоксид титана представляет собой коррозионную, легковоспламеняющуюся жидкость, которая бурно реагирует с окисляющими материалами. Несовместим с серной и азотной кислотами, неорганическими гидроксидами и пероксидами, основаниями, аминами, амидами, изоцианатами и боранами. Он раздражает кожу и глаза, а при проглатывании вызывает тошноту и рвоту. ЛД50 составляет 3122 мг/кг (крыса, перорально) и 180 мг/кг (мыши, внутривенно); температура вспышки 77°С. При нагревании выделяет раздражающие дымы, которые при концентрации выше 2 об.% образуют с воздухом взрывоопасные смеси. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж Бутилтитанат . pubchem.ncbi.nlm.nih.gov
- ^ Jump up to: а б с Тетрабутил титанат . nist.gov
- ^ Поханиш, Ричард П.; Грин, Стэнли А. (2009). Руководство Wiley по химической несовместимости . Джон Уайли и сыновья. п. 1010. ИСБН 978-0-470-52330-8 .
- ^ Jump up to: а б Ван, Цуй (2015). «Жесткое моделирование хиральных нановолокон TiO 2 с оптической активностью на основе электронных переходов» . Наука и технология перспективных материалов . 16 (5): 054206. Бибкод : 2015STAdM..16e4206W . дои : 10.1088/1468-6996/16/5/054206 . ПМК 5070021 . ПМИД 27877835 .
- ^ Ву, Лимин; Багдачи, Джамиль (2015). Функциональные полимерные покрытия: принципы, методы и применение . Уайли. п. 10. ISBN 978-1-118-88303-7 .
- ^ Цинь, Цин; Чжао, Юн; Шмаллеггер, Макс; Приветствую, Тобиас; Шмидт, Йоханнес; Вальчак, Ральф; Гешайдт-Демнер, Георг; Цзяо, Хайцзюнь; Ошац, Мартин (2019). «Усиленное электрокаталитическое восстановление N 2 посредством частичного замещения анионов в композитах оксид титана с углеродом». Международное издание «Прикладная химия» . 58 (37): 13101–13106. дои : 10.1002/anie.201906056 . hdl : 21.11116/0000-0004-023B-8 . ПМИД 31257671 . S2CID 195760017 .
- ^ Сян, Цюаньцзюнь; Ю, Цзяго; Яронец, Метек (2012). «Синергетический эффект MoS 2 и графена как сокатализаторов для повышения фотокаталитической активности по производству H 2 наночастиц TiO 2 ». Журнал Американского химического общества . 134 (15): 6575–6578. дои : 10.1021/ja302846n . ПМИД 22458309 .
- ^ Вейманн-Шилдкнетч, Сандрин; Генри, Марк (2001). «Механистические аспекты гидролиза и конденсации алкоксидов титана, комплексированных триподальными лигандами». Журнал Химического общества, Dalton Transactions (16): 2425–2428. дои : 10.1039/b103398k .
- ^ К.А. Андрианов; Ш. В. Пичхадзе; В.В. Комарова; Ц. Н. Вардосанидзе (1962). «Реакции органоциклосилоксанов с тетрабутилортотитанатом». Вестник Отделения химических наук АН СССР . 11 (5): 776–779. дои : 10.1007/BF00905301 . ISSN 0568-5230 .