Триацетат алюминия
| Имена | |
|---|---|
| Название ИЮПАК
Ацетат алюминия
| |
| Другие имена
Ацетат алюминия(III)
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.004.868 |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| C6H9AlOC6H9AlO6 | |
| Молярная масса | 204.114 g·mol −1 |
| Появление | белое твердое вещество [1] |
| растворимый | |
| Родственные соединения | |
Родственные соединения
|
Основной диацетат алюминия (диацетат гидроксиалюминия), CAS RN 142-03-0, HOAl(CH 3 СО 2 ) 2 [1] Двухосновный моноацетат алюминия (ацетат дигидроксиалюминия), CAS RN 7360-44-3, (HO) 22АлЧ 3 СО 2 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Триацетат алюминия , официальное название ацетат алюминия . [2] представляет собой химическое соединение состава Al(CH
3 СО
2 )
3 . В стандартных условиях он выглядит как белое водорастворимое твердое вещество. [1] который разлагается при нагревании примерно до 200 °C. [3] Триацетат гидролизуется до смеси основных гидроксида и ацетата солей . [4] и несколько видов сосуществуют в химическом равновесии , особенно в водных растворах ацетат-иона; Для этой смешанной системы обычно используется название ацетат алюминия.
Он имеет терапевтическое применение благодаря своим противозудным, вяжущим и антисептическим свойствам. [5] и в качестве безрецептурного препарата, такого как раствор Буроу , [6] его используют для лечения ушных инфекций . [7] [8] Препараты раствора Бурова были разбавлены и модифицированы аминокислотами , чтобы сделать их более вкусными для использования в качестве полосканий при таких состояниях, как афтозные язвы полости рта. [9] В ветеринарии вяжущие свойства триацетата алюминия используются для лечения болезни Мортелларо у копытных животных, таких как крупный рогатый скот. [10]
Триацетат алюминия используется в качестве протравы для красителей, таких как ализарин , [11] как по отдельности, так и в сочетании. Вместе с диацетатом алюминия [12] или с сульфататом алюминия [13] используется с хлопком , другими целлюлозными волокнами, [14] и шелк . [13] Его также комбинировали с ацетатом железа для получения различных цветов. [15]
Номенклатура
[ редактировать ]Согласно формальным правилам наименования неорганических соединений , название Al(CH
3 СО
2 )
3 – ацетат алюминия, [2] хотя более формальные названия, такие как ацетат алюминия (III) и этаноат алюминия, приемлемы. [4] Использование префикса «три» в названии триацетата алюминия, хотя и не является технически необходимым, регулярно используется во избежание возможной путаницы с родственными соединениями с гидроксолигандами . Основной диацетат алюминия , формально диацетат гидроксиалюминия ( CAS RN 142-03-0), [1] имеет состав HOAl(CH
3 СО
2 )
2 с одним гидроксилигандом вместо ацетатного лиганда и двухосновным моноацетатом алюминия , формально ацетатом дигидроксиалюминия (CAS RN 7360-44-3), имеет состав (HO)
22АлЧ
3 СО
2 только с одним ацетатным лигандом. Эти три соединения различаются в твердой фазе, но обычно рассматриваются как группа и описываются вместе как ацетат алюминия в растворе из-за гидролиза триацетата до смеси, которая включает две другие формы. [4] Аббревиатура AlAc, а также такие варианты, как AlAc. 2+
и АлАк +
2 , иногда используются в дисциплине геохимии , [16] хотя они несовместимы со стандартной практикой в основной химии . [а]
Структура
[ редактировать ]Формула Al(CH
3 СО
2 )
3 указывает на наличие алюминиевых центров в степени окисления +3 и ацетатных групп в соотношении 1:3. Изображения, используемые для представления этого вещества, такие как показанные слева, представляют собой две сильно упрощенные аппроксимации твердотельной структуры: первая представляет собой чисто ионную соль с одним катионом алюминия (III) (Al 3+ ) окружен и электростатически связан с тремя ацетатными анионами ( CH
3 СО −
2 ), но это не следует воспринимать как передачу информации о кристаллической структуре . катион-анион Например, хлорид натрия (NaCl) имеет стехиометрию 1:1, но он имеет кубическую структуру , в которой каждый ион октаэдрически окружен шестью ионами противоположного заряда. [17]
Другое изображение представляет собой молекулярную форму с тремя ацетатными группами, ковалентно связанными с металлическим центром в тригональной планарной геометрии, и межмолекулярными взаимодействиями, удерживающими молекулы вместе друг с другом в кристаллической структуре. Весьма вероятно, что структура твердого тела является более сложной и включает в себя как ковалентные, так и ионные характеристики, и возможно, что могут присутствовать множественные алюминиевые центры и / или мостиковые ацетатные группы - оба из них были обнаружены в растворе ацетата алюминия. [18] а хлорид алюминия, как известно, существует в виде Al
2 кл.
6 димер . [19]
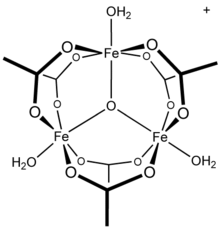
ЯМР- исследования водной системы алюминий(III)/ацетат показывают наличие алюминия в виде гексааквакомплекса Al [ (H
2О )
6 ] 3+
, [20] а также мононуклеарные виды с различными заменами. Кроме того, исследования показывают, что важным компонентом фазы раствора является Al
13 тридекамер , [21] фрагмент , о котором сообщается в противоречивых механизмах гидролиза и полимеризации растворов алюминия. [22] Известно, что катионы других трехвалентных металлов образуют полиядерные соединения: ацетат железа (III) образует трехъядерную структуру. например, [23] с тройным мостовым оксо-центром [24] с катионом [Fe 3 ( μ 3 –O)(OAc) 6 (H 2 O) 3 ] + . [25] Соединение гидроксид ацетата хрома Cr 3 (OH) 2 (OAc) 7 также было описано как изоструктурное. [26] аналогичные соединения рутения(III), ванадия(III), родия(III) и иридия(III) трехядерного строения. Известны [27] Ацетат меди(II) и ацетат хрома(II) имеют двухъядерные дигидратные структуры, M 2 (OAc) 4 (H 2 O) 2 , [28] как и ацетат родия (II) ; [29] каждый демонстрирует значительные связующие взаимодействия металл-металл. [28] [29]
Химия
[ редактировать ]Подготовка
[ редактировать ]Согласно Справочнику неорганических соединений CRC, триацетат алюминия представляет собой белое водорастворимое твердое вещество, которое обычно получают из хлорида алюминия или непосредственно из алюминия путем нагревания в растворе уксусной кислоты с уксусным ангидридом . [1]
- 3 СН
3 СООН + AlCl
3 → Al(CH
3 СО
2 )
3 + 3 HCl
- 6 СН
3 COOH + 2 Al → 2 Al(CH
3 СО
2 )
3 + 3 ч
2
алюминия/ацетата/гидроксида Теоретически все соли могут быть получены из гидроксида алюминия или алюмината натрия и уксусной кислоты, но образование триацетата происходит только в отсутствие воды. [4] В растворах диацетат является основным образующимся продуктом, а также образуется при обработке хлорида алюминия раствором ацетата натрия в основных условиях. [30] Уравнения этих процессов:
- 2 СН
3 СО
2 Na + Al(OH)
3 → Al(CH
3 СО
2 )
2 ОН + 2 NaOH
- 2 СН
3 СО
2 Na + AlCl
3 + NaOH → Al(CH
3 СО
2 )
2 ОН + 3 NaCl
- 2 СН
3 СО
2 Na + NaAlO
2 + 2 ч
2 O → Al(CH
3 СО
2 )
2 ОН + 3 NaOH
улучшенный процесс с использованием комбинации хлорида алюминия и алюмината натрия с ацетатом натрия, полученного месте Запатентован на : [31]
- 29 НаАлО
2 + 10 NaOH + 84 СН
3 СООН + 13 AlCl
3 → 42Ал (СН
3 СО
2 )
2 ОН + 39 NaCl + 26 Н
22О
Протравы , триацетат и сульфатат алюминия можно приготовить из сульфата алюминия при этом количество образующегося продукта определяется количеством использованного ацетата свинца (II) : [13]
- Ал
2 (ТАК
4 )
3 + 3 Pb(CH
3 СО
2 )
2 → 2Al (СН
3 СО
2 )
3 + 3 PbSO
4
- Ал
2 (ТАК
4 )
3 + 2 Pb(CH
3 СО
2 )
2 → Ал
2 ТАК
4 (СН
3 СО
2 )
4 + 2 PbSO
4
Разложение
[ редактировать ]При нагревании триацетат алюминия разлагается при температуре выше 200 °C по процессу, аналогичному процессу формиата алюминия . [3] Процесс начинается с потери уксусного ангидрида ( Ac
2 O ) между 120 и 140 °C. [1] с образованием смеси основных оксидов ацетатов, таких как Al
2О (СН
3 СО
2 )
4 и Ал
3О (СН
3 СО
2 )
7 , [30] которые в конечном итоге трансформируются в Ал
22О
3 ( оксид алюминия ), сначала в виде аморфного безводного твердого вещества, а затем через другие твердые фазы (γ-, δ- и θ- кристаллические формы ), чтобы в конечном итоге стать полиморфным α- Al.
22О
3 : [3]
- 2Al (СН
3 СО
2 )
3 → Ал
2О (СН
3 СО
2 )
4 + СН
3 СО(О)КРАСНЫЙ
3 → Ал
22О
3 + 3 СН
3 СО(О)КРАСНЫЙ
3
- 2Al (СН
3 СО
2 )
2OH → Ал
22О
3 + 2 СН
3 СООН + СН
3 СО(О)КРАСНЫЙ
3
Гидролиз
[ редактировать ]Триацетат алюминия гидролизуется с образованием ацетатов моно- и двухосновных гидроксидов в растворе или методом гигроскопии : [4]
- Al(CH
3 СО
2 )
3 + Ч
2 O → Al(CH
3 СО
2 )
2 ОН + СН
3 СООН
- Al(CH
3 СО
2 )
3 + 2 ч
2 O → Al(CH
3 СО
2 )(ОН)
2 + 2 СН
3 СООН
Использование
[ редактировать ]По данным Национального института рака , ацетаты алюминия применяются местно у людей в качестве антисептических средств , которые также вызывают сокращение тканей тела . [5] Его вяжущие свойства также используются для лечения болезни Мортелларо у копытных животных, таких как крупный рогатый скот. [10] Ацетат алюминия способствует заживлению инфицированной кожи , а также помогает при воспалении , зуде и жжении. [5] Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило его для использования для «временного облегчения незначительных раздражений кожи, вызванных… ядовитым плющом », «ядовитым дубом», « ядовитым сумахом », «укусами насекомых», « стопой спортсмена » или «ногами спортсмена». сыпь, вызванная мылом, моющими средствами, косметикой или украшениями». [32] Для этих целей безрецептурные препараты, такие как раствор Буроу . обычно используются [6] в то время как разбавленные формы используются в качестве полосканий при таких состояниях, как афтозные язвы полости рта, в том числе с аминокислотными добавками для улучшения вкусовых качеств и вкуса . [9] Чаще всего раствор Бурова применяют при лечении ушных инфекций. [7] [8] включая отомикоз , хотя он, как правило, не так эффективен, как клотримазол, при этих грибковых инфекциях. [33] Вяжущий порошок для местного применения Domeboro содержит тетрадекагидрат сульфата алюминия , [Al(H
2О )
6 ]
2 (ТАК
4 )
3 •2H
2 O и моногидрат ацетата кальция Ca (CH
3 СО
2 )
2 •H
2 O и при растворении образует раствор ацетата алюминия, аналогичный раствору Бурова. [34] Растворы Домеборо в теплой воде можно использовать при вросших ногтях на ногах . [35] чтобы уменьшить раздражение и сдержать любую инфекцию, которая может присутствовать.
протрава
[ редактировать ]
2 О)(ОН)Аз
2 ]•2H
2О , [36] который образует ализарин с алюминиевой протравой
Протрава — это вещество, используемое для закрепления красителей на тканях или срезах тканей путем образования с красителем координационного комплекса , который впоследствии прикрепляется к ткани или тканям. [37] Протрава часто содержит ион поливалентного металла, обычно алюминия или железа. [38] как и в случае смесей триацетата алюминия с сульфататом алюминия [13] или с основным диацетатом алюминия. [12] Протравы на основе триацетата алюминия использовались с хлопком , другими целлюлозы , волокнами на основе [14] и шелк . [13] Их также комбинировали с ацетатом железа для получения разных цветов. [15]

2 Al(мк-ОН)
2 АлАз
2 прибл. [11]
В случае красителя ализарина (1,2- дигидроксиантрахинон , H
2 Az ), предполагалось, что протравливание связано с образованием дианиона ализарина. В результате образуется пятикоординационный комплекс алюминия CaAl(OH)Az.
2 , [39] который может поглощать воду с образованием гидрата с шестикоординационным дианионом с алюминиевым центром Ca[Al(H
2 О)(ОН)Аз
2 ]•2H
2О . [40] Предложение было основано на данных инфракрасной спектроскопии и впоследствии было оспорено в работе, предлагающей структуру с двумя мостиковыми гидроксильными лигандами, соединяющими двухъядерное ядро Az .
2 Al(мк-ОН)
2 АлАз 4−
2 , с двумя фрагментами ализарина, каждый из которых хелатирует каждый алюминиевый центр. [36] Структура была предложена Soubayrol et al. на основе 27 Al-ЯМР-спектроскопии и с ионизацией электрораспылением . масс-спектрометрии Доказательства [41] Они сообщили, что степень гидратации зависела от личности противоиона: натриевая соль представляет собой стабильный тетрагидрат, а моногидрат образуется из гидроксида калия . Их можно было различить по химическим сдвигам , что позволяет предположить, что воды связаны с алюминиевыми центрами или фрагментами ализарина и ведут себя не так, как это типично для кристаллизационной воды . [41]
О родственной структуре с ионами кальция сообщалось в 1994 году, и в ней ализарины хелатируются с ионами кальция с образованием мостиков AzCaAz между алюминиевыми центрами (которые также соединены гидроксогруппами), а алюминиевые центры впоследствии связываются с депротонированными фенольными остатками краситель; [11] в модели Субайрола каждый ализарин связан с одним катионом алюминия. [41] Как и в случае со структурой самого ацетата алюминия, формы, которые он принимает при применении, до сих пор не решены.
Примечания
[ редактировать ]а Это «Ac» не относится к элементу актиний . При таком использовании в органической химии Ac обозначает ацетильную группу, радикальная форма которой - CH.
3 СО , [42] и OAc или AcO будут использоваться для ацетатного радикала CH
3 СО
2 , [43] иногда его также называют «ацетокси». Тогда ацетат-ион будет AcO. − , СН
3 СО −
2 , а уксусная кислота будет AcOH или HOAc. Согласно этому соглашению, триацетат алюминия будет представлять собой Al(OAc) 3 . Однако в публикациях по геохимии Ac используется для обозначения ацетата, а не ацетила, и, следовательно, AlAc. +
2 в геохимии будет записываться в соответствии с более обычными химическими соглашениями как [Al(OAc)
2 ] +
или [Al(CH
3 СО
2 )
2 ] +
.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж Перри, Дейл Л.; Филлипс, Сидни Л., ред. (1995). Справочник неорганических соединений . ЦРК Пресс . п. 3. ISBN 9780849386718 .
- ^ Перейти обратно: а б Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии, Рекомендации ИЮПАК 2005 г. (PDF) . Издательство РСК . ISBN 0854044388 .
- ^ Перейти обратно: а б с Сато, Тайчи; Икома, Сюдзи; Одзава, Фусаджи (1984). «Термическое разложение органических основных солей алюминия - формиата и ацетата». Термохим. Акта . 75 (1–2): 129–137. дои : 10.1016/0040-6031(84)85013-3 .
- ^ Перейти обратно: а б с д и Дэйнтит, Джон, изд. (2008). «Этаноат алюминия (ацетат алюминия)». Химический словарь (6-е изд.). Издательство Оксфордского университета . ISBN 9780191726569 .
- ^ Перейти обратно: а б с «Алюминий ацетат (код С47387)» . Тезаурус Национального института рака (NCIt). 31 октября 2016. Архивировано из оригинала 16 декабря 2016 года . Проверено 15 ноября 2016 г.
- ^ Перейти обратно: а б «Раствор уксусной кислоты/ацетата алюминия» . Наркотики.com . 3 ноября 2016 г. Проверено 23 ноября 2016 г.
- ^ Перейти обратно: а б Торп, Массачусетс; Крюгер, Дж.; Оливер, С.; Нильссен, ЕЛК; Прескотт, CAJ (1998). «Антибактериальная активность уксусной кислоты и раствора Бурова как местных отологических препаратов». Дж. Ларинг. Отол. 112 (10): 925–928. дои : 10.1017/S0022215100142100 . ПМИД 10211213 . S2CID 29258555 .
- ^ Перейти обратно: а б Касивамура, Масааки; Мацумура, Мичия; Суда, Нориюки; Тераяма, Фукуда, Сатоши (2004). Отол. 25 (1): 9–13. doi : 10.1097/ . PMID 14724484. . S2CID 7562816 00129492-200401000-00002
- ^ Перейти обратно: а б США предоставили патент 5250569 , Годфри, Джон К., «Аминокислотные ароматизаторы алюминиевого вяжущего средства для перорального применения», опубликован 5 октября 1993 г., выпущен 5 октября 1993 г., передан компании Godfrey Science & Design, Inc.
- ^ Перейти обратно: а б США предоставили 8703104 , Морелли, Джозеф П.; Фернандес, Джеффри Р. и Веркаар, Эдвард Л.С. и др., «Использование металлических вяжущих средств для лечения волосатых пяточных бородавок», опубликовано 22 апреля 2014 г., передано Ecolab USA Inc.
- ^ Перейти обратно: а б с Вундерлих, Кристиан Генрих; Бергерхофф, Гюнтер (1994). «Состав и цвет ализариновых и пурпуриновых лаков». хим. Бер. (на немецком языке). 127 (7): 1185–1190. дои : 10.1002/cber.19941270703 .
- ^ Перейти обратно: а б Хаар, Шерри; Шрейдер, Эрика; Гейтвуд, Барбара М. (2013). «Сравнение алюминиевых протрав по стойкости натуральных красителей на хлопке» (PDF) . Ткань. и Текстиль Рез. Дж. 31 (2): 97–108. дои : 10.1177/0887302X13480846 . hdl : 2097/16316 . S2CID 56218102 .
- ^ Перейти обратно: а б с д и Георгиевич, Фон (2013). Химическая технология текстильных волокон - их происхождение, структура, подготовка, стирка, отбеливание, крашение, печать и отделка . Читайте Книги . ISBN 9781447486121 .
- ^ Перейти обратно: а б Браун, Донна; де Соуза, Диана; Эллис, Кэтрин (2010). «Как протравить хлопок — позвольте мне посчитать способы» . Красный журнал Турции . 15 (2). Архивировано из оригинала 27 февраля 2021 г. Проверено 23 ноября 2016 г.
- ^ Перейти обратно: а б Эллис, Кэтрин (2016). «Трансформационные процессы» . Ткацкая мастерская Ткацкие шибори . F + W Media, Inc., стр. 83–84. ISBN 9781632503541 . [ постоянная мертвая ссылка ]
- ^ Весоловский, диджей; Бленко, Дж. Г.; Коул, доктор медицинских наук; Белл, JLS; Палмер, Д.А. (1992). «Геохимия коровых процессов при высоких температурах и давлениях». Краткое изложение исследований в области наук о Земле за 92 финансовый год (PDF) . Министерство энергетики США . стр. 38–44.
- ^ Майерсон, Аллан С.; Гинде, Раджив (2002). «Кристаллы, рост кристаллов и зарождение» . В Майерсоне, Аллан С. (ред.). Справочник по промышленной кристаллизации (2-е изд.). Баттерворт-Хайнеманн . п. 37. ИСБН 9780080533513 .
- ^ Алкок, Натаниэль В.; Трейси, Валери М.; Уоддингтон, Томас К. (1976). «Ацетаты и ацетатокомплексы. Часть 2. Спектроскопические исследования». Дж. Хим. Soc., Далтон Транс. 1976 (21): 2243–2246. дои : 10.1039/DT9760002243 .
- ^ Дэйнтит, Джон, изд. (2008). «Хлорид алюминия». Химический словарь (6-е изд.). Издательство Оксфордского университета . ISBN 9780191726569 .
- ^ Кубицки, доктор медицинских наук; Сайкс, Д.; Апитц, SE (1999). «Абпринципный расчет водного алюминия и алюминиево-карбоксилатного комплекса. Энергетика и 27 Химические сдвиги ЯМР Al». J. Phys. Chem. A. 103 ( 7): 903–915. Bibcode : 1999JPCA..103..903K . doi : 10.1021/jp983462w .
- ^ Томас, Фабьен; Мейсон, Арманд; Боттеро, Жан Ив; Роуллер, Джеймс; Женевье, Франсин; Будо, Дени (1991). «Разделение алюминия (III) с ацетатом и оксалатом. Потенциометрический и». 27 Al-ЯМР-исследование». Environ. Sci. Technol. 25 (9): 1553–1559. doi : 10.1021/es00021a004 .
- ^ Би, Шупинг; Ван, Ченьи; Цао, Цин; Чжан, Цайхуа (2004). «Исследование механизма гидролиза и полимеризации солей алюминия в водном растворе: корреляция между моделью «Ядро-звенья» и «клеточной» моделью Кеггин-Ал 13 ». Коорд. хим. Откр. 248 (5–6): 441–455. дои : 10.1016/j.ccr.2003.11.001 .
- ^ Вейнланд, Р.; Динкелакер, П. (1909). «О солях гексацетато(формато)-трихромного основания. II» . Бер. Немецкий. Хим. Гес . 42 (3): 2997–3018. дои : 10.1002/cber.19090420318 .
- ^ Фиггис, Б.Н.; Робертсон, Великобритания (1965). «Кристалл-молекулярная структура и магнитные свойства Cr 3 (CH 3 . COO) 6 OCl.5H 2 O". Nature . 205 (4972): 694–695. Bibcode : 1965Natur.205..694F . doi : 10.1038/205694a0 . S2CID 4283321 .
- ^ Берджесс, Дж.; Твигг, М.В. (2005). Кинг, Р. Брюс (ред.). Энциклопедия неорганической химии (10-е изд.). Уайли . ISBN 9780470860786 .
- ^ «Гидроксид ацетата хрома(III)» . Chemicalbook.com . Химическая книга. 2016 . Проверено 18 ноября 2016 г.
- ^ Каттерик, Джанет; Торнтон, Питер (1977). «Структура и физические свойства полиядерных карбоксилатов» . В Эмелеусе, HJ ; Шарп, А.Г. (ред.). Достижения неорганической химии и радиохимии . Том. 20. Академическая пресса . стр. 291–362. ISBN 9780080578699 .
- ^ Перейти обратно: а б Ван Никерк, младший; Шенинг, Франция (1953). «Рентгеновские доказательства наличия связей металл-металл в ацетате меди и хрома». Природа . 171 (4340): 36–37. Бибкод : 1953Природа.171...36В . дои : 10.1038/171036a0 . S2CID 4292992 .
- ^ Перейти обратно: а б Коттон, Флорида ; Дебоер, Б.Г.; Лапрад, Мэриленд; Пипал, младший; Учко, Д.А. (1971). «Кристаллическая и молекулярная структура дигидрата тетраацетата дихрома и дигидрата тетраацетата диродия» (PDF) . Акта Кристаллогр. Б 27 (8): 1664. Бибкод : 1971AcCrB..27.1664C . дои : 10.1107/S0567740871004527 .
- ^ Перейти обратно: а б Уэйд, К.; Банистер, Эй Джей (1973). «Химия алюминия, галлия, индия и таллия» . В Байларе, JC; Эмелеус, HJ; Нихолм, Р. (ред.). Комплексная неорганическая химия . Эльзевир . п. 1047. ИСБН 9781483153223 .
- ^ США предоставили номер 6498262 , Джером, Джеймс Э.; Флеминг, Гленда Л. и Суинсон, Джоэл Х., «Процесс производства одноосновного диацетата алюминия», опубликовано 24 декабря 2002 г., передано Chattem Chemicals, Inc.
- ^ Управление по контролю за продуктами и лекарствами (1 апреля 2016 г.). «Часть 347 – Лекарственные средства для защиты кожи, отпускаемые без рецепта человека». CFR – Свод федеральных правил, раздел 21 . Министерство здравоохранения и социальных служб США . Проверено 15 ноября 2016 г.
- ^ Мунгия, Раймундо; Дэниел, Сэм Дж. (2008). «Ототопические противогрибковые препараты и отомикоз: обзор». Межд. Дж. Пед. Оториноларинг. 72 (4): 453–459. дои : 10.1016/j.ijporl.2007.12.005 . ПМИД 18279975 .
- ^ «Домеборо – тетрадекагидрат сульфата алюминия, порошок моногидрата ацетата кальция, для раствора» . ДейлиМед . Национальная медицинская библиотека США . 12 мая 2016 года . Проверено 23 ноября 2016 г.
- ^ Саймон, Харви (31 января 2013 г.). «Вросшие ногти» . Нью-Йорк Таймс . Проверено 23 ноября 2016 г.
- ^ Перейти обратно: а б Атта-ур-Рахман (2002). «Рубия тинкторум Л». Биоактивные натуральные продукты (Часть G) . Исследования в области химии натуральных продуктов. Том. 26. Эльзевир . стр. 629–684. ISBN 9780080542065 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Протрава ». два : 10.1351/goldbook.M04029
- ^ Ллевеллин, Брайан Д. (май 2005 г.). «Теория пятен - Как действуют протравы» . Архивировано из оригинала 14 августа 2007 года.
- ^ Киль, Э.Г.; Хертьес, премьер-министр (1965). «Металлические комплексы ализарина V — исследования хлопчатобумажных тканей, окрашенных ализарином». Технология окраски . 81 (3): 98–102. дои : 10.1111/j.1478-4408.1965.tb02647.x .
- ^ Киль, Э.Г.; Хертьес, премьер-министр (1963). «Металлические комплексы ализарина I - структура кальциево-алюминиевого озера ализарина». Технология окраски . 79 : 21–27. дои : 10.1111/j.1478-4408.1963.tb02507.x .
- ^ Перейти обратно: а б с Субайрол, Патрик; Дана, Гилберт; Мужчина, Паскаль П. (1996). «Исследование методом ЯМР твердого тела алюминия-27 алюминиевых координационных комплексов ализарина». Магнитный резонанс в химии . 34 (8): 638–645. doi : 10.1002/(SICI)1097-458X(199608)34:8<638::AID-OMR926>3.0.CO;2-5 . S2CID 49575597 .
- ^ Хэнсон, Джеймс Ральф (2001). Химия функциональных групп . Королевское химическое общество . п. 11. ISBN 0854046275 .
- ^ «Распространенные сокращения в органической химии» (PDF) . Имперский колледж . Проверено 18 ноября 2016 г.

