Рифамицин
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Эмколо |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а619010 |
| Данные лицензии | |
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Химические и физические данные | |
| Формула | С 37 Н 47 Н О 12 |
| Молярная масса | 697.778 g·mol −1 |
| 3D model ( JSmol ) | |
Рифамицины представляют собой группу антибиотиков , которые синтезируются либо естественным путем бактерией Amycolatopsis rifamycinica , либо искусственно. Они являются подклассом более крупного семейства ансамицинов . Рифамицины особенно эффективны против микобактерий и поэтому используются для лечения туберкулеза , проказы и комплекса Mycobacterium avium инфекций (MAC).
В группу рифамицина входят «классические» препараты рифамицина, а также производные рифамицина рифампицин (или рифампин), рифабутин , рифапентин , рифалазил и рифаксимин . Рифамицин, продаваемый под торговым названием Aemcolo, при некоторых обстоятельствах одобрен в США для лечения диареи путешественников. [1] [2] [3]
Название «рифамицин» (первоначально «рифомицин») произошло от французского фильма 1955 года «Рифифи» . [4] : S402
Бактерия
[ редактировать ]Streptomyces mediterranei был впервые выделен в 1957 году из образца почвы, собранного недалеко от прибрежного города Сен-Рафаэль на юге Франции. Первоначально название было дано двумя микробиологами, работавшими с итальянской фармацевтической компанией Group Lepetit SpA в Милане , итальянкой Грацией Береттой и Пинхасом Маргалитом из Израиля. [5]
В 1969 году бактерия была переименована в Nocardia mediterranei , когда другой ученый по имени Тиманн обнаружил, что ее клеточная стенка типична для видов Nocardia. Затем, в 1986 году, бактерию снова переименовали в Amycolatopsis mediterranei , как первый вид нового рода, поскольку ученый по имени Лешевалье обнаружил, что в клеточной стенке отсутствует миколевая кислота и она не способна инфицироваться фагами Nocardia и Rhodococcus.На основании 16S рибосомальной РНК последовательностей Bala et al. в 2004 году этот вид переименовали в Amycolatopsis rifamycinica .
Первые лекарства
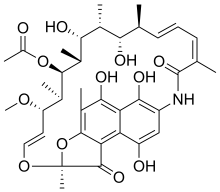
[ редактировать ]Рифамицины были впервые выделены в 1957 году из ферментационной культуры Streptomyces mediterranei в лаборатории Gruppo Lepetit SpA в Милане двумя учеными по имени Пьеро Сенси и Марией Терезой Тимбал, работавшими с израильским ученым Пинхасом Маргалитом. Первоначально было открыто семейство близкородственных антибиотиков, получившее название Рифамицин А, В, С, D, Е. Единственным компонентом этой смеси, достаточно стабильным для выделения в чистом виде, был рифамицин В, который, к сожалению, был малоактивен. Однако дальнейшие исследования показали, что, хотя рифамицин B был практически неактивен, он самопроизвольно окислялся и гидролизовался в водных растворах с образованием высокоактивного рифамицина S. Простое восстановление рифамицина S привело к образованию формы гидрохинона, называемой рифамицин SV, которая стала первым членом этой группы. класс для клинического применения в качестве внутривенного антибиотика. Дальнейшая химическая модификация Рифамицина СВ привела к созданию улучшенного аналога Рифамида, который также был внедрен в клиническую практику, но также был ограничен внутривенным применением. После обширной программы модификаций в конечном итоге был произведен рифампин, который доступен для перорального применения и стал основой терапии туберкулеза. [4]
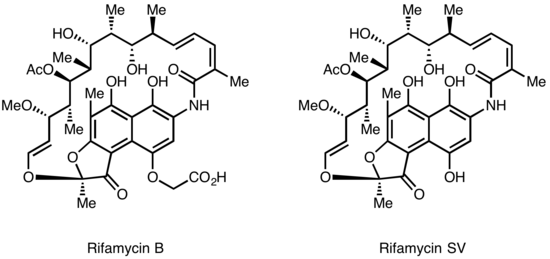
Лепетит подал заявку на патентную защиту рифамицина B в Великобритании в августе 1958 года и в США в марте 1959 года. Британский патент GB921045 был выдан в марте 1963 года, а патент США 3 150 046 был выдан в сентябре 1964 года. помогли решить проблему лекарственно-устойчивого туберкулеза в 1960-х годах.
Клинические испытания
[ редактировать ]Рифамицины используются для лечения многих заболеваний, наиболее важным из которых является туберкулез, связанный с ВИЧ. Систематический обзор клинических испытаний альтернативных схем профилактики активного туберкулеза у ВИЧ-отрицательных лиц с латентным туберкулезом показал, что еженедельный режим приема рифапентина с изониазидом под непосредственным наблюдением в течение трех месяцев был столь же эффективен, как и ежедневный режим самостоятельного приема изониазида. на девять месяцев. Но схема рифапентин-изониазид имела более высокие показатели завершения лечения и более низкие показатели гепатотоксичности . Однако частота побочных эффектов, ограничивающих лечение, была выше при применении режима рифапентин-изониазид. [6]
Рифамицины обладают уникальным механизмом действия, избирательно ингибируя бактериальную ДНК-зависимую РНК-полимеразу , и не проявляют перекрестной резистентности с другими антибиотиками при клиническом использовании. Однако, несмотря на свою активность в отношении бактерий, устойчивых к другим антибиотикам , сами рифамицины страдают от довольно высокой частоты резистентности. По этой причине Рифампин и другие рифамицины обычно используются в сочетании с другими антибактериальными препаратами. Это обычно практикуется при лечении туберкулеза и служит для предотвращения образования мутантов, устойчивых к любому из препаратов в комбинации. Рифампин быстро убивает быстро делящиеся штаммы бацилл, а также «персистирующие» клетки, которые остаются биологически неактивными в течение длительных периодов времени, что позволяет им уклоняться от действия антибиотиков. [7] Кроме того, рифабутин и рифапентин использовались против туберкулеза, приобретенного у ВИЧ-положительных пациентов. Хотя терапия туберкулеза остается наиболее важным применением рифампина, растущая проблема серьезных бактериальных инфекций с множественной лекарственной устойчивостью привела к использованию в некоторых случаях комбинаций антибиотиков, содержащих рифампицин, для их лечения.
Механизм действия
[ редактировать ]Антибактериальная активность рифамицинов основана на ингибировании ДНК-зависимого синтеза РНК бактерий. [8] Это связано с высоким сродством рифамицинов к прокариотической РНК-полимеразе . Селективность рифамицинов зависит от того, что они обладают очень плохим сродством к аналогичному ферменту млекопитающих. Данные о кристаллической структуре антибиотика, связанного с РНК-полимеразой, показывают, что рифамицин блокирует синтез, вызывая сильные стерические столкновения с растущим олигонуклеотидом (механизм «стерической окклюзии»). [9] [10] Если рифамицин связывается с полимеразой после начала процесса удлинения цепи, ингибирования биосинтеза не наблюдается, что соответствует механизму стерической окклюзии. Одноступенчатая устойчивость высокого уровня к рифамицинам возникает в результате изменения одной аминокислоты в бактериальной ДНК-зависимой РНК-полимеразе.
Биосинтез
[ редактировать ]Первые сведения о биосинтезе рифамицинов поступили в результате исследований с использованием стабильного изотопа углерода-13 и ЯМР-спектроскопии для установления происхождения углеродного скелета. Эти исследования показали, что анса-цепь произошла от ацетата и пропионата , как и другие поликетидные антибиотики. хромофор Было показано , что нафталиновый образуется из пропионатной единицы, связанной с семиуглеродной аминогруппой неизвестного происхождения. Общая схема биосинтеза начинается с необычной исходной единицы, 3-амино-5-гидроксибензойной кислоты ( AHBA ), через поликетидный путь типа I ( PKS I ), в котором удлинение цепи осуществляется с использованием 2 ацетатных и 8 пропионатных единиц. [11] Считается, что AHBA возникла из шикиматного пути , однако это не было включено в механизм биосинтеза. Это связано с наблюдением, что 3 аналога аминокислот превращаются в AHBA в бесклеточных экстрактах A. mediterranei . [12]
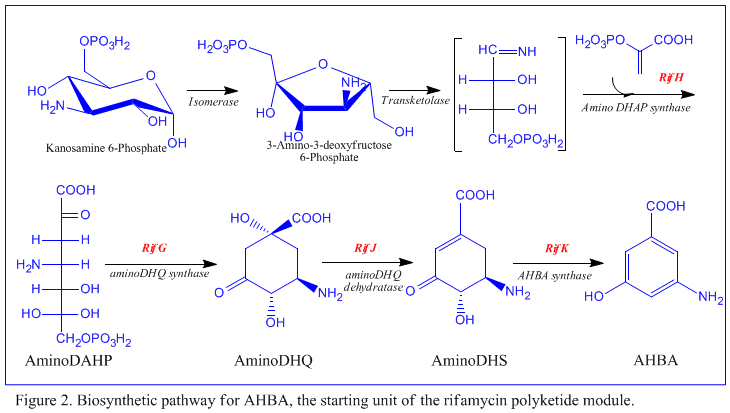
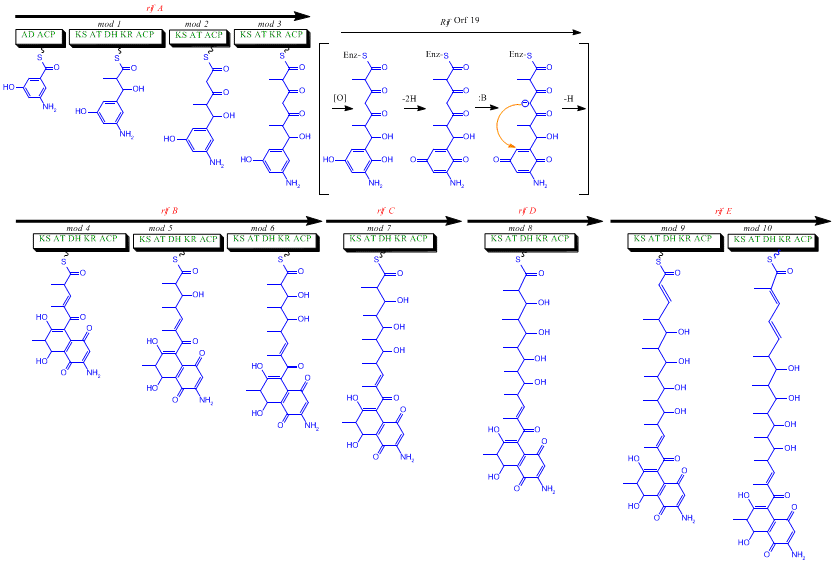

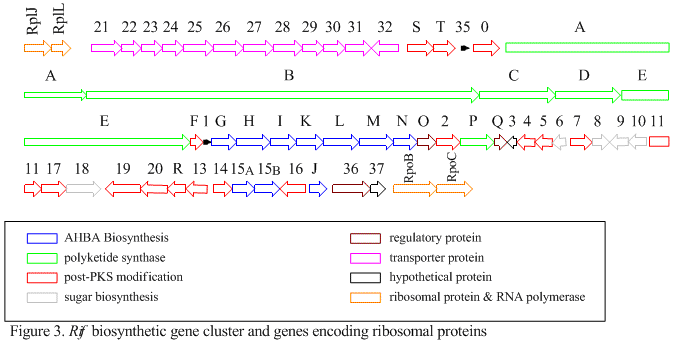
Кластер rif отвечает за биосинтез рифамицинов. Он содержит гены от rifG до rifN , которые, как было показано, биосинтезируют AHBA.[10] RifK , rifL , rifM и rifN Считается, что действуют как трансаминазы , образуя предшественника AHBA канозамина. [13] [14] «RifH» кодирует аминоDAHP-синтазу, которая катализирует конденсацию между 1-дезокси-1-имино-d-эритрозо-4-фосфатом и фосфоенолпируватом . [15] От RifA до rifE кодируют модуль поликетидсинтазы I типа, причем загрузочный модуль представляет собой нерибосомальную пептидсинтетазу . В целом, rifA-E собирает линейный ундекекетид, за которым следует rifF , который кодирует амидсинтазу и вызывает высвобождение ундекекетида и образование структуры макролактама. Более того, кластер rif содержит различные регуляторные белки и гликозилирующие гены, которые, по-видимому, молчат. Другие типы генов, по-видимому, осуществляют постсинтазные модификации исходного поликетида.
Производные
[ редактировать ]В 1966 году компания Lepetit представила рифампицин, активный для перорального применения рифамицин. [16] Рифабутин , производное рифамицина S, был изобретен итальянским производителем лекарств Achifar в 1975 году и появился на рынке США в 1992 году. [16] Компания Hoechst Marion Roussel (ныне часть Aventis ) представила рифапентин на рынке США в 1998 году, а Ачифар синтезировал его в 1965 году. [17] Использование рифапентина для лечения туберкулеза легких остается редким , и лечение рифапентином проводится на основе тщательного отбора пациентов. [18]
Рифаксимин представляет собой пероральный рифамицин, продаваемый в США компанией Salix Pharmaceuticals , который плохо всасывается из кишечника. Его использовали для лечения печеночной энцефалопатии и диареи путешественников . [19]
Доступные рифамицины
[ редактировать ]- Рифампицин или Рифампин
- Рифабутин
- Рифапентин
- Рифаксимин
- Эмколо [20] [21]
Ссылки
[ редактировать ]- ^ Линь С.В., Линь CJ, Ян JC (август 2017 г.). «Рифамицин СВ ММХ для лечения диареи путешественников». Экспертное заключение по фармакотерапии . 18 (12): 1269–1277. дои : 10.1080/14656566.2017.1353079 . ПМИД 28697313 . S2CID 8853242 .
- ^ «FDA одобрило новый препарат для лечения диареи путешественников» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 16 ноября 2018 года . Проверено 19 ноября 2018 г.
- ^ «Пакет одобрения лекарств: Aemcolo (рифамицин)» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 21 декабря 2018 года . Проверено 27 декабря 2019 г.
- ^ Jump up to: а б Сенси, П. (1983). «История развития рифампицина». Клинические инфекционные болезни . 5 (Приложение 3): S402–S406. doi : 10.1093/clinids/5.Supplement_3.S402 . ПМИД 6635432 .
- ^ Маргалит П., Беретта Г (1960). «Рифомицин. XI. Таксономическое исследование Streptomyces mediterranei nov. sp». Микопатология и прикладная микология . 13 (4): 321–330. дои : 10.1007/BF02089930 . ISSN 0301-486X . S2CID 23241543 .
- ^ Шарма С.К., Шарма А., Кадираван Т., Тарьян П. (июль 2013 г.). «Рифамицины (рифампицин, рифабутин и рифапентин) в сравнении с изониазидом для профилактики туберкулеза у ВИЧ-отрицательных людей с риском развития активного туберкулеза» . Кокрановская база данных систематических обзоров . 2013 (7): CD007545. дои : 10.1002/14651858.CD007545.pub2 . ПМК 6532682 . ПМИД 23828580 .
- ^ Позняк А.Л., Миллер Р., Ормерод Л.П. (март 1999 г.). «Лечение туберкулеза у ВИЧ-инфицированных» . СПИД . 13 (4): 435–445. дои : 10.1097/00002030-199907300-00035 . ПМИД 10197371 .
- ^ Кальвори С., Фронтали Л., Леони Л., Течче Дж. (июль 1965 г.). «Влияние рифамицина на синтез белка». Природа . 207 (995): 417–418. Бибкод : 1965Natur.207..417C . дои : 10.1038/207417a0 . ПМИД 4957347 . S2CID 4144738 .
- ^ Кэмпбелл Э.А., Коржева Н., Мустаев А., Мураками К., Наир С., Гольдфарб А., Дарст С.А. (март 2001 г.). «Структурный механизм ингибирования рифампицином бактериальной РНК-полимеразы» . Клетка . 104 (6): 901–912. дои : 10.1016/S0092-8674(01)00286-0 . ПМИД 11290327 . S2CID 8229399 .
- ^ Феклистов А., Меклер В., Цзян К., Вестблэйд Л.Ф., Ирщик Х., Янсен Р. и др. (сентябрь 2008 г.). «Рифамицины не действуют путем аллостерической модуляции связывания Mg2+ с активным центром РНК-полимеразы» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (39): 14820–14825. Бибкод : 2008PNAS..10514820F . дои : 10.1073/pnas.0802822105 . ПМК 2567451 . ПМИД 18787125 .
- ^ Ланчини Дж., Каваллери Б. (1997). «Ванкомицин и другие гликопептиды». В Строле GR (ред.). Биотехнология антибиотиков . Нью-Йорк, США: Марсель Деккер. п. 521.
- ^ Флосс Х.Г., Ю Т.В. (февраль 2005 г.). «Рифамицин-способ действия, резистентность и биосинтез». Химические обзоры . 105 (2): 621–632. дои : 10.1021/cr030112j . ПМИД 15700959 .
- ^ Го Дж., Фрост Дж.В. (сентябрь 2002 г.). «Биосинтез канозамина: вероятный источник атома азота аминосикиматного пути». Журнал Американского химического общества . 124 (36): 10642–10643. дои : 10.1021/ja026628m . ПМИД 12207504 .
- ^ Аракава К., Мюллер Р., Махмуд Т., Ю Т.В., Флосс Х.Г. (сентябрь 2002 г.). «Характеристика аминосикиматного пути ранней стадии образования 3-амино-5-гидроксибензойной кислоты: белок RifN специфически превращает канозамин в канозамин-6-фосфат». Журнал Американского химического общества . 124 (36): 10644–10645. дои : 10.1021/ja0206339 . ПМИД 12207505 .
- ^ Го Дж., Фрост Дж.В. (январь 2002 г.). «Биосинтез 1-дезокси-1-имино-D-эритрозо-4-фосфата: определяющий метаболит в аминосикиматном пути». Журнал Американского химического общества . 124 (4): 528–529. дои : 10.1021/ja016963v . ПМИД 11804477 .
- ^ Jump up to: а б Редди Д.С., Синха А., Кумар А., Сайни В.К. (ноябрь 2022 г.). «Реорганизация и перепрофилирование лекарств: значительный и быстрый подход к открытию лекарств от туберкулеза». Архив фармации . 355 (11): e2200214. дои : 10.1002/ardp.202200214 . ПМИД 35841594 . S2CID 250582950 .
- ^ Гульельметти Л., Гюнтер Г., Леу С., Чирилло Д., Дуарте Р., Гарсиа-Бастейру А.Л. и др. (май 2022 г.). «Доступ к рифапентину в Европе: растущая обеспокоенность по поводу ключевого компонента лечения туберкулеза» . Европейский респираторный журнал . 59 (5). дои : 10.1183/13993003.00388-2022 . ПМЦ 9186306 . ПМИД 35589114 .
- ^ Мунсифф СС, Камбили С., Ахуджа С.Д. (декабрь 2006 г.). «Рифапентин для лечения туберкулеза легких» . Клинические инфекционные болезни . 43 (11): 1468–1475. дои : 10.1086/508278 . ПМИД 17083024 .
- ^ Ожетти В., Лауритано Э.К., Барбаро Ф., Миньеко А., Айнора М.Э., Фонтана Л. и др. (июнь 2009 г.). «Фармакология рифаксимина и клиническое значение». Экспертное заключение по метаболизму и токсикологии лекарственных средств . 5 (6): 675–682. дои : 10.1517/17425250902973695 . ПМИД 19442033 . S2CID 41970585 .
- ^ «Таблетки замедленного высвобождения AEMCOLO (рифамицин) для перорального применения» (PDF) . Овен Фармасьютикалс, Инк . Управление по контролю за продуктами и лекарствами США. 2018.
- ^ «Aemcolo Oral: использование, побочные эффекты, взаимодействие, изображения, предупреждения и дозировка» . ВебМД .
Дальнейшее чтение
[ редактировать ]- Сенси П., Маргалит П., Тимбал М.Т. (1959). «Рифомицин, новый антибиотик; предварительный отчет». Иль Фармако; Научное издание . 14 (2): 146–147. ПМИД 13639988 . - статья, объявляющая об открытии рифамицинов.
- Тиманн Дж. Э., Зукко Дж., Пелицца Дж. (1969). «Предложение о переводе Streptomyces mediterranei Margalith и Beretta 1960 в род Nocardia как Nocardia mediterranea (Margalith и Beretta) comb. nov». Архив микробиологии . 67 (2): 147–155. дои : 10.1007/BF00409680 . ПМИД 5386179 . S2CID 19596120 . - статья, в которой Streptomyces mediterranei была переименована в Nocardia mediterranei .
- Лешевалье М.П., Праузер Х., Лабеда Д.П., Руан Дж.С. (январь 1986 г.). «Два новых рода нокардиоформных актиномицетов: Amycolata gen. nov. и Amycolatopsis gen. nov» . Международный журнал систематической и эволюционной микробиологии . 36 (1): 29–37. дои : 10.1099/00207713-36-1-29 . - статья, переименовавшая Nocardia mediterranei в Amycolatopsis mediterranei .
- Бала С., Кханна Р., Дадвал М., Прабагаран С.Р., Шиваджи С., Каллум Дж., Лал Р. (июль 2004 г.). «Реклассификация Amycolatopsis mediterranei DSM 46095 в Amycolatopsis rifamycinica sp. nov» . Международный журнал систематической и эволюционной микробиологии . 54 (Часть 4): 1145–1149. дои : 10.1099/ijs.0.02901-0 . ПМИД 15280283 . - газета с последним изменением названия