Грепафлоксацин
 | |
| Клинические данные | |
|---|---|
| AHFS / Drugs.com | Много информации для потребителей |
| код АТС | |
| Фармакокинетические данные | |
| Связывание с белками | 50% |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.159.692 |
| Химические и физические данные | |
| Формула | С 19 Ч 22 Ф Н 3 О 3 |
| Молярная масса | 359.401 g·mol −1 |
| 3D model ( JSmol ) | |
| Хиральность | Рацемическая смесь |
| (проверять) | |
Грепафлоксацин (торговое название Raxar , Glaxo Wellcome ) представлял собой пероральный фторхинолоновый антибактериальный препарат широкого спектра действия, используемый для лечения бактериальных инфекций . Грепафлоксацин был отозван с рынков во всем мире в 1999 г. [1] [2] из-за способности препарата вызывать потенциально смертельную сердечную аритмию . [3]
Клиническое использование
[ редактировать ]Грепафлоксацин использовался для лечения обострений хронического бронхита, вызванных чувствительными бактериями (например, Haemophilus influenzae , Streptococcus pneumoniae , Moraxella cataralis ), [4] [5] [6] внебольничная пневмония (в т.ч. вызванная помимо вышеперечисленных возбудителей Mycoplasma pneumoniae ) [7] [8] гонорея , негонококковый уретрит и цервицит (например, вызванные Chlamydia trachomatis или Ureaplasma urealyticum ). [9] [10]
Синтез
[ редактировать ]Получение хинолонов, несущих заместитель в положении 5, осложняется большей электрофильностью 8-го положения. Одна из схем решения проблемы состоит в том, чтобы заблокировать доступ к позиции 8, предварительно добавив в этот центр легкосъемную группу.
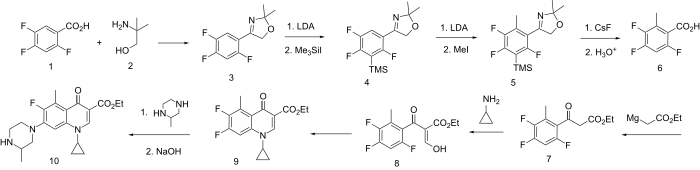
Схема начинается с превращения карбоновой кислоты ( 1 ) в ее производное диметилоксазолина ( 3 ) путем реакции с аминометилпропанолом ( 2 ). Затем диизопропиламид лития (LDA) удаляет протон из 8-го положения; обработка этого аниона триметилсилилиодидом приводит к образованию силилированного промежуточного соединения ( 4 ). Затем второй раунд LDA генерирует карбанион в единственной открытой позиции; реакция с йодидом метила приводит к соответствующему 5-метилпроизводному ( 5 ). Обработка этого продукта фторидом цезия разрывает связь углерод-кремний, удаляя силильную группу; затем водная кислота гидролизует оксазолин с образованием свободной кислоты ( 6 ). Этот последний промежуточный продукт затем превращается в хинолон ( 9 ). [13] по существу по той же схеме, что и для получения дифлоксацина , с той лишь разницей, что удлинение цепи осуществляется с помощью реактива Гриньяра этилбромацетата . Обработка ( 9 ) 2-метилпиперазином протекает по реакции по менее затрудненной из двух аминогрупп; затем омыление дает грепафлоксацин ( 10 ).
Стереохимия
[ редактировать ]Грепафлоксацин содержит стереоцентр и состоит из двух энантиомеров. Это рацемат , то есть смесь ( R )- и ( S )-форм в соотношении 1:1:
| Энантиомеры грепафлоксацина | |
|---|---|
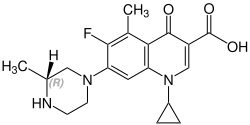 ( R )-грепафлоксацин Номер CAS: 146761-68-4 | 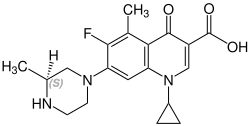 ( S )-грепафлоксацин Номер CAS: 146761-69-5 |
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Glaxo Wellcome добровольно отозвала Раксар (грепафлоксацин)» (PDF) . Управление по контролю за продуктами и лекарствами . Проверено 12 октября 2014 г.
- ^ «Отзыв продукта: RAXAR (грепафлоксацин гидрохлорид) таблетки по 600 мг, таблетки по 400 мг и таблетки по 200 мг» . Управление по контролю за продуктами и лекарствами США . Проверено 12 октября 2014 г.
- ^ Шпрандел К.А., Родволд К.А. (2003). «Безопасность и переносимость фторхинолонов». Клинический краеугольный камень . Приложение 3: S29–S36. дои : 10.1016/s1098-3597(03)90027-5 . ПМИД 14992418 .
- ^ Чодош С., Лакшминараян С., Сварц Х., Брайш С. (январь 1998 г.). «Эффективность и безопасность 10-дневного курса 400 или 600 мг грепафлоксацина один раз в день для лечения острых бактериальных обострений хронического бронхита: сравнение с 10-дневным курсом ципрофлоксацина по 500 мг два раза в день» . Антимикробные средства и химиотерапия . 42 (1): 114–120. дои : 10.1128/AAC.42.1.114 . ПМЦ 105465 . ПМИД 9449270 .
- ^ Ланган С.Э., Крэнфилд Р., Брайш С., Петтит Р. (декабрь 1997 г.). «Рандомизированное двойное слепое исследование грепафлоксацина по сравнению с амоксициллином у пациентов с острыми бактериальными обострениями хронического бронхита» . Журнал антимикробной химиотерапии . 40 Приложение А: 63–72. дои : 10.1093/jac/40.suppl_1.63 . ПМИД 9484875 .
- ^ Ланган С.Э., Цук П., Фогель Ф., МакИвор А., Пейрцчала В., Смакал М. и др. (октябрь 1999 г.). «Рандомизированное двойное слепое исследование короткого курса (5 дней) грепафлоксацина по сравнению с 10-дневным курсом кларитромицина у пациентов с острыми бактериальными обострениями хронического бронхита» . Журнал антимикробной химиотерапии . 44 (4): 515–523. дои : 10.1093/jac/44.4.515 . ПМИД 10588313 .
- ^ О'Догерти Б., голландец Д.А., Петтит Р., Мароли А. (декабрь 1997 г.). «Рандомизированное двойное слепое сравнительное исследование грепафлоксацина и амоксициллина при лечении пациентов с внебольничной пневмонией». Журнал антимикробной химиотерапии . 40 Приложение А: 73–81. дои : 10.1093/jac/40.suppl_1.73 . ПМИД 9484876 .
- ^ Фелмингем Д. (март 2000 г.). «Респираторные патогены: оценка моделей резистентности в Европе и потенциальная роль грепафлоксацина в лечении пациентов с инфекциями, вызванными этими микроорганизмами». Журнал антимикробной химиотерапии . 45 (90002): 1–8. дои : 10.1093/jac/45.suppl_2.1 . ПМИД 10719006 .
- ^ Риджуэй Г.Л., Салман Х., Роббинс М.Дж., Денсер С., Фелмингем Д. (декабрь 1997 г.). «Активность грепафлоксацина in vitro в отношении видов Chlamydia, Mycoplasma spp., Ureaplasma urealyticum и Legionella spp» . Журнал антимикробной химиотерапии . 40 Приложение А: 31–34. дои : 10.1093/jac/40.suppl_1.31 . ПМИД 9484871 .
- ^ Маккормак В.М., Мартин Д.Х., Хук Э.В., Джонс Р.Б. (1998). «Ежедневный пероральный прием грепафлоксацина по сравнению с пероральным доксициклином два раза в день при лечении эндоцервикальной инфекции Chlamydia trachomatis» . Инфекционные болезни в акушерстве и гинекологии . 6 (3): 109–115. дои : 10.1155/S1064744998000210 . ПМЦ 1784789 . ПМИД 9785106 .
- ^ Хаген С.Е., Домагала Дж.М., Хейфец К.Л., Джонсон Дж. (март 1991 г.). «Синтез и биологическая активность 5-алкил-1,7,8-тризамещенных-6-фторхинолин-3-карбоновых кислот». Журнал медицинской химии . 34 (3): 1155–1161. дои : 10.1021/jm00107a040 . ПМИД 2002456 .
- ^ WO 8906649 ; Эйдем, патент США № 4 920 120 (1989, 1990, оба принадлежат Warner-Lambert).
- ^ Хаген С.Е., Домагала Дж.М. (1990). «Синтез 5-метил-4-оксохинолинкарбоновых кислот». Журнал гетероциклической химии . 27 (6): 1609–1616. дои : 10.1002/jhet.5570270616 .