Микоплазма пневмонии
Возможно, эту статью необходимо реорганизовать, чтобы она соответствовала рекомендациям Википедии по оформлению . Причина: Фотографии. ( декабрь 2023 г. ) |
| Микоплазма пневмонии | |
|---|---|
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Микоплазматота |
| Сорт: | Молликуты |
| Заказ: | Микоплазматы |
| Семья: | Микоплазмовые |
| Род: | Микоплазма |
| Разновидность: | М. пневмония |
| Биномиальное имя | |
| Микоплазма пневмонии Сомерсон и др., 1963 г. | |
Mycoplasma pneumoniae без клеточной стенки — очень мелкая бактерия класса Mollicutes . Это человеческий патоген, вызывающий микоплазменную пневмонию , форму атипичной бактериальной пневмонии, связанную с болезнью холодовых агглютининов . M. pneumoniae характеризуется отсутствием клеточной стенки пептидогликана и, как следствие, устойчивостью ко многим антибактериальным агентам . Сохранение инфекции M. pneumoniae даже после лечения связано с ее способностью имитировать состав поверхности клеток-хозяев .
Открытие и история
[ редактировать ]В 1898 году Нокар и Ру выделили возбудитель, предположительно вызывающий пневмонию крупного рогатого скота, и назвали его микробом перипневмонии. [1] [2] [3] [4] [5] [6] Микроорганизмы из других источников, обладающие свойствами, сходными с организмом плевропневмонии (ППО) крупного рогатого скота, вскоре стали известны как плевропневмоноподобные организмы (ППЛО), но их истинная природа осталась неизвестной. [1] [2] [3] [4] Позже было доказано, что многие PPLO являются причиной пневмоний и артритов у некоторых низших животных. [1] [7] [8] [9]
В 1944 году Монро Итон использовала куриные яйца с эмбрионом для культивирования возбудителя, который считается причиной первичной атипичной пневмонии человека (ПАП), широко известной как «ходячая пневмония». [10] Этот неизвестный организм стал известен как «агент Итона». [11] В то время использование компанией Eaton яиц с эмбрионами, которые затем использовались для культивирования вирусов, подтвердило идею о том, что агент Eaton был вирусом. Тем не менее, было известно, что ПАП поддается лечению антибиотиками широкого спектра действия , что делает возможным подозрение на вирусную этиологию. [1] [2] [7] [12] [13]
Роберт Чанок , исследователь из НИЗ , изучавший агент Итона как вирус, посетил Институт Вистар в Филадельфии в 1961 году, чтобы получить клеточную культуру нормального штамма клеток человека, разработанного Леонардом Хейфликом . Известно, что этот клеточный штамм чрезвычайно чувствителен к выделению и выращиванию человеческих вирусов. Чанок рассказал Хейфлику о своих исследованиях агента Итона и о своей уверенности в том, что его вирусная природа сомнительна. Хотя Хейфлик мало что знал о текущих исследованиях этого агента, его докторская диссертация была посвящена болезням животных, вызываемым PPLO. Хейфлик знал, что многие низшие животные страдают пневмониями, вызванными PPLO (позже получившими название микоплазмы ). Хейфлик предположил, что агент Итона может быть микоплазмой, а не вирусом.Чанок никогда не слышал о микоплазмах и по просьбе Хейфлика прислал ему яичный желток, содержащий агент Итона. [1] [4] [14] [15] [16] [17]
новый состав агара и жидкой среды, Используя разработанный им [14] Хейфлик выделил из яичного желтка уникальную микоплазму. Вскоре Чанок и Хейфлик доказали, что это возбудитель ПАП. [14] [18] [19] [20] Когда об этом открытии стало известно Эмми Клинебергер-Нобель из Института Листера в Лондоне, ведущему мировому специалисту по этим организмам, она предложила назвать этот организм Mycoplasma hayflickiae . [21] Хейфлик возражал в пользу Mycoplasma pneumoniae . [22] [23]
Этот самый маленький свободноживущий микроорганизм был первым, который был выделен и оказался причиной заболеваний человека. За свое открытие Хейфлик был удостоен Президентской премии Международной организации микоплазмологии. Инвертированный микроскоп, под которым Хейфлик обнаружил Mycoplasma pneumoniae, хранится в Смитсоновском институте . [20]
Таксономия и классификация
[ редактировать ]В этом разделе отсутствует информация о микоплазмоидах. ( декабрь 2023 г. ) |
Термин «микоплазма» ( «mykes» означает «грибок», а «плазма » означает «сформированный») происходит от грибкового роста некоторых видов микоплазмы. [6] Микоплазмы были классифицированы как Mollicutes («mollis», что означает «мягкий», и «cutis», что означает «кожа») в 1960 году из-за их небольшого размера и генома , отсутствия клеточной стенки , низкого содержания G+C и необычных потребностей в питании . [6] [24] M. pneumoniae также относят к видам аргинин неферментирующим . [25] Микоплазмы далее классифицируются по составу последовательностей 16s рРНК . Все микоплазмы группы pneumoniae обладают схожими вариациями 16s рРНК, уникальными для этой группы, из которых M. pneumoniae имеет 6,3% вариаций в консервативных областях , что позволяет предположить, что микоплазмы образовались в результате дегенеративной эволюции из группы грамположительных эубактерий , включающей бациллы , стрептококки. и лактобактерии . [6] [24] [25] M. pneumoniae является представителем семейства Mycoplasmataceae и порядка Mycoplasmatales . [6]
Клеточная биология
[ редактировать ]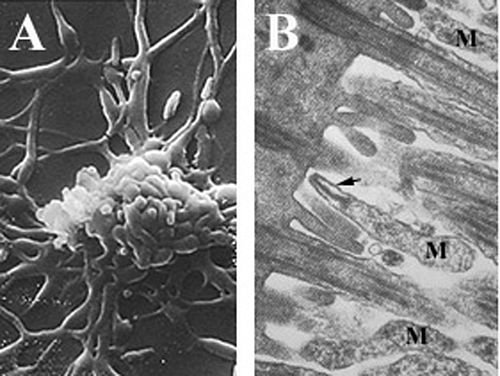
Микоплазмы, которые являются одними из самых маленьких самовоспроизводящихся организмов, представляют собой паразитические виды, у которых нет клеточной стенки и периплазматического пространства , имеют уменьшенный геном и ограниченную метаболическую активность. [6] [25] [26] Клетки Mycoplasma pneumoniae имеют удлиненную форму, ширину примерно 0,1–0,2 мкм (100–200 нм ) и длину 1–2 мкм (1000–2000 нм). Чрезвычайно маленький размер клеток означает, что их невозможно исследовать с помощью световой микроскопии ; стереомикроскоп . необходим для изучения морфологии колоний M. pneumoniae мкм , длина которых обычно составляет менее 100 [6] Неспособность синтезировать клеточную стенку пептидогликана обусловлена отсутствием генов, кодирующих его образование, и приводит к повышению важности поддержания осмотической стабильности во избежание высыхания . [6] Отсутствие клеточной стенки также требует усиленной поддержки клеточной мембраны (усиленной стеринами), которая включает в себя жесткий цитоскелет, состоящий из сложной белковой сети и, возможно, внеклеточной капсулы для облегчения присоединения к клетке-хозяину . [6] M. pneumoniae — единственные бактериальные клетки, которые содержат холестерин в клеточной мембране (полученный от хозяина) и содержат больше генов, кодирующих вариации мембранных липопротеинов , чем другие микоплазмы. [25] которые, как полагают, связаны с его паразитическим образом жизни. Клетки M. pneumoniae прикрепления также обладают органеллой , которая по неизвестному механизму используется в скользящей подвижности организма. [6]
Геномика и метаболическая реконструкция
[ редактировать ]Секвенирование генома M. pneumoniae в 1996 году показало, что его размер составляет 816 394 п.н. [24] Геном содержит 687 генов, кодирующих белки, из которых около 56,6% кодируют важные метаболические ферменты ; особенно те, которые участвуют в гликолизе и органических кислот ферментации . [6] [24] [25] [27] Следовательно, M. pneumoniae очень восприимчивы к потере ферментативной функции из-за генных мутаций , поскольку единственные буферные системы против функциональной потери из-за точковых мутаций предназначены для поддержания пентозофосфатного пути и метаболизма нуклеотидов . [27] Предполагается, что потеря функции в других путях компенсируется метаболизмом клетки-хозяина. [27] Помимо потенциальной потери функции путей, в редуцированном геноме M. pneumoniae совершенно отсутствует ряд путей, включая цикл ТСА , дыхательную цепь транспорта электронов и биосинтеза пути аминокислот , жирных кислот , холестерина , пуринов и пиримидинов. . [6] [25] [27] Эти ограничения делают M. pneumoniae зависимыми от систем импорта в плане приобретения необходимых строительных блоков от хозяина или окружающей среды, которые невозможно получить гликолитическими путями . [25] [27] Наряду с производством энергозатратных белков и РНК , большая часть энергетического метаболизма тратится на поддержание протонных градиентов (до 80%) из-за высокого соотношения площади поверхности к объему клеток M. pneumoniae . Только 12–29% энергетического метаболизма направлено на рост клеток , что необычно мало для бактериальных клеток и считается адаптацией к их паразитическому образу жизни. [27]
Альтернативный генетический код
[ редактировать ]В отличие от других бактерий, M. pneumoniae использует кодон UGA для кодирования триптофана, а не в качестве стоп-кодона. [6] [24]
Сравнительная метаболомика
[ редактировать ]Mycoplasma pneumoniae имеет уменьшенный метаболом по сравнению с другими видами бактерий . [28] Это означает, что у возбудителя меньше метаболических реакций по сравнению с другими видами бактерий, такими как B.subtilis и Escherichia coli . [28] [29]

Поскольку Mycoplasma pneumoniae имеет уменьшенный геном, у нее меньше общих путей и метаболических ферментов, что способствует ее более линейному метаболому. [28] Линейный метаболом приводит к тому, что Mycoplasma pneumoniae становится менее адаптируемой к внешним факторам. [28] Кроме того, поскольку Mycoplasma pneumoniae имеет уменьшенный геном, большинство ее метаболических ферментов необходимы. [28] В этом отличие от другого модельного организма, Escherichia coli , у которого только 15% метаболических ферментов необходимы. [28] Таким образом, линейная топология метаболома Mycoplasma pneumoniae приводит к снижению эффективности ее метаболических реакций, но при этом сохраняет аналогичные уровни концентраций метаболитов, клеточной энергетики, адаптивности и глобальной экспрессии генов. [28]
| Разновидность | М. пневмония | л. молока | Б. субтилис | кишечная палочка |
|---|---|---|---|---|
| Среднее количество путей | 8.17 | 5.37 | 7.54 | 6.12 |
В таблице выше показана средняя длина пути метаболомов M. pneumoniae , E. coli , L. Lactis и B. subtilis . [28] Это число описывает, по сути, среднее количество реакций, происходящих в метаболоме. Mycoplasma pneumoniae в среднем имеет большее количество реакций на каждый путь внутри своего метаболома по сравнению с другими модельными видами бактерий. [28]
Одним из эффектов Mycoplasma pneumoniae является более длительное время его дупликации. уникального метаболома [28] Для размножения патогена в среднем требуется значительно больше времени по сравнению с бактериями других модельных организмов. [28] Это может быть связано с тем, что метаболом Mycoplasma pneumoniae менее эффективен, чем метаболом Escherichia coli . [28]
Метаболом Mycoplasma pneumoniae также может быть информативным при анализе ее патогенеза. [31] Обширное изучение метаболической сети этого организма привело к выявлению биомаркеров , которые потенциально могут выявить наличие серьезных осложнений, которые могут вызвать бактерии. [31] Метаболомика все чаще используется как полезный инструмент для проверки биомаркеров инфекционных патогенов. [31]
Хост и размножение
[ редактировать ]Mycoplasma pneumoniae размножается исключительно за счет паразитирования на млекопитающих. Таким образом, размножение зависит от прикрепления к клетке-хозяину. По мнению Уэйтса и Токингтона, специализированное размножение происходит посредством « бинарного деления , временно связанного с дублированием прикрепляющейся к нему органеллы, которая мигрирует к противоположному полюсу клетки во время репликации и перед разделением нуклеоида ». [6] Мутации , влияющие на формирование органеллы прикрепления, не только препятствуют подвижности и делению клеток , но и снижают способность клеток M. pneumoniae прикрепляться к клетке-хозяину. [25]
Патогенность
[ редактировать ]
Mycoplasma pneumoniae паразитирует дыхательных путей в эпителии человека. [6] Считается, что прикрепление к респираторным эпителиальным клеткам происходит через органеллу прикрепления с последующим уклонением от хозяина иммунной системы за счет внутриклеточной локализации и корректировки состава клеточной мембраны для имитации мембраны клетки-хозяина. [ нужна ссылка ]
Цитоадгерентность
[ редактировать ]Прикрепление M. pneumoniae к клетке-хозяину (обычно к клетке дыхательных путей , но иногда к эритроцитам или клеткам слизистой оболочки мочеполовой системы ) является инициирующим событием пневмонического заболевания и связанных с ним симптомов. [6] Специализированная органелла прикрепления представляет собой полярное , электронно-плотное и удлиненное удлинение клетки, которое облегчает подвижность и прикрепление к клеткам-хозяевам. [6] [25] Он состоит из центральной нити, окруженной внутрицитоплазматическим пространством , а также ряда адгезинов , а также структурных и вспомогательных белков, локализованных на кончике органеллы. [6] [25] Известно, что различные белки способствуют формированию и функционированию органеллы прикрепления, включая вспомогательные белки HMW1–HMW5, P30, P56 и P90, которые придают структуру и поддержку адгезина, а также P1, P30 и P116, которые непосредственно участвуют в вложение. [6] [32] [33] Эта сеть белков участвует не только в инициации образования и адгезии органелл прикрепления, но также и в подвижности . [33] Адгезин P1 (чувствительный к трипсину белок) представляет собой белок массой 120 кДа , плотно сгруппированный на поверхности кончика органеллы прикрепления вирулентных микоплазм. [6] [33] [34] Как наличие P1, так и его концентрация на поверхности клетки необходимы для прикрепления M. pneumoniae к клетке-хозяину. Было показано, что клетки M. pneumoniae , обработанные моноклональными антителами , специфичными к иммуногенному С-концу адгезина P1, подавляют свою способность прикрепляться к поверхности клетки-хозяина примерно на 75%, что позволяет предположить, что P1 является основным компонентом адгезии. [6] [32] [33] Эти антитела также снижают способность клетки быстро скользить , что может способствовать снижению прилипания к хозяину, препятствуя их способности определять местонахождение клетки-хозяина. [32] Кроме того, мутации в P1 или деградация под действием трипсина приводят к образованию авирулентных клеток M. pneumoniae . [6] Потеря белков в цитоскелете, участвующих в локализации P1 в структуре кончика, таких как HMW1–HMW3, также вызывает авирулентность из-за отсутствия кластеризации адгезина. [33] [34] Другим белком, который, как считается, играет важную роль в адгезии, является P30, поскольку клетки M. pneumoniae с мутациями в этом белке или клетки, в которых были выработаны антитела против P30, неспособны прикрепляться к клеткам-хозяевам. [6] [25] P30 не участвует в локализации P1 в структуре кончика, поскольку P1 переносится к органелле прикрепления у мутантов P30, а скорее может функционировать как рецептор -связывающий вспомогательный адгезин. [25] [34] Мутанты P30 также демонстрируют отчетливые морфологические особенности, такие как множественные доли и округлую форму, а не удлиненную, что позволяет предположить, что P30 может взаимодействовать с цитоскелетом во время формирования органеллы прикрепления. [25] Ряд компонентов поверхности эукариотических клеток участвует в прикреплении клеток M. pneumoniae дыхательных путей к эпителию . Среди них сиалогликоконъюгаты , сульфатированные гликолипиды , гликопротеины , фибронектин и рецепторы нейраминовой кислоты . [6] [32] [35] Лектины на поверхности бактериальных клеток способны связывать олигосахаридные цепи на гликолипидах и гликопротеинах для облегчения прикрепления, в дополнение к белкам TU и пируватдегидрогеназе E1β , которые связываются с фибронектином. [6] [32]

Внутриклеточная локализация
[ редактировать ]Mycoplasma pneumoniae Известно, что уклоняется от обнаружения иммунной системой хозяина , устойчива к лечению антибиотиками и проникает через барьеры слизистой оболочки , что может быть связано с ее способностью сливаться с клетками хозяина и выживать внутриклеточно . [6] [26] Помимо непосредственной физической близости M. pneumoniae и клеток-хозяев, слиянию может способствовать отсутствие клеточной стенки и специфических клеточной мембраны компонентов , таких как холестерин (1). Внутренняя локализация может привести к хроническим или латентным инфекциям, поскольку M. pneumoniae способна персистировать , синтезировать ДНК и реплицироваться внутри клетки-хозяина даже после лечения антибиотиками. [26] Точный механизм внутриклеточной локализации неизвестен, однако возможность секвестрации цитоплазмы внутри хозяина объясняет трудность полной элиминации M. pneumoniae инфекции у больных людей. [6]
Иммунный ответ
[ редактировать ]Помимо уклонения от иммунной системы хозяина за счет внутриклеточной локализации, M. pneumoniae может изменять состав своей клеточной мембраны, имитируя мембрану клетки-хозяина и избегая обнаружения клетками иммунной системы . Клетки M. pneumoniae обладают рядом белковых и гликолипидных антигенов , которые вызывают иммунные реакции , но вариации этих поверхностных антигенов позволяют инфекции сохраняться достаточно долго, чтобы клетки M. pneumoniae сливались с клетками-хозяевами и избегали обнаружения. Сходство состава M. pneumoniae и клеточных мембран человека также может приводить к аутоиммунным реакциям в некоторых органах и тканях. [6]
Цитотоксичность и воздействие на организм
[ редактировать ]Основным цитотоксическим действием M. pneumoniae является локальное нарушение тканевой и клеточной структуры вдоль эпителия дыхательных путей вследствие его непосредственной близости к клеткам-хозяевам. Прикрепление бактерий к клеткам-хозяевам может привести к потере ресничек , снижению метаболизма , биосинтеза и импорта макромолекул и, в конечном итоге, инфицированные клетки могут отделиться от эпителиальной выстилки. [6] M. pneumoniae производит уникальный фактор вирулентности, известный как токсин внебольничного респираторного дистресс-синдрома (CARDS). [36] Токсин CARDS, скорее всего, способствует колонизации и патогенным путям M. pneumoniae, что приводит к воспалению и дисфункции дыхательных путей. Кроме того, образование перекиси водорода является ключевым фактором вирулентности инфекций, вызванных M. pneumoniae . [6] Прикрепление M. pneumoniae к эритроцитам обеспечивает диффузию перекиси водорода от бактерий к клетке-хозяину без детоксикации каталазой липидных или пероксидазой , которые могут повредить клетку-хозяина за счет восстановления глутатиона , повреждения мембран и денатурации белков . [6] [35] Местное повреждение также может быть результатом приобретения лактоферрина и последующего образования гидроксильного радикала , супероксид-аниона и пероксида . [6] Цитотоксические эффекты инфекций, вызванных M. pneumoniae, выражаются в таких распространенных симптомах, как кашель и раздражение легких , которые могут сохраняться в течение нескольких месяцев после стихания инфекции. Местное воспаление вызванных инфекцией, и гиперреактивность, вызванная выработкой цитокинов, связаны с хроническими состояниями, такими как бронхиальная астма , а также с прогрессированием симптомов у людей с муковисцидозом и ХОБЛ . [6]
См. также
[ редактировать ]| Внешние видео | |
|---|---|
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Хейфлик Л., Чанок Р.М. (июнь 1965 г.). «Микоплазма человека» . Бактериологические обзоры . 29 (2): 185–221. дои : 10.1128/ммбр.29.2.185-221.1965 . ПМК 441270 . ПМИД 14304038 .
- ^ Jump up to: а б с Хейфлик, Л. (май 1965 г.). «Микоплазменный (PPLO) вид человека». Труды Нью-Йоркской академии наук . Серия II. 27 (7): 817–827. дои : 10.1111/j.2164-0947.1965.tb02241.x . ПМИД 14333465 .
- ^ Jump up to: а б Хейфлик, Л. (1967). Хейфлик, Л. (ред.). Биология микоплазм . Вторая конференция по биологии микоплазм. Том. 143. Анналы Нью-Йоркской академии наук. стр. 5–6.
- ^ Jump up to: а б с Хейфлик, Л., изд. (1969). Mycoplasmatales и L-фаза бактерий . Нью-Йорк, штат Нью-Йорк: Appleton-Century-Crofts. ISBN 9780608123905 .
- ^ Мармион, БП (1990). «Агент Итона – наука и научное признание: исторический комментарий». Обзоры инфекционных болезней . 12 (2): 338–353. дои : 10.1093/clinids/12.2.338 . ПМИД 2109871 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в Уэйтс КБ, Токингтон DF (октябрь 2004 г.). «Микоплазма пневмонии и ее роль как патогена человека» . Обзоры клинической микробиологии . 17 (4): 697–728. doi : 10.1128/CMR.17.4.697-728.2004 . ПМК 523564 . ПМИД 15489344 .
- ^ Jump up to: а б Разин С., Хейфлик Л. (март 2010 г.). «Основные моменты исследований микоплазмы – историческая перспектива». Биологические препараты . 38 (2): 183–190. doi : 10.1016/j.biologicals.2009.11.008 . ПМИД 20149687 .
- ^ Хейфлик, Л. (1956). Рост плевропневмоноподобных организмов человека и птицы в тканевых культурах и in ovo и характеристика инфекционного агента, вызывающего тендовагинит с артритом у кур (кандидатская диссертация). Пенсильванский университет.
- ^ Хейфлик Л., Стайнбринг В.Р. (январь 1960 г.). «Внутриклеточный рост плевропневмоноподобных организмов (PPLO) в культуре тканей и in ovo». Анналы Нью-Йоркской академии наук . 79 (10): 433–449. Бибкод : 1960NYASA..79..433H . дои : 10.1111/j.1749-6632.1960.tb42709.x . ПМИД 14400338 . S2CID 21089254 .
- ^ Итон, доктор медицинских наук, Мейкледжон Дж., ван Херик В. (июнь 1944 г.). «Исследования этиологии первичной атипичной пневмонии: фильтрующийся агент, передающийся хлопковым крысам, хомякам и куриным эмбрионам» . Журнал экспериментальной медицины . 79 (6): 649–668. дои : 10.1084/jem.79.6.649 . ПМК 2135382 . ПМИД 19871393 .
- ^ Даджани А.С., Клайд В.А., Денни Ф.В. (июнь 1965 г.). «Экспериментальное заражение Mycoplasma pneumoniae (агент Итона)» . Журнал экспериментальной медицины . 121 (6): 1071–1086. дои : 10.1084/jem.121.6.1071 . ПМК 2138014 . ПМИД 14319403 .
- ^ Хейфлик, Л. (1969). «Фундаментальная биология класса Mollicutes отряда Mycoplasmatales». В Хейфлике, Л. (ред.). Mycoplasmatales и L-фаза бактерий . Нью-Йорк, штат Нью-Йорк: Appleton-Century-Crofts. ISBN 9780608123905 .
- ^ Хейфлик, Л. (1971). «Биология микоплазматических». В Мэдоффе, С. (ред.). Микоплазмы и L-формы бактерий . Нью-Йорк, штат Нью-Йорк: Гордон и Брич. дои : 10.1002/jobm.19720120516 .
- ^ Jump up to: а б с Хейфлик, Л. (1965). «Тканевые культуры и микоплазмы». Техасские отчеты по биологии и медицине . 23 (1): 285–303. ПМИД 5833547 .
- ^ Хейфлик, Л. (1966). «Роль микоплазм в заболеваниях человека». Новый Врач . Декабрь: 328–333, 348–350.
- ^ Хейфлик, Л. (1972). Микоплазмы как возбудители . Симпозиум Фонда CIBA: Патогенные микоплазмы. Амстердам, Нидерланды: Elsevier Excerpta Medica. стр. 17–31.
- ^ Хейфлик, Л. (4 октября 1993 г.). «Выделение и идентификация микоплазмы как этиологического агента первичной атипичной пневмонии у человека» . Цитирование Классик. Текущее содержание . 40 : 8.
- ^ Чанок Р.М., Хейфлик Л., Барил М.Ф. (январь 1962 г.). «Рост на искусственной среде возбудителя, ассоциированного с атипичной пневмонией, и его идентификация как PPLO» . Труды Национальной академии наук Соединенных Штатов Америки . 48 (1): 41–49. Бибкод : 1962ПНАС...48...41С . дои : 10.1073/pnas.48.1.41 . ПМК 285494 . ПМИД 13878126 .
- ^ Jump up to: а б «Роберт Чанок и агент Итона» . Сеть историй . 8 августа 2012 г.
- ^ Jump up to: а б Шаррер, Т. (2007). «Инвертированные микроскопы Лейтца, около 1958 года». Ученый . 21 (3): 96.
- ^ Клинебергер-Нобель, Э. (1980). Мемуары (английское изд.). Лондон, Великобритания: Академическая пресса. ISBN 0-12-414850-6 .
- ^ Чанок, Р.М. (май 1963 г.). «Mycoplasma pneumoniae: Предлагаемая номенклатура атипичных микроорганизмов пневмонии (агент Итона)». Наука . 140 (3567): 662. Бибкод : 1963Sci...140..662C . дои : 10.1126/science.140.3567.662 . ПМИД 14020096 . S2CID 34513645 .
- ^ Эдвард Д.Г., Фрейндт Э.А., Чанок Р.М., Фабрикант Дж., Хейфлик Л., Лемке Р.М. и др. (март 1967 г.). «Рекомендации по номенклатуре отряда Mycoplasmatales» . Наука . 155 (3770): 1694–1696. Бибкод : 1967Sci...155.1694E . дои : 10.1126/science.155.3770.1694 . ПМИД 6020298 .
- ^ Jump up to: а б с д и Вайсбург В.Г., Талли Дж.Г., Роуз Д.Л., Петцель Дж.П., Ояизу Х., Ян Д. и др. (декабрь 1989 г.). «Филогенетический анализ микоплазм: основы их классификации» . Журнал бактериологии . 171 (12): 6455–67. дои : 10.1128/jb.171.12.6455-6467.1989 . ПМК 210534 . ПМИД 2592342 .
- ^ Jump up to: а б с д и ж г час я дж к л м Ромеро-Арройо CE, Джордан Дж., Пикок С.Дж., Уиллби М.Дж., Фармер М.А., Краузе, округ Колумбия (февраль 1999 г.). «Белок P30 Mycoplasma pneumoniae необходим для цитоадгезии и связан с правильным развитием клеток» . Журнал бактериологии . 181 (4): 1079–87. дои : 10.1128/JB.181.4.1079-1087.1999 . ПМК 93483 . ПМИД 9973332 .
- ^ Jump up to: а б с Далло С.Ф., игрок с низов Дж.Б. (ноябрь 2000 г.). «Внутриклеточная репликация ДНК и долгосрочное выживание патогенных микоплазм». Микробный патогенез . 29 (5): 301–9. дои : 10.1006/mpat.2000.0395 . ПМИД 11031124 .
- ^ Jump up to: а б с д и ж Водке Ю.А., Пухалка Дж., Ллуч-Сенар М., Маркос Дж., Юс Э., Годиньо М. и др. (2013). «Анализ энергетического метаболизма Mycoplasma pneumoniae посредством метаболического моделирования в масштабе генома» . Молекулярная системная биология . 9 : 653. дои : 10.1038/msb.2013.6 . ПМЦ 3658275 . ПМИД 23549481 .
- ^ Jump up to: а б с д и ж г час я дж к л Юс Э., Майер Т., Михалодимитракис К., ван Ноорт В., Ямада Т., Чен У.Х. и др. (ноябрь 2009 г.). «Влияние редукции генома на бактериальный метаболизм и его регуляцию». Наука . 326 (5957): 1263–1268. Бибкод : 2009Sci...326.1263Y . дои : 10.1126/science.1177263 . ПМИД 19965476 . S2CID 17576843 .
- ^ Чоудхури С., Хеппер С., Лоди М.К., Сайер М.Х., Утц П. (апрель 2021 г.). «Белковый интерактом гликолиза в Escherichia coli » . Протеомы . 9 (2): 16. doi : 10.3390/proteomes9020016 . ПМК 8167557 . ПМИД 33917325 .
- ^ «ПУТЬ КЕГГА: гликолиз / глюконеогенез – Mycoplasma pneumoniae 309» . www.genome.jp . Проверено 27 октября 2022 г.
- ^ Jump up to: а б с Ли Дж., Луу Л.Д., Ван Х, Цуй Х, Хуан Х, Фу Дж. и др. (декабрь 2022 г.). «Метаболомный анализ выявляет потенциальные биомаркеры и основной патогенез пневмонии, вызванной Mycoplasma pneumoniae » . Новые микробы и инфекции . 11 (1): 593–605. дои : 10.1080/22221751.2022.2036582 . ПМЦ 8865114 . ПМИД 35094669 .
- ^ Jump up to: а б с д и Драсбек М., Кристиансен Г., Драсбек К.Р., Холм А., Биркелунд С. (ноябрь 2007 г.). «Взаимодействие белка P1 Mycoplasma pneumoniae с рецепторами клеток HEp-2» . Микробиология . 153 (Часть 11): 3791–3799. дои : 10.1099/mic.0.2007/010736-0 . ПМИД 17975088 .
- ^ Jump up to: а б с д и Бэйсмен Дж.Б., Коул Р.М., Краузе, округ Колумбия, Лейт Д.К. (сентябрь 1982 г.). «Молекулярные основы цитадсорбции Mycoplasma pneumoniae» . Журнал бактериологии . 151 (3): 1514–22. дои : 10.1128/JB.151.3.1514-1522.1982 . ПМК 220433 . ПМИД 6809731 .
- ^ Jump up to: а б с Хан Т.В., Уиллби М.Дж., Краузе, округ Колумбия (март 1998 г.). «HMW1 необходим для доставки цитадгезина P1 к органелле прикрепления Mycoplasma pneumoniae» . Журнал бактериологии . 180 (5): 1270–6. дои : 10.1128/JB.180.5.1270-1276.1998 . ПМК 107017 . ПМИД 9495768 .
- ^ Jump up to: а б Собеславский О., Прескотт Б., Чанок Р.М. (сентябрь 1968 г.). «Адсорбция Mycoplasma pneumoniae рецепторами нейраминовой кислоты различных клеток и возможная роль в вирулентности» . Журнал бактериологии . 96 (3): 695–705. дои : 10.1128/JB.96.3.695-705.1968 . ПМК 252361 . ПМИД 4183967 .
- ^ «CDC Микоплазменная пневмония» . CDC . Проверено 23 сентября 2015 г.
Эта статья включает в себя цитируемый текст, являющийся общественным достоянием из CDC.
Дальнейшее чтение
[ редактировать ]- Бейсмен Дж.Б., Редди С.П., Далло С.Ф. (октябрь 1996 г.). «Взаимодействие между поверхностными белками микоплазмы, клетками дыхательных путей и разнообразными проявлениями микоплазменных инфекций человека». Американский журнал респираторной медицины и медицины интенсивной терапии . 154 (4, часть 2): S137–44. дои : 10.1164/ajrccm/154.4_Pt_2.S137 . ПМИД 8876532 .
- Разин С., Йогев Д., Наот Ю. (декабрь 1998 г.). «Молекулярная биология и патогенность микоплазм» . Обзоры микробиологии и молекулярной биологии . 62 (4): 1094–156. дои : 10.1128/MMBR.62.4.1094-1156.1998 . ПМК 98941 . ПМИД 9841667 .
- Кашьяп С., Саркар М. (апрель 2010 г.). «Микоплазменная пневмония: клинические особенности и лечение» . Легкие Индия . 27 (2): 75–85. дои : 10.4103/0970-2113.63611 . ПМЦ 2893430 . ПМИД 20616940 .
- Нарита М. (сентябрь 2009 г.). «Патогенез неврологических проявлений инфекции Mycoplasma pneumoniae». Детская неврология . 41 (3): 159–66. doi : 10.1016/j.pediatrneurol.2009.04.012 . ПМИД 19664529 .
- Ферверда А., Молл Х.А., де Гроот Р. (август 2001 г.). «Инфекции дыхательных путей, вызванные Mycoplasma pneumoniae, у детей: обзор диагностических и лечебных мероприятий». Европейский журнал педиатрии . 160 (8): 483–91. дои : 10.1007/s004310100775 . ПМИД 11548186 . S2CID 9131256 .
- Эспозито С., Дрогетти Р., Бозис С., Кло Л., Маркизио П., Принципи Н. (август 2002 г.). «Секреция цитокинов у детей с острой инфекцией Mycoplasma pneumoniae и хрипами». Детская пульмонология . 34 (2): 122–7. дои : 10.1002/ppul.10139 . ПМИД 12112778 . S2CID 1386332 .
- Риос А.М., Мехиас А., Чавес-Буэно С., Фонсека-Атен М., Кац К., Хэтфилд Дж. и др. (август 2004 г.). «Влияние терапии цетромицином (ABT-773) на микробиологические, гистологические, иммунологические и респираторные показатели на мышиной модели инфекции нижних дыхательных путей Mycoplasma pneumoniae» . Антимикробные средства и химиотерапия . 48 (8): 2897–904. doi : 10.1128/AAC.48.8.2897-2904.2004 . ПМЦ 478543 . ПМИД 15273098 .
- См. также комментарии Хейфлика к книге Мередит Уодман «Гонка вакцин: наука, политика и человеческие издержки победы над болезнью», книга «Ошибки в гонке вакцин» 2017 г.