Хроническая обструктивная болезнь легких
Хроническая обструктивная болезнь легких ( ХОБЛ ) — это тип прогрессирующего заболевания легких, характеризующийся длительными респираторными симптомами и ограничением воздушного потока. [8] GOLD 2024 определил ХОБЛ как гетерогенное заболевание легких, характеризующееся хроническими респираторными симптомами (одышка, кашель, выделение мокроты и/или обострения) вследствие аномалий дыхательных путей (бронхит, бронхиолит) и/или альвеол (эмфизема), которые вызывают стойкие, часто прогрессирующие , затруднение воздушного потока. [9]
Основные симптомы ХОБЛ включают одышку и кашель , который может сопровождаться или не сопровождаться выделением слизи . [4] ХОБЛ прогрессивно ухудшается , при этом повседневная деятельность , такая как ходьба или одевание, становится затрудненной. [3] Хотя ХОБЛ неизлечима, ее можно предотвратить и лечить. Двумя наиболее распространенными типами ХОБЛ являются эмфизема и хронический бронхит , и они представляют собой два классических фенотипа ХОБЛ . Однако эта основная догма была поставлена под сомнение, поскольку у пациентов с ХОБЛ были признаны различные степени сопутствующей эмфиземы, хронического бронхита и потенциально значимых сосудистых заболеваний, что привело к классификации других фенотипов или подтипов. [10]
Emphysema is defined as enlarged airspaces (alveoli) whose walls have broken down resulting in permanent damage to the lung tissue. Chronic bronchitis is defined as a productive cough that is present for at least three months each year for two years. Both of these conditions can exist without airflow limitation when they are not classed as COPD. Emphysema is just one of the structural abnormalities that can limit airflow and can exist without airflow limitation in a significant number of people.[11][12] Chronic bronchitis does not always result in airflow limitation but in young adults with chronic bronchitis who smoke, the risk of developing COPD is high.[13] Many definitions of COPD in the past included emphysema and chronic bronchitis, but these have never been included in GOLD report definitions.[8] Emphysema and chronic bronchitis remain the predominant phenotypes of COPD but there is often overlap between them and a number of other phenotypes have also been described.[10][14] COPD and asthma may coexist and converge in some individuals.[15] COPD is associated with low-grade systemic inflammation.[16]
The most common cause of COPD is tobacco smoking.[17] Other risk factors include indoor and outdoor air pollution including dust, exposure to occupational irritants such as dust from grains, cadmium dust or fumes, and genetics, such as alpha-1 antitrypsin deficiency.[13][18] In developing countries, common sources of household air pollution are the use of coal and biomass such as wood and dry dung as fuel for cooking and heating.[19][13] The diagnosis is based on poor airflow as measured by spirometry.[4]
Most cases of COPD can be prevented by reducing exposure to risk factors such as smoking and indoor and outdoor pollutants.[20] While treatment can slow worsening, there is no conclusive evidence that any medications can change the long-term decline in lung function.[6] COPD treatments include smoking cessation, vaccinations, pulmonary rehabilitation, inhaled bronchodilators and corticosteroids.[6] Some people may benefit from long-term oxygen therapy, lung volume reduction and lung transplantation.[21] In those who have periods of acute worsening, increased use of medications, antibiotics, corticosteroids and hospitalization may be needed.[22]
As of 2015, COPD affected about 174.5 million people (2.4% of the global population).[7] It typically occurs in males and females over the age of 35–40.[1][3] In 2019 it caused 3.2 million deaths, 80% occurring in lower and middle income countries,[3] up from 2.4 million deaths in 1990.[23][24] The number of deaths is projected to increase further because of continued exposure to risk factors and an aging population.[8] In the United States in 2010 the economic cost was put at US$32.1 billion and projected to rise to US$49 billion in 2020.[25] In the United Kingdom this cost is estimated at £3.8 billion annually.[26]
Signs and symptoms[edit]

Shortness of breath[edit]
A cardinal symptom of COPD is the chronic and progressive shortness of breath which is most characteristic of the condition. Shortness of breath (breathlessness) is often the most distressing symptom responsible for the associated anxiety and level of disability experienced.[4] Symptoms of wheezing and chest tightness associated with breathlessness can be variable over the course of a day or between days and are not always present. Chest tightness often follows exertion.[4] Many people with more advanced COPD breathe through pursed lips, which can improve shortness of breath.[27] Shortness of breath is often responsible for reduced physical activity and low levels of physical activity are associated with worse outcomes.[28][29] In severe and very severe cases there may be constant tiredness, weight loss, muscle loss and anorexia. People with COPD often have increased breathlessness and frequent colds before seeking treatment.[4]
Cough[edit]
The most often first symptom of COPD is a chronic cough, which may or may not be productive of mucus as phlegm. Phlegm coughed up as sputum can be intermittent and may be swallowed or spat out depending on social or cultural factors and is therefore not always easy to evaluate. However, an accompanying productive cough is only seen in up to 30% of cases. Sometimes limited airflow may develop in the absence of a cough.[4] Symptoms are usually worse in the morning.[30]
A chronic productive cough is the result of mucus hypersecretion and when it persists for more than three months each year for at least two years, it is defined as chronic bronchitis.[13] Chronic bronchitis can occur before the restricted airflow diagnostic of COPD.[8] Some people with COPD attribute the symptoms to the consequences of smoking. In severe COPD, vigorous coughing may lead to rib fractures or to a brief loss of consciousness.[4]
Exacerbations[edit]
An acute exacerbation is a sudden worsening of signs and symptoms that lasts for several days. The key symptom is increased breathlessness, other more pronounced symptoms are of excessive mucus, increased cough and wheeze. A commonly found sign is air trapping giving a difficulty in complete exhalation.[31]The usual cause of an exacerbation is a viral infection, most often the common cold.[13] The common cold is usually associated with the winter months but can occur at any time.[32] Other respiratory infections may be bacterial or in combination sometimes secondary to a viral infection.[33] The most common bacterial infection is caused by Haemophilus influenzae.[34] Other risks include exposure to tobacco smoke (active and passive) and environmental pollutants – both indoor and outdoor.[35] During the COVID-19 pandemic, hospital admissions for COPD exacerbations sharply decreased which may be attributable to reduction of emissions and cleaner air.[36] There has also been a marked decrease in the number of cold and flu infections during this time.[37]
Smoke from wildfires is proving an increasing risk in many parts of the world and government agencies have published protective advice on their websites. In the US the EPA advises that the use of dust masks do not give protection from the fine particles in wildfires and instead advise the use of well-fitting particulate masks.[38] This same advice is offered in Canada and Australia to the effects of their forest fires.[39][40]
The number of exacerbations is not seen to relate to any stage of the disease; those with two or more a year are classed as frequent exacerbators and these lead to a worsening in the disease progression.[31] Frailty in ageing increases exacerbations and hospitalization.[41]
Acute exacerbations in COPD are often unexplained and thought to have many causes other than infections. A study has emphasized the possibility of a pulmonary embolism as sometimes being responsible in these cases. Signs can include pleuritic chest pain and heart failure without signs of infection. Such emboli could respond to anticoagulants.[42]
Other conditions[edit]
COPD often occurs along with a number of other conditions (comorbidities) due in part to shared risk factors. Common comorbidities include cardiovascular disease, skeletal muscle dysfunction, metabolic syndrome, osteoporosis, depression, anxiety, asthma and lung cancer.[43] Alpha-1 antitrypsin deficiency (A1AD) is an important risk factor for COPD.[44] It is advised that everybody with COPD be screened for A1AD.[43] Metabolic syndrome has been seen to affect up to fifty percent of those with COPD and significantly affects the outcomes.[45] When comorbid with COPD there is more systemic inflammation.[45] It is not known if it co-exists with COPD or develops as a consequence of the pathology. Metabolic syndrome on its own has a high rate of morbidity and mortality and this rate is amplified when comorbid with COPD. Tuberculosis is a risk factor for the development of COPD, and is also a potential comorbidity.[13] Most people with COPD die from comorbidities and not from respiratory problems.[46]
Anxiety and depression are often complications of COPD.[2][1] Other complications include a reduced quality of life and increased disability, cor pulmonale, frequent chest infections including pneumonia, secondary polycythemia, respiratory failure, pneumothorax, lung cancer, and cachexia (muscle wasting).[1][2][47]
Cognitive impairment is common in those with COPD as it is for other lung conditions that affect airflow. Cognitive impairment is associated with the declining ability to cope with the basic activities of daily living.[48]
It is unclear if those with COPD are at greater risk of contracting COVID-19, though if infected they are at risk of hospitalization and developing severe COVID-19.Differentiating COVID-19 symptoms from an exacerbation is difficult; mild prodromal symptoms may delay its recognition and where they include loss of taste or smell COVID-19 is to be suspected.[36]
Definition[edit]
Many definitions of COPD in the past included chronic bronchitis and emphysema but these have never been included in GOLD report definitions.[8] Emphysema is defined as enlarged airspaces (alveoli) whose walls break down resulting in permanent damage to the lung tissue and is just one of the structural abnormalities that can limit airflow. The condition can exist without airflow limitation but commonly it does.[11] Chronic bronchitis is defined as a productive cough that is present for at least three months each year for two years but does not always result in airflow limitation although the risk of developing COPD is great.[13] These older definitions grouped the two types as type A and type B. Type A were emphysema types known as pink puffers due to their pink complexion, fast breathing rate and pursed lips. Type B were chronic bronchitic types referred to as blue bloaters due to low oxygen levels causing a bluish color to the skin and lips and swollen ankles.[49] These differences were suggested to be due to the presence or not of collateral ventilation, evident in emphysema and lacking in chronic bronchitis.[50] This terminology was no longer accepted as useful, as most people with COPD have a combination of both emphysema and airway disease.[49] These are now recognized as the two major phenotypes of COPD – emphysematous phenotype and chronic bronchitic phenotype.[10]
Subtypes[edit]
It has since been recognized that COPD is more complex, with a diverse group of disorders of differing risk factors and clinical courses that has resulted in a number of subtypes or phenotypes of COPD being accepted and proposed.[51][52] The two classic emphysematous and chronic bronchitic phenotypes are fundamentally different conditions with unique underlying mechanisms.[10] Another subtype of COPD, categorized by some as a separate clinical entity, is asthma-COPD overlap, which is a condition sharing clinical features of both asthma and COPD.[53][54] Spirometry measures are inadequate for defining phenotypes and chest X-ray, CT and MRI scans have been mostly employed. Most cases of COPD are diagnosed at a late stage and the use of imaging methods would allow earlier detection and treatment.[10]
The identification and recognition of different phenotypes can guide appropriate treatment approaches. For example, the PDE4 inhibitor roflumilast is targeted at the chronic-bronchitic phenotype.[55]
Two inflammatory phenotypes show a phenotype stability: the neutrophilic inflammatory phenotype and the eosinophilic inflammatory phenotype.[56] Mepolizumab, a monoclonal antibody, has been shown to have benefit in treating the eosinophilic inflammatory type rather than the use of oral corticosteroids, but further studies have been called for.[57]
Another recognized phenotype is the frequent exacerbator.[58] The frequent exacerbator has two or more exacerbations a year, has a poor prognosis and is described as a moderately stable phenotype.[31]
A pulmonary vascular COPD phenotype has been described due to cardiovascular dysfunction.[59] A molecular phenotype of CFTR dysfunction is shared with cystic fibrosis.[14] A combined phenotype of chronic bronchitis and bronchiectasis has been described with a difficulty noted of determining the best treatment.[60]
The only genotype is the alpha-1 antitrypsin deficiency (AATD) genetic subtype and this has a specific treatment.[61]
Cause[edit]
The cause of the development of COPD is the exposure to harmful particles or gases, including tobacco smoke, that irritate the lung causing inflammation that interacts with a number of host factors. Such exposure needs to be significant or long-term.[8] The greatest risk factor for the development of COPD is tobacco smoke.[17] However, less than 50 percent of heavy smokers develop COPD, so other factors need to be considered, including exposure to indoor and outdoor pollutants, allergens, occupational exposure, and host factors.[30][13] One of the known causes of COPD is the exposure to construction dust. The three main types of construction dust are silica dust, non-silica dust (e.g., dust from gypsum, cement, limestone, marble and dolomite) and wood dust.[62] Host factors include a genetic susceptibility, factors associated with poverty, aging and physical inactivity. Asthma and tuberculosis are also recognized as risk factors, as the comorbidity of COPD is reported to be 12 times higher in patients with asthma after adjusting for smoking history.[13] In Europe airway hyperresponsiveness is rated as the second most important risk factor after smoking.[13]
A host factor of an airway branching variation, arising during development has been described.[63] The respiratory tree is a filter for harmful substances and any variant has the potential to disrupt this. A variation has been found to be associated with the development of chronic bronchitis and another with the development of emphysema. A branch variant in the central airway is specifically associated with an increased susceptibility for the later development of COPD. A genetic association for the variants has been sometimes found with FGF10.[63][64]
Alcohol abuse can lead to alcoholic lung disease and is seen to be an independent risk factor for COPD.[65][66]Mucociliary clearance is disrupted by chronic exposure to alcohol; macrophage activity is diminished and an inflammatory response promoted.[67][66] The damage leads to a susceptibility for infection, including COVID-19,[68] more so when combined with smoking; smoking induces the upregulation of the expression of ACE2, a receptor for the SARS-CoV-2 virus.[65]
Smoking[edit]
The primary risk factor for COPD globally is tobacco smoking with an increased rate of developing COPD shown in smokers and ex-smokers.[8][17] Of those who smoke, about 20% will get COPD,[69] increasing to less than 50% in heavy smokers.[8] In the United States and United Kingdom, of those with COPD, 80–95% are either current or previous smokers.[69][70][71] Several studies indicate that women are more susceptible than men to the harmful effects of tobacco smoke.[72] For the same amount of cigarette smoking, women have a higher risk of COPD than men.[73] In non-smokers, exposure to second-hand smoke (passive smoking) is the cause of 1.2 million deaths from the more than 8 million deaths worldwide each year due to tobacco smoke.[74] Women who smoke during pregnancy, and during the early life of the child is a risk factor for the later development of COPD in their child.[75]
Inhaled smoke triggers the release of excessive proteases in lungs, which then degrades elastin, the major component of alveoli.[17] Smoke also impairs the action of cilia, inhibiting mucociliary clearance that clears the bronchi of mucus, cellular debris and unwanted fluid.[17]
Other types of tobacco smoke, such as from cigar, pipe, water-pipe and hookah use, also confer a risk.[13] Water-pipe or hookah smoke appears to be as harmful or even more harmful than smoking cigarettes.[76]
Marijuana is the second most commonly smoked substance, but evidence linking its use to COPD is very limited. Limited evidence shows that marijuana does not accelerate lung function decline.[77] A low use of marijuana gives a bronchodilatory effect rather than the bronchoconstrictive effect from tobacco use, but it is often smoked in combination with tobacco or on its own by tobacco smokers. Higher use however has shown a decline in the FEV1.[78] There is evidence of it causing some respiratory problems and its use in combination may have a cumulative toxic effect suggesting it as a risk factor for spontaneous pneumothorax, bullous emphysema, COPD and lung cancer.[77][79] A noted difference between marijuana use and tobacco was that respiratory problems were resolved with stopping usage unlike the continued decline with stopping tobacco smoking.[77] Respiratory symptoms reported with marijuana use included chronic cough, increased sputum production and wheezing but not shortness of breath. Also these symptoms were typically reported ten years ahead of their affecting tobacco smokers.[77] Another study found that chronic marijuana smokers even with the additional use of tobacco developed similar respiratory problems, but did not seem to develop airflow limitation and COPD.[80]
Pollution[edit]

Exposure to particulates can bring about the development of COPD, or its exacerbations. Those with COPD are more susceptible to the harmful effects of particulate exposure that can cause acute exacerbations brought about by infections.[45] Black carbon also known as soot, is an air pollutant associated with an increased risk of hospitalization due to the exacerbations caused. Long-term exposure is indicated as an increased rate of mortality in COPD.[45] Studies have shown that people who live in large cities have a higher rate of COPD compared to people who live in rural areas.[82] Areas with poor outdoor air quality, including that from exhaust gas, generally have higher rates of COPD.[83] Urban air pollution significantly effects the developing lung and its maturation, and contributes a potential risk factor for the later development of COPD. The overall effect in relation to smoking is believed to be small.[13]
Poorly ventilated fires used for cooking and heating, are often fueled by coal or biomass such as wood and dry dung, leading to indoor air pollution and are one of the most common causes of COPD in developing countries. Women are affected more as they have a greater exposure.[13] These fuels are used as the main source of energy in 80% of homes in India, China and sub-Saharan Africa.[83]
Occupational exposure[edit]
Intense and prolonged exposure to workplace dusts, chemicals and fumes increases the risk of COPD in smokers, nonsmokers and never-smokers. Substances implicated in occupational exposure and listed in the UK, include organic and inorganic dusts such as cadmium, silica, dust from grains and flour and fumes from cadmium and welding that promote respiratory symptoms.[18][13] Workplace exposure is believed to be the cause in 10–20% of cases and in the United States, it is believed to be related to around 30% of cases among never smokers and probably represents a greater risk in countries without sufficient regulations.[13][84] The negative effects of dust exposure and cigarette smoke exposure appear to be cumulative.[85]
Genetics[edit]
Genetics play a role in the development of COPD. It is more common among relatives of those with COPD who smoke than unrelated smokers.[13] The most well known genetic risk factor is alpha-1 antitrypsin deficiency (AATD) and this is the only genotype (genetic subtype) with a specific treatment.[61] This risk is particularly high if someone deficient in alpha-1 antitrypsin (AAT) also smokes.[86] It is responsible for about 1–5% of cases[86][87] and the condition is present in about three to four in 10,000 people.[88]
Mutations in MMP1 gene that encodes for interstitial collagenase are associated with COPD.[89]
The COPDGene study is an ongoing longitudinal study into the epidemiology of COPD, identifying phenotypes and looking for their likely association with susceptible genes. Genome wide analyses in concert with the International COPD Genetics Consortium has identified more than 80 genome regions associated with COPD and further studies in these regions has been called for. Whole genome sequencing is an ongoingcollaboration (2019) with the National Heart, Lung and Blood Institute (NHLBI) to identify rare genetic determinants.[90]
Pathophysiology[edit]
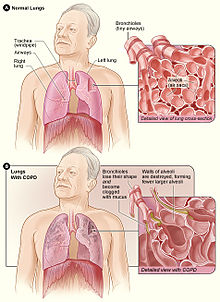
COPD is a progressive lung disease in which chronic, incompletely reversible poor airflow (airflow limitation) and an inability to breathe out fully (air trapping) exist.[91] The poor airflow is the result of small airways disease and emphysema (the breakdown of lung tissue).[92] The relative contributions of these two factors vary between people.[8] Air trapping precedes lung hyperinflation.[93]
COPD develops as a significant and chronic inflammatory response to inhaled irritants which ultimately leads to bronchial and alveolar remodelling in the lung known as small airways disease.[94][95] Thus, airway remodelling with narrowing of peripheral airway and emphysema are responsible for the alteration of lung function.[56] Mucociliary clearance is particularly altered with a dysregulation of cilia and mucus production.[96] Small airway disease sometimes called chronic bronchiolitis, appears to be the precursor for the development of emphysema.[97]The inflammatory cells involved include neutrophils and macrophages, two types of white blood cells. Those who smoke additionally have cytotoxic T cell involvement and some people with COPD have eosinophil involvement similar to that in asthma. Part of this cell response is brought on by inflammatory mediators such as chemotactic factors. Other processes involved with lung damage include oxidative stress produced by high concentrations of free radicals in tobacco smoke and released by inflammatory cells and breakdown of the connective tissue of the lungs by proteases (particularly elastase) that are insufficiently inhibited by protease inhibitors. The destruction of the connective tissue of the lungs leads to emphysema, which then contributes to the poor airflow and finally, poor absorption and release of respiratory gases. General muscle wasting that often occurs in COPD may be partly due to inflammatory mediators released by the lungs into the blood.[13]
Narrowing of the airways occurs due to inflammation and subsequent scarring within them. This contributes to the inability to breathe out fully. The greatest reduction in air flow occurs when breathing out, as the pressure in the chest is compressing the airways at this time.[98] This can result in more air from the previous breath remaining within the lungs when the next breath is started, resulting in an increase in the total volume of air in the lungs at any given time, a process called air trapping which is closely followed by hyperinflation.[98][99][93] Hyperinflation from exercise is linked to shortness of breath in COPD, as breathing in is less comfortable when the lungs are already partly filled.[100] Hyperinflation may also worsen during an exacerbation.[101] There may also be a degree of airway hyperresponsiveness to irritants similar to those found in asthma.[88]
Low oxygen levels and eventually, high carbon dioxide levels in the blood, can occur from poor gas exchange due to decreased ventilation from airway obstruction, hyperinflation and a reduced desire to breathe.[13] During exacerbations, airway inflammation is also increased, resulting in increased hyperinflation, reduced expiratory airflow and worsening of gas transfer. This can lead to low blood oxygen levels which if present for a prolonged period, can result in narrowing of the arteries in the lungs, while emphysema leads to the breakdown of capillaries in the lungs. Both of these conditions may result in pulmonary heart disease also classically known as cor pulmonale.[47]
Diagnosis[edit]
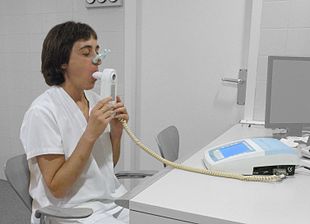
The diagnosis of COPD should be considered in anyone over the age of 35 to 40 who has shortness of breath, a chronic cough, sputum production, or frequent winter colds and a history of exposure to risk factors for the disease. Spirometry is then used to confirm the diagnosis.[4][102]
Spirometry[edit]
Spirometry measures the amount of airflow obstruction present and is generally carried out after the use of a bronchodilator, a medication to open up the airways.[103] Two main components are measured to make the diagnosis, the forced expiratory volume in one second (FEV1), which is the greatest volume of air that can be breathed out in the first second of a breath and the forced vital capacity (FVC), which is the greatest volume of air that can be breathed out in a single large breath.[104] Normally, 75–80% of the FVC comes out in the first second[104] and a FEV1/FVC ratio less than 70% in someone with symptoms of COPD defines a person as having the disease.[103] Based on these measurements, spirometry would lead to over-diagnosis of COPD in the elderly.[103] The National Institute for Health and Care Excellence criteria additionally require a FEV1 less than 80% of predicted.[105] People with COPD also exhibit a decrease in diffusing capacity of the lung for carbon monoxide due to decreased surface area in the alveoli, as well as damage to the capillary bed.[106] Testing the peak expiratory flow (the maximum speed of expiration), commonly used in asthma diagnosis, is not sufficient for the diagnosis of COPD.[105]
Screening using spirometry in those without symptoms has uncertain effect and is generally not recommended; however, it is recommended for those without symptoms but with a known risk factor.[43]
Assessment[edit]
| Grade | Activity affected |
|---|---|
| 1 | Only strenuous activity |
| 2 | Vigorous walking |
| 3 | With normal walking |
| 4 | After a few minutes of walking |
| 5 | With changing clothing |
| Severity | FEV1 % predicted |
|---|---|
| Mild (GOLD 1) | ≥80 |
| Moderate (GOLD 2) | 50–79 |
| Severe (GOLD 3) | 30–49 |
| Very severe (GOLD 4) | <30 |
A number of methods can be used to assess the affects and severity of COPD.[102][43] The MRC breathlessness scale or the COPD assessment test (CAT) are simple questionnaires that may be used.[107][102] GOLD refers to a modified MRC scale that if used, needs to include other tests since it is simply a test of breathlessness experienced.[43][108] Scores on CAT range from 0–40 with the higher the score, the more severe the disease.[109] Spirometry may help to determine the severity of airflow limitation.[4] This is typically based on the FEV1 expressed as a percentage of the predicted "normal" for the person's age, gender, height and weight.[4] Guidelines published in 2011 by American and European medical societies recommend partly basing treatment recommendations on the FEV1.[103] The GOLD guidelines group people into four categories based on symptoms assessment, degree of airflow limitation and history of exacerbations.[108] Weight loss, muscle loss and fatigue are seen in severe and very severe cases.[43]
Use of screening questionnaires, such as COPD diagnostic questionnaire (CDQ), alone or in combination with hand-held flow meters is appropriate for screening of COPD in primary care.[110]
Other tests[edit]
A chest X-ray is not useful to establish a diagnosis of COPD but it is of use in either excluding other conditions or including comorbidities such as pulmonary fibrosis and bronchiectasis. Characteristic signs of COPD on X-ray include hyperinflation (shown by a flattened diaphragm and an increased retrosternal air space) and lung hyperlucency.[5] A saber-sheath trachea may also be shown that is indicative of COPD.[111]
A CT scan is not routinely used except for the exclusion of bronchiectasis.[5] An analysis of arterial blood is used to determine the need for oxygen supplementation and assess for high levels of carbon dioxide in the blood; this is recommended in those with an FEV1 less than 35% predicted, those with a peripheral oxygen saturation less than 92% and those with symptoms of congestive heart failure.[112] WHO recommends that all those diagnosed with COPD be screened for alpha-1 antitrypsin deficiency.[43]
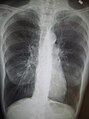
- Chest X-ray demonstrating severe COPD, displaying small heart size in comparison to the lungs
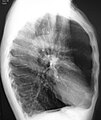
- A lateral chest X-ray of a person with emphysema, displaying barrel chest and flat diaphragm
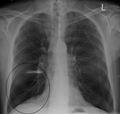
- Lung bulla as seen on chest X-ray in a person with severe COPD
- A severe case of bullous emphysema
- Axial CT image of the lung of a person with end-stage bullous emphysema
- Very severe emphysema with lung cancer on the left (CT scan)
Differential diagnosis[edit]
COPD may need to be differentiated from other conditions such as congestive heart failure, asthma, bronchiectasis, tuberculosis, obliterative bronchiolitis and diffuse panbronchiolitis.[5] The distinction between asthma and COPD is made on the basis of the symptoms, smoking history and whether airflow limitation is reversible with bronchodilators at spirometry.[113] Chronic bronchitis with normal airflow is not classified as COPD.[88]
Prevention[edit]
Most cases of COPD are potentially preventable through decreasing exposure to tobacco smoke and other indoor and outdoor pollutants.[20]
Smoking cessation[edit]
The policies of governments, public health agencies and antismoking organizations can reduce smoking rates by discouraging people from starting and encouraging people to stop smoking.[114] Smoking bans in public areas and places of work are important measures to decrease exposure to secondhand smoke and while many places have instituted bans, more are recommended.[83]
In those who smoke, stopping smoking is the only measure shown to slow down the worsening of COPD.[115][116] Even at a late stage of the disease, it can reduce the rate of worsening lung function and delay the onset of disability and death.[117] Often, several attempts are required before long-term abstinence is achieved.[114] Attempts over 5 years lead to success in nearly 40% of people.[118]
Some smokers can achieve long-term smoking cessation through willpower alone. Smoking, however, is highly addictive and many smokers need further support.[119] The chance of quitting is improved with social support, engagement in a smoking cessation program and the use of medications such as nicotine replacement therapy, bupropion, or varenicline.[114][116][118] Combining smoking-cessation medication with behavioral therapy is more than twice as likely to be effective in helping people with COPD stop smoking, compared with behavioral therapy alone.[120]
Occupational health[edit]
A number of measures have been taken to reduce the likelihood that workers in at-risk industries—such as coal mining, construction and stonemasonry—will develop COPD.[83] Examples of these measures include the creation of public policy,[83] education of workers and management about the risks, promoting smoking cessation, checking workers for early signs of COPD, use of respirators and dust control.[121][122] Effective dust control can be achieved by improving ventilation, using water sprays and by using mining techniques that minimize dust generation.[123] If a worker develops COPD, further lung damage can be reduced by avoiding ongoing dust exposure, for example by changing their work role.[124]
Pollution control[edit]
Both indoor and outdoor air quality can be improved, which may prevent COPD or slow the worsening of existing disease.[83] This may be achieved by public policy efforts, cultural changes and personal involvement.[125] Many developed countries have successfully improved outdoor air quality through regulations which has resulted in improvements in the lung function of their populations.[83] Individuals are also advised to avoid irritants of indoor and outdoor pollution.[20]
In developing countries one key effort is to reduce exposure to smoke from cooking and heating fuels through improved ventilation of homes and better stoves and chimneys.[125] Proper stoves may improve indoor air quality by 85%. Using alternative energy sources such as solar cooking and electrical heating is also effective. Using fuels such as kerosene or coal might produce less household particulate matter than traditional biomass such as wood or dung, but whether this is better health wise is unclear.[83]
Management[edit]
COPD currently has no cure,[126] but the symptoms are treatable and its progression can be delayed, particularly by stopping smoking.[1][6] The major goals of management are to reduce exposure to risk factors including offering non-pharmacological treatments such as help with stopping smoking. Stopping smoking can reduce the rate of lung function decline and also reduce mortality from smoking-related diseases such as lung cancer and cardiovascular disease.[1] Other recommendations include annual influenza vaccinations and pneumococcal vaccination to help reduce the risk of exacerbations; CDC and GOLD 2024 also recommends RSV vaccine for individuals above 60 years;[127][128] giving advice as to healthy eating and encouraging physical exercise. Guidance is also advised as to managing breathlessness and stress.[6]
Other illnesses are also managed. An action plan is drawn up and is to be reviewed.[20] Providing people with a personalized action plan, an educational session and support for use of their action plan in the event of an exacerbation, reduces the number of hospital visits and encourages early treatment of exacerbations.[129] When self-management interventions, such as taking corticosteroids and using supplemental oxygen, is combined with action plans, health-related quality of life is improved compared to usual care.[130] In those with COPD who are malnourished, supplementation with vitamin C, vitamin E, zinc and selenium can improve weight, strength of respiratory muscles and health-related quality of life.[21] Significant vitamin D deficiency is common in those with COPD and can cause increased exacerbations. Supplementation when deficient can give a 50% reduction in the number of exacerbations.[31][131]
A number of medical treatments are used in the management of stable COPD and exacerbations. These include bronchodilators, corticosteroids and antibiotics.
In those with a severe exacerbation, antibiotics improve outcomes.[132] A number of different antibiotics may be used including amoxicillin, doxycycline and azithromycin; whether one is better than the others is unclear.[133] There is no clear evidence of improved outcomes for those with less severe cases.[132] The FDA recommends against the use of fluoroquinolones when other options are available due to higher risks of serious side effects.[134]In treating acute hypercapnic respiratory failure (acutely raised levels of carbon dioxide), bilevel positive airway pressure (BPAP) can decrease mortality and the need of intensive care.[135] Fewer than 20% of exacerbations require hospital admission.[125] In those without acidosis from respiratory failure, home care may be able to help avoid some admissions.[125]
In those with end-stage disease, palliative care is focused on relieving symptoms.[136] Morphine can improve exercise tolerance.[21] Non-invasive ventilation may be used to support breathing and also reduce daytime breathlessness.[137][21]
Bronchodilators[edit]
Inhaled short-acting bronchodilators are the primary medications used on an as needed basis; their use on a regular basis is not recommended.[6] The two major types are beta2-adrenergic agonists and anticholinergics; either in long-acting or short-acting forms. Beta2–adrenergic agonists target receptors in the smooth muscle cells in bronchioles causing them to relax and allow improved airflow. They reduce shortness of breath, tend to reduce dynamic hyperinflation and improve exercise tolerance.[6][138] Short-acting bronchodilators have an effect for four hours and for maintenance therapy long acting bronchodilators with an effect of over twelve hours are used. In times of more severe symptoms a short acting agent may be used in combination.[6] An inhaled corticosteroid used with a long-acting beta-2 agonist is more effective than either one on its own.[139]
Which type of long-acting agent, long-acting muscarinic antagonist (LAMA) such as tiotropium or long-acting beta agonist (LABA), is better is unclear and trying each and continuing with the one that works best may be advisable.[140] Both types of agent appear to reduce the risk of acute exacerbations by 15–25%.[135] The combination of LABA/LAMA may reduce COPD exacerbations and improve quality-of-life compared to long-acting bronchodilators alone.[141] The 2018 NICE guideline recommends use of dual long-acting bronchodilators with economic modelling suggesting that this approach is preferable to starting one long acting bronchodilator and adding another later.[142]
Several short-acting β2 agonists are available, including salbutamol (albuterol) and terbutaline.[125] They provide some relief of symptoms for four to six hours.[125] A long-acting beta agonist (LABA) such as salmeterol, formoterol and indacaterol are often used as maintenance therapy. Some feel the evidence of benefits is limited,[143] while others view the evidence of benefit as established.[144][145][146] Long-term use appears safe in COPD[147] with adverse effects include shakiness and heart palpitations.[135] When used with inhaled steroids they increase the risk of pneumonia.[135] While steroids and LABAs may work better together,[143] it is unclear if this slight benefit outweighs the increased risks.[148] There is some evidence that combined treatment of LABAs with long-acting muscarinic antagonists (LAMA), an anticholinergic, and LABA +ICS (inhaled corticosteroid) may be similar in benefits in terms of fewer exacerbation's and quality of life measures for moderate to severe COPD, but LAMA+LABA offers better improvements in forced expiratory volume (FEV1%) and a lower risk of pneumonia.[149] All three together, LABA, LAMA and ICS, have some evidence of benefits.[150] Indacaterol requires an inhaled dose once a day and is as effective as the other long-acting β2 agonist drugs that require twice-daily dosing for people with stable COPD.[146]
The two main anticholinergics used in COPD are ipratropium and tiotropium. Ipratropium is a short-acting muscarinic antagonist (SAMA), while tiotropium is long-acting (LAMA). Tiotropium is associated with a decrease in exacerbations and improved quality of life,[151] and tiotropium provides those benefits better than ipratropium.[152] It does not appear to affect mortality or the overall hospitalization rate.[151] Anticholinergics can cause dry mouth and urinary tract symptoms.[135] They are also associated with increased risk of heart disease and stroke.[153] Aclidinium, another long-acting agent, reduces hospitalizations associated with COPD and improves quality of life.[154][155][156] The LAMA umeclidinium bromide is another anticholinergic alternative.[157] When compared to tiotropium, the LAMAs aclidinium, glycopyrronium and umeclidinium appear to have a similar level of efficacy; with all four being more effective than placebo.[158] Further research is needed comparing aclidinium to tiotropium.[156]
Corticosteroids[edit]
Inhaled corticosteroids are anti-inflammatories that are recommended by GOLD as a first-line maintenance treatment in COPD cases with repeated exacerbations.[159][160] Their regular use increases the risk of pneumonia in severe cases.[31] Studies have shown that the risk of pneumonia is associated with all types of corticosteroids; is related to the disease severity and a dose-response relationship has been noted.[159] Oral glucocorticoids can be effective in treating an acute exacerbation.[139] They appear to have fewer side effects than those given intravenously.[161] Five days of steroids work as well as ten or fourteen days.[162]
The use of corticosteroids is associated with a decrease in the number of lymphoid follicles (in the bronchial lymphoid tissue).[97] A triple inhaled therapy of LABA/LAMA/ICS improves lung function, reduces symptoms and exacerbations and is seen to be more effective than mono or dual therapies.[163][139] NICE guidelines recommend the use of ICSs in people with asthmatic features or features suggesting steroid responsiveness.[142]
PDE4 inhibitors[edit]
Phosphodiesterase-4 inhibitors (PDE4 inhibitors) are anti-inflammatories that improve lung function and reduce exacerbations in moderate to severe illness. Roflumilast is a PDE4 inhibitor used orally once daily to reduce inflammation, it has no direct bronchodilatory effects. It is essentially used in treating those with chronic bronchitis along with systemic corticosteroids.[57] Reported adverse effects of roflumilast appear early in treatment, become less with continued treatment and are reversible. One effect is dramatic weight loss and its use is to be avoided in underweight people. It is also advised to be used with caution in those who have depression.[57]
Other medications[edit]
Long-term preventive use of antibiotics, specifically those from the macrolide class such as erythromycin, reduce the frequency of exacerbations in those who have two or more a year.[164][165] This practice may be cost effective in some areas of the world.[166] Concerns include the potential for antibiotic resistance and side effects including hearing loss, tinnitus and changes to the heart rhythm known as long QT syndrome.[165]
Methylxanthines such as theophylline are widely used. Theophylline is seen to have a mild bronchodilatory effect in stable COPD. Inspiratory muscle function is seen to be improved but the causal effect is unclear. Theophylline is seen to improve breathlessness when used as an add-on to salmeterol. All instances of improvement have been reported using sustained release preparations.[6] Methylxanthines are not recommended for use in exacerbations due to adverse effects.[31]
Mucolytics may help to reduce exacerbations in some people with chronic bronchitis; noticed by less hospitalization and less days of disability in one month.[167] Erdosteine is recommended by NICE.[168] GOLD also supports the use of some mucolytics that are advised against when inhaled corticosteroids are being used and singles out erdosteine as having good effects regardless of corticosteroid use. Erdosteine also has antioxidant properties but there is not enough evidence to support the general use of antioxidants.[57] Erdosteine has been shown to significantly reduce the risk of exacerbations, shorten their duration and hospital stays.[169]
Cough medicines are not recommended.[170] Beta blockers are not contraindicated for those with COPD and should only be used where there is concomitant cardiovascular disease.[57]
Recent studies show that metformin plays a role in reducing systemic inflammation by reducing biomarker levels that are increased during COPD exacerbations.[171]
Oxygen therapy[edit]
Supplemental oxygen is recommended for those with low oxygen levels in respiratory failure at rest (a partial pressure of oxygen less than 50–55 mmHg or oxygen saturations of less than 88%).[21] When taking into account complications including cor pulmonale and pulmonary hypertension, the levels involved are 56–59 mmHg.[172] Oxygen therapy is to be used for between 15 and 18 hours per day and is said to decrease the risk of heart failure and death.[172] In those with normal or mildly low oxygen levels, oxygen supplementation (ambulatory) may improve shortness of breath when given during exercise, but may not improve breathlessness during normal daily activities or affect the quality of life.[173] During acute exacerbations, many require oxygen therapy; the use of high concentrations of oxygen without taking into account a person's oxygen saturations may lead to increased levels of carbon dioxide and worsened outcomes.[174][175] In those at high risk of high carbon dioxide levels, oxygen saturations of 88–92% are recommended, while for those without this risk, recommended levels are 94–98%.[175] Once prescribed long-term oxygen therapy, patients should be re-assessed after 60 to 90 days, to deteermine whether supplemental oxygen is still indicated and if prescribed supplemental oxygen is effective.[176][177]
Rehabilitation[edit]
Pulmonary rehabilitation is a program of exercise, disease management and counseling, coordinated to benefit the individual.[178] A severe exacerbation leads to hospital admission, high mortality and a decline in the ability to carry out daily activities. Following a hospital admission pulmonary rehabilitation has been shown to significantly reduce future hospital admissions, mortality and improve quality of life.[55]
The optimal exercise routine, use of noninvasive ventilation during exercise and intensity of exercise suggested for people with COPD, is unknown.[179][180] Performing endurance arm exercises improves arm movement for people with COPD and may result in a small improvement in breathlessness.[181] Performing arm exercises alone does not appear to improve quality of life.[181] Pursed-lip breathing exercises may be useful.[27] Tai chi exercises appear to be safe to practice for people with COPD and may be beneficial for pulmonary function and pulmonary capacity when compared to a regular treatment program.[182] Tai Chi was not found to be more effective than other exercise intervention programs.[182] Inspiratory and expiratory muscle training (IMT, EMT) have been suggested and may provide some improvements when compared to no treatment.[183] A combination of IMT and walking exercises at home may help limit breathlessness in cases of severe COPD.[184] Additionally, the use of low amplitude high velocity joint mobilization together with exercise improves lung function and exercise capacity.[185] The goal of spinal manipulation therapy is to improve thoracic mobility in an effort to reduce the work on the lungs during respiration, however, the evidence supporting manual therapy for people with COPD is very weak.[185][186]
Airway clearance techniques (ACTs), such as postural drainage, percussion/vibration, autogenic drainage, hand-held positive expiratory pressure (PEP) devices and other mechanical devices, may reduce the need for increased ventilatory assistance, the duration of ventilatory assistance and the length of hospital stay in people with acute COPD.[187] У людей со стабильной ХОБЛ АКТ могут привести к краткосрочному улучшению качества жизни, связанному со здоровьем, и снижению долгосрочной потребности в госпитализации, связанной с респираторными проблемами. [187]
Недостаточный или избыточный вес может повлиять на симптомы, степень инвалидности и прогноз ХОБЛ. Люди с ХОБЛ и недостаточным весом могут улучшить силу дыхательных мышц, увеличив потребление калорий. В сочетании с регулярными физическими упражнениями или программой легочной реабилитации это может привести к улучшению симптомов ХОБЛ. Дополнительное питание может быть полезно тем, кто недоедает . [21] [188]
Лечение обострений [ править ]
У людей с ХОБЛ могут наблюдаться обострения (обострения), которые обычно вызваны инфекциями дыхательных путей . Симптомы, которые ухудшаются, не являются специфичными для ХОБЛ, и необходимо учитывать дифференциальный диагноз. [31] Острые обострения обычно лечат путем увеличения использования бронходилататоров короткого действия, включая комбинацию ингаляционных бета-агонистов короткого действия и антихолинергических средств короткого действия. [31] Эти лекарства можно вводить либо через дозированный ингалятор со спейсером , либо через небулайзер , причем оба препарата одинаково эффективны. [125] [189] Распыление может быть проще для тех, кто более плохо себя чувствует. [125] Добавки кислорода могут быть полезны. Избыток кислорода; однако это может привести к CO 2 повышению уровня и снижению уровня сознания. [190] Кортикостероиды, принимаемые перорально, могут улучшить функцию легких и сократить время пребывания в больнице, но их использование рекомендуется только в течение пяти-семи дней; более длительные курсы повышают риск развития пневмонии и смерти. [31]
Комнатная температура [ править ]
Поддержание комнатной температуры на уровне не менее 21 °C [70 °F] в течение как минимум девяти часов в день было связано с улучшением здоровья у людей с ХОБЛ, особенно у курильщиков. [191] Всемирная организация здравоохранения (ВОЗ) рекомендует поддерживать температуру в помещении в несколько более высоком диапазоне от 18 °C до 24 °C [от 65 °F до 75 °F]. [192]
Влажность в помещении [ править ]
Для людей с ХОБЛ идеальный уровень влажности в помещении составляет 30–50 % относительной влажности. Зимой поддерживать влажность в помещении может быть затруднительно, особенно в холодном климате, где постоянно работает система отопления. [193]
Поддержание относительной влажности в помещении выше 40% относительной влажности значительно снижает инфекционность аэрозольных вирусов. [194]
Процедуры при эмфиземе [ править ]
Существует ряд процедур по уменьшению объема легких при тяжелой эмфиземе с гиперинфляцией.
Хирургический [ править ]
При тяжелой эмфиземе, не поддающейся другим методам лечения, операция по уменьшению объема легких (LVRS). вариантом может быть [195] [196] LVRS предполагает удаление поврежденных тканей, что улучшает функцию легких, позволяя остальным легким расширяться. [135] [125] Ее рассматривают при эмфиземе верхних долей и отсутствии сопутствующих заболеваний. [197]
Бронхоскопический [ править ]
Для уменьшения объема легких могут быть проведены минимально инвазивные бронхоскопические процедуры. К ним относятся использование клапанов, спиралей или термическая абляция. [21] [198] Эндобронхиальные клапаны представляют собой односторонние клапаны, которые можно использовать у пациентов с тяжелой гиперинфляцией, возникшей в результате развитой эмфиземы; Для этой процедуры не требуется подходящая целевая доля и не требуется коллатеральная вентиляция . Размещение одного или нескольких клапанов в доле вызывает частичный коллапс доли, что обеспечивает уменьшение остаточного объема, что улучшает функцию легких, способность к физическим нагрузкам и качество жизни. [199]
Установка нитиноловых спиралей вместо клапанов рекомендуется там, где имеется боковая вентиляция, препятствующая использованию клапанов. [200] Нитинол – биосовместимый сплав .
Оба этих метода связаны с побочными эффектами, включая постоянные утечки воздуха и сердечно-сосудистые осложнения. Термопаровая абляция имеет улучшенный профиль. Нагретый водяной пар используется для воздействия на области долей, что приводит к стойкому фиброзу и уменьшению объема. Процедура способна воздействовать на отдельные сегменты долей, может проводиться независимо от коллатеральной вентиляции и может быть повторена при естественном прогрессировании эмфиземы. [201]
Другие операции [ править ]
В очень тяжелых случаях возможность трансплантации легких . можно рассмотреть [195] КТ может быть полезна при хирургическом вмешательстве. [88] Вентиляционно-перфузионная сцинтиграфия — еще один метод визуализации, который можно использовать для оценки случаев хирургического вмешательства, а также для оценки послеоперационного ответа. [202] Буллэктомию булла можно провести, если гигантская занимает более трети гемиторакса. [197]
Прогноз [ править ]


| нет данных ≤110 110–220 220–330 330–440 440–550 550–660 | 660–770 770–880 880–990 990–1100 1100–1350 ≥1350 |
ХОБЛ прогрессирует и может привести к преждевременной смерти. По оценкам, 3% всей инвалидности связано с ХОБЛ. [204] Доля инвалидности от ХОБЛ во всем мире снизилась с 1990 по 2010 год благодаря улучшению качества воздуха в помещениях, прежде всего в Азии. [204] Однако общее количество лет, прожитых с инвалидностью вследствие ХОБЛ, увеличилось. [205]
Существует множество переменных, влияющих на долгосрочный результат при ХОБЛ, и GOLD рекомендует использовать комплексный тест ( BODE ), который включает в себя основные переменные: индекс массы тела , обструкцию дыхательных путей, одышку (одышку) и физические упражнения, а не только результаты спирометрии. . [206]
NICE не рекомендует использовать BODE для оценки прогноза при стабильной ХОБЛ; такие факторы, как обострения и слабость . необходимо учитывать [198] Другие факторы, способствующие неблагоприятному исходу, включают пожилой возраст, сопутствующие заболевания, такие как рак легких и сердечно-сосудистые заболевания, а также количество и тяжесть обострений, требующих госпитализации. [31]
Эпидемиология [ править ]
Оценки распространенности имеют значительные различия из-за различий в аналитическом и исследовательском подходах, а также в выборе диагностических критериев. [207] По оценкам, в 2010 году ХОБЛ было у 384 миллионов человек в возрасте 30 лет и старше, что соответствует глобальной распространенности 12%. [8] Заболевание поражает мужчин и женщин. [3] Считается, что рост курения в развивающемся мире в период с 1970 по 2000-е годы связан с увеличением уровня курения в этом регионе, ростом населения и старением населения из-за меньшего количества смертей от других причин, таких как инфекционные заболевания. [135] В некоторых развитых странах наблюдался рост заболеваемости, в некоторых остался стабильным, а в некоторых наблюдалось снижение распространенности ХОБЛ. [135]
Ежегодно от ХОБЛ умирают около трех миллионов человек. [8] В некоторых странах смертность снизилась у мужчин, но увеличилась у женщин. [208] Скорее всего, это связано с тем, что показатели курения среди женщин и мужчин становятся более схожими. [88] Более высокий уровень ХОБЛ обнаруживается у лиц старше 40 лет, и он значительно увеличивается с возрастом, при этом самый высокий уровень заболеваемости наблюдается у лиц старше 60 лет. [8] Половые различия в анатомии дыхательной системы включают меньший просвет дыхательных путей и более толстые стенки дыхательных путей у женщин, что способствует большей выраженности симптомов ХОБЛ, таких как одышка, и частоте обострений ХОБЛ. [209]
Сообщается, что в Великобритании три миллиона человек страдают от ХОБЛ, причем два миллиона из них не диагностированы. В среднем число смертей, связанных с ХОБЛ, в период с 2007 по 2016 год составило 28 600 человек. По оценкам, число смертей в результате профессионального воздействия составило около 15% и составило около 4000 человек. [207] В Соединенных Штатах в 2018 году почти 15,7 миллионам человек был поставлен диагноз ХОБЛ, и, по оценкам, еще миллионам диагноз не был поставлен. [210]
В 2011 году в США было зарегистрировано около 730 000 госпитализаций по поводу ХОБЛ. [211] В мире ХОБЛ в 2019 году стала третьей по значимости причиной смерти. В странах с низким уровнем дохода ХОБЛ не входит в десятку основных причин смерти; в других группах по доходам он входит в пятерку лучших. [212]
История [ править ]

Считается, что название « хроническая обструктивная болезнь легких» впервые было использовано в 1965 году. [213] Ранее он был известен под разными названиями, в том числе хроническая обструктивная бронхолегочная болезнь , хроническая обструкция дыхательных путей , хроническая обструктивная болезнь легких , неспецифическая хроническая болезнь легких , диффузный обструктивный легочный синдром . [213]
Термины «эмфизема» и «хронический бронхит» были официально определены как компоненты ХОБЛ в 1959 году на гостевом симпозиуме CIBA и в 1962 году на заседании Комитета Американского торакального общества по диагностическим стандартам. [213]
Ранние описания вероятной эмфиземы начались в 1679 г. Т. Боне о состоянии «объемных легких» и в 1769 г. Джованни Морганьи о легких, которые были «набухшими, особенно от воздуха». [213] [214] В 1721 году Руйш сделал первые рисунки эмфиземы. [214] Рене Лаэннек использовал термин «эмфизема» в своей книге «Трактат о болезнях грудной клетки и опосредованной аускультации» (1837) для описания легких, которые не спались, когда он открыл грудную клетку во время вскрытия. Он отметил, что они не спались, как обычно, потому что были полны воздуха, а дыхательные пути заполнены слизью. [213] В 1842 году Джон Хатчинсон изобрел спирометр , который позволил измерить жизненную емкость легких. Однако его спирометр мог измерять только объем, а не поток воздуха. Тиффено и Пинелли в 1947 году описали принципы измерения воздушного потока. [213]
Загрязнение воздуха и рост курения сигарет в Великобритании в начале 20-го века привели к высокому уровню хронических заболеваний легких, хотя этому уделялось мало внимания до Великого смога в Лондоне в декабре 1952 года. Это стимулировало эпидемиологические исследования в Соединенном Королевстве. , Голландия и другие страны. [215] В 1953 году Джордж Л. Уолдботт, американский аллерголог, впервые описал новое заболевание, которое он назвал респираторным синдромом курильщика, в журнале Американской медицинской ассоциации за 1953 год . Это была первая связь между курением табака и хроническими респираторными заболеваниями. [216]
Современные методы лечения были разработаны во второй половине 20 века. Доказательства, подтверждающие использование стероидов при ХОБЛ, были опубликованы в конце 1950-х годов. Бронходилататоры начали использовать в 1960-х годах после многообещающих испытаний изопреналина . Другие бронходилататоры, такие как сальбутамол короткого действия , были разработаны в 1970-х годах, а использование бронходилятаторов длительного действия началось в середине 1990-х годов. [217]
и Общество культура
Принято считать, что ХОБЛ широко не диагностируется и многие люди остаются без лечения. В США НИЗ объявил ноябрь Месяцем осведомленности о ХОБЛ, чтобы ежегодно уделять повышенное внимание повышению осведомленности об этом заболевании. [218]
Экономика [ править ]
По оценкам, в 2010 году ХОБЛ привела к экономическим потерям в размере 2,1 триллиона долларов США, половина из которых приходится на развивающиеся страны. [219] Из этой суммы примерно 1,9 триллиона долларов составляют прямые расходы, такие как медицинское обслуживание, а 0,2 триллиона долларов — это косвенные расходы, такие как пропуск работы. [220] Ожидается, что к 2030 году этот показатель увеличится более чем вдвое. [219] В Европе ХОБЛ составляет 3% расходов на здравоохранение. [125] В США ущерб от болезни оценивается в 50 миллиардов долларов, большая часть из которых связана с обострением. [112] ХОБЛ была одним из самых дорогих заболеваний, наблюдаемых в больницах США в 2011 году, ее общая стоимость составила около 5,7 миллиардов долларов. [211]
Исследования [ править ]
Гиалуронан — это натуральный сахар во внеклеточном матриксе , который обеспечивает защитное покрытие клеток. Показано, что под воздействием загрязнений гиалуронан в легких распадается на фрагменты, вызывая раздражение и активацию иммунной системы. За этим следует сужение и воспаление дыхательных путей. Исследование показало, что ингаляция нефрагментированной гиалуроновой кислоты преодолевает эффекты фрагментированной ГК и уменьшает воспаление. Вдыхаемая ГК действует только локально в бронхиальном дереве и не влияет на действие каких-либо лекарств. Это улучшает выведение слизи, позволяя ей двигаться более свободно. Дальнейшие исследования будут проводиться в г. УЗИ для определения оптимальных дозировок. [221]
Новое криогенное лечение, направленное на хронический бронхитический подтип, с использованием криоспрея с дозированием жидкого азота проходит испытания и должно быть завершено в сентябре 2021 года. [222] [223]
Терапия стволовыми клетками с использованием мезенхимальных стволовых клеток потенциально способна восстановить функцию легких и тем самым улучшить качество жизни. В июне 2021 года восемь клинических исследований были завершены и семнадцать находятся в стадии реализации. В целом терапия стволовыми клетками оказалась безопасной. Испытания включают использование стволовых клеток из различных источников, таких как жировая ткань , костный мозг и пуповинная кровь . [224]
Процедура, известная как целевая денервация легких , проходит испытания и использовалась в рамках клинического испытания (2021 г.) в больнице в Великобритании. Новая минимально инвазивная процедура , выполнение которой занимает около часа, предполагает установку электродов для разрушения ветвей блуждающего нерва в легких. Блуждающий нерв отвечает как за сокращение мышц , так и за секрецию слизи, что приводит к сужению дыхательных путей. У людей с ХОБЛ эти нервы сверхактивны, обычно в результате повреждения курением, а постоянное выделение слизи и сужение дыхательных путей приводит к таким симптомам, как кашель, одышка, хрипы и чувство стеснения в груди. [225]
Эффективность лечения альфа-1-антитрипсином у людей с дефицитом альфа-1-антитрипсина неясна. [226] Более позднее клиническое испытание двойной дозы показало некоторые улучшения в замедлении распада эластина и прогрессирования эмфиземы, поэтому требуются дальнейшие исследования. [227]
Масс-спектрометрия изучается как инструмент диагностики ХОБЛ. [228]
Продолжаются исследования по использованию телемедицины для лечения людей с ХОБЛ, когда у них возникают эпизоды одышки; Дистанционное лечение людей может сократить количество посещений отделений неотложной помощи и улучшить качество жизни человека. [229]
Появляется все больше доказательств эффективности астаксантина против заболеваний легких, включая ХОБЛ. Астаксантин является мощным антиоксидантом с противовоспалительными свойствами, и, как говорят, необходимы дополнительные испытания для его использования. [230]
Американские пациенты с ХОБЛ и лица, осуществляющие за ними уход, считают наиболее важными следующие области исследований, связанные с ХОБЛ:
- семейные/социальные/общественные исследования
- благополучие пациентов
- лечебные исследования
- биомедицинская терапия
- политика
- целостная терапия. [231]
Другие животные [ править ]
Хроническая обструктивная болезнь легких может возникнуть у ряда других животных и может быть вызвана воздействием табачного дыма. [232] Однако в большинстве случаев заболевание протекает относительно легко. [233] У лошадей это явление известно как рецидивирующая обструкция дыхательных путей (РАО) или рвота . РАО может быть довольно тяжелым и чаще всего связано с воздействием обычных аллергенов. [234] ХОБЛ также часто встречается у старых собак. [235]
См. также [ править ]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я "Хроническая обструктивная болезнь легких" . хороший.орг . Проверено 5 июля 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б с «Хроническая обструктивная болезнь легких (ХОБЛ) – осложнения | Лучшая практика BMJ» . bestpractice.bmj.com . Проверено 11 июля 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г «Хроническая обструктивная болезнь легких (ХОБЛ)» . Информационные бюллетени . Всемирная организация здравоохранения . Проверено 1 июля 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л Золотой отчет 2021 , стр. 20–27, Глава 2: Диагностика и первоначальная оценка.
- ↑ Перейти обратно: Перейти обратно: а б с д Золотой отчет 2021 , стр. 33–35, Глава 2: Диагностика и первоначальная оценка.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к Gold Report 2021 , стр. 40–46, Глава 3: Фактические данные, подтверждающие профилактику и поддерживающую терапию.
- ↑ Перейти обратно: Перейти обратно: а б Соавторы ГББ, 2015 г., по заболеваемости и распространенности заболеваний и травм (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и количество лет жизни с инвалидностью по 310 заболеваниям и травмам, 1990–2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1545–1602. дои : 10.1016/S0140-6736(16)31678-6 . ПМК 5055577 . ПМИД 27733282 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л Gold Report 2021 , стр. 4–8, Глава 1: Определение и обзор.
- ^ «Отчет ЗОЛОТА 2024» . Глобальная инициатива по борьбе с хронической обструктивной болезнью легких – GOLD . Проверено 23 февраля 2024 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и Мик Л.А., Шим Ю.М., Лаубах В.Е., Димастроматтео Дж. (апрель 2019 г.). «Роль медицинской и молекулярной визуализации при ХОБЛ» . Клин Трансл Мед . 8 (1): 12. дои : 10.1186/s40169-019-0231-z . ПМК 6465368 . ПМИД 30989390 .
- ↑ Перейти обратно: Перейти обратно: а б «МКБ-11 — МКБ-11 по статистике смертности и заболеваемости» . icd.who.int . Проверено 30 июня 2021 г.
- ^ Мартини К., Фрауэнфельдер Т. (ноябрь 2020 г.). «Достижения в области визуализации эмфиземы легких» . Энн Трансл Мед . 8 (21): 1467. doi : 10.21037/atm.2020.04.44 . ПМЦ 7723580 . ПМИД 33313212 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р Gold Report 2021 , стр. 8–14, Глава 1: Определение и обзор.
- ↑ Перейти обратно: Перейти обратно: а б Де Роуз В., Моллой К., Гохи С., Пилетт С., Грин СМ (2018). «Дисфункция эпителия дыхательных путей при муковисцидозе и ХОБЛ» . Медиаторы воспаления . 2018 : 1309746. doi : 10.1155/2018/1309746 . ПМЦ 5911336 . ПМИД 29849481 .
- ^ Совместные рекомендации GINA и GOLD Ga (2014 г.). «Астма ХОБЛ и синдром перекрытия астмы ХОБЛ (ACOS)» (PDF) . Рекомендации GINA .
- ^ Агусти А., Сориано Дж. Б. (январь 2008 г.). «ХОБЛ как системное заболевание» . ХОБЛ: Журнал хронической обструктивной болезни легких . 5 (2): 133–138. дои : 10.1080/15412550801941349 . ISSN 1541-2555 . ПМИД 18415812 . S2CID 32732993 .
- ↑ Перейти обратно: Перейти обратно: а б с д и «Хроническая обструктивная болезнь легких (ХОБЛ) – этиология | Передовая практика BMJ» . bestpractice.bmj.com . Проверено 25 ноября 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б «Причины ХОБЛ – профессии и вещества» . www.hse.gov.uk. Проверено 3 июля 2021 г.
- ^ Торрес-Дуке Калифорния, Гарсиа-Родригес MC, Гонсалес-Гарсия М (август 2016 г.). «Является ли хроническая обструктивная болезнь легких, вызванная дымом древесины, другим фенотипом или другой сущностью?». Архив бронконеумологии . 52 (8): 425–31. дои : 10.1016/j.arbres.2016.04.004 . ПМИД 27207325 .
- ↑ Перейти обратно: Перейти обратно: а б с д Gold Report 2021 , стр. 80–83, Глава 4: Лечение стабильной ХОБЛ.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Gold Report 2021 , стр. 60–65, Глава 3: Фактические данные, подтверждающие профилактику и поддерживающую терапию.
- ^ Доблер CC, Морроу А.С., Беушель Б., Фара М.Х., Маджзуб А.М., Уилсон М.Е. и др. (март 2020 г.). «Фармакологическая терапия у пациентов с обострением хронической обструктивной болезни легких: систематический обзор с метаанализом». Анналы внутренней медицины . 172 (6): 413–422. дои : 10.7326/M19-3007 . ПМИД 32092762 . S2CID 211476101 .
- ^ Ван Х., Нагави М., Аллен С., Барбер Р.М., Бхутта З.А., Картер А. и др. (GBD 2015 Смертность и причины смерти, сотрудники) (октябрь 2016 г.). «Глобальная, региональная и национальная продолжительность жизни, смертность от всех причин и смертность от конкретных причин по 249 причинам смерти, 1980–2015 гг.: систематический анализ для исследования глобального бремени болезней, 2015 г.» . Ланцет . 388 (10053): 1459–1544. дои : 10.1016/S0140-6736(16)31012-1 . ПМЦ 5388903 . ПМИД 27733281 .
- ^ ГББ 2013 Смертность и причины смерти Соавторы (январь 2015 г.). «Глобальная, региональная и национальная смертность от всех причин и по конкретным причинам в разбивке по возрасту и по конкретным причинам по 240 причинам смерти, 1990–2013 гг.: систематический анализ для исследования глобального бремени болезней, 2013 г.» . Ланцет . 385 (9963): 117–71. дои : 10.1016/S0140-6736(14)61682-2 . ПМК 4340604 . ПМИД 25530442 .
- ^ «Затраты на ХОБЛ» . www.cdc.gov . 5 июля 2019 г.
- ^ «Инструментарий для ввода в эксплуатацию ХОБЛ» (PDF) . www.assets.publishing.service.gov.uk . Проверено 18 июля 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б Майер А.Ф., Карлох М., Дос Сантос К., де Араужо К.Л., Гуларт А.А. (март 2018 г.). «Эффекты острого использования дыхания с поджатыми губами во время физических упражнений у пациентов с ХОБЛ: систематический обзор и метаанализ». Физиотерапия . 104 (1): 9–17. дои : 10.1016/j.physio.2017.08.007 . ПМИД 28969859 .
- ^ Gold Report 2021 , стр. 90–96, Глава 4: Лечение стабильной ХОБЛ.
- ^ О'Доннелл Д.Э., Милн К.М., Джеймс М.Д., де Торрес Дж.П., Недер Дж.А. (январь 2020 г.). «Одышка при ХОБЛ: новые механистические идеи и последствия управления» . Достижения в терапии . 37 (1): 41–60. дои : 10.1007/s12325-019-01128-9 . ПМЦ 6979461 . ПМИД 31673990 .
- ↑ Перейти обратно: Перейти обратно: а б Салонтай К., Гемес Н., Фурак Дж. и др. (июнь 2021 г.). «Хроническая обструктивная болезнь легких: эпидемиология, биомаркеры и путь к раку легких» . Джей Клин Мед . 10 (13): 2889. doi : 10.3390/jcm10132889 . ПМЦ 8268950 . ПМИД 34209651 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж Золотой отчет 2021 , стр. 104–109, Глава 5: Лечение обострений.
- ^ «Обычная простуда» . Центры по контролю и профилактике заболеваний . 7 октября 2020 года. Архивировано из оригинала 18 июня 2023 года . Проверено 20 августа 2021 г.
- ^ Го-Парке Х., Линден Д., Уэлдон С., Кидни Дж.К., Таггарт CC (2020). «Механизмы вирус-индуцированной дисфункции иммунитета дыхательных путей в патогенезе, прогрессировании и обострении ХОБЛ» . Границы в иммунологии . 11 : 1205. дои : 10.3389/fimmu.2020.01205 . ПМЦ 7325903 . ПМИД 32655557 .
- ^ Шорт Б., Карсон С., Девлин А.С. и др. (март 2021 г.). «Хроническая колонизация нетипируемой Haemophilus influenzae при хронической обструктивной болезни легких (ХОБЛ)» . Критические обзоры по микробиологии . 47 (2): 192–205. дои : 10.1080/1040841X.2020.1863330 . ПМИД 33455514 . S2CID 230608674 .
- ^ Агентство по охране окружающей среды США O (19 апреля 2016 г.). «Основы твердых частиц (ТЧ)» . www.epa.gov . Проверено 21 июля 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б Халпин Д.М., Крайнер Г.Дж., Папи А., Сингх Д., Ансуэто А., Мартинес Ф.Дж., Агусти А.А., Фогельмайер К.Ф. (январь 2021 г.). «Глобальная инициатива по диагностике, лечению и профилактике хронической обструктивной болезни легких. Отчет научного комитета GOLD 2020 года о COVID-19 и хронической обструктивной болезни легких» . Am J Respir Crit Care Med . 203 (1): 24–36. doi : 10.1164/rccm.202009-3533SO . ПМЦ 7781116 . ПМИД 33146552 .
- ^ Якобуччи Дж. (август 2020 г.). «Изоляция Covid: в Англии меньше случаев простуды, гриппа и бронхита» . БМЖ . 370 : м3182. дои : 10.1136/bmj.m3182 . ПМИД 32784206 . S2CID 221097739 .
- ^ Агентство по охране окружающей среды США O (13 августа 2019 г.). «Последствия для здоровья, связанные с дымом лесных пожаров» . www.epa.gov . Проверено 21 июля 2021 г.
- ^ «Лесные пожары и здоровье легких» . легочная ассоциация . 25 августа 2014 года . Проверено 21 июля 2021 г.
- ^ «Дым лесных пожаров» . Национальный центр здоровья фермеров . 19 марта 2014 года . Проверено 21 июля 2021 г.
- ^ Ло Дж, Чжан Д, Тан В, Доу Ли, Сунь Ю (2021). «Влияние слабости на риск обострений и смертность от всех причин у пожилых пациентов со стабильной хронической обструктивной болезнью легких» . Клин Интервальное старение . 16 : 593–601. дои : 10.2147/CIA.S303852 . ПМК 8053481 . ПМИД 33880018 .
- ^ Алева Ф.Е., Воетс Л.В., Саймонс С.О., де Маст К., ван дер Вен А.Дж., Хейдра Ю.Ф. (март 2017 г.). «Распространенность и локализация легочной эмболии при необъяснимых острых обострениях ХОБЛ: систематический обзор и метаанализ». Грудь . 151 (3): 544–554. дои : 10.1016/j.chest.2016.07.034 . ПМИД 27522956 . S2CID 7181799 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Золотой отчет 2021 , стр. 26–33, Глава 2: Диагностика и первоначальная оценка.
- ^ Эдгар Р.Г., Патель М., Бейлисс С., Кроссли Д., Сапи Э., Тернер А.М. (2017). «Лечение заболеваний легких при дефиците альфа-1-антитрипсина: систематический обзор» . Int J Chron Obstruct Pulmon Dis . 12 : 1295–1308. дои : 10.2147/COPD.S130440 . ПМЦ 5422329 . ПМИД 28496314 .
- ↑ Перейти обратно: Перейти обратно: а б с д Клементи Е.А., Талусан А., Вайдьянатан С., Вираппан А., Михаил М., Островский Д. и др. (январь 2019 г.). «Метаболический синдром и загрязнение воздуха: описательный обзор их сердечно-легочных эффектов» . Токсики . 7 (1): 6. doi : 10.3390/toxis7010006 . ПМК 6468691 . ПМИД 30704059 .
- ^ Чан С.Х., Селемидис С., Божиновски С., Влахос Р. (июнь 2019 г.). «Патобиологические механизмы, лежащие в основе метаболического синдрома (MetS) при хронической обструктивной болезни легких (ХОБЛ): клиническое значение и терапевтические стратегии» . Фармакол Тер . 198 : 160–188. doi : 10.1016/j.pharmthera.2019.02.013 . ПМК 7112632 . ПМИД 30822464 .
- ↑ Перейти обратно: Перейти обратно: а б Forfia PR, Vaidya A, Wiegers SE (январь 2013 г.). «Легочное сердце: взаимодействие сердца и легких и его влияние на фенотипы пациентов» . Пульм Цирк . 3 (1): 5–19. дои : 10.4103/2045-8932.109910 . ПМЦ 3641739 . ПМИД 23662171 .
- ^ Gold Report 2021 , стр. 121–126, Глава 6: ХОБЛ и сопутствующие заболевания.
- ↑ Перейти обратно: Перейти обратно: а б Вайнбергер С.Э. (2019). Принципы легочной медицины (Седьмое изд.). Филадельфия, Пенсильвания. п. 104. ИСБН 978-0-323-52371-4 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Делонуа Л. (октябрь 1989 г.). «Анатомия и физиология коллатеральных дыхательных путей» . Европейский респираторный журнал . 2 (9): 893–904. дои : 10.1183/09031936.93.02090893 . ПМИД 2680588 . S2CID 7124561 . Проверено 30 августа 2021 г.
- ^ Рамирес-Венегас А, Торрес-Дюке К.А., Гусман-Буйо Н.Е., Гонсалес-Гарсия М., Сансорес Р.Х. (2019). «ЗАБОЛЕВАНИЕ МАЛЫХ ДЫХАТЕЛЬНЫХ ПУТЕЙ ПРИ ХОБЛ, СВЯЗАННОЕ С ВОЗДЕЙСТВИЕМ БИОМАССЫ» . Рев Инвест Клин . 71 (1): 70–78. дои : 10.24875/RIC.18002652 . ПМИД 30810542 .
- ^ Корлатяну А., Мендес Ю., Ван Ю., Гарника Р.Дж., Ботнару В., Сифакас Н. (2020). «Хроническая обструктивная болезнь легких и фенотипы: современное состояние» . Пульмонология . 26 (2): 95–100. дои : 10.1016/j.pulmoe.2019.10.006 . ПМИД 31740261 .
- ^ Постма Д.С., Рабе К.Ф. (24 сентября 2015 г.). «Синдром перекрытия астмы и ХОБЛ». Медицинский журнал Новой Англии . 373 (13): 1241–1249. дои : 10.1056/NEJMra1411863 . ПМИД 26398072 .
- ^ Меков Э., Нуньес А., Син Д.Д., Ичиносе М., Ри К.К., Маселли Д.Д., Коте А., Суппли Ульрик С., Мальтаис Ф., Ансуэто А., Миравитлес М. (июнь 2021 г.). «Обновленная информация о пересечении астмы и ХОБЛ (ACO): описательный обзор» . Международный журнал хронической обструктивной болезни легких . 16 : 1783–1799. дои : 10.2147/COPD.S312560 . ПМК 8216660 . PMID 34168440 .
- ↑ Перейти обратно: Перейти обратно: а б Халпин Д.М., Миравитлес М., Мецдорф Н., Челли Б. (2017). «Воздействие и профилактика тяжелых обострений ХОБЛ: обзор доказательств» . Int J Chron Obstruct Pulmon Dis . 12 : 2891–2908. дои : 10.2147/COPD.S139470 . ПМЦ 5638577 . ПМИД 29062228 .
- ↑ Перейти обратно: Перейти обратно: а б Брайтлинг С., Грининг Н. (август 2019 г.). «Воспаление дыхательных путей при ХОБЛ: прогресс в точной медицине» (PDF) . Эур Респир Дж . 54 (2). дои : 10.1183/13993003.00651-2019 . ПМИД 31073084 . S2CID 149444134 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Gold Report 2021 , стр. 54–58, Глава 3: Фактические данные, подтверждающие профилактику и поддерживающую терапию.
- ^ Бай С, Чжао Л (2021). «Дисбаланс между травмой и защитой при эмфизематозном фенотипе ХОБЛ» . Границы в медицине . 8 : 653332. doi : 10.3389/fmed.2021.653332 . ПМК 8131650 . ПМИД 34026786 .
- ^ Кумар А., Махаджан А., Салазар Э.А. и др. (июнь 2021 г.). «Влияние вируса иммунодефицита человека на заболевания легочных сосудов» . Глобальная кардиологическая научная практика . 2021 (2): e202112. дои : 10.21542/gcsp.2021.12 . ПМЦ 8272407 . ПМИД 34285903 .
- ^ Осадник CR, McDonald CF, Holland AE (2014). «Клинические вопросы накопления слизи при ХОБЛ» . Int J Chron Obstruct Pulmon Dis . 9 : 301–2. дои : 10.2147/COPD.S61797 . ПМЦ 3970915 . ПМИД 24741301 .
- ↑ Перейти обратно: Перейти обратно: а б Сильверман ЭК (февраль 2020 г.). «Генетика ХОБЛ» . Анну преподобный Физиол . 82 : 413–431. doi : 10.1146/annurev-psyol-021317-121224 . ПМЦ 7193187 . ПМИД 31730394 .
- ^ «Часто задаваемые вопросы: Пыль — руководитель отдела охраны труда и техники безопасности (HSE)» .
- ↑ Перейти обратно: Перейти обратно: а б Николич М.З., Сан Д., Роулинз Э.Л. (15 августа 2018 г.). «Развитие легких человека: недавний прогресс и новые проблемы» . Разработка . 145 (16). дои : 10.1242/dev.163485 . ПМК 6124546 . ПМИД 30111617 .
- ^ Смит Б.М., Трабулси Х., Остин Дж.М. и др. (январь 2018 г.). «Вариации ветвей дыхательных путей человека и хроническая обструктивная болезнь легких» . Proc Natl Acad Sci США . 115 (5): Е974–Е981. Бибкод : 2018PNAS..115E.974S . дои : 10.1073/pnas.1715564115 . ПМК 5798356 . ПМИД 29339516 .
- ↑ Перейти обратно: Перейти обратно: а б Бэйли К.Л., Самуэльсон Д.Р., Вятт Т.А. (февраль 2021 г.). «Расстройство, связанное с употреблением алкоголя: уже существующее состояние при COVID-19?» . Алкоголь . 90 : 11–17. дои : 10.1016/j.alcohol.2020.10.003 . ПМЦ 7568767 . ПМИД 33080339 .
- ↑ Перейти обратно: Перейти обратно: а б Смит П., Джефферс Л.А., Коваль М. (ноябрь 2019 г.). «Влияние различных путей повреждения эндотоксина на барьерную функцию при алкогольном синдроме легких» . Алкоголь . 80 : 81–89. дои : 10.1016/j.alcohol.2018.08.007 . ПМК 6613986 . ПМИД 31278041 .
- ^ Арверс П. (декабрь 2018 г.). «[Употребление алкоголя и повреждение легких: Опасные отношения]». Преподобный Мал Респир (на французском языке). 35 (10): 1039–1049. дои : 10.1016/j.rmr.2018.02.009 . ПМИД 29941207 . S2CID 239523761 .
- ^ Словински В.С., Ромеро Ф., Сейлз Д., Шагаги Х., Саммер Р. (ноябрь 2019 г.). «Вовлечение дефицита GM-CSF в параллельные пути легочного альвеолярного протеиноза и алкогольного легкого» . Алкоголь . 80 : 73–79. дои : 10.1016/j.alcohol.2018.07.006 . ПМК 6592783 . ПМИД 31229291 .
- ↑ Перейти обратно: Перейти обратно: а б Уорд Х (2012). Оксфордский справочник по эпидемиологии для врачей . Издательство Оксфордского университета. стр. 289–290. ISBN 978-0-19-165478-7 .
- ^ Реннард С. (2013). Клиническое ведение хронической обструктивной болезни легких (2-е изд.). Информа Здравоохранение. п. 23. ISBN 978-0-8493-7588-0 .
- ^ Шарма А., Барклай Дж. (2010). ХОБЛ в первичной медико-санитарной помощи . Рэдклифф Паб. п. 9. ISBN 978-1-84619-316-3 .
- ^ Хан МК, Мартинес Ф.Дж. (сентябрь 2020 г.). «Хозяин, пол и факторы раннего возраста как риски хронической обструктивной болезни легких» . Клиники грудной медицины . 41 (3): 329–337. дои : 10.1016/j.ccm.2020.06.009 . ПМЦ 7993923 . ПМИД 32800188 .
- ^ Амарал А.Ф., Страчан Д.П., Берни П.Г., Джарвис Д.Л. (май 2017 г.). «Курильщики-женщины подвергаются большему риску обструкции дыхательных путей, чем курильщики-мужчины. Биобанк Великобритании» (PDF) . Американский журнал респираторной медицины и медицины интенсивной терапии . 195 (9): 1226–1235. дои : 10.1164/rccm.201608-1545OC . hdl : 10044/1/45106 . ПМИД 28075609 . S2CID 9360093 .
- ^ «Табак» . Информационные бюллетени . Всемирная организация здравоохранения . Проверено 12 июля 2021 г.
- ^ Савран О, Ульрик CS (2018). «Оскорбления в раннем возрасте как детерминанты хронической обструктивной болезни легких во взрослой жизни» . Международный журнал хронической обструктивной болезни легких . 13 : 683–693. дои : 10.2147/COPD.S153555 . ПМЦ 5834168 . ПМИД 29520136 .
- ^ Патель М.П., Хангура В.С., Марик П.Е. (октябрь 2019 г.). «Обзор влияния употребления кальяна на легкие и здоровье». Анналы Американского торакального общества . 16 (10): 1215–1219. doi : 10.1513/AnnalsATS.201902-129CME . ПМИД 31091965 . S2CID 155103502 .
- ↑ Перейти обратно: Перейти обратно: а б с д Чаткин Дж.М., Заберт Г., Заберт И., Чаткин Г., Хименес-Руис К.А., де Гранда-Ориве Дж.И. и др. (сентябрь 2017 г.). «Заболевания легких, связанные с употреблением марихуаны». Арка Бронконеумол . 53 (9): 510–515. дои : 10.1016/j.arbres.2017.03.019 . ПМИД 28483343 .
- ^ Ундернер М., Урбан Т., Перриот Дж., Пайффер Дж., Харика-Джермано Дж., Джаафари Н. (декабрь 2018 г.). «[Спонтанный пневмоторакс и эмфизема легких у потребителей каннабиса]». Преподобный Пневмол Клин (на французском языке). 74 (6): 400–415. дои : 10.1016/j.pneumo.2018.06.003 . ПМИД 30420278 . S2CID 59233744 .
- ^ Мартинасек, член парламента, Макгроган Дж.Б., Мэйсонет А (ноябрь 2016 г.). «Систематический обзор респираторного воздействия ингаляционной марихуаны» . Уход за дыханием . 61 (11): 1543–1551. doi : 10.4187/respcare.04846 . ПМИД 27507173 .
- ^ Рибейро Л.И., Ind PW (октябрь 2016 г.). «Влияние курения каннабиса на функцию легких и респираторные симптомы: структурированный обзор литературы» . npj Первичная медико-санитарная помощь по респираторной медицине . 26 : 16071. дои : 10.1038/npjpcrm.2016.71 . ПМК 5072387 . ПМИД 27763599 .
- ^ «Доступ к чистым видам топлива и технологиям приготовления пищи» . Наш мир в данных . Проверено 15 февраля 2020 г.
- ^ Халберт Р.Дж., Натоли Дж.Л., Гано А., Бадамгарав Э., Буист А.С., Маннино Д.М. (сентябрь 2006 г.). «Глобальное бремя ХОБЛ: систематический обзор и метаанализ» . Европейский респираторный журнал . 28 (3): 523–32. дои : 10.1183/09031936.06.00124605 . ПМИД 16611654 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Пироцци С., Шоланд М.Б. (июль 2012 г.). «Отказ от курения и гигиена окружающей среды». Медицинские клиники Северной Америки . 96 (4): 849–67. дои : 10.1016/j.mcna.2012.04.014 . ПМИД 22793948 .
- ^ Хоппер Т. (2014). Аптечный техник Мосби – электронная книга: принципы и практика . Elsevier Науки о здоровье. п. 610. ИСБН 978-0-323-29245-0 .
- ^ Барнс П.Дж., Дразен Дж.М., Реннард С.И. (2009). «Связь между курением сигарет и профессиональными воздействиями» . В Барнс П.Дж., Дразен Дж.М., Реннард С.И., Томсон Северная Каролина (ред.). Астма и ХОБЛ: основные механизмы и клиническое ведение . Академический. п. 464. ИСБН 978-0-12-374001-4 .
- ↑ Перейти обратно: Перейти обратно: а б Форман М.Г., Кампос М., Селедон Х.К. (июль 2012 г.). «Гены и хроническая обструктивная болезнь легких» . Медицинские клиники Северной Америки . 96 (4): 699–711. дои : 10.1016/j.mcna.2012.02.006 . ПМЦ 3399759 . ПМИД 22793939 .
- ^ Броде С.К., Линг С.К., Чепмен К.Р. (сентябрь 2012 г.). «Дефицит альфа-1-антитрипсина: часто упускаемая из виду причина заболеваний легких» . CMAJ . 184 (12): 1365–71. дои : 10.1503/cmaj.111749 . ПМЦ 3447047 . ПМИД 22761482 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Рейли Дж.Дж., Сильверман Э.К., Шапиро С.Д. (2011). "Хроническая обструктивная болезнь легких". В Лонго Д., Фаучи А., Каспер Д., Хаузер С., Джеймсон Дж., Лоскальцо Дж. (ред.). Принципы внутренней медицины Харрисона (18-е изд.). МакГроу Хилл. стр. 2151–9. ISBN 978-0-07-174889-6 .
- ^ «Дом – Джин – NCBI» . www.ncbi.nlm.nih.gov . Проверено 17 июля 2022 г.
- ^ Маселли DJ, Бхатт С.П., Анзуэто А., Боулер Р.П., ДеМео Д.Л., Диас А.А. и др. (август 2019 г.). «Клиническая эпидемиология ХОБЛ: результаты 10-летнего исследования генов ХОБЛ» . Грудь . 156 (2): 228–238. дои : 10.1016/j.chest.2019.04.135 . ПМЦ 7198872 . ПМИД 31154041 .
- ^ Капрон Т., Бурден А., Перес Т., Чанес П. (июнь 2019 г.). «ХОБЛ за пределами проксимальной бронхиальной обструкции: фенотипирование и связанные с ним инструменты у постели больного» (PDF) . Eur Respir Rev. 28 (152): 190010. doi : 10.1183/16000617.0010-2019 . ПМЦ 9488991 . ПМИД 31285287 . S2CID 195844108 .
- ^ Кумар В., Аббас А.К., Астер Дж.К. (2018). Основная патология Роббинса (10-е изд.). Эльзевир. стр. 498–502. ISBN 978-0-323-35317-5 .
- ↑ Перейти обратно: Перейти обратно: а б Д'Асканио М., Виккаро Ф., Калабро Н., Геррьери Г., Сальвуччи С., Пиццируссо Д. и др. (2020). «Оценка статической гиперинфляции легких с помощью плетизмографии всего тела, разведения гелия и системы импульсной осциллометрии (IOS) у пациентов с ХОБЛ» . Int J Chron Obstruct Pulmon Dis . 15 : 2583–9. дои : 10.2147/COPD.S264261 . ПМЦ 7585810 . ПМИД 33116475 .
- ^ Нокс-Браун Б., Патель Дж., Поттс Дж., Ахмед Р., Акварт-Стюарт А., Черкаски Х. и др. (январь 2023 г.). «Обструкция малых дыхательных путей и ее факторы риска в исследовании бремени обструктивной болезни легких (ЖИРНЫЙ): многонациональное поперечное исследование». Ланцет Глоб Здоровье . 11 (1): е69–е82. дои : 10.1016/S2214-109X(22)00456-9 . hdl : 10044/1/100800 . ПМИД 36521955 . S2CID 254665705 .
- ^ Нокс-Браун Б., Патель Дж., Поттс Дж. и др. (23 мая 2023 г.). «Связь спирометрической обструкции мелких дыхательных путей с респираторными симптомами, кардиометаболическими заболеваниями и качеством жизни: результаты исследования бремени обструктивной болезни легких (BOLD)» . Респираторные исследования . 24 (1): 137. дои : 10.1186/s12931-023-02450-1 . ПМЦ 10207810 . ПМИД 37221593 .
- ^ Ло Белло Ф., Йени А., Хансбро П.М., Руджери П., Ди Стефано А., Нусера Ф. и др. (май 2020 г.). «Роль муцинов в патогенезе ХОБЛ: значение для терапии». Экспертное обозрение респираторной медицины . 14 (5): 465–483. дои : 10.1080/17476348.2020.1739525 . hdl : 10453/139160 . ПМИД 32133884 . S2CID 212416323 .
- ↑ Перейти обратно: Перейти обратно: а б Хайэм А., Куинн А.М., Кансадо Дж.Э., Сингх Д. (март 2019 г.). «Патология заболеваний мелких дыхательных путей при ХОБЛ: исторические аспекты и будущие направления» . Дыхание Рес . 20 (1): 49. дои : 10.1186/s12931-019-1017-y . ПМК 6399904 . ПМИД 30832670 .
- ↑ Перейти обратно: Перейти обратно: а б Калверли П.М., Кулурис Н.Г. (январь 2005 г.). «Ограничение потока и динамическая гиперинфляция: ключевые концепции современной физиологии дыхания» . Европейский респираторный журнал . 25 (1): 186–99. дои : 10.1183/09031936.04.00113204 . ПМИД 15640341 .
- ^ Карри GP (2010). Азбука ХОБЛ (2-е изд.). Уайли-Блэквелл, BMJ Books. п. 32. ISBN 978-1-4443-2948-3 .
- ^ О'Доннелл Д.Э. (апрель 2006 г.). «Гиперинфляция, одышка и непереносимость физической нагрузки при хронической обструктивной болезни легких». Труды Американского торакального общества . 3 (2): 180–4. дои : 10.1513/pats.200508-093DO . ПМИД 16565429 . S2CID 20644418 .
- ^ Купер CB (октябрь 2006 г.). «Связь между симптомами хронической обструктивной болезни легких и гиперинфляцией и ее влияние на физические упражнения и функции». Американский медицинский журнал . 119 (10 Приложение 1): 21–31. doi : 10.1016/j.amjmed.2006.08.004 . ПМИД 16996896 .
- ↑ Перейти обратно: Перейти обратно: а б с «Хроническая обструктивная болезнь легких – Пути NICE» . paths.nice.org.uk . 9 апреля 2020 г. Проверено 29 июня 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б с д Касим А., Уилт Т.Дж., Вайнбергер С.Е., Ханания Н.А., Крайнер Г., ван дер Молен Т. и др. (август 2011 г.). «Диагностика и лечение стабильной хронической обструктивной болезни легких: обновленное руководство по клинической практике Американского колледжа врачей, Американского колледжа торакальных врачей, Американского торакального общества и Европейского респираторного общества». Анналы внутренней медицины . 155 (3): 179–191. дои : 10.7326/0003-4819-155-3-201108020-00008 . ПМИД 21810710 . S2CID 18830625 .
- ↑ Перейти обратно: Перейти обратно: а б Молодой В.Б. (2010). Чертежи медицины (5-е изд.). Wolters Kluwer Health/Lippincott Williams & Wilkins. п. 69. ИСБН 978-0-7817-8870-0 .
- ↑ Перейти обратно: Перейти обратно: а б с Национальный институт здравоохранения и клинического мастерства . Клиническое руководство 101: Хроническая обструктивная болезнь легких . Лондон, июнь 2010 г.
- ^ Бейли К.Л. (июль 2012 г.). «Важность оценки функции легких при ХОБЛ» . Медицинские клиники Северной Америки . 96 (4): 745–752. дои : 10.1016/j.mcna.2012.04.011 . ПМК 3998207 . ПМИД 22793942 .
- ^ Уильямс Н. (август 2017 г.). «Шкала одышки MRC» . Оккуп Мед (Лондон) . 67 (6): 496–497. doi : 10.1093/ocmed/kqx086 . ПМИД 28898975 .
- ↑ Перейти обратно: Перейти обратно: а б «Хроническая обструктивная болезнь легких (ХОБЛ) – Критерии | Передовая практика BMJ» . bestpractice.bmj.com . Проверено 2 июля 2021 г.
- ^ «Тест оценки ХОБЛ (CAT)» . Американское торакальное общество . Архивировано из оригинала 3 декабря 2013 года . Проверено 29 ноября 2013 г.
- ^ Тьяги Дж., Мула С., Бхаумик С. (июнь 2021 г.). «Диагностическая точность инструментов скрининга хронической обструктивной болезни легких в первичной медико-санитарной помощи: быстрый синтез доказательств» . Журнал семейной медицины и первичной медицинской помощи . 10 (6): 2184–2194. дои : 10.4103/jfmpc.jfmpc_2263_20 . ПМЦ 8284240 . ПМИД 34322411 .
- ^ «Ножны для сабли трахеи | Поиск | Radiopaedia.org» . Радиопедия . Проверено 13 августа 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б Вестбо Дж., Херд С.С., Агусти А.Г. и др. (февраль 2013 г.). «Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких: краткое изложение GOLD» . Американский журнал респираторной медицины и медицины интенсивной терапии . 187 (4): 350–352. doi : 10.1164/rccm.201204-0596PP . ПМИД 22878278 .
- ^ Консорциум БТС ХОБЛ (2005 г.). «Спирометрия на практике – практическое руководство по использованию спирометрии в первичной медико-санитарной помощи» . стр. 8–9. Архивировано из оригинала 26 августа 2014 года . Проверено 25 августа 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б с Политические рекомендации по прекращению курения и лечению табачной зависимости . Всемирная организация здравоохранения. 2003. стр. 15–40. ISBN 978-92-4-156240-9 . Архивировано из оригинала 15 сентября 2008 г.
- ^ Хименес-Руис, Калифорния, Фагерстрем, нокаут (март 2013 г.). «Лечение отказа от курения для курильщиков ХОБЛ: роль консультирования» . Архивы Мональди по заболеваниям грудной клетки . 79 (1): 33–7. дои : 10.4081/monaldi.2013.107 . ПМИД 23741944 .
- ↑ Перейти обратно: Перейти обратно: а б «Хроническая обструктивная болезнь легких у лиц старше 16 лет: диагностика и лечение | Рекомендации и рекомендации | NICE» . www.nice.org.uk. 23 июня 2010 года . Проверено 5 июня 2018 г.
- ^ Кумар П., Кларк М. (2005). Клиническая медицина (6-е изд.). Эльзевир Сондерс. стр. 900–1. ISBN 978-0-7020-2763-5 .
- ↑ Перейти обратно: Перейти обратно: а б Тоннесен П. (март 2013 г.). «Отказ от курения и ХОБЛ» . Европейский респираторный обзор . 22 (127): 37–43. дои : 10.1183/09059180.00007212 . ПМЦ 9487432 . ПМИД 23457163 .
- ^ «Борьба с тягой» . nhs.uk. 27 апреля 2018 года . Проверено 15 июля 2021 г.
- ^ ван Эрд Э.А., ван дер Меер Р.М., ван Шайк О.К., Коц Д. (август 2016 г.). «Отказ от курения для людей с хронической обструктивной болезнью легких» . Кокрановская база данных систематических обзоров . 2019 (8): CD010744. дои : 10.1002/14651858.CD010744.pub2 . ПМК 6400424 . ПМИД 27545342 .
- ^ Смит Б.К., Тимби Н.Е. (2005). Основы сестринского дела: уход за взрослыми и детьми . Липпинкотт Уильямс и Уилкинс. п. 338. ИСБН 978-0-7817-5098-1 .
- ^ Ром В.Н., Марковиц С.Б., ред. (2007). Экологическая и профессиональная медицина (4-е изд.). Уолтерс Клювер/Липпинкотт Уильямс и Уилкинс. стр. 521–522. ISBN 978-0-7817-6299-1 .
- ^ «Мокрая резка» . Исполнительный директор по охране труда и технике безопасности . Архивировано из оригинала 3 декабря 2013 года . Проверено 29 ноября 2013 г.
- ^ Джордж РБ (2005). Грудная медицина: основы легочной медицины и интенсивной терапии (5-е изд.). Липпинкотт Уильямс и Уилкинс. п. 172. ИСБН 978-0-7817-5273-2 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж Вестбо Дж., Херд С.С., Агусти А.Г., Джонс П.В., Фогельмайер С., Анзуэто А. и др. (февраль 2013 г.). «Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких: краткое изложение GOLD» . Американский журнал респираторной медицины и медицины интенсивной терапии . 187 (4): 347–365. doi : 10.1164/rccm.201204-0596PP . ПМИД 22878278 .
- ^ «Хроническая обструктивная болезнь легких (ХОБЛ) – Лечение – Национальная служба здравоохранения» . 20 октября 2017 г.
- ^ CDC (18 января 2024 г.). «Информация RSV для медицинских работников» . Центры по контролю и профилактике заболеваний . Проверено 23 февраля 2024 г.
- ^ «Отчет ЗОЛОТА 2024» . Глобальная инициатива по борьбе с хронической обструктивной болезнью легких – GOLD . Проверено 23 февраля 2024 г.
- ^ Хоукрофт М., Уолтерс Э.Х., Вуд-Бейкер Р., Уолтерс Дж.А. (декабрь 2016 г.). «Планы действий с кратким обучением пациентов при обострениях хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 2016 (12): CD005074. дои : 10.1002/14651858.CD005074.pub4 . ПМК 6463844 . ПМИД 27990628 .
- ^ Ленферинк А., Брюсс-Кейзер М., ван дер Валк П.Д., Фрит П.А., Цверинк М., Моннинхоф Э.М. и др. (август 2017 г.). «Вмешательства по самоконтролю, включая планы действий при обострениях, в сравнении с обычным лечением пациентов с хронической обструктивной болезнью легких» . Кокрановская база данных систематических обзоров . 2017 (8): CD011682. дои : 10.1002/14651858.CD011682.pub2 . ПМК 6483374 . ПМИД 28777450 .
- ^ Джоллифф Д.А., Гринберг Л., Хупер Р.Л., Матиссен С., Рафик Р., де Йонг Р.Т. и др. (апрель 2019 г.). «Витамин D для предотвращения обострений ХОБЛ: систематический обзор и метаанализ данных отдельных участников рандомизированных контролируемых исследований» . Торакс . 74 (4): 337–345. doi : 10.1136/thoraxjnl-2018-212092 . ПМИД 30630893 .
- ↑ Перейти обратно: Перейти обратно: а б Волленвейдер DJ, Фрей А., Стойрер-Стей, Калифорния, Гарсия-Аймерих Дж, Пухан М.А. (октябрь 2018 г.). «Антибиотики при обострениях хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 2018 (10): CD010257. дои : 10.1002/14651858.CD010257.pub2 . ПМК 6517133 . ПМИД 30371937 .
- ^ Маккей А.Дж., Херст-младший (июль 2012 г.). «Обострения ХОБЛ: причины, профилактика и лечение». Медицинские клиники Северной Америки . 96 (4): 789–809. дои : 10.1016/j.mcna.2012.02.008 . ПМИД 22793945 .
- ^ «Фторхинолоновые антибактериальные препараты: сообщение о безопасности лекарств – FDA рекомендует ограничить использование при некоторых неосложненных инфекциях» . FDA . 12 мая 2016 г. Архивировано из оригинала 16 мая 2016 г. . Проверено 16 мая 2016 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Декрамер М., Янссенс В., Миравитлес М. (апрель 2012 г.). "Хроническая обструктивная болезнь легких" . Ланцет . 379 (9823): 1341–51. CiteSeerX 10.1.1.1000.1967 . дои : 10.1016/S0140-6736(11)60968-9 . ПМЦ 7172377 . ПМИД 22314182 .
- ^ Оливейра Е.П., Медейрос Жуниор П. (2020). «Паллиативная помощь в легочной медицине» . Бразильский журнал пульмонологии (на португальском языке). 46 (3): e20190280. дои : 10.36416/1806-3756/e20190280 . ПМЦ 7572288 . ПМИД 32638839 .
- ^ Уилсон М.Е., Доблер CC, Морроу А.С., Беушель Б., Алсавас М., Бенхадра Р. и др. (февраль 2020 г.). «Связь домашней неинвазивной вентиляции с положительным давлением с клиническими результатами при хронической обструктивной болезни легких: систематический обзор и метаанализ» . ДЖАМА . 323 (5): 455–465. дои : 10.1001/jama.2019.22343 . ПМК 7042860 . ПМИД 32016309 .
- ^ Алмадхун К., Шарма С. (2021). «Бронхолитики» . СтатПерлс . Издательство StatPearls. ПМИД 30085570 . Проверено 27 июля 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б с Gold Report 2021 , стр. 48–52, Глава 3: Фактические данные, подтверждающие профилактику и поддерживающую терапию.
- ^ Фарн Х.А., Кейтс СиДжей (октябрь 2015 г.). «Бета2-агонист длительного действия в дополнение к тиотропию по сравнению с тиотропием или только бета2-агонистом длительного действия при хронической обструктивной болезни легких» (PDF) . Кокрановская база данных систематических обзоров . 2015 (10): CD008989. дои : 10.1002/14651858.CD008989.pub3 . ПМК 4164463 . ПМИД 26490945 .
- ^ Оба Ю., Кини Э., Гатехорд Н., Диас С. и др. (Cochrane Airways Group) (декабрь 2018 г.). «Двойная комбинированная терапия против одних бронходилататоров длительного действия при хронической обструктивной болезни легких (ХОБЛ): систематический обзор и сетевой метаанализ» . Кокрановская база данных систематических обзоров . 2018 (12): CD012620. дои : 10.1002/14651858.CD012620.pub2 . ПМК 6517098 . ПМИД 30521694 .
- ↑ Перейти обратно: Перейти обратно: а б «Рекомендации | Хроническая обструктивная болезнь легких у лиц старше 16 лет: диагностика и лечение | Руководство | NICE» . www.nice.org.uk. 5 декабря 2018 года . Проверено 1 августа 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б Cave AC, Hurst MM (май 2011 г.). «Использование β2-агонистов длительного действия отдельно или в сочетании с ингаляционными кортикостероидами при хронической обструктивной болезни легких (ХОБЛ): анализ риска и пользы». Фармакология и терапия . 130 (2): 114–143. doi : 10.1016/j.pharmthera.2010.12.008 . ПМИД 21276815 .
- ^ Спенсер С., Карнер С., Кейтс СиДжей, Эванс DJ (декабрь 2011 г.). Спенсер С. (ред.). «Ингаляционные кортикостероиды в сравнении с бета(2)-агонистами длительного действия при хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 2011 (12): CD007033. дои : 10.1002/14651858.CD007033.pub3 . ПМК 6494276 . ПМИД 22161409 .
- ^ Ван Дж, Не Б, Сюн В, Сюй Ю (апрель 2012 г.). «Влияние бета-агонистов длительного действия на частоту обострений ХОБЛ: метаанализ» . Журнал клинической фармации и терапии . 37 (2): 204–211. дои : 10.1111/j.1365-2710.2011.01285.x . ПМИД 21740451 . S2CID 45383688 .
- ↑ Перейти обратно: Перейти обратно: а б Гик Дж.Б., Дабчек Э.Дж., Вуд-Бейкер Р., Кейтс СиДжей (январь 2015 г.). «Индакатерол, бета2-агонист, принимаемый один раз в день, по сравнению с бета-агонистами, принимаемыми два раза в день, или плацебо при хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 1 (3): CD010139. дои : 10.1002/14651858.CD010139.pub2 . ПМК 6464646 . ПМИД 25575340 .
- ^ Декрамер М.Л., Ханания Н.А., Лётваль Д.О., Йон Б.П. (2013). «Безопасность β2-агонистов длительного действия при лечении стабильной хронической обструктивной болезни легких» . Международный журнал хронической обструктивной болезни легких . 8 : 53–64. дои : 10.2147/COPD.S39018 . ПМЦ 3558319 . ПМИД 23378756 .
- ^ Наннини Л.Дж., Лассерсон Т.Дж., Пул П. (сентябрь 2012 г.). Наннини LJ (ред.). «Комбинация кортикостероида и бета(2)-агониста длительного действия в одном ингаляторе в сравнении с бета-агонистами длительного действия (2) при хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 9 (9): CD006829. дои : 10.1002/14651858.CD006829.pub2 . ПМК 4170910 . ПМИД 22972099 .
- ^ Фукуда Н., Хорита Н., Канеко А., Гото А., Канеко Т., Ота Э., Кью К.М. (05.06.2023). «Антагонист мускариновой кислоты длительного действия (LAMA) плюс бета-агонист длительного действия (LABA) в сравнении с LABA плюс ингаляционный кортикостероид (ICS) при стабильной хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 2023 (6): CD012066. дои : 10.1002/14651858.CD012066.pub3 . ISSN 1469-493X . ПМЦ 10241721 . ПМИД 37276335 .
- ^ Чжэн Ю, Чжу Дж, Лю Ю, Лай В, Линь С, Цю К и др. (ноябрь 2018 г.). «Тройная терапия в лечении хронической обструктивной болезни легких: систематический обзор и метаанализ» . БМЖ . 363 :к4388. дои : 10.1136/bmj.k4388 . ПМК 6218838 . ПМИД 30401700 .
- ↑ Перейти обратно: Перейти обратно: а б Карнер С., Чонг Дж., Пул П. (июль 2014 г.). «Тиотропий против плацебо при хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 2016 (7): CD009285. дои : 10.1002/14651858.CD009285.pub3 . ПМЦ 8934583 . ПМИД 25046211 .
- ^ Чейн Л., Ирвин-Селлерс М.Дж., Уайт Дж. (сентябрь 2015 г.). «Тиотропий в сравнении с ипратропием бромидом при хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 2015 (9): CD009552. дои : 10.1002/14651858.CD009552.pub3 . ПМЦ 8749963 . ПМИД 26391969 .
- ^ Сингх С., Локе Ю.К., Энрайт П., компакт-диск Фурберга (январь 2013 г.). «Проаритмические и проишемические эффекты ингаляционных антихолинергических препаратов» . Торакс . 68 (1): 114–6. doi : 10.1136/thoraxjnl-2011-201275 . ПМИД 22764216 .
- ^ Джонс П. (апрель 2013 г.). «Аклидиния бромид два раза в день для лечения хронической обструктивной болезни легких: обзор». Достижения в терапии . 30 (4): 354–68. дои : 10.1007/s12325-013-0019-2 . ПМИД 23553509 . S2CID 3530290 .
- ^ Каззола М., Пейдж CP, Матера М.Г. (июнь 2013 г.). «Аклидиния бромид для лечения хронической обструктивной болезни легких». Экспертное заключение по фармакотерапии . 14 (9): 1205–14. дои : 10.1517/14656566.2013.789021 . ПМИД 23566013 . S2CID 24973904 .
- ↑ Перейти обратно: Перейти обратно: а б Ни Х, Со З, Мо С (сентябрь 2014 г.). «Аклидиния бромид при стабильной хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 9 (9): CD010509. дои : 10.1002/14651858.CD010509.pub2 . ПМЦ 8922974 . ПМИД 25234126 .
- ^ Ни Х, Хтет А, Мо С (июнь 2017 г.). «Умеклидиния бромид по сравнению с плацебо для людей с хронической обструктивной болезнью легких (ХОБЛ)» . Кокрановская база данных систематических обзоров . 2017 (6): CD011897. дои : 10.1002/14651858.CD011897.pub2 . ПМК 6481854 . ПМИД 28631387 .
- ^ Исмаила А.С., Хьюсман Э.Л., Пунекар Ю.С., Карабис А. (2015). «Сравнительная эффективность монотерапии мускариновыми антагонистами длительного действия при ХОБЛ: систематический обзор и сетевой метаанализ» . Международный журнал хронической обструктивной болезни легких . 10 : 2495–517. дои : 10.2147/COPD.S92412 . ПМЦ 4655912 . ПМИД 26604738 .
- ↑ Перейти обратно: Перейти обратно: а б Чен Х., Сунь Дж., Хуан Ц., Лю Ю., Юань М., Ма С. и др. (2021). «Ингаляционные кортикостероиды и риск развития пневмонии у пациентов с хронической обструктивной болезнью легких: метаанализ рандомизированных контролируемых исследований» . Фронт Фармакол . 12 : 691621. дои : 10.3389/fphar.2021.691621 . ПМЦ 8275837 . ПМИД 34267661 .
- ^ Шине Т., Дюмулен Дж., Оноре И., Браун Дж.М., Кудерк Л.Дж., Февр М. и др. (декабрь 2016 г.). «[Место ингаляционных кортикостероидов при ХОБЛ]». Журнал респираторных заболеваний . 33 (10): 877–891. дои : 10.1016/j.rmr.2015.11.009 . ПМИД 26831345 .
- ^ Уолтерс Дж.А., Тан DJ, Уайт CJ, Гибсон П.Г., Вуд-Бейкер Р., Уолтерс Э.Х. (сентябрь 2014 г.). «Системные кортикостероиды при обострении хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 9 (9): CD001288. дои : 10.1002/14651858.CD001288.pub4 . ПМИД 25178099 .
- ^ Уолтерс Дж.А., Тан DJ, Уайт CJ, Вуд-Бейкер Р. (март 2018 г.). «Различная продолжительность кортикостероидной терапии при обострениях хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 2018 (3): CD006897. дои : 10.1002/14651858.CD006897.pub4 . ПМК 6494402 . ПМИД 29553157 .
- ^ ван Геффен WH, Тан DJ, Уолтерс Дж.А., Уолтерс Э.Х. (06 декабря 2023 г.). Cochrane Airways Group (ред.). «Ингаляционные кортикостероиды с комбинацией ингаляционных бета2-агонистов длительного действия и мускариновых антагонистов длительного действия при хронической обструктивной болезни легких». Кокрейновская база данных систематических обзоров . 2023 (12): CD011600. дои : 10.1002/14651858.CD011600.pub3 . PMC 10698842. PMID 38054551 .
- ^ Маммен М.Дж., Сети С. (2012). «Макролидная терапия для профилактики обострений хронической обструктивной болезни легких». Польский архив медицины Wewnetrznej . 122 (1–2): 54–9. дои : 10.20452/pamw.1134 . ПМИД 22353707 . S2CID 35183033 .
- ↑ Перейти обратно: Перейти обратно: а б Херат СК, Норманселл Р., Мэйси С., Пул П. (октябрь 2018 г.). «Профилактическая антибиотикотерапия хронической обструктивной болезни легких (ХОБЛ)» . Кокрановская база данных систематических обзоров . 2018 (10): CD009764. дои : 10.1002/14651858.CD009764.pub3 . ПМК 6517028 . ПМИД 30376188 .
- ^ Симоенс С., Лакеман Г., Декрамер М. (май 2013 г.). «Предотвращение обострений ХОБЛ с помощью макролидов: обзор и анализ влияния на бюджет» . Респираторная медицина . 107 (5): 637–48. дои : 10.1016/j.rmed.2012.12.019 . ПМИД 23352223 .
- ^ Пул П., Сатанантан К., Фортескью Р. (май 2019 г.). «Муколитики по сравнению с плацебо при хроническом бронхите или хронической обструктивной болезни легких» . Кокрановская база данных систематических обзоров . 5 (3): CD001287. дои : 10.1002/14651858.CD001287.pub6 . ПМК 6527426 . ПМИД 31107966 .
- ^ «Эрдостеин» . ХОРОШИЙ . Проверено 20 июля 2021 г.
- ^ Мелдрам О.В., Чотирмолл С.Х. (июнь 2021 г.). «Слизь, микробиомы и легочные заболевания» . Биомедицины . 9 (6): 675. doi : 10.3390/biomedicines9060675 . ПМК 8232003 . ПМИД 34199312 .
- ^ «Бронхит» . nhs.uk. 17 октября 2017 г.
- ^ Чжу А, Тэн Ю, Гэ Д, Чжан Х, Ху М, Яо Х (октябрь 2019 г.). «Роль метформина в лечении пациентов с хронической обструктивной болезнью легких: систематический обзор» . Журнал торакальных заболеваний . 11 (10): 4371–4378. дои : 10.21037/jtd.2019.09.84 . ПМК 6837976 . ПМИД 31737323 .
- ↑ Перейти обратно: Перейти обратно: а б Хор Ю.Х., Ренцони Э.А., Виска Д., Макдональд К.Ф., Го Н.С. (июль 2019 г.). «Кислородная терапия при ХОБЛ и интерстициальном заболевании легких: знакомство с известным и неизвестным» . Открытое разрешение ERJ . 5 (3). дои : 10.1183/23120541.00118-2019 . ПМК 6745413 . ПМИД 31544111 .
- ^ Экстрем М., Ахмади З., Борнефальк-Херманссон А., Абернети А., Карроу Д. (ноябрь 2016 г.). «Кислород при одышке у пациентов с хронической обструктивной болезнью легких, которым не показана домашняя кислородная терапия» . Кокрановская база данных систематических обзоров . 11 (8): CD006429. дои : 10.1002/14651858.CD006429.pub3 . ПМК 6464154 . ПМИД 27886372 .
- ^ Джиндал С.К. (2013). Хроническая обструктивная болезнь легких . Медицинский центр братьев Джейпи. п. 139. ИСБН 978-93-5090-353-7 .
- ↑ Перейти обратно: Перейти обратно: а б О'Дрисколл Б.Р., Ховард Л.С., Дэвисон А.Г. (октябрь 2008 г.). «Руководство BTS по экстренному использованию кислорода у взрослых пациентов» . Торакс . 63 (6): vi1-68. дои : 10.1136/thx.2008.102947 . ПМИД 18838559 .
- ^ «Отчет ЗОЛОТА 2024» . Глобальная инициатива по борьбе с хронической обструктивной болезнью легких – GOLD . Проверено 23 февраля 2024 г.
- ^ Венкатесан П. (январь 2024 г.). «Отчет GOLD COPD: обновленная информация за 2024 год» . Ланцет респираторной медицины . 12 (1): 15–16. дои : 10.1016/S2213-2600(23)00461-7 . ПМИД 38061380 . S2CID 265751322 .
- ^ «Легочная реабилитация» . medlineplus.gov . Проверено 9 сентября 2021 г.
- ^ Макнамара Р.Дж., Маккио З.Дж., Маккензи Д.К., Элисон Дж.А. (декабрь 2013 г.). «Водная физкультура при хронической обструктивной болезни легких». Кокрейновская база данных систематических обзоров (12): CD008290. дои : 10.1002/14651858.CD008290.pub2 . ПМИД 24353107 .
- ^ Менадуэ С., Пайпер Эй Джей, Ван 'т Хул Эй Джей, Вонг К. К. (май 2014 г.). «Неинвазивная вентиляция легких при физических нагрузках у людей с хронической обструктивной болезнью легких» . Кокрановская база данных систематических обзоров . 2014 (5): CD007714. дои : 10.1002/14651858.CD007714.pub2 . ПМЦ 10984247 . ПМИД 24823712 .
- ↑ Перейти обратно: Перейти обратно: а б МакКео З.Дж., Веллосо М., Лима В.П., Элисон Дж.А. (ноябрь 2016 г.). «Тренировка верхних конечностей при ХОБЛ» . Кокрановская база данных систематических обзоров . 2016 (11): CD011434. дои : 10.1002/14651858.CD011434.pub2 . ПМК 6464968 . ПМИД 27846347 .
- ↑ Перейти обратно: Перейти обратно: а б Нгай С.П., Джонс А.Ю., Там В.В. (июнь 2016 г.). «Тай Чи при хронической обструктивной болезни легких (ХОБЛ)» . Кокрановская база данных систематических обзоров . 2016 (6): CD009953. дои : 10.1002/14651858.CD009953.pub2 . ПМЦ 8504989 . ПМИД 27272131 .
- ^ Аммус О, Феки В, Лотфи Т, Хамис А.М., Госселинк Р., Ребай А., Каммун С. (06.01.2023). Cochrane Airways Group (ред.). «Тренировка дыхательных мышц с сопутствующей легочной реабилитацией или без нее при хронической обструктивной болезни легких (ХОБЛ)» . Кокрейновская база данных систематических обзоров . 2023 (1): CD013778. дои : 10.1002/14651858.CD013778.pub2 . ПМЦ 9817429 . ПМИД 36606682 .
- ^ Томас М.Дж., Симпсон Дж., Райли Р., Грант Э. (июнь 2010 г.). «Влияние физиотерапевтических вмешательств на дому на одышку во время повседневной деятельности при тяжелой ХОБЛ: систематический обзор». Физиотерапия . 96 (2): 108–19. дои : 10.1016/j.physio.2009.09.006 . ПМИД 20420957 .
- ↑ Перейти обратно: Перейти обратно: а б Ношение Дж., Бомонт С., Форбс Д., Браун Б., Энгель Р. (февраль 2016 г.). «Использование спинальной манипулятивной терапии в лечении хронической обструктивной болезни легких: систематический обзор» . Журнал альтернативной и дополнительной медицины . 22 (2): 108–14. дои : 10.1089/acm.2015.0199 . ПМЦ 4761829 . ПМИД 26700633 .
- ^ Симонелли С., Витакка М., Виньони М., Амброзино Н., Панерони М. (2019). «Эффективность мануальной терапии при ХОБЛ: систематический обзор рандомизированных контролируемых исследований» . Пульмонология . 25 (4): 236–247. дои : 10.1016/j.pulmoe.2018.12.008 . ПМИД 30738792 .
- ↑ Перейти обратно: Перейти обратно: а б Осадник Ч.Р., Макдональд К.Ф., Джонс А.П., Холланд А.Е. (март 2012 г.). «Методы очистки дыхательных путей при хронической обструктивной болезни легких». Кокрановская база данных систематических обзоров . 3 (3): CD008328. дои : 10.1002/14651858.CD008328.pub2 . ПМИД 22419331 .
- ^ Феррейра И.М., Брукс Д., Уайт Дж., Гольдштейн Р. (декабрь 2012 г.). Феррейра И.М. (ред.). «Пищевые добавки при стабильной хронической обструктивной болезни легких». Кокрановская база данных систематических обзоров . 12 : CD000998. дои : 10.1002/14651858.CD000998.pub3 . ПМИД 23235577 .
- ^ Ван Геффен WH, Дума WR, Слебос DJ, Керстьенс HA (29 августа 2016 г.). «Бронхолитики, вводимые с помощью небулайзера, по сравнению с ингаляторами при приступах легких при хронической обструктивной болезни легких» . Кокрейновская база данных систематических обзоров . 29 (8): 011826. doi : 10.1002/14651858.CD011826.pub2 . hdl : 11370/95fc3e6e-ebd0-440f-9721-489729f80add . ПМЦ 8487315 . ПМИД 27569680 .
- ^ Уайз Р. «Хроническая обструктивная болезнь легких (ХОБЛ)» . Легочные заболевания: Справочник MSD, профессиональная версия . Архивировано из оригинала 28 декабря 2016 года . Проверено 16 декабря 2016 г. .
- ^ Осман Л.М., Эйрес Дж.Г., Гарден С., Реглиц К., Лайон Дж., Дуглас Дж.Г. (2008). «Домашнее тепло и состояние здоровья больных ХОБЛ» . Евро. Дж. Общественное здравоохранение . 18 (4): 399–405. дои : 10.1093/eurpub/ckn015 . ПМИД 18367496 .
- ^ Му З, Чен ПЛ, Гэн ФХ, Жэнь Л, Гу ВК, Ма Цзюй, Пэн Л, Ли Цюй (2017). «Синергетическое влияние температуры и влажности на симптомы пациентов с ХОБЛ». Int J Биометеорол . 61 (11): 1919–25. Бибкод : 2017IJBm...61.1919M . дои : 10.1007/s00484-017-1379-0 . ПМИД 28567499 . S2CID 25962322 .
- ^ «Увлажнители: облегчают кожу и симптомы дыхания» . Клиника Майо.
- ^ Ноти Дж.Д., Блашер Ф.М., МакМиллен СМ, Линдсли В.Г., Кашон М.Л., Слотер Д.Р., Бизхолд Д.Х. (2013). «Высокая влажность приводит к потере инфекционного вируса гриппа из-за симулированного кашля» . ПЛОС ОДИН . 8 (2): e57485. Бибкод : 2013PLoSO...857485N . дои : 10.1371/journal.pone.0057485 . ПМЦ 3583861 . ПМИД 23460865 .
- ↑ Перейти обратно: Перейти обратно: а б Gold Report 2021 , стр. 92–96, Глава 4: Лечение стабильной ХОБЛ.
- ^ ван Геффен WH, Слебос DJ, Херт Ф.Дж., Кемп С.В., Ведер В., Шах П.Л. (апрель 2019 г.). «Хирургические и эндоскопические вмешательства, уменьшающие объем легких при эмфиземе: системный обзор и метаанализ» (PDF) . «Ланцет». Респираторная медицина . 7 (4): 313–324. дои : 10.1016/S2213-2600(18)30431-4 . ПМИД 30744937 . S2CID 73428098 .
- ↑ Перейти обратно: Перейти обратно: а б Даффи С., Маркетти Н., Крайнер Г.Дж. (сентябрь 2020 г.). «Хирургическое лечение хронической обструктивной болезни легких». Клиники грудной медицины . 41 (3): 559–566. дои : 10.1016/j.ccm.2020.06.011 . ПМИД 32800206 . S2CID 221145423 .
- ↑ Перейти обратно: Перейти обратно: а б «1 Рекомендации | Установка эндобронхиального клапана для уменьшения объема легких при эмфиземе | Руководство | NICE» . www.nice.org.uk. 20 декабря 2017 года . Проверено 7 июля 2021 г.
- ^ Клоостер К., Slebos DJ (май 2021 г.). «Эндобронхиальные клапаны для лечения запущенной эмфиземы» . Грудь . 159 (5): 1833–1842. дои : 10.1016/j.chest.2020.12.007 . ПМЦ 8129734 . ПМИД 33345947 .
- ^ Веллинг Дж.Б., Slebos DJ (август 2018 г.). «Уменьшение объема легких с помощью эндобронхиальных спиралей у больных эмфиземой» . Дж. Торак Дис . 10 (Приложение 23): S2797–S2805. дои : 10.21037/jtd.2017.12.95 . ПМК 6129816 . ПМИД 30210833 .
- ^ Валипур А (январь 2017 г.). «Бронхоскопическая термопаровая абляция: новейший метод лечения пациентов с эмфиземой!». Архив бронконеумологии . 53 (1): 1–2. дои : 10.1016/j.arbr.2016.11.009 . ПМИД 27916315 . S2CID 78181696 .
- ^ Мортенсен Дж., Берг Р.М. (январь 2019 г.). «Сцинтиграфия легких при ХОБЛ» . Семинары по ядерной медицине . 49 (1): 16–21. doi : 10.1053/j.semnuclmed.2018.10.010 . ПМИД 30545511 . S2CID 56486118 .
- ^ «Оценки ВОЗ по болезням и травмам в странах» . Всемирная организация здравоохранения . 2009. Архивировано из оригинала 11 ноября 2009 г. Проверено 11 ноября 2009 г.
- ↑ Перейти обратно: Перейти обратно: а б Мюррей С.Дж., Вос Т., Лозано Р., Нагави М., Флаксман А.Д., Мишо С. и др. (декабрь 2012 г.). «Годы жизни с поправкой на инвалидность (DALY) для 291 заболевания и травмы в 21 регионе, 1990-2010 гг.: систематический анализ для исследования глобального бремени болезней 2010 г.». Ланцет . 380 (9859): 2197–2223. дои : 10.1016/S0140-6736(12)61689-4 . ПМИД 23245608 . S2CID 205967479 .
- ^ Вос Т., Флаксман А.Д., Нагави М., Лозано Р., Мишо С., Эззати М. и др. (декабрь 2012 г.). «Количество лет жизни с инвалидностью (YLD) по 1160 последствиям 289 заболеваний и травм в 1990–2010 гг.: систематический анализ для исследования глобального бремени болезней 2010 г.» . Ланцет . 380 (9859): 2163–2196. дои : 10.1016/S0140-6736(12)61729-2 . ПМК 6350784 . ПМИД 23245607 .
- ^ Gold Report 2021 , стр. 26–33, Глава 2: Диагностика и оценка.
- ↑ Перейти обратно: Перейти обратно: а б «Распространенность ХОБЛ» . ХОРОШИЙ . Проверено 18 июля 2021 г.
- ^ Райкрофт CE, Хейес А., Ланца Л., Беккер К. (2012). «Эпидемиология хронической обструктивной болезни легких: обзор литературы» . Международный журнал хронической обструктивной болезни легких . 7 : 457–94. дои : 10.2147/COPD.S32330 . ПМЦ 3422122 . ПМИД 22927753 .
- ^ Мартинес Ф.Дж., Кертис Дж.Л., Шиурба Ф., Мамфорд Дж., Джардино Н.Д., Вайнманн Дж., Казеруни Е., Мюррей С., Крайнер Г.Дж., Син Д.Д., Хогг Дж., Райс А.Л., Хан М., Фишман А.П., Маке Б, Хоффман Э.А., Мохсенифар З. , Wise R (апрель 2007 г.). «Половые различия при тяжелой эмфиземе легких» . Американский журнал респираторной медицины и медицины интенсивной терапии . 176 (3): 243–252. дои : 10.1164/rccm.200606-828OC . ЧВК 1994221 . ПМИД 17431226 .
- ^ «Основы ХОБЛ» . Хроническая обструктивная болезнь легких (ХОБЛ) . Центры по контролю и профилактике заболеваний США. 9 июня 2021 г. Проверено 18 июля 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б Торио CM, Эндрюс RM (2006). «Расходы на национальные стационарные больницы: самые дорогие условия по плательщикам, 2011 г.: Статистическая справка № 160» . Статистические сводки проекта затрат и использования здравоохранения (HCUP) . ПМИД 24199255 . Архивировано из оригинала 14 марта 2017 г.
- ^ «10 главных причин смерти» . Информационные бюллетени . Всемирная организация здравоохранения.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Петти ТЛ (2006). «История ХОБЛ» . Международный журнал хронической обструктивной болезни легких . 1 (1): 3–14. дои : 10.2147/copd.2006.1.1.3 . ПМК 2706597 . ПМИД 18046898 .
- ↑ Перейти обратно: Перейти обратно: а б Райт Дж.Л., Черг А. (2008). «Патологические особенности хронической обструктивной болезни легких: диагностические критерии и дифференциальный диагноз» (PDF) . В Фишман А, Элиас Дж, Фишман Дж, Гриппи М, Старший Р, Пакет А (ред.). Легочные заболевания и расстройства Фишмана (4-е изд.). МакГроу-Хилл. стр. 693–705. ISBN 978-0-07-164109-8 . Архивировано из оригинала (PDF) 3 марта 2016 г. Проверено 11 ноября 2008 г.
- ^ Вулкок А (1984). «В поисках слов для описания плохих воздуходувок». Грудь . 85 (6): 73С–74С. doi : 10.1378/chest.85.6_Supplement.73S .
- ^ Уолдботт Г.Л. (1965). Борьба с Титанами . Карлтон Пресс. п. 6.
- ^ Фишман А.П. (май 2005 г.). «Сто лет хронической обструктивной болезни легких». Американский журнал респираторной медицины и медицины интенсивной терапии . 171 (9): 941–8. doi : 10.1164/rccm.200412-1685OE . ПМИД 15849329 .
- ^ «Ноябрь — Национальный месяц осведомленности о ХОБЛ | NHLBI, NIH» . www.nhlbi.nih.gov . Проверено 21 июля 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б Ломборг Б (2013). Глобальные проблемы, локальные решения: затраты и выгоды . Издательство Кембриджского университета. п. 143. ИСБН 978-1-107-03959-9 .
- ^ Блум Д. (2011). Глобальное экономическое бремя неинфекционных заболеваний (PDF) . Всемирный экономический форум. п. 24. Архивировано (PDF) из оригинала 4 февраля 2015 г.
- ^ «Исследование Национального института здравоохранения показывает, что гиалуронан эффективен при лечении хронических заболеваний легких» . Национальные институты здравоохранения (NIH) . 1 февраля 2021 г. Проверено 7 августа 2021 г.
- ^ Погги С, Мантовани С, Пекораро Ю, Карилло С, Басси М, Д'Андрилли А, Аниле М, Рендина Э.А., Венута Ф, Дисо Д (ноябрь 2018 г.). «Бронхоскопическое лечение эмфиземы: обновленная информация» . Дж. Торак Дис . 10 (11): 6274–6284. дои : 10.21037/jtd.2018.10.43 . ПМК 6297441 . ПМИД 30622803 .
- ^ «Проспективное исследование безопасности и технико-экономического обоснования дозированной криотерапии с помощью системы RejuvenAir™ для пациентов с хроническим бронхитом» . www.clinicaltrials.gov. 25 января 2021 г. Проверено 16 августа 2021 г.
- ^ Чен Ю.Т., Мяо К., Чжоу Л., Сюн В.Н. (июнь 2021 г.). «Терапия стволовыми клетками при хронической обструктивной болезни легких» . Чин Мед Джей (Англия) . 134 (13): 1535–1545. дои : 10.1097/CM9.0000000000001596 . ПМК 8280064 . ПМИД 34250959 .
- ^ «Первые британские пациенты получают новаторское новое лечение серьезных заболеваний легких | Больницы Royal Brompton & Harefield» . www.rbht.nhs.uk. Проверено 4 августа 2021 г.
- ^ Гётше ПК, Йохансен ХК (сентябрь 2016 г.). «Внутривенная терапия, усиливающая альфа-1-антитрипсин, для лечения пациентов с дефицитом альфа-1-антитрипсина и заболеваниями легких» . Кокрановская база данных систематических обзоров . 2016 (9): CD007851. дои : 10.1002/14651858.CD007851.pub3 . ПМЦ 6457738 . ПМИД 27644166 .
- ^ Кампос М.А., Джерати П., Холт Г., Мендес Э., Ньюби П.Р., Ма С. и др. (август 2019 г.). «Биологические эффекты двойной дозы альфа-1-антитрипсина. Пилотное клиническое исследование» . Американский журнал респираторной медицины и медицины интенсивной терапии . 200 (3): 318–326. doi : 10.1164/rccm.201901-0010OC . ПМК 6680306 . ПМИД 30965011 .
- ^ Намбиар С., Бонг Хау С., Гаммер Дж., Тренгов Р., Мудли Ю. (февраль 2020 г.). «Метаболомика при хронических заболеваниях легких» . Респирология . 25 (2): 139–148. дои : 10.1111/соответственно 13530 . ПМИД 30907495 .
- ^ Маклин С., Нурматов У., Лю Дж.Л., Пальяри С., Кар Дж., Шейх А. (июль 2011 г.). «Телемедицинская помощь при хронической обструктивной болезни легких» (PDF) . Кокрановская база данных систематических обзоров . 2012 (7): CD007718. дои : 10.1002/14651858.CD007718.pub2 . ПМЦ 8939044 . ПМИД 21735417 .
- ^ Ченг Дж., Эроглу А. (июнь 2021 г.). «Многообещающее воздействие астаксантина на заболевания легких» . Адв Нутр . 12 (3): 850–864. дои : 10.1093/advances/nmaa143 . ПМЦ 8166543 . ПМИД 33179051 .
- ^ Грус И, МакКрири ГМ, Ивлев И, Хулихан М.Э., Яун Б.П., Паскуале С. и др. (декабрь 2021 г.). «Разработка программы исследований хронической обструктивной болезни легких (ХОБЛ) с участием пациентов в США» . Журнал результатов, сообщаемых пациентами . 5 (1): 126. дои : 10.1186/s41687-021-00399-7 . ПМЦ 8643383 . ПМИД 34865193 .
- ^ Акерс Р.М., Денбоу Д.М. (2008). Анатомия и физиология домашних животных . Уайли. п. 852. ИСБН 978-1-118-70115-7 .
- ^ Чург А., Райт Дж.Л. (2007). «Животные модели хронической обструктивной болезни легких, вызванной сигаретным дымом». Модели обострений астмы и ХОБЛ . Вклад в микробиологию. Том. 14. С. 113–25. дои : 10.1159/000107058 . ISBN 978-3-8055-8332-9 . ПМИД 17684336 .
- ^ «Рецидивирующая обструкция дыхательных путей у лошадей – дыхательная система» . Ветеринарный справочник . Проверено 7 июля 2021 г.
- ^ Миллер М.С., Тилли Л.П., Смит Ф.В. (январь 1989 г.). «Сердечно-легочные заболевания у пожилых собак и кошек». Ветеринарные клиники Северной Америки. Практика с мелкими животными . 19 (1): 87–102. дои : 10.1016/S0195-5616(89)50007-X . ПМИД 2646821 .
Цитируемые работы [ править ]
- Глобальная стратегия профилактики, диагностики и лечения ХОБЛ: отчет 2021 г. (PDF) . Глобальная инициатива по хронической обструктивной болезни легких. 25 ноября 2020 г. Проверено 28 июня 2021 г.
Внешние ссылки [ править ]
- Информационный бюллетень ВОЗ по ХОБЛ
- Хроническая обструктивная болезнь легких в Керли
- «ХОБЛ» . МедлайнПлюс . Национальная медицинская библиотека США.