Эластин
| ЭЛН | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ELN , SVAS, WBS, WS, эластин, ADCL1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 130160 ; МГИ : 95317 ; GeneCards : ELN ; ОМА : ЭЛН – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||

Эластин — это белок , кодируемый ELN геном у человека. компонентом внеклеточного матрикса челюстноротых Эластин является ключевым (челюстных позвоночных). [5] Он очень эластичен и присутствует в соединительной ткани тела, восстанавливая свою форму после растяжения или сжатия. [6] Эластин помогает коже вернуться в исходное положение, когда ее надавливали или зажимали. Эластин также содержится в важных несущих тканях позвоночных животных и используется в местах, где требуется накопление механической энергии. [7]
Функция
[ редактировать ]Ген ELN кодирует белок, который является одним из двух компонентов эластичных волокон . Кодируемый белок богат гидрофобными аминокислотами, такими как глицин и пролин , которые образуют мобильные гидрофобные области, связанные поперечными связями между лизина . остатками [8] Для этого гена обнаружено множество вариантов транскрипта, кодирующих разные изоформы. [8] Растворимый предшественник эластина – тропоэластин. [9] Характеристика беспорядка согласуется с энтропийным механизмом упругой отдачи. Сделан вывод, что конформационный беспорядок является конститутивным признаком структуры и функции эластина. [10]
Клиническое значение
[ редактировать ]Делеции и мутации в этом гене связаны с надклапанным стенозом аорты (SVAS) и аутосомно-доминантным заболеванием кожи . [8] Другие сопутствующие дефекты эластина включают синдром Марфана , эмфизему, вызванную дефицитом α 1 -антитрипсина , атеросклероз , синдром Бушке-Оллендорфа , синдром Менкеса , эластическую псевдоксантому и синдром Вильямса . [11]
Эластоз
[ редактировать ]Эластоз — это накопление эластина в тканях и форма дегенеративного заболевания . [12] Существует множество причин, но наиболее распространенной причиной является актинический эластоз кожи, также известный как солнечный эластоз , который вызывается длительным и чрезмерным пребыванием на солнце, процесс, известный как фотостарение . Нечастые причины эластоза кожи включают перфорирующий серпигинозный эластоз , перфорирующий кальцинирующий эластоз и линейный очаговый эластоз . [12]
| Состояние | Отличительные особенности | Гистопатология |
|---|---|---|
| Актинический эластоз (наиболее распространенный, также называемый солнечным эластозом) | Эластин заменяет коллагеновые волокна сосочковой и ретикулярной дермы. |  |
| Перфорирующий серпигинозный эластоз | Дегенерированные эластические волокна и трансэпидермальные перфорантные каналы (стрелка на изображении указывает на один из них) [13] | 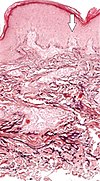 |
| Перфорирующий кальцифицирующий эластоз | Слипание коротких эластических волокон в дерме. [13] |  |
| Линейный очаговый эластоз | Накопление фрагментированного эластотического материала в сосочковой дерме и чрескожное удаление эластотических волокон. [13] |  |
Состав
[ редактировать ]
В организме эластин обычно связан с другими белками соединительных тканей. Эластические волокна в организме представляют собой смесь аморфного эластина и волокнистого фибриллина . Оба компонента в основном состоят из более мелких аминокислот, таких как глицин , валин , аланин и пролин . [11] [14] Общий эластин составляет от 58 до 75% веса сухой обезжиренной артерии в нормальных артериях собак. [15] Сравнение свежих и переваренных тканей показывает, что при 35% деформации минимум 48% артериальной нагрузки переносится эластином, а минимум 43% изменения жесткости артериальной ткани обусловлено изменением жесткости эластина. . [16]
Распределение тканей
[ редактировать ]Эластин выполняет важную функцию в артериях в качестве среды распространения волн давления, помогая кровотоку , и его особенно много в крупных эластичных кровеносных сосудах, таких как аорта . Эластин также очень важен для легких , эластичных связок , эластичных хрящей , кожи и мочевого пузыря . Он присутствует у челюстных позвоночных . [17]
Характеристики
[ редактировать ]Эластин — очень долгоживущий белок, период полураспада которого у человека составляет более 78 лет. [18]
Клинические исследования
[ редактировать ]Была изучена возможность использования рекомбинантного человеческого тропоэластина для производства эластиновых волокон для улучшения эластичности кожи при ранах и рубцах. [19] [20] После подкожных инъекций рекомбинантного человеческого тропоэластина в свежие раны не было обнаружено улучшения рубцевания или гибкости возможных рубцов. [19] [20]
Биосинтез
[ редактировать ]Предшественники тропоэластина
[ редактировать ]Эластин производится путем соединения множества небольших растворимых предшественника тропоэластина молекул белка- (50-70 кДа ) с образованием конечного массивного, нерастворимого и прочного комплекса. Несвязанные молекулы тропоэластина обычно недоступны в клетке, поскольку они сшиваются в волокна эластина сразу после их синтеза клеткой и экспортируются во внеклеточный матрикс . [21]
Каждый тропоэластин состоит из цепочки из 36 небольших доменов , каждый из которых весит около 2 кДа в конформации случайного клубка . Белок состоит из чередующихся гидрофобных и гидрофильных доменов, которые кодируются отдельными экзонами , так что доменная структура тропоэластина отражает экзонную организацию гена. Гидрофильные домены содержат мотивы Lys-Ala (KA) и Lys-Pro (KP), которые участвуют в сшивании во время образования зрелого эластина. В доменах KA остатки лизина встречаются в виде пар или триплетов, разделенных двумя или тремя остатками аланина (например, AAAKAAKAA), тогда как в доменах KP остатки лизина разделены в основном остатками пролина (например, KPLKP).
Агрегация
[ редактировать ]Тропоэластин агрегирует при физиологической температуре за счет взаимодействия между гидрофобными доменами в процессе, называемом коацервацией . Этот процесс обратим , термодинамически контролируем и не требует расщепления белка . Коацерват становится нерастворимым за счет необратимой сшивки.
сшивание
[ редактировать ]Чтобы образовать зрелые волокна эластина, молекулы тропоэластина сшиваются через остатки лизина с десмозин и изодесмозин молекулами, сшивающими . Ферментом, который осуществляет сшивку, является лизилоксидаза , использующая in vivo реакцию синтеза пиридина Чичибабина . [22]
Молекулярная биология
[ редактировать ]
У млекопитающих геном содержит только один ген тропоэластина, называемый ELN . человека Ген ELN представляет собой сегмент длиной 45 т.п.н. на хромосоме 7 и имеет 34 экзона, прерываемых почти 700 интронами, причем первый экзон представляет собой сигнальный пептид, определяющий его внеклеточную локализацию. Большое количество интронов позволяет предположить, что генетическая рекомбинация может способствовать нестабильности гена, что приводит к таким заболеваниям, как СВАС . Экспрессия мРНК тропоэластина строго регулируется по меньшей мере в восьми различных сайтах начала транскрипции .
Тканеспецифичные варианты эластина производятся путем альтернативного сплайсинга гена тропоэластина. Существует по меньшей мере 11 известных изоформ тропоэластина человека. эти изоформы находятся под регуляцией развития, однако между тканями на одной и той же стадии развития существуют минимальные различия. [11]
См. также
[ редактировать ]- Дряблая кожа
- Эластичные волокна
- Рецептор эластина
- Резилин : белок беспозвоночных.
- синдром Вильямса
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000049540 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000029675 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Митьё С.М., Вайс А.С. (2005). «Эластин». Достижения в области химии белков . 70 : 437–461. дои : 10.1016/S0065-3233(05)70013-9 . ISBN 9780120342709 . ПМИД 15837523 .
- ^ Виндин Х., Митье С.М., Вайс А.С. (ноябрь 2019 г.). «Эластиновая архитектура». Матричная биология . 84 : 4–16. дои : 10.1016/j.matbio.2019.07.005 . ПМИД 31301399 . S2CID 196458819 .
- ^ Карран М.Э., Аткинсон Д.Л., Юарт А.К., Моррис К.А., Лепперт М.Ф., Китинг М.Т. (апрель 1993 г.). «Ген эластина разрушается в результате транслокации, связанной с надклапанным стенозом аорты». Клетка . 73 (1): 159–168. дои : 10.1016/0092-8674(93)90168-П . ПМИД 8096434 . S2CID 8274849 .
- ^ Перейти обратно: а б с «Энтрез Ген: эластин» .
- ^ «Эластин (ЭЛН)» . Архивировано из оригинала 13 марта 2017 года . Проверено 31 октября 2011 г.
- ^ Муизниекс Л.Д., Вайс А.С., Кили Ф.В. (апрель 2010 г.). «Структурное нарушение и динамика эластина». Биохимия и клеточная биология . 88 (2): 239–250. дои : 10.1139/o09-161 . ПМИД 20453927 .
- ^ Перейти обратно: а б с Врховский Б., Вайс А.С. (ноябрь 1998 г.). «Биохимия тропоэластина» . Европейский журнал биохимии . 258 (1): 1–18. дои : 10.1046/j.1432-1327.1998.2580001.x . ПМИД 9851686 .
- ^ Перейти обратно: а б Райт Б. «Эластоз» . ДермНет Новая Зеландия .
- ^ Перейти обратно: а б с Хосен М.Дж., Ламоен А., Де Паепе А., Ванаккер О.М. (2012). «Гистопатология эластической псевдоксантомы и связанных с ней нарушений: гистологические признаки и диагностические признаки» . Научка . 2012 : 598262. doi : 10.6064/2012/598262 . ПМЦ 3820553 . ПМИД 24278718 .
- Creative Commons Attribution 3.0 Непортированная лицензия - ^ Килти CM, Шерратт MJ, Шаттлворт, Калифорния (июль 2002 г.). «Эластичные волокна» . Журнал клеточной науки . 115 (Часть 14): 2817–2828. дои : 10.1242/jcs.115.14.2817 . ПМИД 12082143 .
- ^ Фишер ГМ, Ллаурадо Дж.Г. (август 1966 г.). «Содержание коллагена и эластина в артериях собак, выбранных из функционально разных сосудистых руслов» . Исследование кровообращения . 19 (2): 394–399. дои : 10.1161/01.res.19.2.394 . ПМИД 5914851 .
- ^ Ламмерс С.Р., Као П.Х., Ци Х.Дж., Хантер К., Лэннинг С., Альбиец Дж. и др. (октябрь 2008 г.). «Изменения структурно-функциональных взаимоотношений эластина и его влияние на механику проксимальных легочных артерий гипертонических телят» . Американский журнал физиологии. Физиология сердца и кровообращения . 295 (4): H1451–H1459. дои : 10.1152/ajpheart.00127.2008 . ПМЦ 2593497 . ПМИД 18660454 .
- ^ Сейдж Э.Х., Грей В.Р. (1977). «Эволюция структуры эластина». Эластин и эластичная ткань . Достижения экспериментальной медицины и биологии. Том. 79. стр. 291–312. дои : 10.1007/978-1-4684-9093-0_27 . ISBN 978-1-4684-9095-4 . ПМИД 868643 .
- ^ Тояма Б.Х., Хетцер М.В. (январь 2013 г.). «Белковый гомеостаз: живи долго, не процветай» . Обзоры природы. Молекулярно-клеточная биология . 14 (1): 55–61. дои : 10.1038/nrm3496 . ПМК 3570024 . ПМИД 23258296 .
- ^ Перейти обратно: а б Соуто Э.Б., Рибейро А.Ф., Феррейра М.И., Тейшейра М.К., Симоджо А.А., Сориано Дж.Л. и др. (январь 2020 г.). «Новые нанотехнологии для лечения и восстановления ожогов кожи» . Международный журнал молекулярных наук . 21 (2): 393. doi : 10.3390/ijms21020393 . ПМК 7013843 . ПМИД 31936277 .
- ^ Перейти обратно: а б Се Х., Лучези Л., Чжэн Б., Ладич Э., Пинеда Т., Мертен Р. и др. (1 сентября 2017 г.). «Лечение ожогов и хирургических ран рекомбинантным тропоэластином человека приводит к образованию новых волокон эластина в рубцах». Журнал ухода за ожогами и исследований . 38 (5): е859–е867. дои : 10.1097/BCR.0000000000000507 . ПМИД 28221299 . S2CID 39251937 .
- ^ Валенсуэла К.Д., Вагнер В.Л., Беннетт Р.Д., Исаси А.Б., Белль Дж.М., Молтер К. и др. (сентябрь 2017 г.). «Внеклеточная сборка элемента эластиновой кабельной линии в развивающемся легком» . Анатомическая запись . 300 (9): 1670–1679. дои : 10.1002/ar.23603 . ПМК 6315300 . ПМИД 28380679 .
- ^ Умеда Х., Такеучи М., Суяма К. (апрель 2001 г.). «Две новые сшивки эластина, имеющие пиридиновый скелет. Влияние аммиака на сшивку эластина in vivo» . Журнал биологической химии . 276 (16): 12579–12587. дои : 10.1074/jbc.M009744200 . ПМИД 11278561 .
Дальнейшее чтение
[ редактировать ]- Ян С.Л., Чан С.К., Фу Ю.К., Лин С.Дж. (июнь 2009 г.). «Исследование гена эластина у детей с изолированной врожденной аневризмой артериального протока». Акта Кардиологика . 64 (3): 363–369. дои : 10.2143/ac.64.3.2038023 . ПМИД 19593948 . S2CID 31411296 .
- Кили Ф.В., Беллингем СМ, Вудхаус К.А. (февраль 2002 г.). «Эластин как самоорганизующийся биоматериал: использование рекомбинантно экспрессируемых полипептидов эластина человека в качестве модели для исследования структуры и самосборки эластина» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 357 (1418): 185–189. дои : 10.1098/rstb.2001.1027 . ПМК 1692930 . ПМИД 11911775 .
- Чоудри Р., Макговерн А., Ридли С., Кейн С.А., Болдуин А., Ван М.К. и др. (сентябрь 2009 г.). «Дифференциальная регуляция образования эластических волокон фибулином-4 и -5» . Журнал биологической химии . 284 (36): 24553–24567. дои : 10.1074/jbc.M109.019364 . ПМК 2782046 . ПМИД 19570982 .
- Хубмахер Д., Цирулис Дж.Т., Миао М., Кили Ф.В., Рейнхардт Д.П. (январь 2010 г.). «Функциональные последствия гомоцистеинилирования белков эластических волокон фибриллина-1 и тропоэластина» . Журнал биологической химии . 285 (2): 1188–1198. дои : 10.1074/jbc.M109.021246 . ПМК 2801247 . ПМИД 19889633 .
- Кулен Н.А., Схоутен К.К., Мидделькооп Э., Ульрих М.М. (январь 2010 г.). «Сравнение кожи плода человека и кожи взрослого человека» . Архив дерматологических исследований . 302 (1): 47–55. дои : 10.1007/s00403-009-0989-8 . ПМЦ 2799629 . ПМИД 19701759 .
- Макгичи М., Рамони Р.Л., Михалецкий Дж.К., Фьюри К.Л., Дрейфусс Дж.М., Лю Ю. и др. (декабрь 2009 г.). «Интегративная прогностическая модель кальцификации коронарных артерий при атеросклерозе» . Тираж . 120 (24): 2448–2454. doi : 10.1161/CIRCULATIONAHA.109.865501 . ПМК 2810344 . ПМИД 19948975 .
- Ёсида Т., Като К., Ёкой К., Огури М., Ватанабэ С., Метоки Н. и др. (август 2009 г.). «Ассоциация генетических вариантов с хронической болезнью почек у лиц с различным липидным профилем» . Международный журнал молекулярной медицины . 24 (2): 233–246. дои : 10.3892/ijmm_00000226 . ПМИД 19578796 .
- Акима Т., Наканиси К., Сузуки К., Катаяма М., Осузу Ф., Каваи Т. (ноябрь 2009 г.). «Растворимый эластин снижается по мере формирования атеромы аорты человека» . Тиражный журнал . 73 (11): 2154–2162. doi : 10.1253/circj.cj-09-0104 . ПМИД 19755752 .
- Чен Ц, Чжан Т, Рошецкий Дж. Ф., Оуян З., Эссерс Дж., Фань С. и др. (сентябрь 2009 г.). «Фибулин-4 регулирует экспрессию гена тропоэластина и последующее образование эластичных волокон фибробластами человека» . Биохимический журнал . 423 (1): 79–89. дои : 10.1042/BJ20090993 . ПМК 3024593 . ПМИД 19627254 .
- Тинтар Д., Самуйлан В., Дандуран Дж., Лакабанн С., Пепе А., Бокиккио Б., Тамбурро А.М. (ноябрь 2009 г.). «Последовательность тропоэластина человека: динамика полипептида, кодируемого экзоном 6, в растворе» (PDF) . Биополимеры . 91 (11): 943–952. дои : 10.1002/bip.21282 . ПМИД 19603496 .
- Дикстерхейс Л.Б., Вайс А.С. (июнь 2010 г.). «Модели гомологии доменов 21-23 тропоэластина человека проливают свет на сшивку лизина». Связь с биохимическими и биофизическими исследованиями . 396 (4): 870–873. дои : 10.1016/j.bbrc.2010.05.013 . ПМИД 20457133 .
- Ромеро Р., Велес Эдвардс Д.Р., Кусанович Дж.П., Хасан С.С., Мазаки-Тови С., Вайсбух Э. и др. (май 2010 г.). «Идентификация однонуклеотидных полиморфизмов плода и матери в генах-кандидатах, которые предрасполагают к спонтанным преждевременным родам при интактных плодных оболочках» . Американский журнал акушерства и гинекологии . 202 (5): 431.e1–431.34. дои : 10.1016/j.ajog.2010.03.026 . ПМЦ 3604889 . ПМИД 20452482 .
- Фан Б.Дж., Фигиередо Сена Д.Р., Паскуале Л.Р., Гросскройц К.Л., Ри Дж., Чен Т.С. и др. (сентябрь 2010 г.). «Отсутствие связи полиморфизмов эластина с псевдоэксфолиативным синдромом и глаукомой» . Журнал глаукомы . 19 (7): 432–436. дои : 10.1097/IJG.0b013e3181c4b0fe . ПМК 6748032 . ПМИД 20051886 .
- Бертрам С., Хасс Р. (октябрь 2009 г.). «Клеточное старение эпителиальных клеток молочной железы человека (HMEC) связано с измененной передачей сигналов MMP-7 / HB-EGF и повышенным образованием эластин-подобных структур». Механизмы старения и развития . 130 (10): 657–669. дои : 10.1016/j.mad.2009.08.001 . ПМИД 19682489 . S2CID 46477586 .
- Робертс К.Э., Кавут С.М., Кроука М.Дж., Браун Р.С., Троттер Дж.Ф., Шах В. и др. (июль 2010 г.). «Генетические факторы риска гепатопульмонального синдрома у пациентов с прогрессирующим заболеванием печени» . Гастроэнтерология . 139 (1): 130–9.e24. дои : 10.1053/j.gastro.2010.03.044 . ПМЦ 2908261 . ПМИД 20346360 .
- Розенблум Дж. (декабрь 1984 г.). «Эластин: связь структуры белка и генов с болезнями». Лабораторные исследования; Журнал технических методов и патологии . 51 (6): 605–623. ПМИД 6150137 .
- Бакс Д.В., Роджерс УР, Билек М.М., Вайс А.С. (октябрь 2009 г.). «Адгезия клеток к тропоэластину опосредуется через С-концевой мотив GRKRK и интегрин альфаVbeta3» . Журнал биологической химии . 284 (42): 28616–28623. дои : 10.1074/jbc.M109.017525 . ПМК 2781405 . ПМИД 19617625 .
- Родригес-Ревенга Л., Иранзо П., Баденас К., Пуч С., Каррио А., Мила М. (сентябрь 2004 г.). «Новая мутация гена эластина, приводящая к аутосомно-доминантной форме лакса кожи». Архив дерматологии . 140 (9): 1135–1139. дои : 10.1001/archderm.140.9.1135 . ПМИД 15381555 .
- Микале Л., Туртуро М.Г., Фуско С., Ауджелло Б., Хурадо Л.А., Иззи С. и др. (март 2010 г.). «Идентификация и характеристика семи новых мутаций гена эластина в когорте пациентов, страдающих надклапанным аортальным стенозом» . Европейский журнал генетики человека . 18 (3): 317–323. дои : 10.1038/ejhg.2009.181 . ПМК 2987220 . ПМИД 19844261 .
- Цафлиду М (2004). «Роль коллагена и эластина в возрастной коже: подход к обработке изображений». Микрон . 35 (3): 173–177. дои : 10.1016/j.micron.2003.11.003 . ПМИД 15036271 .
Внешние ссылки
[ редактировать ]- Эластин Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Гистологическое изображение: 21402loa - Система обучения гистологии в Бостонском университете.
- Запись GeneReviews/NIH/NCBI/UW о синдроме Вильямса или Вильямса-Бойрена
- Эластиновый белок
- Микрофибрилла
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .



