Витронектин
| ВТН | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ВТН , В75, ВН, ВНТ, витронектин | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 193190 ; МГИ : 98940 ; Гомологен : 532 ; GeneCards : ВТН ; ОМА : ВТН - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Витронектин ( VTN или VN ) представляет собой гликопротеин семейства гемопексинов , который синтезируется и выводится печенью и в большом количестве обнаруживается в сыворотке, внеклеточном матриксе и костях . [ 5 ] У человека он кодируется VTN геном . [ 6 ] [ 7 ]
Витронектин связывается с интегрином альфа-V бета-3 и, таким образом, способствует клеток адгезии и распространению . Он также ингибирует повреждающее мембрану действие терминального цитолитического пути комплемента и связывается с несколькими серпинами (ингибиторами сериновых протеаз). Это секретируемый белок, который существует либо в одноцепочечной форме, либо в обрезанной двухцепочечной форме, удерживаемой вместе дисульфидной связью. [ 6 ] Предполагается, что витронектин участвует в гемостазе. [ 8 ] и опухолей злокачественность . [ 9 ] [ 10 ]
Структура
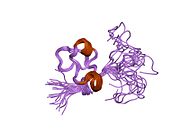
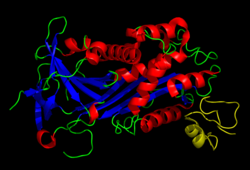
[ редактировать ]Витронектин представляет собой гликопротеин массой 54 кДа, состоящий из 478 аминокислотных остатков . белка Около одной трети молекулярной массы составляют углеводы . Иногда белок расщепляется после аргинина 379 с образованием двухцепочечного витронектина, где две части связаны дисульфидной связью . Ни одна структура высокого разрешения пока не определена экспериментально. за исключением N-концевого домена.
Белок состоит из трёх доменов :
- N -концевой домен соматомедина B (1-39)
- Центральные домены с гомологией гемопексина (131-342)
- С -концевой домен (остатки 347-459) также гомологичен гемопексину.
Сообщалось о нескольких структурах домена соматомедина B. Первоначально белок был кристаллизован в комплексе с одним из его физиологических партнеров по связыванию: ингибитором активатора плазминогена-1 (PAI-1), и была решена структура этого комплекса. [ 11 ] Впоследствии две группы сообщили о ЯМР-структурах домена. [ 12 ] [ 13 ]
Домен соматомедина В представляет собой плотный дисульфидный узел с 4 дисульфидными связями в пределах 35 остатков. Для этого домена сообщалось о различных конфигурациях дисульфида. [ 14 ] [ 15 ] [ 16 ] но эта двусмысленность разрешилась кристаллической структурой. [ 16 ]
Модели гомологии построены для центрального и С-концевого доменов. [ 16 ]
Функция
[ редактировать ]Соматомедин B-домен витронектина связывается с ингибитором активатора плазминогена-1 (PAI-1) и стабилизирует его. [ 11 ] Таким образом, витронектин регулирует протеолиз, инициируемый активацией плазминогена . Кроме того, витронектин входит в состав тромбоцитов и, таким образом, участвует в гемостазе. Витронектин содержит последовательность RGD (45-47), которая является сайтом связывания мембраносвязанных интегринов , например, рецептора витронектина , которые служат для закрепления клеток во внеклеточном матриксе. Домен соматомедина B взаимодействует с рецептором урокиназы , и это взаимодействие участвует в миграции клеток и передаче сигнала. Было показано, что высокие уровни PAI-1 и рецептора урокиназы в плазме коррелируют с негативным прогнозом для больных раком. Адгезия и миграция клеток напрямую участвуют в метастазировании рака , что дает вероятное механистическое объяснение этому наблюдению.
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Ensembl, выпуск 89: ENSG00000109072 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000017344 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Борон, Уолтер Ф. и Булпап, Эмиль Л. «Медицинская физиология». Сондерс, 2012, стр.1097.
- ^ Jump up to: а б «Энтрез Ген: М Витронектин» .
- ^ Дженн Д., Стэнли К.К. (октябрь 1987 г.). «Нуклеотидная последовательность и организация гена S-белка человека: повторяющиеся пептидные мотивы в семействе пексинов и модель их эволюции». Биохимия . 26 (21): 6735–42. дои : 10.1021/bi00395a024 . ПМИД 2447940 .
- ^ Прейсснер К.Т., Зайфферт Д. (январь 1998 г.). «Роль витронектина и его рецепторов в гемостазе и ремоделировании сосудов». Исследование тромбоза . 89 (1): 1–21. дои : 10.1016/S0049-3848(97)00298-3 . ПМИД 9610756 .
- ^ Фелдинг-Хаберманн Б., Череш Д.А. (октябрь 1993 г.). «Витронектин и его рецепторы». Современное мнение в области клеточной биологии . 5 (5): 864–8. дои : 10.1016/0955-0674(93)90036-П . ПМИД 7694604 .
- ^ Херт, Элейн М.; Чан, король; Серрат, Мария Ана Духагон; Томас, Сунита Б.; Винстра, Тимоти Д.; Фаррар, Уильям Л. (2009). «Идентификация витронектина как внешнего индуктора дифференцировки раковых стволовых клеток и образования опухолей» . Стволовые клетки . 28 (3): 390–8. дои : 10.1002/stem.271 . ПМЦ 3448441 . ПМИД 19998373 .
- ^ Jump up to: а б Чжоу А., Хантингтон Дж.А., Панну Н.С., Каррелл Р.В., Рид Р.Дж. (июль 2003 г.). «Как витронектин связывает PAI-1, модулируя фибринолиз и миграцию клеток». Структурная биология природы . 10 (7): 541–4. дои : 10.1038/nsb943 . ПМИД 12808446 . S2CID 26086796 .
- ^ Камикубо Ю., Де Гузман Р., Кроон Г., Карриден С., Нилс Дж.Г., Черчилль М.Дж., Доусон П., Олдзей С., Ягельска А., Шерага Х.А., Лоскутофф DJ, Дайсон Х.Дж. (июнь 2004 г.). «Механизмы дисульфидных связей в активных формах домена соматомедина B витронектина человека». Биохимия . 43 (21): 6519–34. дои : 10.1021/bi049647c . ПМИД 15157085 .
- ^ Маясундари А., Уиттемор Н.А., Серперсу Э.Х., Петерсон CB (июль 2004 г.). «Структура раствора N-концевого домена витронектина человека: проксимальные участки, регулирующие фибринолиз и миграцию клеток» . Журнал биологической химии . 279 (28): 29359–66. дои : 10.1074/jbc.M401279200 . ПМИД 15123712 .
- ^ Камикубо Ю., Окумура Ю., Лоскутофф DJ (июль 2002 г.). «Идентификация дисульфидных связей в рекомбинантном домене соматомедина В человеческого витронектина» . Журнал биологической химии . 277 (30): 27109–19. дои : 10.1074/jbc.M200354200 . ПМИД 12019263 .
- ^ Хорн Н.А., Херст ГБ, Маясундари А., Уиттемор Н.А., Серперсу Э.Х., Петерсон CB (август 2004 г.). «Назначение четырех дисульфидов в N-концевом домене соматомедина B нативного витронектина, выделенного из плазмы человека» . Журнал биологической химии . 279 (34): 35867–78. дои : 10.1074/jbc.M405716200 . ПМИД 15173163 .
- ^ Jump up to: а б с Сюй Д., Бабурадж К., Петерсон CB, Сюй Ю (август 2001 г.). «Модель трехмерной структуры витронектина: предсказания многодоменного белка на основе резьбы и стыковки». Белки . 44 (3): 312–20. дои : 10.1002/прот.1096 . ПМИД 11455604 . S2CID 24765480 .
Дальнейшее чтение
[ редактировать ]- Сингх Б., Су Ю.К., Рисбек К. (2010). «Витронектин в бактериальном патогенезе: белок-хозяин, используемый для ускользания комплемента и клеточной инвазии» . Мол. Микробиол . 78 (3): 545–60. дои : 10.1111/j.1365-2958.2010.07373.x . ПМИД 20807208 . S2CID 24516528 .
- Сингх Б., Джалалванд Ф., Мергелин М., Зипфель П., Блом А.М., Рисбек К. (2011). «Белок E Haemophilus influenzae распознает С-концевой домен витронектина и модулирует мембраноатакующий комплекс» . Мол. Микробиол . 81 (1): 80–98. дои : 10.1111/j.1365-2958.2011.07678.x . ПМИД 21542857 . S2CID 26484037 .
- Су Ю.К., Джалалванд Ф., Мергелин М., Блом А.М., Сингх Б., Рисбек К. (2013). «Haemophilus influenzae приобретает витронектин через вездесущий белок F, чтобы подорвать врожденный иммунитет хозяина» . Мол. Микробиол . 87 (6): 1245–66. дои : 10.1111/mmi.12164 . ПМИД 23387957 . S2CID 26923730 .
Внешние ссылки
[ редактировать ]- Витронектин Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)