Проколлаген-пролиндиоксигеназа
| Проколлаген-пролиндиоксигеназа | |||
|---|---|---|---|
 Альфа-субъединицы проколлаген-пролиндиоксигеназы. На изображении показана область связывания субстрата (оранжевый) и канавка связывания остатков тирозина (желтый). | |||
| Идентификаторы | |||
| Номер ЕС. | 1.14.11.2 | ||
| Номер CAS. | 9028-06-2 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Проколлаген-пролиндиоксигеназа , широко известная как пролилгидроксилаза , является членом класса ферментов, известных как альфа-кетоглутарат-зависимые гидроксилазы . Эти ферменты катализируют включение кислорода в органические субстраты посредством механизма, для которого требуется альфа-кетоглутаровая кислота , Fe. 2+ и аскорбат . [ 1 ] [ 2 ] Этот конкретный фермент катализирует образование (2S , 4R ) -4-гидроксипролина , соединения, которое представляет собой наиболее распространенную посттрансляционную модификацию человека в протеоме . [ 3 ]
Ферментативный механизм
[ редактировать ]Проколлаген-пролиндиоксигеназа катализирует следующую реакцию:
L-пролин + альфа-кетоглутаровая кислота + O 2 → (2 S , 4 R )-4-гидроксипролин + сукцинат + CO 2
Механизм реакции аналогичен механизму реакции других диоксигеназ и протекает в две отдельные стадии: [ 3 ] высокореактивная разновидность Fe(IV)=O В первом случае образуется . Молекулярный кислород связан торцом в осевом положении, образуя дикислородное звено. Нуклеофильная атака на C2 приводит к образованию тетраэдрического промежуточного соединения с потерей двойной связи в дикислородном звене и связью с железом и альфа-углеродом 2-оксоглутарата. Последующее удаление CO 2 совпадает с образованием частиц Fe(IV)=O. Второй этап включает отрыв атома водорода про - R от С-4 пролинового субстрата с последующим радикальным объединением, в результате которого образуется гидроксипролин. [ 4 ]
Вследствие механизма реакции одна молекула 2-оксоглутарата декарбоксилируется с образованием сукцината. Этот сукцинат гидролизуется и заменяется другим 2-оксоглутаратом после каждой реакции, и был сделан вывод, что в присутствии 2-оксоглутарата Fe, связанный с ферментом, 2+ быстро превращается в Fe 3+ , что приводит к инактивации фермента. [ 5 ] Аскорбат используется в качестве кофактора для снижения содержания железа. 3+ обратно в Фе 2+ . [ 6 ]
Структура фермента
[ редактировать ]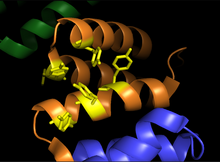
Пролилгидроксилаза представляет собой тетрамер с двумя уникальными субъединицами. [ 7 ] α-субъединица имеет массу 59 кДа и отвечает как за связывание пептидов, так и за каталитическую активность. [ 8 ] Пептидсвязывающий домен охватывает остатки 140–215 α-субъединицы. [ 9 ] и состоит из вогнутой поверхности, покрытой множеством остатков тирозина , которые благоприятно взаимодействуют с богатым пролином субстратом. Активный центр состоит из Fe 2+ связан с двумя остатками гистидина и одним остатком аспартата , что характерно для большинства 2-оксоглутарат-зависимых диоксигеназ. β-субъединица массой 55 кДа отвечает за локализацию и удержание фермента в эндоплазматическом ретикулуме . [ 10 ] Эта субъединица идентична ферменту, известному как протеиндисульфидизомераза . [ 11 ]
Биологическая функция
[ редактировать ]Пролилгидроксилаза катализирует образование гидроксипролина. Модификация оказывает существенное влияние на стабильность коллагена — основной соединительной ткани человеческого организма. [ 12 ] В частности, гидроксилирование увеличивает температуру плавления (Tm ) спирального коллагена на 16 °C по сравнению с негидроксилированным коллагеном. [ 13 ] разница, которая позволяет белку оставаться стабильным при температуре тела. Из-за обилия коллагена (около одной трети общего белка) у людей и высокой распространенности этой модификации в коллагене, гидроксипролин является количественно наиболее распространенной посттрансляционной модификацией у людей. [ 14 ]
Фермент действует специфически на пролин, содержащийся в мотиве X-Pro-Gly, где Pro — это пролин. Из-за такого поведения, специфичного для мотива, фермент также действует на другие белки, содержащие ту же последовательность. К таким белкам относятся C1q , [ 15 ] эластины , [ 16 ] ПрП , [ 17 ] Аргонавт 2 , [ 18 ] и конотоксины , [ 19 ] среди других.
Актуальность заболевания
[ редактировать ]Поскольку для функционирования пролилгидроксилазы в качестве кофактора требуется аскорбат, [ 5 ] его отсутствие ставит под угрозу активность фермента. В результате снижение гидроксилирования приводит к заболеванию, известному как цинга . Поскольку у пациентов с цингой стабильность коллагена нарушается, симптомы включают ослабление кровеносных сосудов, вызывающее пурпуру , петехии и кровотечение десен.
Фактор, индуцируемый гипоксией (HIF), является эволюционно консервативным фактором транскрипции. [ 20 ] Это позволяет клетке физиологически реагировать на уменьшение количества кислорода. [ 21 ] Идентифицирован класс пролилгидроксилаз, специфически действующих на HIF; [ 22 ] гидроксилирование HIF позволяет белку подвергаться деградации. [ 22 ] На HIF-пролилгидроксилазу воздействуют различные ингибиторы , предназначенные для лечения инсульта . [ 23 ] болезнь почек, [ 24 ] ишемия , [ 25 ] анемия , [ 26 ] и другие важные заболевания.
Альтернативные названия
[ редактировать ]- Протоколлаген гидроксилаза
- Пролилгидроксилаза
- Пролил-4-гидроксилаза
- Протоколлаген пролилгидроксилаза
Ссылки
[ редактировать ]- ^ Смит Т.Г., Талбот Н.П. (апрель 2010 г.). «Пролилгидроксилазы и терапия». Антиоксиданты и окислительно-восстановительная сигнализация . 12 (4): 431–3. дои : 10.1089/ars.2009.2901 . ПМИД 19761407 .
- ^ Хаттон Дж. Дж., Траппель А. Л., Уденфренд С. (июль 1966 г.). «Потребности коллаген-пролингидроксилазы в альфа-кетоглутарате, ионах железа и аскорбате». Связь с биохимическими и биофизическими исследованиями . 24 (2): 179–84. дои : 10.1016/0006-291x(66)90716-9 . ПМИД 5965224 .
- ^ Jump up to: а б Горрес К.Л., Рейнс РТ (апрель 2010 г.). «Пролил-4-гидроксилаза» . Критические обзоры по биохимии и молекулярной биологии . 45 (2): 106–24. дои : 10.3109/10409231003627991 . ПМЦ 2841224 . ПМИД 20199358 .
- ^ Фудзита Ю., Готлиб А., Петеркофски Б., Уденфренд С., Виткоп Б. (1964). «Получение цис- и транс-4-H3-L-пролинов и их использование в изучении механизма ферментативного гидроксилирования в куриных эмбрионах». Журнал Американского химического общества . 86 (21): 4709–4716. дои : 10.1021/ja01075a036 .
- ^ Jump up to: а б де Йонг Л., Альбрахт С.П., Кемп А. (июнь 1982 г.). «Активность пролил-4-гидроксилазы в зависимости от степени окисления фермент-связанного железа. Роль аскорбата в гидроксилировании пептидилпролина». Биохимика и биофизика Acta . 704 (2): 326–32. дои : 10.1016/0167-4838(82)90162-5 . ПМИД 6285984 .
- ^ Де Йонг Л., Кемп А. (май 1984 г.). «Стехеометрия и кинетика частичной реакции пролил-4-гидроксилазы». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 787 (1): 105–11. дои : 10.1016/0167-4838(84)90113-4 . ПМИД 6326839 .
- ^ Берг Р.А., Prockop DJ (февраль 1973 г.). «Аффинная колоночная очистка протоколлагенпролингидроксилазы из куриных эмбрионов и дальнейшая характеристика фермента» . Журнал биологической химии . 248 (4): 1175–82. дои : 10.1016/S0021-9258(19)44278-6 . ПМИД 4346946 .
- ^ Хелаакоски Т., Вуори К., Мюллиля Р., Кивирикко К.И., Пихлаяниеми Т. (июнь 1989 г.). «Молекулярное клонирование альфа-субъединицы пролил-4-гидроксилазы человека: полная аминокислотная последовательность, полученная из кДНК, и доказательства альтернативного сплайсинга транскриптов РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 86 (12): 4392–6. Бибкод : 1989PNAS...86.4392H . дои : 10.1073/pnas.86.12.4392 . ПМК 287275 . ПМИД 2543975 .
- ^ Пеккала М., Хиета Р., Бергманн У., Кивирикко К.И., Веренга Р.К., Мюллихарью Дж. (декабрь 2004 г.). «Пептид-субстрат-связывающий домен коллаген-пролил-4-гидроксилазы представляет собой тетратрикопептидный повторяющийся домен с функциональными ароматическими остатками» . Журнал биологической химии . 279 (50): 52255–61. дои : 10.1074/jbc.M410007200 . ПМИД 15456751 .
- ^ Вуори К., Пихлааниеми Т., Мюллюля Р., Кивирикко К.И. (ноябрь 1992 г.). «Сайт-направленный мутагенез протеиндисульфидизомеразы человека: влияние на сборку, активность и удержание в эндоплазматическом ретикулуме пролил-4-гидроксилазы человека в клетках насекомых Spodoptera frugiperda» . Журнал ЭМБО . 11 (11): 4213–7. дои : 10.1002/j.1460-2075.1992.tb05515.x . ПМК 556932 . ПМИД 1327760 .
- ^ Пихлаяниеми Т., Хелаакоски Т., Тасанен К., Мюллюля Р., Хухтала М.Л., Койву Дж., Кивирикко К.И. (март 1987 г.). «Молекулярное клонирование бета-субъединицы пролил-4-гидроксилазы человека. Эта субъединица и протеиндисульфидизомераза являются продуктами одного и того же гена» . Журнал ЭМБО . 6 (3): 643–9. дои : 10.1002/j.1460-2075.1987.tb04803.x . ПМЦ 553446 . ПМИД 3034602 .
- ^ Шоулдерс, доктор медицинских наук, Рейнс РТ (2009). «Структура и стабильность коллагена» . Ежегодный обзор биохимии . 78 : 929–58. doi : 10.1146/annurev.biochem.77.032207.120833 . ПМЦ 2846778 . ПМИД 19344236 .
- ^ Берг Р.А., Prockop DJ (май 1973 г.). «Термический переход негидроксилированной формы коллагена. Доказательства роли гидроксипролина в стабилизации тройной спирали коллагена». Связь с биохимическими и биофизическими исследованиями . 52 (1): 115–20. дои : 10.1016/0006-291x(73)90961-3 . ПМИД 4712181 .
- ^ Горрес, Келли Л.; Рейнс, Рональд Т. (апрель 2010 г.). «Пролил-4-гидроксилаза» . Критические обзоры по биохимии и молекулярной биологии . 45 (2): 106–124. дои : 10.3109/10409231003627991 . ПМЦ 2841224 . ПМИД 20199358 .
- ^ Мюллер В., Ханауске-Абель Х., Лоос М. (октябрь 1978 г.). «Биосинтез первого компонента комплемента перитонеальными макрофагами человека и морской свинки: доказательства независимого производства субъединиц C1» . Журнал иммунологии . 121 (4): 1578–84. doi : 10.4049/jimmunol.121.4.1578 . ПМИД 701808 . S2CID 36397927 .
- ^ Розенблум Дж., Цивински А. (июнь 1976 г.). «Ингибирование гидроксилирования пролина не подавляет секрецию тропоэластина клетками аорты цыпленка». Письма ФЭБС . 65 (2): 246–50. дои : 10.1016/0014-5793(76)80490-5 . ПМИД 6335 . S2CID 34210226 .
- ^ Гилл А.С., Ричи М.А., Хант Л.Г., Стейн С.Е., Дэвис К.Г., Бокинг С.П., Ри А.Г., Беннетт А.Д., Хоуп Дж. (октябрь 2000 г.). «Посттрансляционное гидроксилирование на N-конце прионного белка обнаруживает наличие структуры PPII in vivo» . Журнал ЭМБО . 19 (20): 5324–31. дои : 10.1093/emboj/19.20.5324 . ПМК 314005 . ПМИД 11032800 .
- ^ Ци Х.Х., Онгусаха П.П., Мюллихарью Дж., Ченг Д., Пакканен О., Ши Ю., Ли С.В., Пэн Дж., Ши Ю. (сентябрь 2008 г.). «Пролил-4-гидроксилирование регулирует стабильность Argonaute 2» . Природа . 455 (7211): 421–4. Бибкод : 2008Natur.455..421Q . дои : 10.1038/nature07186 . ПМК 2661850 . ПМИД 18690212 .
- ^ Дейли Н.Л., Крейк DJ (февраль 2009 г.). «Структурные исследования конотоксинов» . ИУБМБ Жизнь . 61 (2): 144–50. дои : 10.1002/iub.158 . ПМИД 19165896 . S2CID 8678009 .
- ^ Бэкон Н.К., Ваппнер П., О'Рурк Дж.Ф., Бартлетт С.М., Шайло Б., Пью К.В., Рэтклифф П.Дж. (август 1998 г.). «Регуляция белка bHLH-PAS дрозофилы Sima под действием гипоксии: функциональные доказательства гомологии с HIF-1 альфа млекопитающих». Связь с биохимическими и биофизическими исследованиями . 249 (3): 811–6. дои : 10.1006/bbrc.1998.9234 . ПМИД 9731218 .
- ^ Смит Т.Г., Роббинс П.А., Рэтклифф П.Дж. (май 2008 г.). «Человеческая сторона фактора, индуцируемого гипоксией» . Британский журнал гематологии . 141 (3): 325–34. дои : 10.1111/j.1365-2141.2008.07029.x . ПМК 2408651 . ПМИД 18410568 .
- ^ Jump up to: а б Бруик Р.К., Макнайт С.Л. (ноябрь 2001 г.). «Консервативное семейство пролил-4-гидроксилаз, модифицирующих HIF». Наука . 294 (5545): 1337–40. Бибкод : 2001Sci...294.1337B . дои : 10.1126/science.1066373 . ПМИД 11598268 . S2CID 9695199 .
- ^ Каруппагундер СС, Ратан Р.Р. (июль 2012 г.). «Ингибирование фактора пролилгидроксилазы, индуцируемого гипоксией: новая надежная мишень или еще один большой провал в лечении инсульта?» . Журнал церебрального кровотока и метаболизма . 32 (7): 1347–61. дои : 10.1038/jcbfm.2012.28 . ПМК 3390817 . ПМИД 22415525 .
- ^ Варнеке С., Грите В., Вайдеманн А., Юргенсен Дж.С., Уиллам С., Бахманн С., Иващенко Ю., Вагнер И., Фрей Ю., Визенер М., Эккардт К.Ю. (июнь 2003 г.). «Активация факторного пути, индуцируемого гипоксией, и стимуляция ангиогенеза путем применения ингибиторов пролилгидроксилазы» . Журнал ФАСЭБ . 17 (9): 1186–8. дои : 10.1096/fj.02-1062fje . ПМИД 12709400 . S2CID 45194703 .
- ^ Сельвараджу В., Паринанди Н.Л., Адлури Р.С., Голдман Дж.В., Хуссейн Н., Санчес Х.А., Маулик Н. (июнь 2014 г.). «Молекулярные механизмы действия и терапевтическое применение фармакологических ингибиторов HIF-пролил-4-гидроксилазы для лечения ишемических заболеваний» . Антиоксиданты и окислительно-восстановительная сигнализация . 20 (16): 2631–65. дои : 10.1089/ars.2013.5186 . ПМК 4026215 . ПМИД 23992027 .
- ^ Мучник Э., Каплан Дж. (май 2011 г.). «Ингибиторы пролилгидроксилазы HIF при анемии». Экспертное мнение об исследуемых препаратах . 20 (5): 645–56. дои : 10.1517/13543784.2011.566861 . ПМИД 21406036 . S2CID 21973130 .
Внешние ссылки
[ редактировать ]- Проколлаген-пролин + диоксигеназа в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Домен Fe(2+)-2-оксоглутаратдиоксигеназы в PROSITE