Тирозинаминотрансфераза
| Тирозинтрансаминаза | |||
|---|---|---|---|
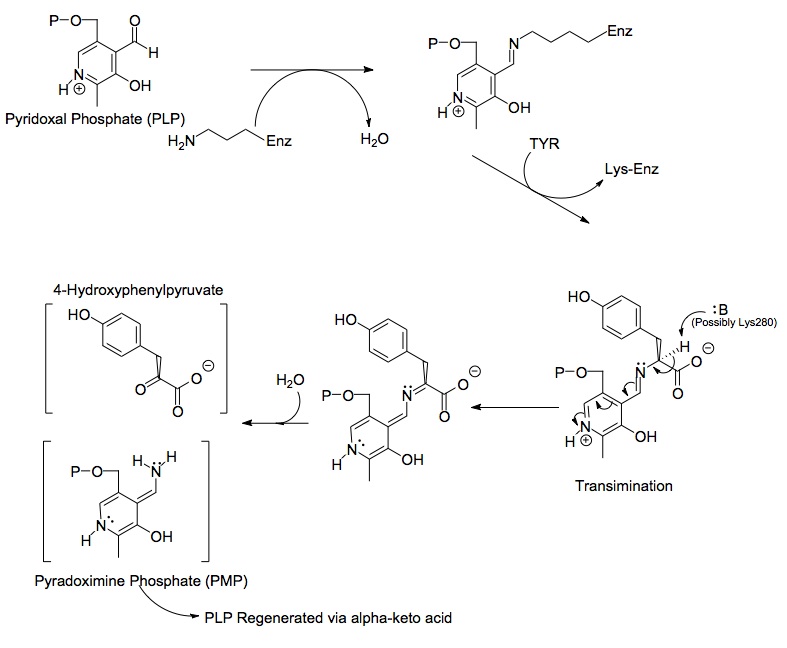
 Тирозинаминотрансфераза человека (радужного цвета, N-конец = синий, С-конец = красный) в комплексе с пиридоксальфосфатом ( модель заполнения пространства ). [1] | |||
| Идентификаторы | |||
| Номер ЕС. | 2.6.1.5 | ||
| Номер CAS. | 9014-55-5 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| ТАТ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ТАТ , Тат, тирозинаминотрансфераза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 613018 ; МГИ : 98487 ; Гомологен : 37293 ; Генные карты : ТАТ ; ОМА : ТАТ – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер ЕС | 2.6.1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Тирозинаминотрансфераза (или тирозинтрансаминаза ) представляет собой фермент, присутствующий в печени и катализирующий превращение тирозина в 4-гидроксифенилпируват . [6]

У человека белок тирозинаминотрансфераза кодируется ТАТ геном . [7] Дефицит фермента у людей может привести к так называемой тирозинемии типа II , при которой тирозин присутствует в избытке в результате того, что тирозин не подвергается реакции аминотрансферазы с образованием 4-гидроксифенилпирувата. [8]
Механизм
[ редактировать ]Ниже показаны структуры трех основных молекул, участвующих в химической реакции, катализируемой ферментом тирозинаминотрансферазой: аминокислота тирозин (слева), простетическая группа пиридоксальфосфат (справа) и образующийся продукт 4-гидроксифенилпируват (в центре).
Каждая сторона димерного белка включает пиридоксальфосфат (PLP), связанный с остатком Lys280 молекулы тирозинаминотрансферазы. Аминная группа тирозина атакует альфа-углерод имина, связанного с Lys280, образуя тетраэдрический комплекс и затем запуская LYS-ENZ. Этот процесс известен как трансиминация, поскольку происходит выключение иминной группы, связанной с PLP. Вновь образованная молекула PLP-TYR затем подвергается атаке основания.
Возможным кандидатом на роль основания в этом механизме может быть Lys280, который только что отодвинулся от PLP, который изолирует вновь образованную аминогруппу молекулы PLP-TYR. В аналогичном механизме аспартаттрансаминазы лизин, который образует первоначальный имин для PLP, позже действует как основание, атакующее тирозин при трансиминации. Электроны, оставшиеся после потери протона, движутся вниз, образуя новую двойную связь с имином, который, в свою очередь, выталкивает уже связанные с двойной связью электроны через PLP и в конечном итоге оказывается неподеленной парой на положительно заряженном азоте в шестичленном соединении. кольцо молекулы. Вода атакует альфа-углерод имина PLP-TYR и посредством ацильного замещения отщепляет азот PLP и образует фосфат пиридоксамина (PMP) и 4-гидроксифенилпируват.
Затем PMP регенерируется в PLP путем переноса его аминной группы на альфа-кетоглутарат, преобразуя его альдегидную функциональную группу. За этим следует еще одна реакция замещения с остатком Lys280 для восстановления его иминной связи с ферментом, образуя ENZ-PLP.
Активный сайт
[ редактировать ]
Тирозинаминотрансфераза в виде димера имеет два одинаковых активных центра. Lys280 присоединен к PLP, который удерживается на месте посредством двух неполярных боковых цепей аминокислот; фенилаланин и изолейцин (см. миниатюру справа). PLP также удерживается за счет водородных связей с окружающими молекулами, главным образом, за счет фосфатной группы.
Ниже показан один активный сайт при трех разных увеличениях: 
Патология
[ редактировать ]Тирозинемия — наиболее распространенное метаболическое заболевание, связанное с тирозинаминотрансферазой. Заболевание возникает в результате дефицита печеночной тирозинаминотрансферазы. [10] Тирозинемия II типа (синдром Рихнера-Ханхарта, RHS) — заболевание аутосомно-рецессивного наследования, характеризующееся кератитом, ладонно-подошвенным гиперкератозом, умственной отсталостью и повышенным уровнем тирозина в крови. [10] Кератит у пациентов с тирозинемией II типа вызван отложением кристаллов тирозина в роговице и приводит к воспалению роговицы. [11] Ген ТАТ расположен на хромосоме человека 16q22-24 и имеет длину более 10,9 тыс. оснований (т.п.н.) и содержит 12 экзонов, а его мРНК размером 3,0 т.п.н. кодирует белок из 454 аминокислот массой 50,4 кДа. [12] Сообщалось о двенадцати различных мутациях гена ТАТ. [12]
Ссылки
[ редактировать ]- ^ Jump up to: а б PDB : 3DYD ; Карлберг Т., Моче М., Андерссон Дж. и др. (2008). «Человеческая тирозинаминотрансфераза». Банк данных по белкам . дои : 10.2210/pdb3dyd/pdb .
- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000198650 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000001670 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Дитрих Дж. Б. (апрель 1992 г.). «Тирозинаминотрансфераза: трансаминаза среди других?». Клеточная и молекулярная биология . 38 (2): 95–114. ПМИД 1349265 .
- ^ Зеа-Рей А.В., Крус-Камино Х., Васкес-Канту Д.Л., Гутьеррес-Гарсия В.М., Сантос-Гусман Х., Канту-Рейна К. (27 ноября 2017 г.). «Заболеваемость транзиторной неонатальной тирозинемией среди населения Мексики» . Журнал врожденных ошибок метаболизма и скрининга . 5 : 232640981774423. doi : 10.1177/2326409817744230 .
- ^ Реттенмайер Р., Натт Э., Зентграф Х., Шерер Г. (июль 1990 г.). «Выделение и характеристика гена тирозинаминотрансферазы человека» . Нуклеиновые кислоты Рез . 18 (13): 3853–61. дои : 10.1093/нар/18.13.3853 . ПМК 331086 . ПМИД 1973834 .
- ^ Петтерсен, Э.Ф., Годдард, Т.Д., Хуанг, К.С., Коуч, Г.С., Гринблатт, Д.М., Мэн, Э.К., Феррин, Т.Э. (2004). «UCSF Chimera - система визуализации для поисковых исследований и анализа». Журнал вычислительной химии . 25 (13): 1605–1612. CiteSeerX 10.1.1.456.9442 . дои : 10.1002/jcc.20084 . ПМИД 15264254 . S2CID 8747218 .
- ^ Jump up to: а б Натт Э., Кида К., Одиевр М., Ди Рокко М., Шерер Г. (октябрь 1992 г.). «Точечные мутации в гене тирозинаминотрансферазы при тирозинемии II типа» . Учеб. Натл. акад. наук. США . 89 (19): 9297–301. Бибкод : 1992PNAS...89.9297N . дои : 10.1073/pnas.89.19.9297 . ПМК 50113 . ПМИД 1357662 .
- ^ аль-Хемидан А.И., аль-Хаззаа С.А. (март 1995 г.). «Синдром Рихнера-Ханхарта (тирозинемия II типа). Отчет о случае и обзор литературы». Офтальмологический Генет . 16 (1): 21–6. дои : 10.3109/13816819509057850 . ПМИД 7648039 .
- ^ Jump up to: а б Минами-Хори М., Исида-Ямамото А., Като Н., Такахаси Х., Иидзука Х. (январь 2006 г.). «Синдром Рихнера-Ханхарта: сообщение о случае новой мутации тирозинаминотрансферазы». Дж. Дерматол. Наука . 41 (1): 82–4. дои : 10.1016/j.jdermsci.2005.10.007 . ПМИД 16318910 .
Изображения молекулярной графики были созданы с использованием пакета UCSF Chimera из Ресурса биокомпьютеров, визуализации и информатики Калифорнийского университета в Сан-Франциско (при поддержке NIH P41 RR-01081).
Внешние ссылки
[ редактировать ]- Тирозин + аминотрансфераза Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для тирозинаминотрансферазы человека.