Цистатионин-гамма-лиаза
| цистатионин-γ-лиаза | |||
|---|---|---|---|
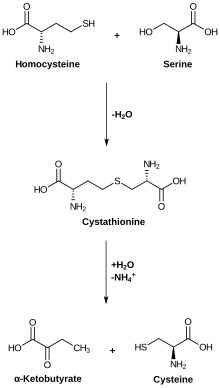 Метаболизм цистеина. Цистатионаза катализирует низшую реакцию. | |||
| Идентификаторы | |||
| Номер ЕС. | 4.4.1.1 | ||
| Номер CAS. | 9012-96-8 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| цистатионаза (цистатионин-γ-лиаза) | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Символ | КТХ | ||
| ген NCBI | 1491 | ||
| HGNC | 2501 | ||
| МОЙ БОГ | 607657 | ||
| RefSeq | НМ_001902 | ||
| ЮниПрот | P32929 | ||
| Другие данные | |||
| Номер ЕС | 4.4.1.1 | ||
| Локус | Хр. 1 п31.1 | ||
| |||
Фермент цистатионин-γ-лиаза (EC 4.4.1.1, CTH или CSE ; также цистатионаза ; систематическое название L -цистатионинцистеин-лиаза (дезаминирующая; 2-оксобутаноатобразующая) ) расщепляет цистатионин на цистеин , 2-оксобутаноат ( α-кетобутират). ), и аммиак :
- L -цистатионин + H 2 O = L -цистеин + 2-оксобутаноат + NH 3 (общая реакция)
- (1a) L -цистатионин = L -цистеин + 2-аминобут-2-еноат
- (1b) 2-аминобут-2-еноат = 2-иминобутаноат (спонтанный)
- (1в) 2-иминобутаноат + H 2 O = 2-оксобутаноат + NH 3 (спонтанное)
Пиридоксальфосфат является простетической группой этого фермента. [1] [2] [3]
Цистатионин-γ-лиаза также катализирует следующие реакции элиминации:
- L - гомосерин с образованием H 2 O, NH 3 и 2-оксобутаноата.
- L — цистин , продуцирующий тиоцистеин, пируват и NH 3 [4]
- L - цистеин , продуцирующий пируват, NH 3 и H 2 S
У некоторых бактерий и млекопитающих , в том числе у человека, этот фермент принимает участие в образовании сероводорода . [2] [5] Сероводород — один из немногих газов, роль которого в передаче сигналов клетками в организме недавно была обнаружена. [6]
Ферментативный механизм
[ редактировать ]Цистатионаза использует пиридоксальфосфат для облегчения расщепления связи сера-гамма-углерод цистатионина, что приводит к высвобождению цистеина. [3] Остаток лизина преобразует внутренний альдимин, выделяя α-иминомасляную кислоту. После этого внешний кетимин гидролизуется, вызывая образование α-кетобутирата. [7]
Аминогруппа цистатионина депротонируется и подвергается нуклеофильной атаке внутреннего альдимина. Дополнительное депротонирование общим основанием приводит к образованию внешнего альдимина и удалению остатка лизина. Основной остаток лизина затем способен депротонировать альфа-углерод, перемещая электронную плотность в азот пиридинового кольца . [3] Пиридоксальфосфат необходим для стабилизации этого карбанионного промежуточного соединения; протона в противном случае pKa была бы слишком высокой. [7] Затем бета-углерод депротонируется, создавая альфа-бета-ненасыщенность и оттесняя неподеленную пару на альдиминовый азот. Чтобы преобразовать альдимин, эта неподеленная пара опускается вниз, разрывая связь сера-гамма-углерод, что приводит к высвобождению цистеина. [3]
пиридоксаминовое производное винилглиоксилата гамма-излучения остается После отщепления . Неподеленная пара пиридинового азота передает электронную плотность гамма-углероду, который протонируется лизином. Затем лизин атакует внешний альдимин, перемещая электронную плотность к бета-углероду, который протонируется обычной кислотой. Затем имин гидролизуется с выделением α-кетобутирата. Депротонирование остатка лизина приводит к уходу аммиака, тем самым завершая каталитический цикл . [7]
Цистатионин-гамма-лиаза также проявляет гамма-синтазную активность в зависимости от концентрации присутствующих реагентов. [8] Механизмы одинаковы, пока они не расходятся после образования производного винилглиоксилата. В механизме гамма-синтазы гамма-углерод подвергается атаке сернистого нуклеофила, что приводит к образованию новой связи сера-гамма-углерод. [7] [8]

Структура фермента
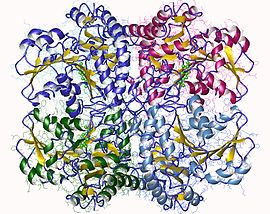
[ редактировать ]Цистатионин-γ-лиаза является членом семейства PLP-зависимых ферментов метаболизма Cys/Met. Другие члены включают цистатионин-γ-синтазу, цистатионин-β-лиазу и метионин-γ-лиазу. [8] Он также является членом более широкого семейства аспартатаминотрансфераз . [1] [8] Как и многие другие PLP-зависимые ферменты, цистатионин-γ-лиаза представляет собой тетрамер с симметрией D2 . [8]
Пиридоксальфосфат связывается в активном центре с помощью Lys. 212 . [2]
Актуальность заболевания
[ редактировать ]
Цистеин является , ограничивающим скорость субстратом синтеза глутатиона в глазах. Глутатион — антиоксидант , который защищает кристаллины глаза от активных форм кислорода; денатурированные кристаллины могут привести к катаракте . Цистатионаза также является мишенью для активных форм кислорода. Таким образом, по мере окисления цистатионазы ее активность снижается, вызывая снижение содержания цистеина и, в свою очередь, глутатиона в глазах, что приводит к снижению доступности антиоксидантов, вызывая дальнейшее снижение активности цистатионазы. Было также показано, что дефицит активности цистатионазы способствует истощению запасов глутатиона у пациентов с раком и СПИДом . [9]
Мутации и дефицит цистатионазы связаны с цистатионинурией . Мутации T67I и Q240E ослабляют сродство фермента к пиридоксальфосфату, кофактору, жизненно важному для ферментативной функции. [2] Низкие уровни H 2 S также были связаны с гипертонией у мышей. [10]
Избыточный уровень H 2 S вследствие повышения активности цистатионазы связан с эндотоксемией , острым панкреатитом , геморрагическим шоком и сахарным диабетом . [2]
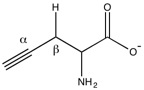
Пропаргилглицин и β-цианоаланин являются двумя необратимыми ингибиторами цистатионазы, используемыми для лечения повышенных уровней H 2 S. Механически аминогруппа пропаргилглицина атакует альдимин с образованием внешнего альдимина. Затем β-положение алкина депротонируется с образованием аллена , который затем подвергается атаке фенола Тира. 114 . Внутренний альдимин может регенерировать, но вновь созданный виниловый эфир стерически препятствует активному центру, не позволяя цистеину атаковать пиридоксальфосфат. [2]
Регулирование
[ редактировать ]H 2 S снижает транскрипцию цистатионазы в концентрациях от 10 до 80 мкм. Однако транскрипция усиливается при концентрациях около 120 мкМ и полностью ингибируется при концентрациях, превышающих 160 мкМ. [6]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Берг Дж. М., Тимочко Дж. Л. и Страйер Л. (2012). Биохимия (7-е изд.). Нью-Йорк: Компания WH Freeman.
- ^ Jump up to: а б с д и ж г Сунь К., Коллинз Р., Хуанг С., Холмберг-Шьявоне Л., Ананд Г.С., Тан Ч., ван-ден-Берг С., Денг Л.В., Мур П.К., Карлберг Т., Шивараман Дж. (2009). «Структурная основа механизма ингибирования человеческой цистатионин-γ-лиазы, фермента, ответственного за выработку H 2 S» . Ж. Биол. Хим . 284 (5): 3076–85. дои : 10.1074/jbc.M805459200 . ПМИД 19019829 .
- ^ Jump up to: а б с д Стигборн С., Клаузен Т., Зондерманн П., Джейкоб У., Уорбс М., Маринкович С., Хубер Р., Валь М.С. (1999). «Кинетика и ингибирование рекомбинантной цистатионин-γ-лиазы человека. На пути к рациональному контролю транссульфурации» . Ж. Биол. Хим . 274 (18): 12675–84. дои : 10.1074/jbc.274.18.12675 . ПМИД 10212249 .
- ^ Яманиши Т., Тубой С. (1981). «Механизм реакции расщепления L-цистина, катализируемой γ-цистатионазой печени крысы». Дж. Биохим . 89 (6): 1913–21. doi : 10.1093/oxfordjournals.jbchem.a133393 . ПМИД 7287665 .
- ^ Ван Р. (март 2010 г.). «Токсичный газ, спасатель» . Научный американец . 302 (3): 66–71. Бибкод : 2010SciAm.302c..66W . doi : 10.1038/scientificamerican0310-66 . ПМИД 20184185 .
- ^ Jump up to: а б Ван М, Го З, Ван С (2013). «Влияние определенных условий на регуляцию цистатионин-γ-лиазы экзогенным сероводородом в клетках млекопитающих». Биохим. Жене . 51 (7–8): 503–13. дои : 10.1007/s10528-013-9581-1 . ПМИД 23515848 . S2CID 6865017 .
- ^ Jump up to: а б с д Бржович П., Литценбергер Холбрук Э. (январь 1990 г.). «Механизм реакции цистатионин-гамма-синтазы Escherichia coli: прямое доказательство того, что пиридоксаминовое производное винилглоксилата является ключевым промежуточным продуктом в реакциях пиридоксальфосфат-зависимого гамма-элиминирования и гамма-замещения». Биохимия . 29 (2): 442–451. дои : 10.1021/bi00454a020 . ПМИД 2405904 .
- ^ Jump up to: а б с д и Мессершмидт А., Ворбс М., Стигборн С., Валь М.С., Хубер Р., Лабер Б., Клаузен Т. (2003). «Детерминанты ферментативной специфичности в семействе PLP-зависимых ферментов Cys-Met-метаболизма: кристаллическая структура цистатионин-гамма-лиазы из дрожжей и сравнение внутризнакомых структур». Биол. Хим . 384 (3): 373–86. дои : 10.1515/BC.2003.043 . ПМИД 12715888 . S2CID 24552794 .
- ^ Састре Х., Мартин Х.А., Гомес-Кабрера М.К., Переда Х., Боррас К., Паллардо Ф.В., Винья Х. (2005). «Возрастное окислительное повреждение приводит к отсутствию гамма-цистатионазы более чем в 50% хрусталиков крыс: значение для катарактогенеза». Свободный Радик. Биол. Мед . 38 (5): 575–82. doi : 10.1016/j.freeradbiomed.2004.11.029 . ПМИД 15683713 .
- ^ Ян Г, Ву Л, Цзян Б, Ян В, Ци Дж, Цао К, Мэн Ц, Мустафа АК, Му В, Чжан С, Снайдер Ш, Ван Р (2008). «H 2 S как физиологический сосудорасширяющий агент: гипертония у мышей с делецией цистатионин-γ-лиазы» . Наука . 322 (5901): 587–90. Бибкод : 2008Sci...322..587Y . дои : 10.1126/science.1162667 . ПМЦ 2749494 . ПМИД 18948540 .
Внешние ссылки
[ редактировать ]- Цистатионин + гамма-лиаза Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)