Гомогентизат 1,2-диоксигеназы
| гомогентизат 1,2-диоксигеназы | |||
|---|---|---|---|
 3D-рендеринг гомогентизат-диоксигеназы с аминокислотными остатками активного центра и окрашенным атомом железа. Гистидин имеет коричневый цвет, глутамат — красный, а железо — синий. | |||
| Идентификаторы | |||
| Номер ЕС. | 1.13.11.5 | ||
| Номер CAS. | 9029-49-6 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| гомогентизат-1,2-диоксигеназа (гомогентизатоксидаза) | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ХГД | ||
| Альт. символы | МНЕ | ||
| ген NCBI | 3081 | ||
| HGNC | 4892 | ||
| МОЙ БОГ | 607474 | ||
| RefSeq | XM_001125882 | ||
| ЮниПрот | Q93099 | ||
| Другие данные | |||
| Номер ЕС | 1.13.11.5 | ||
| Локус | Хр. 3 q21-q23 | ||
| |||
Гомогентизат-1,2-диоксигеназа ( гомогентизатоксидаза , гомогентизатоксидаза , гомогентисиказа ) — фермент , катализирующий превращение гомогентизата в 4-малеилацетоацетат . Гомогентизат-1,2-диоксигеназа или HGD участвует в катаболизме ароматических колец, точнее, в расщеплении аминокислот тирозина и фенилаланина . [1] HGD появляется в метаболическом пути деградации тирозина и фенилаланина после образования гомогентизата молекулы. Гомогентизат реагирует с HGD с образованием малеилацетоацетата, который затем далее используется в метаболическом пути. HGD требует использования Fe 2+ и O 2 для расщепления ароматического кольца гомогентизата. [2]
Активный центр фермента
[ редактировать ]Активный центр гомогентизат-1,2-диоксигеназы был определен по кристаллической структуре, которая была зафиксирована в работе Titus et al. [1] По кристаллической структуре было обнаружено, что активный центр содержит следующие остатки: His292, His335, His365, His371 и Glu341.

Гомогентизат связывается в активном центре с Glu341, His335 и His371 через Fe. 2+ атом. His292 связывается с гидроксильной группой ароматического кольца. His365 связывается с Glu341 посредством водородных связей, стабилизируя боковые цепи аминокислот.
Патология
[ редактировать ]Гомегентизат-1,2-диоксигеназа участвует в типе метаболических заболеваний, называемых алкаптонурией . Это заболевание возникает из-за неспособности организма справиться с гомогентизатом, который при окислении в организме образует соединение, известное как охронотический пигмент , который вызывает черный цвет и имеет ряд негативных последствий. [ нужна ссылка ] Этот первый из этих эффектов заключается в том, что ушная сера пациента начнет чернеть или краснеть, в зависимости от диеты пациента, поскольку кровь окисляется и, таким образом, чернеет из-за избытка охронотического пигмента. Другим эффектом охронотического пигмента является то, что он может накапливаться в соединительной ткани организма, что приводит к дегенеративному артриту по мере взросления человека. [2] Алкаптонурия имеет еще один эффект: моча может почернеть, если ее оставить достаточно долго, чтобы она окислилась, хотя часто это метод проверки генетического дефекта. Метаболическое заболевание является аутосомно-рецессивным , поэтому оба родителя должны передать ген своим детям, чтобыу ребенка есть дефект. [ нужна ссылка ]
Механизм
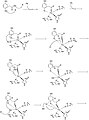
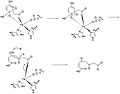
[ редактировать ]Боровский и др. предложили механизм HGD в своей статье, опубликованной в Журнале Американского химического общества. Свой механизм они основывают на результатах гибридных расчетов ДПФ с функционалами B3LYP с использованием программ Gaussian03 и Jaguar . Раскрытие ароматического кольца в гомогентизате представляет собой многостадийный процесс. На первых двух шагах Fe 2+ координаты карбонильного и ортофенольного атомов кислорода. Атом железа также координирован с His335, His371 и Glu341. O 2 затем связывается с атомом железа, [2] последующая реакция с ароматическим кольцом с образованием промежуточного соединения с пероксо-мостиком.
На следующем этапе O 2 расщепляется с образованием эпоксида . Этот эпоксидный промежуточный продукт позволяет радикальным реакциям в конечном итоге раскрыть и окислить шестичленное кольцо.
- Шаги 1-8 механизма
- Шаги 9-11 механизма
Ссылки
[ редактировать ]- ^ Jump up to: а б Титус Г.П., Мюллер Х.А., Бургнер Дж., Родригес Де Кордова С., Пеньяльва М.А., Тимм Д.Е. (июль 2000 г.). «Кристаллическая структура гомогентизатдиоксигеназы человека». Структурная биология природы . 7 (7): 542–6. дои : 10.1038/76756 . hdl : 10261/71724 . ПМИД 10876237 . S2CID 6219553 .
- ^ Jump up to: а б с Боровский Т., Георгиев В., Зигбан П.Е. (декабрь 2005 г.). «Механизм каталитической реакции гомогентизатдиоксигеназы: исследование гибридного DFT». Журнал Американского химического общества . 127 (49): 17303–14. дои : 10.1021/ja054433j . ПМИД 16332080 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW об алкаптонурии
- Записи OMIM об алкаптонурии
- Гомогентизат + 1,2-диоксигеназа в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)