Глутатионсинтетаза
| Глутатионсинтетаза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Символ | ГСС | ||
| ген NCBI | 2937 | ||
| HGNC | 4624 | ||
| МОЙ БОГ | 601002 | ||
| RefSeq | НМ_000178 | ||
| ЮниПрот | P48637 | ||
| Другие данные | |||
| Номер ЕС | 6.3.2.3 | ||
| Локус | Хр. 20 q11.2 | ||
| |||
| Эукариотическая глутатионсинтаза | |||
|---|---|---|---|
 Человеческая глутатионсинтетаза | |||
| Идентификаторы | |||
| Символ | GSH_синтаза | ||
| Пфам | PF03199 | ||
| Пфам Клан | CL0483 | ||
| ИнтерПро | ИПР004887 | ||
| СКОП2 | 2хгс / СКОПе / СУПФАМ | ||
| |||
| глутатионсинтаза | |||
|---|---|---|---|
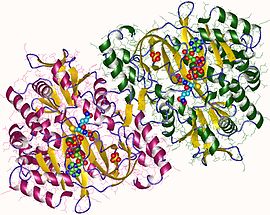 Димер глутатионсинтетазы, человек | |||
| Идентификаторы | |||
| Номер ЕС. | 6.3.2.3 | ||
| Номер CAS. | 9023-62-5 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Эукариотическая глутатионсинтаза, АТФ-связывающий домен | |||
|---|---|---|---|
 Человеческая глутатионсинтетаза | |||
| Идентификаторы | |||
| Символ | GSH_synth_ATP | ||
| Пфам | PF03917 | ||
| ИнтерПро | ИПР005615 | ||
| СКОП2 | 1m0t / ОБЪЕМ / СУПФАМ | ||
| |||
| Прокариотическая глутатионсинтетаза, N-концевой домен | |||
|---|---|---|---|
 Структура глутатионсинтетазы Escherichia coli при рН 7,5 | |||
| Идентификаторы | |||
| Символ | ГШ-С_Н | ||
| Пфам | PF02951 | ||
| ИнтерПро | ИПР004215 | ||
| СКОП2 | 1глв / СКОПе / СУПФАМ | ||
| |||
| Прокариотическая глутатионсинтетаза, домен АТФ-захвата | |||
|---|---|---|---|
 Структура глутатионсинтетазы Escherichia coli при рН 7,5 | |||
| Идентификаторы | |||
| Символ | ГШ-С_АТП | ||
| Пфам | PF02955 | ||
| Пфам Клан | CL0179 | ||
| ИнтерПро | ИПР004218 | ||
| СКОП2 | 1глв / СКОПе / СУПФАМ | ||
| |||
Глутатионсинтетаза ( GSS ) ( EC 6.3.2.3 ) является вторым ферментом в пути биосинтеза глутатиона (GSH). Он катализирует конденсацию гамма-глутамилцистеина и глицина с образованием глутатиона. [2] Глутатионсинтетаза также является мощным антиоксидантом. Он обнаружен у многих видов, включая бактерии, дрожжи, млекопитающих и растения. [3]
У человека дефекты GSS наследуются по аутосомно-рецессивному типу и являются причиной тяжелого метаболического ацидоза , 5-оксопролинурии , повышения скорости гемолиза и нарушения функции ЦНС . [4] Дефицит GSS может вызвать целый ряд вредных симптомов как у растений, так и у людей. [5]
У эукариот это гомодимерный фермент. Субстрат-связывающий домен имеет трехслойную альфа / бета /альфа структуру . [6] Этот фермент использует и стабилизирует промежуточный продукт ацилфосфата для последующего проведения благоприятной атаки глицина нуклеофильной .
Структура
[ редактировать ]Глутатионсинтетазы человека и дрожжей являются гомодимерами , то есть они состоят из двух идентичных субъединиц , нековалентно связанных друг с другом. С другой стороны, E. coli глутатионсинтетаза является гомотетрамером . [3] захвата АТФ Тем не менее, они являются частью суперсемейства , которое состоит из 21 фермента, содержащего складку захвата АТФ. [7] Каждая субъединица взаимодействует друг с другом посредством альфа-спирали и бета-листа взаимодействия водородных связей и содержит два домена. Один домен облегчает механизм захвата АТФ. [8] а другой является каталитическим активным центром глутамилцистеина γ- . Складка захвата АТФ консервативна в суперсемействе захвата АТФ и характеризуется двумя альфа-спиралями и бета-листами, которые удерживают молекулу АТФ между собой. [9] Домен, содержащий активный сайт, демонстрирует интересные свойства специфичности. В отличие от γ-глутамилцистеинсинтетазы, глутатионсинтетаза принимает большое количество модифицированных глутамилом аналогов γ-глутамилцистеина, но гораздо более специфична для модифицированных цистеином аналогов γ-глутамилцистеина. [10] Кристаллические структуры показали, что глутатионсинтетаза связана с GSH, ADP, двумя ионами магния и сульфат-ионом. [11] Два иона магния стабилизируют промежуточный ацилфосфат, облегчают связывание АТФ и активируют удаление фосфатной группы из АТФ. Сульфат-ион служит заменой неорганического фосфата, когда внутри активного центра образуется промежуточный ацилфосфат. [6]
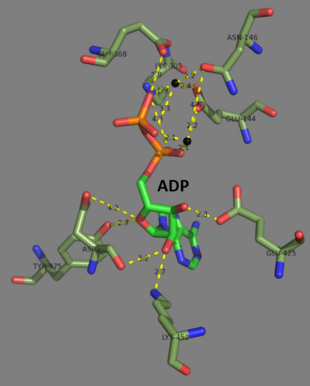
По состоянию на конец 2007 года 7 структур для этого класса ферментов было решено PDB с кодами доступа 1GLV , 1GSA , 1GSH , 1M0T , 1M0W , 2GLT и 2HGS .
Механизм
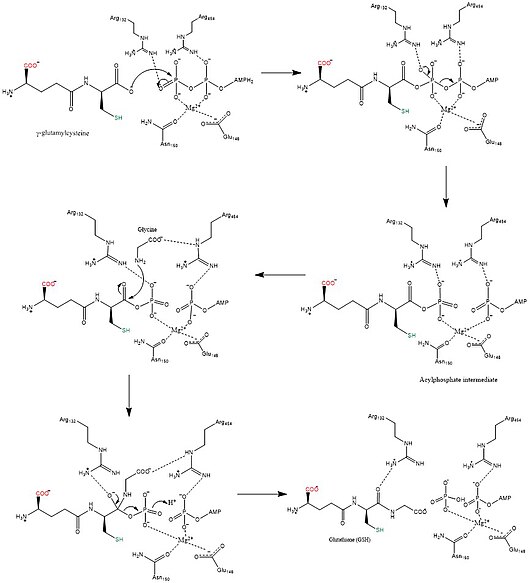
[ редактировать ]Глутатионсинтаза катализирует химическую реакцию.
- АТФ + гамма-L-глутамил-L-цистеин + глицин АДФ + фосфат + глутатион
Тремя субстратами этого фермента являются АТФ , гамма-L-глутамил-L-цистеин и глицин , тогда как тремя его продуктами являются АДФ , фосфат и глутатион .
Этот фермент принадлежит к семейству лигаз , в частности тех, которые образуют связи углерод-азот в виде лигаз кислота-D-аминокислота (пептидсинтазы). Систематическое название этого класса ферментов — гамма-L-глутамил-L-цистеин:глицинлигаза (АДФ-образующая) . Другие широко используемые названия включают глутатионсинтетазу и GSH-синтетазу . Этот фермент участвует в метаболизме глутамата и метаболизме глутатиона . что по крайней мере одно соединение, фосфинат, Известно, ингибирует этот фермент .
Механизмы биосинтеза синтаз используют энергию нуклеозидтрифосфатов , тогда как синтазы этого не делают. [12] Глутатионсинтетаза остается верной этому правилу, поскольку использует энергию, вырабатываемую АТФ. Первоначально карбоксилатная группа γ-глутамилцистеина превращается в ацилфосфат путем переноса неорганической фосфатной группы АТФ с образованием промежуточного ацилфосфата. Затем аминогруппа глицина участвует в нуклеофильной атаке, вытесняя фосфатную группу и образуя GSH. [13] После того, как конечный продукт GSH получен, он может быть использован глутатионпероксидазой для нейтрализации активных форм кислорода (АФК), таких как H 2 O 2 или глутатион S-трансферазы, при детоксикации ксенобиотиков . [7]
Функция
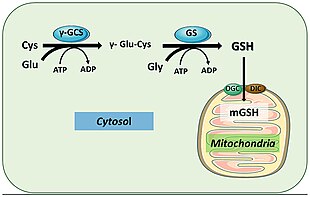
[ редактировать ]Глутатионсинтетаза важна для множества биологических функций во многих организмах. У Arabidopsis thaliana низкие уровни глутатионсинтетазы привели к повышенной уязвимости к стрессорам, таким как тяжелые металлы , токсичные органические химические вещества и окислительный стресс . [15] Наличие тиоловой функциональной группы позволяет его продукту GSH служить как эффективным окислителем , так и восстановителем во многих биологических сценариях. Тиолы могут легко принять пару электронов и окислиться до дисульфидов , а дисульфиды можно легко восстановить для регенерации тиолов. Кроме того, тиоловая боковая цепь цистеинов служит мощными нуклеофилами и реагирует с окислителями и электрофильными соединениями, которые в противном случае могли бы вызвать повреждение клетки. [16] Взаимодействия с некоторыми металлами также стабилизируют тиолатные промежуточные соединения. [17]
У человека глутатионсинтетаза действует аналогичным образом. Его продукт GSH участвует в клеточных путях, участвующих в гомеостазе и поддержании клеток. Например, глутатионпероксидазы катализируют окисление GSH до дисульфида глутатиона (GSSG) путем восстановления свободных радикалов и активных форм кислорода, таких как перекись водорода. [18] Глутатион S-трансфераза использует GSH для очистки различных метаболитов, ксенобиотиков и электрофилов до меркаптуратов для выведения. [19] Благодаря своей антиоксидантной роли GSS в основном продуцирует GSH внутри цитоплазмы клеток печени и импортируется в митохондрии, где происходит детоксикация. [20] GSH также необходим для активации иммунной системы для создания надежных механизмов защиты от вторжения патогенов. [19] GSH способен предотвратить заражение вирусом гриппа. [21] [22]
Клиническое значение
[ редактировать ]У пациентов с мутациями в гене GSS развивается дефицит глутатионсинтетазы (GSS) — аутосомно-рецессивное заболевание. [23] У пациентов развивается широкий спектр симптомов в зависимости от тяжести мутаций. У пациентов с легким поражением развивается компенсированная гемолитическая анемия, поскольку мутации влияют на стабильность фермента. У людей с умеренным и тяжелым поражением ферменты имеют дисфункциональные каталитические центры, что делает их неспособными участвовать в реакциях детоксикации. Физиологические симптомы включают метаболический ацидоз , неврологические дефекты и повышенную восприимчивость к патогенным инфекциям. [4]
Лечение людей с дефицитом глутатионсинтетазы обычно включает терапевтическое лечение, направленное на устранение легких и тяжелых симптомов и состояний. Для лечения метаболического ацидоза тяжелобольным пациентам назначают большое количество бикарбоната и антиоксидантов, таких как витамин Е и витамин С. [24] , что в легких случаях аскорбат и N -ацетилцистеин Было показано повышают уровень глутатиона и увеличивают выработку эритроцитов . [25] Важно отметить, что, поскольку дефицит глутатионсинтетазы встречается очень редко, он плохо изучен. Заболевание также проявляется в широком спектре, поэтому еще труднее сделать обобщение среди немногих встречающихся случаев. [26]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Гогос А., Шапиро Л. (декабрь 2002 г.). «Большие конформационные изменения в каталитическом цикле глутатионсинтазы» . Структура . 10 (12): 1669–76. дои : 10.1016/S0969-2126(02)00906-1 . ПМИД 12467574 .
- ^ Ньолссон Р., Норгрен С. (2005). «Физиологические и патологические аспекты метаболизма GSH». Акта педиатр . 94 (2): 132–7. дои : 10.1080/08035250410025285 . ПМИД 15981742 .
- ^ Перейти обратно: а б Ли Х, Сюй Х, Грэм Д.Э., Уайт Р.Х. (август 2003 г.). «Гомологи глутатионсинтетазы кодируют альфа-L-глутаматлигазы для биосинтеза метаногенного кофермента F420 и тетрагидросарцинаптерина» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (17): 9785–90. Бибкод : 2003PNAS..100.9785L . дои : 10.1073/pnas.1733391100 . ПМК 187843 . ПМИД 12909715 .
- ^ Перейти обратно: а б Ньолссон Р. (сентябрь 2005 г.). «Дефицит глутатионсинтетазы» . Клеточные и молекулярные науки о жизни . 62 (17): 1938–45. дои : 10.1007/s00018-005-5163-7 . ПМЦ 11139123 . ПМИД 15990954 . S2CID 59244 .
- ^ О'Нил М. «Дефицит глутатионсинтетазы» . Интернет-менделевское наследование у человека .
- ^ Перейти обратно: а б с Полехина Г., Совет П.Г., Гали Р.Р., Россджон Дж., Паркер М.В. (июнь 1999 г.). «Молекулярная основа дефицита глутатионсинтетазы и редкое событие перестановки генов» . Журнал ЭМБО . 18 (12): 3204–13. дои : 10.1093/emboj/18.12.3204 . ПМЦ 1171401 . ПМИД 10369661 .
- ^ Перейти обратно: а б Банерджи Р. (2007). «Молекулы антиоксидантов и окислительно-восстановительные факторы» . Редокс-биохимия . Хобокен, Нью-Джерси: Уайли. п. 16. ISBN 978-0-471-78624-5 .
- ^ Фаваз М.В., Топпер М.Э., Файрстин С.М. (декабрь 2011 г.). «Ферменты захвата АТФ» . Биоорганическая химия . 39 (5–6): 185–91. дои : 10.1016/j.bioorg.2011.08.004 . ПМК 3243065 . ПМИД 21920581 .
- ^ Файф П.К., Алфи М.С., Хантер В.Н. (апрель 2010 г.). «Структура глутатионсинтетазы Trypanosoma brucei: изменения домена и петли в каталитическом цикле высококонсервативного фермента» . Молекулярная и биохимическая паразитология . 170 (2): 93–9. дои : 10.1016/j.molbiopara.2009.12.011 . ПМЦ 2845819 . ПМИД 20045436 .
- ^ Гальперин М.Ю., Кунин Е.В. (1997). «Разнообразное суперсемейство ферментов с АТФ-зависимой карбоксилат-амино/тиоллигазной активностью» . Белковая наука . 6 (12): 2639–43. дои : 10.1002/pro.5560061218 . ПМК 2143612 . ПМИД 9416615 .
- ^ Мейстер А (1978). «Текущий статус γ-глутамилового цикла» . В Wendel A, Sies H (ред.). Функции глутатиона в печени и почках . Берлин, Гейдельберг: Springer Berlin Heidelberg. п. 49. ИСБН 978-3-642-67132-6 .
- ^ Хара Т., Като Х., Кацубе Ю., Ода Дж. (сентябрь 1996 г.). «Четвертичный комплекс псевдо-михаэлиса в обратной реакции лигазы: структура глутатионсинтетазы B Escherichia coli в комплексе с АДФ, глутатионом и сульфатом при разрешении 2,0 А». Биохимия . 35 (37): 11967–74. дои : 10.1021/bi9605245 . ПМИД 8810901 .
- ^ «Синтазы и лигазы» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN) и Номенклатурная комиссия IUB (NC-IUB), информационный бюллетень . 1984. Архивировано из оригинала 15 октября 2012 г. Проверено 2 марта 2016 г.
- ^ Эррера К., Кахун Р.Э., Кумаран С., Джез Дж. (июнь 2007 г.). «Механизм реакции глутатионсинтетазы из Arabidopsis thaliana: сайт-направленный мутагенез остатков активного центра» . Журнал биологической химии . 282 (23): 17157–65. дои : 10.1074/jbc.M700804200 . ПМИД 17452339 .
- ^ Мойер А.М., Сан З., Батцлер А.Дж., Ли Л., Шаид Д.Д., Ян П., Вайншилбоум Р.М. (март 2010 г.). «Генетические полиморфизмы пути глутатиона и выживаемость при раке легких после химиотерапии на основе платины» . Эпидемиология рака, биомаркеры и профилактика . 19 (3): 811–21. doi : 10.1158/1055-9965.EPI-09-0871 . ПМЦ 2837367 . ПМИД 20200426 .
- ^ Сян С., Вернер Б.Л., Кристенсен Э.М., Оливер DJ (июнь 2001 г.). «Биологические функции глутатиона вновь рассматриваются в трансгенных растениях арабидопсиса с измененными уровнями глутатиона» . Физиология растений . 126 (2): 564–74. дои : 10.1104/стр.126.2.564 . ПМЦ 111149 . ПМИД 11402187 .
- ^ Конте МЛ, Кэрролл К.С. (14 февраля 2013 г.). «Химия окисления и обнаружения тиолов» (PDF) . Окислительный стресс и окислительно-восстановительная регуляция . стр. 1–42. дои : 10.1007/978-94-007-5787-5_1 . ISBN 978-94-007-5786-8 . Архивировано из оригинала (PDF) 23 ноября 2015 года . Проверено 2 марта 2016 г.
- ^ Сузуки Н., Хигучи Т., Нагано Т. (август 2002 г.). «Множественные активные промежуточные продукты реакции окисления, катализируемой синтетическим гемтиолатным комплексом, соответствующим цитохрому p450». Журнал Американского химического общества . 124 (32): 9622–8. дои : 10.1021/ja0115013 . ПМИД 12167058 .
- ^ Перейти обратно: а б Фан Ю.З., Ян С., Ву Г (октябрь 2002 г.). «Свободные радикалы, антиоксиданты и питание». Питание . 18 (10): 872–9. дои : 10.1016/S0899-9007(02)00916-4 . ПМИД 12361782 .
- ^ Перейти обратно: а б Рибас В., Гарсиа-Руис К., Фернандес-Чека Х.К. (июль 2014 г.). «Глутатион и митохондрии» . Границы в фармакологии . 5 : 151. дои : 10.3389/fphar.2014.00151 . ПМК 4079069 . ПМИД 25024695 .
- ^ Таунсенд Д.М., Тью К.Д., Тапьеро Х (2003). «Важность глутатиона в заболеваниях человека» . Биомедицина и фармакотерапия . 57 (3–4): 145–55. дои : 10.1016/S0753-3322(03)00043-X . ПМК 6522248 . ПМИД 12818476 .
- ^ Цай Дж., Чен Ю., Сет С., Фурукава С., Компанс Р.В., Джонс Д.П. (апрель 2003 г.). «Ингибирование гриппозной инфекции глутатионом». Свободно-радикальная биология и медицина . 34 (7): 928–36. дои : 10.1016/S0891-5849(03)00023-6 . ПМИД 12654482 .
- ^ Ристофф Э., Маятепек Э., Ларссон А. (июль 2001 г.). «Долгосрочный клинический результат у пациентов с дефицитом глутатионсинтетазы». Журнал педиатрии . 139 (1): 79–84. дои : 10.1067/mpd.2001.114480 . ПМИД 11445798 .
- ^ Краут Дж.А., Мадиас Н.Е. (май 2010 г.). «Метаболический ацидоз: патофизиология, диагностика и лечение». Обзоры природы. Нефрология . 6 (5): 274–85. дои : 10.1038/nrneph.2010.33 . ПМИД 20308999 . S2CID 205512465 .
- ^ Джайн А., Бьюист Н.Р., Кеннауэй Н.Г., Пауэлл Б.Р., Олд П.А., Мортенссон Дж. (февраль 1994 г.). «Эффект лечения аскорбатом или N-ацетилцистеином у пациента с наследственной недостаточностью глутатионсинтетазы». Журнал педиатрии . 124 (2): 229–33. дои : 10.1016/S0022-3476(94)70309-4 . ПМИД 8301428 .
- ^ Ристофф Э, Ларссон А (2007). «Врожденные ошибки метаболизма глутатиона» . Сиротский журнал редких заболеваний . 2:16 . дои : 10.1186/1750-1172-2-16 . ПМК 1852094 . ПМИД 17397529 .
- Закон М.И., Холливелл Б. (1986). «Очистка и свойства глутатионсинтетазы из листьев (Spinacia oleracea)». Наука о растениях . 43 (3): 185–191. дои : 10.1016/0168-9452(86)90016-6 .
- Макникол ПК (1987). «Гомоглутатион и глутатионсинтетазы проростков бобовых - частичная очистка и субстратная специфичность». Наука о растениях . 53 (3): 229–235. дои : 10.1016/0168-9452(87)90159-2 .
Внешние ссылки
[ редактировать ]- Глутатион + синтетаза Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
