Транскрипция (биология)
| Часть серии о |
| Генетика |
|---|
 |
Транскрипция – это процесс копирования участка ДНК в РНК. Сегменты ДНК, транскрибируемые в молекулы РНК, которые могут кодировать белки, производят информационную РНК (мРНК). Другие сегменты ДНК транскрибируются в молекулы РНК, называемые некодирующими РНК (нкРНК).
И ДНК, и РНК представляют собой нуклеиновые кислоты которые используют пары оснований нуклеотидов , в качестве дополнительного языка. Во время транскрипции последовательность ДНК считывается РНК- полимеразой , которая производит комплементарную антипараллельную цепь РНК, называемую первичным транскриптом .
В вирусологии термин «транскрипция» также может использоваться применительно к синтезу мРНК из молекулы РНК (т. е. эквивалентному репликации РНК). Например, геном вируса с одноцепочечной РНК с отрицательным смыслом (оцРНК-) может быть матрицей для одноцепочечной РНК с положительным смыслом (оцРНК+). [ нужны разъяснения ] Это связано с тем, что цепь с положительным смыслом содержит информацию о последовательности, необходимую для трансляции вирусных белков, необходимых для репликации вируса . Этот процесс катализируется вирусной РНК-репликазой . [1] [ нужны разъяснения ]
Предыстория [ править ]
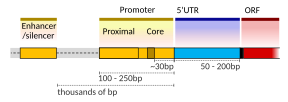
Единица транскрипции ДНК, кодирующая белок, может содержать как кодирующую последовательность , которая будет транслироваться в белок, так и регуляторные последовательности , которые направляют и регулируют синтез этого белка. Регуляторная последовательность перед ( выше ) кодирующей последовательности называется пятью первичными нетранслируемыми областями (5'UTR); последовательность после ( ниже ) кодирующей последовательности называется тремя основными нетранслируемыми областями (3'UTR). [2]
В отличие от репликации ДНК , транскрипция приводит к образованию комплемента РНК, который включает нуклеотид урацил (U) во всех случаях, когда тимин (Т) присутствовал бы в комплементе ДНК. [3]
Только одна из двух цепей ДНК служит матрицей для транскрипции. Антисмысловая . цепь ДНК считывается РНК-полимеразой от 3'-конца к 5'-концу во время транскрипции (3' → 5') Комплементарная РНК создается в противоположном направлении, в направлении 5' → 3', что соответствует последовательности смысловой цепи, за исключением замены урацила на тимин. Такая направленность обусловлена тем, что РНК-полимераза может добавлять нуклеотиды только к 3'-концу растущей цепи мРНК. Такое использование только цепи ДНК 3' → 5' устраняет необходимость во фрагментах Оказаки , которые наблюдаются при репликации ДНК. [2] Это также устраняет необходимость в праймере РНК для инициации синтеза РНК, как в случае репликации ДНК.
Нематричная , поскольку ее последовательность такая же , (смысловая) цепь ДНК называется кодирующей цепью как у вновь созданного транскрипта РНК (за исключением замены тимина на урацил). Это цепь, которая традиционно используется при представлении последовательности ДНК. [4]
Транскрипция имеет некоторые механизмы корректуры, но их меньше и они менее эффективны, чем средства контроля копирования ДНК. В результате транскрипция имеет более низкую точность копирования, чем репликация ДНК. [5]
Основные шаги [ править ]
Транскрипция подразделяется на инициацию , уход от промотора , элонгацию и терминацию . [6]
Настройка транскрипции [ править ]
Этот раздел может потребовать очистки Википедии , чтобы соответствовать стандартам качества . Конкретная проблема заключается в следующем: Дублирование с нормативной последовательностью . Можем ли мы просто сделать каноническую «основную статью» и перенаправлять туда людей? ( сентябрь 2021 г. ) |
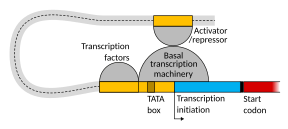
Энхансеры, факторы транскрипции, медиаторный комплекс и петли ДНК транскрипции в млекопитающих

Настройка транскрипции у млекопитающих регулируется многими цис-регуляторными элементами , включая коровый промотор и проксимальные промоторные элементы , которые расположены вблизи сайтов начала транскрипции генов. Core-промоторы в сочетании с общими факторами транскрипции достаточны для управления инициацией транскрипции, но обычно имеют низкую базальную активность. [7] Другие важные цис-регуляторные модули локализованы в участках ДНК, удаленных от сайтов начала транскрипции. К ним относятся усилители , глушители , изоляторы и привязывающие элементы. [8] Среди этого созвездия элементов энхансеры и связанные с ними факторы транскрипции играют ведущую роль в инициации транскрипции генов. [9] Энхансер, локализованный в участке ДНК, удаленном от промотора гена, может оказывать очень большое влияние на транскрипцию гена, при этом транскрипция некоторых генов увеличивается до 100 раз из-за активированного энхансера. [10]
Энхансеры — это участки генома, которые являются основными генно-регуляторными элементами. Энхансеры контролируют программы транскрипции генов, специфичные для определенного типа клеток, чаще всего путем прохождения больших расстояний, чтобы прийти в физическую близость к промоторам генов-мишеней. [11] Хотя существуют сотни тысяч участков ДНК-энхансеров, [12] для определенного типа ткани только определенные энхансеры приближаются к промоторам, которые они регулируют. При исследовании нейронов коры головного мозга было обнаружено 24 937 петель, приводящих энхансеры к целевым промоторам. [10] Множественные энхансеры, каждый из которых часто находится на десятках или сотнях тысяч нуклеотидов, удаленных от генов-мишеней, соединяются с промоторами гена-мишени и могут координироваться друг с другом, чтобы контролировать транскрипцию общего гена-мишени. [11]
Схематическая иллюстрация в этом разделе показывает, как энхансер движется по кругу, чтобы вступить в тесную физическую близость к промотору целевого гена. Петля стабилизируется димером соединительного белка (например, димером CTCF или YY1 ), причем один член димера прикреплен к своему связывающему мотиву на энхансере, а другой член прикреплен к своему связывающему мотиву на промоторе (представленному красные зигзаги на иллюстрации). [13] Несколько факторов транскрипции, специфичных для клеточных функций (в клетке человека насчитывается около 1600 факторов транскрипции). [14] ) обычно связываются с конкретными мотивами энхансера [15] и небольшая комбинация этих связанных с энхансером факторов транскрипции, когда они приближаются к промотору с помощью петли ДНК, регулируют уровень транскрипции целевого гена. Медиатор (комплекс, обычно состоящий примерно из 26 белков во взаимодействующей структуре) передает регуляторные сигналы от энхансерных ДНК-связанных факторов транскрипции непосредственно ферменту РНК-полимеразы II (pol II), связанному с промотором. [16]
Энхансеры, когда они активны, обычно транскрибируются с обеих цепей ДНК с помощью РНК-полимераз, действующих в двух разных направлениях, образуя две энхансерные РНК (еРНК), как показано на рисунке. [17] Неактивный энхансер может быть связан с неактивным фактором транскрипции. Фосфорилирование транскрипционного фактора может активировать его, и этот активированный транскрипционный фактор может затем активировать энхансер, с которым он связан (см. маленькую красную звездочку, обозначающую фосфорилирование транскрипционного фактора, связанного с энхансером, на иллюстрации). [18] Активированный энхансер начинает транскрипцию своей РНК до активации транскрипции информационной РНК из своего гена-мишени. [19]
Метилирование и деметилирование CpG - островков

Регуляция транскрипции примерно на 60% промоторов также контролируется метилированием цитозинов в динуклеотидах CpG (где за 5'-цитозином следует 3'-гуанин или сайты CpG ). 5-метилцитозин (5-mC) представляет собой метилированную форму ДНК основания цитозина (см. рисунок). 5-mC — эпигенетический маркер, обнаруживаемый преимущественно в сайтах CpG. В геноме человека встречается около 28 миллионов CpG-динуклеотидов. [20] В большинстве тканей млекопитающих в среднем от 70% до 80% цитозинов CpG метилированы (образуя 5-метилCpG или 5-mCpG). [21] Однако неметилированные цитозины в 3'-последовательностях 5'-цитозин-гуанин часто встречаются группами, называемыми CpG-островками , на активных промоторах. Около 60% последовательностей промотора имеют островок CpG, тогда как только около 6% последовательностей энхансеров имеют островок CpG. [22] Островки CpG представляют собой регуляторные последовательности, поскольку если острова CpG метилированы в промоторе гена, это может уменьшить или заглушить транскрипцию гена. [23]
Метилирование ДНК регулирует транскрипцию генов посредством взаимодействия с белками метилсвязывающего домена (MBD), такими как MeCP2, MBD1 и MBD2. Эти белки MBD наиболее прочно связываются с высоко метилированными CpG-островками . [24] Эти белки MBD имеют как метил-CpG-связывающий домен, так и домен репрессии транскрипции. [24] Они связываются с метилированной ДНК и направляют белковые комплексы, обладающие активностью ремоделирования хроматина и/или модификации гистонов, к метилированным CpG-островкам. Белки MBD обычно репрессируют локальный хроматин, например, катализируя введение репрессивных меток гистонов или создавая общую репрессивную среду хроматина посредством ремоделирования нуклеосом и реорганизации хроматина. [24]

Как отмечалось в предыдущем разделе, факторы транскрипции представляют собой белки, которые связываются со специфическими последовательностями ДНК и регулируют экспрессию гена. Последовательность связывания фактора транскрипции в ДНК обычно имеет длину около 10 или 11 нуклеотидов. Как подытожили в 2009 году Vaquerizas et al. указали, что существует около 1400 различных факторов транскрипции, кодируемых в геноме человека генами, которые составляют около 6% всех генов, кодирующих человеческие белки. [25] Около 94% сайтов связывания транскрипционных факторов (TFBS), которые связаны с генами, чувствительными к сигналу, встречаются в энхансерах, тогда как только около 6% таких TFBS встречаются в промоторах. [15]
Белок EGR1 представляет собой особый фактор транскрипции, который важен для регуляции метилирования CpG-островков. Сайт связывания транскрипционного фактора EGR1 часто расположен в последовательностях энхансера или промотора. [26] В геноме млекопитающих имеется около 12 000 сайтов связывания EGR1, причем около половины сайтов связывания EGR1 расположены в промоторах, а половина - в энхансерах. [26] Связывание EGR1 с целевым участком связывания ДНК нечувствительно к метилированию цитозина в ДНК. [26]
Хотя в нестимулированных клетках обнаруживаются лишь небольшие количества белка транскрипционного фактора EGR1, трансляция гена EGR1 в белок через час после стимуляции резко увеличивается. [27] Производство белков транскрипционного фактора EGR1 в различных типах клеток может стимулироваться факторами роста, нейротрансмиттерами, гормонами, стрессом и травмой. [27] В мозге, когда нейроны активируются, белки EGR1 активируются и связываются (рекрутируют) ранее существовавшие ферменты TET1 , которые производятся в нейронах в больших количествах. Ферменты ТЕТ могут катализировать деметилирование 5-метилцитозина. Когда факторы транскрипции EGR1 доставляют ферменты TET1 к сайтам связывания EGR1 в промоторах, ферменты TET могут деметилировать метилированные островки CpG на этих промоторах. После деметилирования эти промоторы могут затем инициировать транскрипцию своих генов-мишеней. Сотни генов в нейронах дифференциально экспрессируются после активации нейронов посредством рекрутирования EGR1 TET1 на метилированные регуляторные последовательности в их промоторах. [26]
Метилирование промоторов также изменяется в ответ на сигналы. Три метилтрансферазы ДНК млекопитающих (DNMT1, DNMT3A и DNMT3B) катализируют добавление метильных групп к цитозинам в ДНК. Хотя DNMT1 является поддерживающей метилтрансферазой, DNMT3A и DNMT3B могут осуществлять новые метилирования. Существуют также две сплайсингового изоформы белка, полученные из гена DNMT3A : белки ДНК-метилтрансферазы DNMT3A1 и DNMT3A2. [28]
Изоформа сплайсинга DNMT3A2 ведет себя как продукт классического гена немедленной ранней стадии и, например, она устойчиво и временно продуцируется после активации нейронов. [29] То, где изоформа ДНК-метилтрансферазы DNMT3A2 связывается и добавляет метильные группы к цитозинам, по-видимому, определяется посттрансляционными модификациями гистонов. [30] [31] [32]
С другой стороны, нервная активация вызывает деградацию DNMT3A1, сопровождающуюся снижением метилирования по крайней мере одного оцененного целевого промотора. [33]
Инициация [ править ]
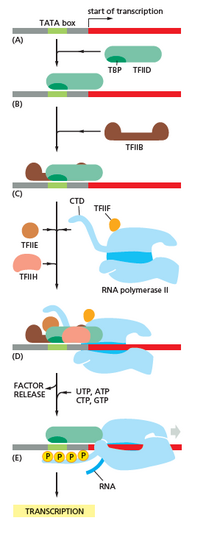
Транскрипция начинается с связывания РНК-полимеразы и одного или нескольких общих факторов транскрипции ДНК с последовательностью промотора с образованием закрытого комплекса РНК-полимераза-промотор. В закрытом комплексе ДНК промотора все еще полностью двухцепочечная. [6]
РНК-полимераза при помощи одного или нескольких общих факторов транскрипции затем раскручивает примерно 14 пар оснований ДНК с образованием открытого комплекса РНК-полимераза-промотор. В открытом комплексе ДНК промотора частично раскручена и является одноцепочечной. Обнаженная одноцепочечная ДНК называется «пузырем транскрипции». [6]
РНК-полимераза, при содействии одного или нескольких общих факторов транскрипции, затем выбирает сайт начала транскрипции в пузыре транскрипции, связывается с инициирующим NTP и расширяющим NTP (или коротким праймером РНК и расширяющим NTP), комплементарным последовательности сайта начала транскрипции. и катализирует образование связей с образованием исходного продукта РНК. [6]
У бактерий РНК-полимеразы голофермент состоит из пяти субъединиц: 2 α-субъединицы, 1 β-субъединицы, 1 β'-субъединицы и 1 ω-субъединицы. У бактерий существует один общий фактор транскрипции РНК, известный как сигма-фактор . Основной фермент РНК-полимеразы связывается с бактериальным фактором общей транскрипции (сигма) с образованием голофермента РНК-полимеразы, а затем связывается с промотором. [6] (РНК-полимераза называется голоферментом, когда сигма-субъединица присоединена к основному ферменту, который состоит только из 2 α-субъединицы, 1 β-субъединицы и только 1 β'-субъединицы). В отличие от эукариот, инициирующий нуклеотид возникающей бактериальной мРНК не кэпирован модифицированным гуаниновым нуклеотидом. Инициирующий нуклеотид бактериальных транскриптов несет 5'-трифосфат (5'-PPP), который можно использовать для полногеномного картирования сайтов инициации транскрипции. [35]
У архей и эукариот РНК-полимераза содержит субъединицы, гомологичные каждой из пяти субъединиц РНК-полимеразы у бактерий, а также содержит дополнительные субъединицы. У архей и эукариот функции бактериального общего фактора транскрипции сигма выполняются несколькими общими факторами транскрипции, которые работают вместе. [6] У архей есть три основных фактора транскрипции: TBP , TFB и TFE . У эукариот в транскрипции, зависимой от РНК-полимеразы II , имеется шесть общих факторов транскрипции: TFIIA , TFIIB ( ортолог архейного TFB), TFIID (многосубъединичный фактор, в котором ключевая субъединица, TBP , является ортологом архейного TBP), TFIIE ( ортолог архейного TFE), TFIIF и TFIIH . TFIID является первым компонентом, который связывается с ДНК благодаря связыванию TBP, тогда как TFIIH является последним компонентом, который рекрутируется. У архей и эукариот закрытый комплекс РНК-полимераза-промотор обычно называют « преинициационным комплексом ». [36]
Инициация транскрипции регулируется дополнительными белками, известными как активаторы и репрессоры , а в некоторых случаях ассоциированными коактиваторами или корепрессорами , которые модулируют образование и функцию комплекса инициации транскрипции. [6]
Побег промоутера [ править ]
После синтеза первой связи РНК-полимераза должна покинуть промотор. В это время наблюдается тенденция к высвобождению транскрипта РНК и образованию усеченных транскриптов. Это называется абортивной инициацией и характерно как для эукариот, так и для прокариот. [37] Абортивная инициация продолжает происходить до тех пор, пока не будет синтезирован продукт РНК пороговой длины примерно 10 нуклеотидов, после чего происходит уход от промотора и формируется комплекс элонгации транскрипции. [ нужна ссылка ]
Механически ускользание промотора происходит за счет сжатия ДНК , обеспечивая энергию, необходимую для разрыва взаимодействий между голоферментом РНК-полимеразы и промотором. [38]
Исторически считалось, что у бактерий сигма-фактор определенно высвобождается после клиренса промотора. Эта теория была известна как модель обязательного выпуска. Однако более поздние данные показали, что после клиренса промотора сигма-фактор высвобождается в соответствии со стохастической моделью, известной как модель стохастического высвобождения . [39]
У эукариот на промоторе, зависимом от РНК-полимеразы II, после клиренса промотора TFIIH фосфорилирует серин 5 на карбокси-концевом домене РНК-полимеразы II, что приводит к задействованию кэпирующего фермента (CE). [40] [41] Точный механизм того, как CE индуцирует клиренс промотора у эукариот, пока не известен.
Удлинение [ править ]

Одна цепь ДНК, матричная цепь (или некодирующая цепь), используется в качестве матрицы для синтеза РНК. По мере продолжения транскрипции РНК-полимераза пересекает цепь матрицы и использует комплементарность спаривания оснований с матрицей ДНК для создания копии РНК (которая удлиняется во время прохождения). Хотя РНК-полимераза пересекает цепь матрицы от 3' → 5', кодирующую (нематричную) цепь и вновь образованную РНК также можно использовать в качестве контрольных точек, поэтому транскрипцию можно описать как происходящую 5' → 3'. В результате образуется молекула РНК из 5' → 3', точная копия кодирующей цепи (за исключением того, что тимины заменены урацилами , а нуклеотиды состоят из рибозного (5-углеродного) сахара, тогда как ДНК содержит дезоксирибозу (на один кислород меньше). атом) в его сахарно-фосфатном остове). [3]
Транскрипция мРНК может включать несколько РНК-полимераз на одной матрице ДНК и несколько раундов транскрипции (амплификация определенной мРНК), поэтому из одной копии гена можно быстро получить множество молекул мРНК. [ нужна ссылка ] Характерные скорости элонгации у прокариот и эукариот составляют около 10–100 нт/сек. [42] Однако у эукариот нуклеосомы действуют как основные барьеры для транскрипции полимераз во время элонгации транскрипции. [43] [44] У этих организмов пауза, индуцированная нуклеосомами, может регулироваться факторами элонгации транскрипции, такими как TFIIS. [44]
Удлинение также включает в себя механизм корректуры, который может заменить неправильно включенные основы. У эукариот это может соответствовать коротким паузам во время транскрипции, которые позволяют соответствующим факторам редактирования РНК связываться. Эти паузы могут быть присущи РНК-полимеразе или обусловлены структурой хроматина. [ нужна ссылка ]
Двухцепочечные разрывы в активно транскрибируемых участках ДНК восстанавливаются путем гомологичной рекомбинации во время фаз S и G2 клеточного цикла . [45] [46] Поскольку транскрипция увеличивает доступность ДНК для экзогенных химических веществ и внутренних метаболитов, которые могут вызывать рекомбиногенные повреждения, транскрипция может сильно стимулировать гомологичную рекомбинацию определенной последовательности ДНК. [47]
Прекращение действия [ править ]
Бактерии используют две разные стратегии терминации транскрипции – Rho-независимую терминацию и Rho-зависимую терминацию. При Rho-независимой терминации транскрипции богатую GC, транскрипция РНК останавливается, когда вновь синтезированная молекула РНК образует шпильку, за которой следует цепочка Us. Когда образуется шпилька, механический стресс разрывает слабые связи ru-dA, которые теперь заполняют гибрид ДНК-РНК. Это вытягивает транскрипт поли-U из активного сайта РНК-полимеразы, прекращая транскрипцию. При Rho-зависимой терминации Rho , белковый фактор, дестабилизирует взаимодействие между матрицей и мРНК, тем самым высвобождая вновь синтезированную мРНК из элонгационного комплекса. [48]
Терминация транскрипции у эукариот менее изучена, чем у бактерий, но включает расщепление нового транскрипта с последующим независимым от матрицы добавлением аденинов к его новому 3'-концу в процессе, называемом полиаденилированием . [49]
Помимо терминации последовательностями терминатора (которые являются частью гена ) , транскрипция также может нуждаться в остановке при возникновении таких условий, как повреждение ДНК или активная репликационная вилка . У бактерий АТФаза Mfd может удалить РНК-полимеразу, застрявшую в повреждении, открыв ее зажим. Он также задействует механизмы эксцизионной репарации нуклеотидов для восстановления повреждения. Предполагается, что Mfd также разрешает конфликты между репликацией и транскрипцией ДНК. [50] У эукайротов АТФаза TTF2 помогает подавлять действие РНКП I и II во время митоза , предотвращая ошибки хромосомной сегрегации. [51] Предполагается, что у архей аналогичную роль играет эта-АТФаза. [52]
РНК РНК-полимеразы в посттранскрипционных Роль изменениях
РНК-полимераза играет очень важную роль на всех этапах, включая посттранскрипционные изменения РНК.
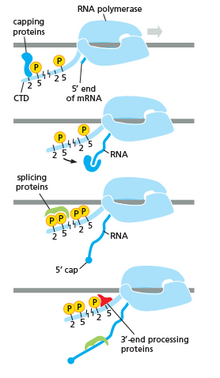
Как показано на изображении справа, очевидно, что CTD (C-концевой домен) представляет собой хвост, который меняет свою форму; этот хвост будет использоваться в качестве носителя сплайсинга, кэпирования и полиаденилирования , как показано на изображении слева. [53]
Ингибиторы [ править ]
Ингибиторы транскрипции можно использовать в качестве антибиотиков против, например, патогенных бактерий ( антибактериальные средства ) и грибов ( противогрибковые средства ). Примером такого антибактериального средства является рифампицин , который ингибирует транскрипцию бактериальной ДНК в мРНК путем ингибирования ДНК-зависимой РНК-полимеразы путем связывания ее бета-субъединицы, тогда как 8-гидроксихинолин является противогрибковым ингибитором транскрипции. [54] Эффекты метилирования гистонов также могут ингибировать действие транскрипции. Недавно сообщалось о мощных биоактивных натуральных продуктах, таких как триптолид, которые ингибируют транскрипцию млекопитающих посредством ингибирования субъединицы XPB общего фактора транскрипции TFIIH в качестве конъюгата глюкозы для воздействия на гипоксические раковые клетки с повышенным производством транспортера глюкозы. [55]
ингибиторы Эндогенные
У позвоночных большинство промоторов генов содержат островок CpG с многочисленными сайтами CpG . [56] Когда многие сайты CpG промотора гена метилированы, ген становится ингибируемым (заглушенным). [57] Колоректальный рак обычно имеет от 3 до 6 мутаций водителя и от 33 до 66 мутаций автостопщика или пассажира. [58] Однако ингибирование транскрипции (замалчивание) может иметь большее значение, чем мутация, в возникновении рака. Например, при колоректальном раке около 600–800 генов транскрипционно ингибируются метилированием CpG-островков (см. «Регуляция транскрипции при раке »). Репрессия транскрипции при раке может также происходить за счет других эпигенетических механизмов, таких как изменение продукции микроРНК . [59] При раке молочной железы репрессия транскрипции BRCA1 может происходить чаще из-за избыточной продукции микроРНК-182, чем из-за гиперметилирования промотора BRCA1 (см. Низкая экспрессия BRCA1 при раке молочной железы и яичников ). [ нужна ссылка ]
Фабрики транскрипции [ править ]
Активные единицы транскрипции группируются в ядре в отдельных участках, называемых фабриками транскрипции или эухроматином . Такие сайты можно визуализировать, позволяя задействованным полимеразам расширять свои транскрипты в меченых предшественниках (Br-UTP или Br-U) и иммуномаркируя меченую возникающую РНК. Фабрики транскрипции также можно локализовать с помощью флуоресцентной гибридизации in situ или пометить антителами, направленными против полимераз. имеется ~10 000 фабрик В нуклеоплазме клетки HeLa , среди которых ~8 000 фабрик полимеразы II и ~2 000 фабрик полимеразы III. Каждая фабрика полимеразы II содержит ~8 полимераз. Поскольку большинство активных единиц транскрипции связаны только с одной полимеразой, каждая фабрика обычно содержит ~8 различных единиц транскрипции. Эти единицы могут быть связаны через промоторы и/или энхансеры с петлями, образующими «облако» вокруг фактора. [60]
История [ править ]
Молекула, которая позволяет генетическому материалу реализоваться в виде белка, была впервые предложена Франсуа Жакобом и Жаком Моно . Северо Очоа получил Нобелевскую премию по физиологии и медицине в 1959 году за разработку процесса синтеза РНК in vitro с помощью полинуклеотидной фосфорилазы , который оказался полезен для взлома генетического кода . Синтез РНК с помощью РНК-полимеразы был установлен in vitro несколькими лабораториями к 1965 году; однако РНК, синтезируемая этими ферментами, обладала свойствами, которые предполагали существование дополнительного фактора, необходимого для правильной терминации транскрипции. [ нужна ссылка ]
Роджер Д. Корнберг получил Нобелевскую премию по химии 2006 года «за исследования молекулярных основ эукариотической транскрипции ». [61]
Измерение и обнаружение [ править ]

Транскрипцию можно измерить и обнаружить различными способами: [ нужна ссылка ]
- Анализ транскрипции G-Less Cassette : измеряет силу промотора
- Анализ транскрипции стока : определяет сайты начала транскрипции (TSS)
- Ядерный анализ : измеряет относительное количество вновь образованных транскриптов.
- KAS-seq : измеряет одноцепочечную ДНК, генерируемую РНК-полимеразой; может работать с 1000 ячейками. [62]
- Анализ защиты РНКазы и -чип РНКП ChIP : обнаружение активных сайтов транскрипции
- ОТ-ПЦР : измеряет абсолютное содержание общих или ядерных уровней РНК, которые, однако, могут отличаться от скорости транскрипции.
- ДНК-микрочипы : измеряют относительное содержание общих или ядерных уровней РНК; однако они могут отличаться от скорости транскрипции
- Гибридизация in situ : обнаруживает наличие транскрипта.
- Маркировка MS2 : путем включения петель ствола РНК , таких как MS2, в ген, они включаются во вновь синтезированную РНК. Затем стволовые петли можно обнаружить с помощью слияния GFP и белка оболочки MS2, который обладает высоким сродством и специфичным для последовательности взаимодействием со стволовыми петлями MS2. Привлечение GFP к месту транскрипции визуализируется как одно флуоресцентное пятно. Этот новый подход показал, что транскрипция происходит прерывистыми всплесками или импульсами (см. « Всплеск транскрипции »). За заметным исключением методов in situ, большинство других методов позволяют получить средние значения клеточной популяции и не способны обнаружить это фундаментальное свойство генов. [63]
- Нозерн-блоттинг : традиционный метод, и до появления RNA-Seq наиболее количественный метод.
- RNA-Seq : применяет методы секвенирования нового поколения для секвенирования целых транскриптомов , что позволяет измерять относительное количество РНК, а также обнаруживать дополнительные вариации, такие как слитые гены, посттранскрипционные изменения и новые сайты сплайсинга.
- Single-cell RNA-Seq : амплифицирует и считывает частичные транскриптомы из изолированных клеток, что позволяет проводить детальный анализ РНК в тканях, эмбрионах и раковых клетках.
Обратная транскрипция [ править ]
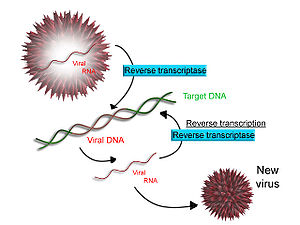
Некоторые вирусы (например, ВИЧ , причина СПИДа ) обладают способностью транскрибировать РНК в ДНК. ВИЧ имеет геном РНК, который обратно транскрибируется в ДНК. Полученная ДНК может быть слита с ДНК генома клетки-хозяина. Основной фермент, ответственный за синтез ДНК из матрицы РНК, называется обратной транскриптазой . [64]
В случае ВИЧ обратная транскриптаза отвечает за синтез комплементарной цепи ДНК (кДНК) к геному вирусной РНК. Затем фермент рибонуклеаза H расщепляет цепь РНК, а обратная транскриптаза синтезирует комплементарную цепь ДНК с образованием структуры двойной спирали ДНК (кДНК). кДНК интегрируется в геном клетки-хозяина с помощью фермента интегразы , который заставляет клетку-хозяина генерировать вирусные белки, которые снова собираются в новые вирусные частицы. При ВИЧ после этого клетка-хозяин подвергается запрограммированной клеточной гибели или апоптозу клеток Т- . [65] Однако у других ретровирусов клетка-хозяин остается интактной, когда вирус выходит из клетки. [ нужна ссылка ]
Некоторые эукариотические клетки содержат фермент с активностью обратной транскрипции, называемый теломеразой . Теломераза переносит матрицу РНК, из которой она синтезирует теломеры , повторяющуюся последовательность ДНК, до конца линейных хромосом. Это важно, потому что каждый раз, когда линейная хромосома удваивается, она укорачивается. Поскольку теломеры находятся на концах хромосом, укорочение устраняет часть несущественных повторяющихся последовательностей, а не последовательность ДНК, кодирующую белок, расположенную дальше от конца хромосомы.
Теломераза часто активируется в раковых клетках, чтобы позволить раковым клеткам бесконечно дублировать свои геномы без потери важной последовательности ДНК, кодирующей белок. Активация теломеразы может быть частью процесса, который позволяет раковым клеткам стать бессмертными. Доказано, что иммортизирующий фактор рака посредством удлинения теломер за счет теломеразы встречается в 90% всех канцерогенных опухолей in vivo, а в оставшихся 10% используется альтернативный путь поддержания теломер, называемый АЛТ или альтернативное удлинение теломер. [66]
См. также [ править ]
- Жизнь
- Клетка (биология)
- Деление клеток
- ДБТСС
- ген
- регуляция генов
- экспрессия генов
- Эпигенетика
- Геном
- Генная регуляция
- Длинная некодирующая РНК
- Миссенс-мРНК
- Сплайсинг – процесс удаления интронов из информационной РНК-предшественника ( пре-мРНК ) для создания информационной РНК ( мРНК ).
- Транскриптомика
- Перевод (биология)
Ссылки [ править ]
- ^ Кунин Е.В., Горбаленя А.Е., Чумаков К.М. (июль 1989 г.). «Предварительная идентификация РНК-зависимых РНК-полимераз дцРНК-вирусов и их связь с РНК-полимеразами положительной цепи» . Письма ФЭБС . 252 (1–2): 42–6. Бибкод : 1989FEBSL.252...42K . дои : 10.1016/0014-5793(89)80886-5 . ПМИД 2759231 . S2CID 36482110 .
- ↑ Перейти обратно: Перейти обратно: а б Эльдра П. Соломон, Линда Р. Берг, Диана В. Мартин. Биология, 8-е издание, международное студенческое издание . Томсон Брукс/Коул. ISBN 978-0495317142
- ↑ Перейти обратно: Перейти обратно: а б Кларк, Дэвид П. (24 июня 2005 г.). Молекулярная биология . Эльзевир . п. 134. ИСБН 978-0-08-045421-4 .
- ^ «Нити ДНК» . www.sci.sdsu.edu . Архивировано из оригинала 27 октября 2017 года . Проверено 1 мая 2018 г.
- ^ Берг Дж., Тимочко Дж.Л., Страйер Л. (2006). Биохимия (6-е изд.). Сан-Франциско: WH Freeman. ISBN 0-7167-8724-5 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Уотсон Дж.Д., Бейкер Т.А., Белл С.П., Ганн А.А., Левин М., Лосик Р.М. (2013). Молекулярная биология гена (7-е изд.). Пирсон. ISBN 978-0-321-76243-6 . OCLC 0321762436 .
- ^ Хаберле В., Старк А. (октябрь 2018 г.). «Коровые промоторы эукариот и функциональная основа инициации транскрипции» . Nat Rev Mol Cell Biol . 19 (10): 621–637. дои : 10.1038/s41580-018-0028-8 . ПМК 6205604 . ПМИД 29946135 .
- ^ Верхёль Т.С., ван Хейфте Л., Перенталер Э., Баракат Т.С. (2020). «Почему YY1: механизмы регуляции транскрипции Инь Ян 1» . Front Cell Dev Biol . 8 : 592164. дои : 10.3389/fcell.2020.592164 . ПМЦ 7554316 . ПМИД 33102493 .
- ^ Шпиц Ф, Ферлонг Э.Э. (сентябрь 2012 г.). «Факторы транскрипции: от связывания энхансера к контролю развития». Нат преподобный Жене . 13 (9): 613–26. дои : 10.1038/nrg3207 . ПМИД 22868264 . S2CID 205485256 .
- ↑ Перейти обратно: Перейти обратно: а б Биган Дж.А., Пастузин Э.Д., Фернандес Л.Р., Го М.Х., Фэн К., Титус КР, Чандрашекар Х., Шеперд Дж.Д., Филлипс-Креминс Дж.Э. (июнь 2020 г.). «Трехмерная реструктуризация генома во временных рамках экспрессии генов нейронов, индуцированной активностью» . Нат Нейроски . 23 (6): 707–717. дои : 10.1038/s41593-020-0634-6 . ПМЦ 7558717 . ПМИД 32451484 .
- ↑ Перейти обратно: Перейти обратно: а б Шенфельдер С., Фрейзер П. (август 2019 г.). «Дальние контакты энхансер-промотор в контроле экспрессии генов». Нат преподобный Жене . 20 (8): 437–455. дои : 10.1038/s41576-019-0128-0 . ПМИД 31086298 . S2CID 152283312 .
- ^ Пеннаккио Л.А., Бикмор В., Дин А., Нобрега М.А., Беджерано Дж. (апрель 2013 г.). «Усилители: пять основных вопросов» . Нат преподобный Жене . 14 (4): 288–95. дои : 10.1038/nrg3458 . ПМЦ 4445073 . ПМИД 23503198 .
- ^ Вайнтрауб А.С., Ли Ч., Замудио А.В., Сигова А.А., Ханнетт Н.М., Дэй Д.С., Абрахам Б.Дж., Коэн М.А., Набет Б., Бакли Д.Л., Го Й.Е., Хниш Д., Джениш Р., Брэднер Дж.Е., Грей Н.С., Янг Р.А. (декабрь 2017 г.) ). «YY1 является структурным регулятором петель энхансер-промотор» . Клетка . 171 (7): 1573–88.e28. дои : 10.1016/j.cell.2017.11.008 . ПМЦ 5785279 . ПМИД 29224777 .
- ^ Ламберт С.А., Йолма А., Кампителли Л.Ф., Дас ПК, Инь Ю, Албу М., Чен Х, Тайпале Дж., Хьюз Т.Р., Вейраух М.Т. (февраль 2018 г.). «Факторы транскрипции человека» . Клетка . 172 (4): 650–665. дои : 10.1016/j.cell.2018.01.029 . ПМИД 29425488 .
- ↑ Перейти обратно: Перейти обратно: а б Гроссман С.Р., Энгрейтц Дж., Рэй Дж.П., Нгуен Т.Х., Хакоэн Н., Ландер Э.С. (июль 2018 г.). «Позиционная специфичность различных классов транскрипционных факторов в энхансерах» . Proc Natl Acad Sci США . 115 (30): E7222–30. Бибкод : 2018PNAS..115E7222G . дои : 10.1073/pnas.1804663115 . ПМК 6065035 . ПМИД 29987030 .
- ^ Аллен Б.Л., Taatjes DJ (март 2015 г.). «Медиаторный комплекс: центральный интегратор транскрипции» . Nat Rev Mol Cell Biol . 16 (3): 155–66. дои : 10.1038/nrm3951 . ПМЦ 4963239 . ПМИД 25693131 .
- ^ Михайличенко О., Бондаренко В., Харнетт Д., Шор И.Е., Малес М., Виалес Р.Р., Ферлонг Э.Э. (январь 2018 г.). «Степень активности энхансера или промотора отражается уровнями и направленностью транскрипции эРНК» . Генс Дев . 32 (1): 42–57. дои : 10.1101/gad.308619.117 . ПМЦ 5828394 . ПМИД 29378788 .
- ^ Ли QJ, Ян Ш., Маэда Ю., Сладек Ф.М., Шаррокс А.Д., Мартинс-Грин М. (январь 2003 г.). «Зависимая от фосфорилирования MAP-киназы активация Elk-1 приводит к активации коактиватора p300» . ЭМБО Дж . 22 (2): 281–91. дои : 10.1093/emboj/cdg028 . ПМК 140103 . ПМИД 12514134 .
- ^ Карулло Н.В., Филлипс И.РА., Саймон Р.К., Сото С.А., Хиндс Дж.Э., Солсбери А.Дж., Реванна Дж.С., Баннер К.Д., Янов Л., Султан Ф.А., Савелл К.Е., Герсбах Калифорния, Дэй Дж.Дж. (сентябрь 2020 г.). «Энхансерные РНК предсказывают регуляторные связи между энхансером и геном и имеют решающее значение для функции энхансера в нейрональных системах» . Нуклеиновые кислоты Рез . 48 (17): 9550–70. дои : 10.1093/nar/gkaa671 . ПМЦ 7515708 . ПМИД 32810208 .
- ^ Левквист С., Додд И.Б., Снеппен К., Хаертер Дж.О. (июнь 2016 г.). «Метилирование ДНК в эпигеномах человека зависит от локальной топологии сайтов CpG» . Нуклеиновые кислоты Рез . 44 (11): 5123–32. дои : 10.1093/нар/gkw124 . ПМЦ 4914085 . ПМИД 26932361 .
- ^ Джаббари К., Бернарди Дж. (май 2004 г.). «Метилирование цитозина и частоты CpG, TpG (CpA) и TpA». Джин . 333 : 143–9. дои : 10.1016/j.gene.2004.02.043 . ПМИД 15177689 .
- ^ Штайнхаус Р., Гонсалес Т., Зелов Д., Робинсон П.Н. (июнь 2020 г.). «Первазивные и CpG-зависимые промотороподобные характеристики транскрибируемых энхансеров» . Нуклеиновые кислоты Рез . 48 (10): 5306–17. дои : 10.1093/nar/gkaa223 . ПМЦ 7261191 . ПМИД 32338759 .
- ^ Птица А (январь 2002 г.). «Схемы метилирования ДНК и эпигенетическая память» . Генс Дев . 16 (1): 6–21. дои : 10.1101/gad.947102 . ПМИД 11782440 .
- ↑ Перейти обратно: Перейти обратно: а б с Ду Кью, Луу П.Л., Стирзакер С., Кларк С.Дж. (2015). «Белки метил-CpG-связывающего домена: читатели эпигенома» . Эпигеномика . 7 (6): 1051–73. дои : 10.2217/эпи.15.39 . ПМИД 25927341 .
- ^ Вакерисас Дж.М., Куммерфельд С.К., Тейхманн С.А., Ласкомб Н.М. (апрель 2009 г.). «Перепись факторов транскрипции человека: функции, экспрессия и эволюция». Нат. Преподобный Жене . 10 (4): 252–63. дои : 10.1038/nrg2538 . ПМИД 19274049 . S2CID 3207586 .
- ↑ Перейти обратно: Перейти обратно: а б с д Сунь З, Сюй Х, Хэ Дж, Мюррей А, Сунь М.А., Вэй Икс, Ван Икс, Маккойг Е, Се Е, Цзян Икс, Ли Л, Чжу Дж, Чен Дж, Морозов А, Пикрелл А.М., Теус М.Х., Се Х (август 2019 г.). «EGR1 привлекает TET1 для формирования метилома мозга во время развития и при активности нейронов» . Нат Коммун . 10 (1): 3892. Бибкод : 2019NatCo..10.3892S . дои : 10.1038/s41467-019-11905-3 . ПМЦ 6715719 . ПМИД 31467272 .
- ↑ Перейти обратно: Перейти обратно: а б Кубосаки А, Томару Ю, Тагами М, Арнер Э, Миура Х, Сузуки Т, Сузуки М, Сузуки Х, Хаяшизаки Ю (2009). «Полногеномное исследование сайтов связывания EGR-1 in vivo при моноцитарной дифференцировке» . Геном Биол . 10 (4): Р41. дои : 10.1186/gb-2009-10-4-r41 . ПМЦ 2688932 . ПМИД 19374776 .
- ^ Байрактар Г., Кройц М.Р. (апрель 2018 г.). «Нейрональные ДНК-метилтрансферазы: эпигенетические медиаторы между синаптической активностью и экспрессией генов?» . Нейробиолог . 24 (2): 171–185. дои : 10.1177/1073858417707457 . ПМЦ 5846851 . ПМИД 28513272 .
- ^ Оливейра А.М., Хемстедт Т.Дж., Бадинг Х. (июль 2012 г.). «Спасение связанного со старением снижения экспрессии Dnmt3a2 восстанавливает когнитивные способности». Нат Нейроски . 15 (8): 1111–3. дои : 10.1038/nn.3151 . ПМИД 22751036 . S2CID 10590208 .
- ^ Дхайалан А., Раджавелу А., Ратер П., Тамаш Р., Юрковска Р.З., Рагозин С., Елч А. (август 2010 г.). «Домен Dnmt3a PWWP считывает триметилирование гистона 3 лизина 36 и управляет метилированием ДНК» . J Биол Хим . 285 (34): 26114–20. дои : 10.1074/jbc.M109.089433 . ПМК 2924014 . ПМИД 20547484 .
- ^ Манзо М., Вирц Дж., Амбрози С., Вилласеньор Р., Рошицкий Б., Баубек Т. (декабрь 2017 г.). «Изоформ-специфическая локализация DNMT3A регулирует точность метилирования ДНК на двухвалентных CpG-островках» . ЭМБО Дж . 36 (23): 3421–34. дои : 10.15252/embj.201797038 . ПМЦ 5709737 . ПМИД 29074627 .
- ^ Дукац М., Хольцер К., Чудалакис М., Эмперле М., Лунгу С., Баштрыков П., Елч А. (декабрь 2019 г.). «Связывание H3K36me2/3 и связывание ДНК домена PWWP ДНК-метилтрансферазы DNMT3A способствуют его взаимодействию с хроматином». Дж Мол Биол . 431 (24): 5063–74. дои : 10.1016/j.jmb.2019.09.006 . ПМИД 31634469 . S2CID 204832601 .
- ^ Байрактар Г., Юаньсян П., Конфеттура А.Д., Гомес Г.М., Раза С.А., Сторк О., Тадзима С., Суэтаке И., Карпова А., Йылдирим Ф., Кройц М.Р. (ноябрь 2020 г.). «Синаптический контроль метилирования ДНК включает зависимую от активности деградацию DNMT3A1 в ядре» . Нейропсихофармакология . 45 (12): 2120–30. дои : 10.1038/s41386-020-0780-2 . ПМК 7547096 . ПМИД 32726795 .
- ↑ Перейти обратно: Перейти обратно: а б Пакай, Джулиан; Дуивенворден, Хендрика; Шафи, Томас; Кларк, Кейтлин (2023). Пороговые концепции в биохимии . Электронное бюро La Trobe. дои : 10.26826/1017 . ISBN 978-0-6484681-9-6 . S2CID 258899183 .
- ^ Бутар, Магали (2016). «Глобальное изменение положения мест начала транскрипции у бактерии, ферментирующей растения» . Природные коммуникации . 7 : 13783. Бибкод : 2016NatCo...713783B . дои : 10.1038/ncomms13783 . ПМК 5171806 . ПМИД 27982035 .
- ^ Редер, Роберт Г. (1991). «Сложности инициации транскрипции эукариот: регуляция сборки преинициативного комплекса». Тенденции биохимических наук . 16 (11): 402–8. дои : 10.1016/0968-0004(91)90164-Q . ПМИД 1776168 .
- ^ Goldman SR, Ebright RH , Nickels BE (май 2009 г.). «Прямое обнаружение абортивных транскриптов РНК in vivo» . Наука . 324 (5929): 927–8. Бибкод : 2009Sci...324..927G . дои : 10.1126/science.1169237 . ПМЦ 2718712 . ПМИД 19443781 .
- ^ Ревякин А., Лю С., Эбрайт Р.Х., Стрик Т.Р. (ноябрь 2006 г.). «Абортивная и продуктивная инициация с помощью РНК-полимеразы включает в себя сжатие ДНК» . Наука . 314 (5802): 1139–43. Бибкод : 2006Sci...314.1139R . дои : 10.1126/science.1131398 . ПМЦ 2754787 . ПМИД 17110577 .
- ^ Рафаэль М., Канин Э.И., Фогт Дж., Берджесс Р.Р., Ансари А.З. (ноябрь 2005 г.). «Голоферментное переключение и стохастическое высвобождение сигма-факторов из РНК-полимеразы in vivo» . Молекулярная клетка . 20 (3): 357–66. doi : 10.1016/j.molcel.2005.10.011 . ПМИД 16285918 .
- ^ Мандал СС, Чу С., Вада Т., Ханда Х., Шаткин А.Дж., Рейнберг Д. (май 2004 г.). «Функциональные взаимодействия РНК-кэпирующего фермента с факторами, которые положительно и отрицательно регулируют выход промотора с помощью РНК-полимеразы II» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (20): 7572–7. Бибкод : 2004PNAS..101.7572M . дои : 10.1073/pnas.0401493101 . ПМК 419647 . ПМИД 15136722 .
- ^ Гудрич Дж. А., Цзян Р. (апрель 1994 г.). «Факторы транскрипции IIE и IIH и гидролиз АТФ направляют клиренс промотора с помощью РНК-полимеразы II». Клетка . 77 (1): 145–56. дои : 10.1016/0092-8674(94)90242-9 . ПМИД 8156590 . S2CID 24602504 .
- ^ Майло, Рон; Филипс, Роб (2015). «4. Скорость и продолжительность: Центральная догма: что быстрее: транскрипция или трансляция?». Клеточная биология в цифрах . ЦРК Пресс. стр. 231–6. ISBN 978-1-317-23069-4 . OCLC 1105558425 .
- ^ Ходжес С., Бинту Л., Лубковска Л., Кашлев М., Бустаманте С. (июль 2009 г.). «Нуклеосомные флуктуации управляют динамикой транскрипции РНК-полимеразы II» . Наука . 325 (5940): 626–8. Бибкод : 2009Sci...325..626H . дои : 10.1126/science.1172926 . ПМЦ 2775800 . ПМИД 19644123 .
- ↑ Перейти обратно: Перейти обратно: а б Фитц В., Шин Дж., Эрлих С., Фарнунг Л., Крамер П., Забурдаев В., Grill SW (2016). «Нуклеосомное расположение влияет на динамику транскрипции одиночных молекул» . Труды Национальной академии наук . 113 (45): 12733–12738. Бибкод : 2016PNAS..11312733F . дои : 10.1073/pnas.1602764113 . ПМК 5111697 . ПМИД 27791062 .
- ^ Эймард Ф., Бюглер Б., Шмидт К.К., Гийу Э., Карон П., Бриуа С., Яковони Дж.С., Дабюрон В., Миллер К.М., Джексон С.П., Легубе Дж. (апрель 2014 г.). «Транскрипционно активный хроматин рекрутирует гомологичную рекомбинацию при двухцепочечных разрывах ДНК» . Nat Struct Мол Биол . 21 (4): 366–74. дои : 10.1038/nsmb.2796 . ПМК 4300393 . ПМИД 24658350 .
- ^ Оуян Дж., Ядав Т., Чжан Дж.М., Ян Х., Рейнбей Э., Го Х., Хабер Д.А., Лан Л., Цзоу Л. (июнь 2021 г.). «Транскрипты РНК стимулируют гомологичную рекомбинацию, образуя DR-петли» . Природа . 594 (7862): 283–8. Бибкод : 2021Natur.594..283O . дои : 10.1038/s41586-021-03538-8 . ПМЦ 8855348 . ПМИД 33981036 .
- ^ Гарсиа-Рубио М., Уэртас П., Гонсалес-Баррера С., Агилера А. (октябрь 2003 г.). «Рекомбиногенные эффекты агентов, повреждающих ДНК, синергически усиливаются за счет транскрипции у Saccharomyces cerevisiae. Новый взгляд на рекомбинацию, связанную с транскрипцией» . Генетика . 165 (2): 457–66. дои : 10.1093/генетика/165.2.457 . ПМЦ 1462770 . ПМИД 14573461 .
- ^ Ричардсон Дж. П. (сентябрь 2002 г.). «Rho-зависимое терминирование и АТФазы в терминации транскрипта». Biochimica et Biophysical Acta (BBA) – Структура и экспрессия генов . 1577 (2): 251–260. дои : 10.1016/S0167-4781(02)00456-6 . ПМИД 12213656 .
- ^ Ликке-Андерсен С., Йенсен Т.Х. (октябрь 2007 г.). «Перекрывающиеся пути диктуют прекращение транскрипции РНК-полимеразы II». Биохимия . 89 (10): 1177–82. дои : 10.1016/j.biochi.2007.05.007 . ПМИД 17629387 .
- ^ Ши, Дж; Вэнь, А; Чжао, М; Джин, С; Ты, Л; Ши, Ю; Донг, С; Хуа, Х; Чжан, Ю; Фэн, Ю. (18 ноября 2020 г.). «Структурные основы Mfd-зависимой терминации транскрипции» . Исследования нуклеиновых кислот . 48 (20): 11762–11772. дои : 10.1093/nar/gkaa904 . ПМЦ 7672476 . ПМИД 33068413 .
- ^ Цзян, Ю; Лю, М; Спенсер, Калифорния; Прайс, DH (7 мая 2004 г.). «Участие фактора терминации транскрипции 2 в митотической репрессии элонгации транскрипции» . Молекулярная клетка . 14 (3): 375–85. дои : 10.1016/s1097-2765(04)00234-5 . PMID 15125840 .
- ^ Маршалл, CJ; Кайюм, МЗ; Уокер, Дж. Э.; Мураками, Канзас; Сантанджело, TJ (9 августа 2022 г.). «Структура и активность архейного фактора терминации транскрипции Eta подробно описывают уязвимости комплекса элонгации транскрипции» . Труды Национальной академии наук Соединенных Штатов Америки . 119 (32): e2207581119. Бибкод : 2022PNAS..11907581M . дои : 10.1073/pnas.2207581119 . ПМЦ 9371683 . ПМИД 35917344 .
- ^ Крамер, П.; Армаш, К.-Ж.; Баумли, С.; Бенкерт, С.; Брюкнер, Ф.; Бухен, К.; Дасмма, GE; Денгл, С.; Гейгер, СР; Ясиак, Эй Джей; Джаухари, А. (июнь 2008 г.). «Структура эукариотических РНК-полимераз» . Ежегодный обзор биофизики . 37 (1): 337–352. doi : 10.1146/annurev.biophys.37.032807.130008 . ПМИД 18573085 .
- ^ http://www.sigmaaldrich.com/US/en/product/sial/h6878 8-гидроксихинолин от SIGMA-ALDRICH. Получено 15 февраля 2022 г.
- ^ Датан Э, Минн И, Пэн X, Хэ QL, Ан Х, Ю Б, Помпер МГ, Лю Джо (2020). «Конъюгат глюкозы-триптолида избирательно воздействует на раковые клетки в условиях гипоксии» . iScience . 23 (9): 101536. Бибкод : 2020iSci...23j1536D . дои : 10.1016/j.isci.2020.101536 . ПМЦ 7509213 . ПМИД 33083765 .
- ^ Саксонов С., Берг П., Брютлаг Д.Л. (январь 2006 г.). «Полногеномный анализ динуклеотидов CpG в геноме человека позволяет выделить два различных класса промоторов» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (5): 1412–7. Бибкод : 2006PNAS..103.1412S . дои : 10.1073/pnas.0510310103 . ПМЦ 1345710 . ПМИД 16432200 .
- ^ Птица А (январь 2002 г.). «Схемы метилирования ДНК и эпигенетическая память» . Гены и развитие . 16 (1): 6–21. дои : 10.1101/gad.947102 . ПМИД 11782440 .
- ^ Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинцлер К.В. (март 2013 г.). «Пейзажи генома рака» . Наука . 339 (6127): 1546–58. Бибкод : 2013Sci...339.1546V . дои : 10.1126/science.1235122 . ПМК 3749880 . ПМИД 23539594 .
- ^ Тесситоре А, Чиччарелли Г, Дель Веккьо Ф, Гаджано А, Верцелла Д, Фискьетти М, Веккьотти Д, Капече Д, Заззерони Ф, Алессе Э (2014). «МикроРНК в сети повреждения/восстановления ДНК и раке» . Международный журнал геномики . 2014 : 820248. doi : 10.1155/2014/820248 . ПМЦ 3926391 . ПМИД 24616890 .
- ^ Папантонис А, Коро Т, Бабу С, Ларкин Дж. Д., Денг Б, Шорт П, Цуцуми С, Тейлор С, Канки Ю, Кобаяши М, Ли Г, По ХМ, Руан Х, Абуратани Х, Руан Ю, Кодама Т, Вада Ю , Кук PR (ноябрь 2012 г.). «TNFα передает сигналы через специализированные фабрики, где транскрибируются ответственное кодирование и гены микроРНК» . Журнал ЭМБО . 31 (23): 4404–14. CiteSeerX 10.1.1.919.1919 . дои : 10.1038/emboj.2012.288 . ПМЦ 3512387 . ПМИД 23103767 .
- ^ «Химия 2006» . Нобелевский фонд . Архивировано из оригинала 15 марта 2007 года . Проверено 29 марта 2007 г.
- ^ Ву, Т (апрель 2020 г.). «Секвенирование одноцепочечной ДНК с помощью кетоксала фиксирует глобальную динамику транскрипции и активность энхансера in situ» . Природные методы . 17 (5): 515–523. дои : 10.1038/s41592-020-0797-9 . ПМК 7205578 . ПМИД 32251394 . S2CID 214810294 .
- ^ Радж А., ван Ауденарден А (октябрь 2008 г.). «Природа, воспитание или случайность: стохастическая экспрессия генов и ее последствия» . Клетка . 135 (2): 216–26. дои : 10.1016/j.cell.2008.09.050 . ПМК 3118044 . ПМИД 18957198 .
- ^ Кларк, Дэвид П. (24 июня 2005 г.). Молекулярная биология . Эльзевир. п. 63. ИСБН 978-0-08-045421-4 .
- ^ Колесникова И.Н. (2000). «Некоторые закономерности механизма апоптоза при ВИЧ-инфекции» . Диссертация . Архивировано из оригинала 10 июля 2011 года . Проверено 20 февраля 2011 г.
- ^ Чезаре А.Дж., Реддел Р.Р. (май 2010 г.). «Альтернативное удлинение теломер: модели, механизмы и последствия». Обзоры природы Генетика . 11 (5): 319–30. дои : 10.1038/nrg2763 . ПМИД 20351727 . S2CID 19224032 .
Внешние ссылки [ править ]
- Интерактивное Java-моделирование инициации транскрипции. Архивировано 22 июля 2011 г. в Wayback Machine из Центра моделей жизни . Архивировано 9 августа 2011 г. в Wayback Machine Института Нильса Бора.
- Интерактивное Java-моделирование интерференции транскрипции — игра доминирования промотора в бактериальном вирусе. Архивировано 26 августа 2011 г. в Wayback Machine из Центра моделей жизни . Архивировано 9 августа 2011 г. в Wayback Machine в Институте Нильса Бора.
- Коллекция виртуальной клеточной анимации, представляющая транскрипцию. Архивировано 14 апреля 2021 г. в Wayback Machine.