Искусственная клетка
Искусственная клетка , синтетическая клетка или минимальная клетка — это искусственно созданная частица, которая имитирует одну или несколько функций биологической клетки . Зачастую искусственные клетки представляют собой биологические или полимерные мембраны, содержащие биологически активные материалы. [1] Таким образом, липосомы , полимерсомы , наночастицы , микрокапсулы и ряд других частиц могут квалифицироваться как искусственные клетки.
Термины «искусственная клетка» и «синтетическая клетка» используются в самых разных областях и могут иметь разные значения, что также отражено в разных разделах этой статьи. Некоторые более строгие определения основаны на предположении, что термин «клетка» напрямую относится к биологическим клеткам и что эти структуры, следовательно, должны быть живыми (или частью живого организма) и, кроме того, что термин «искусственный» подразумевает, что эти структуры искусственно строятся снизу вверх, т.е. из базовых компонентов. Таким образом, в области синтетической биологии искусственную клетку можно понимать как полностью синтетически созданную клетку, которая может захватывать энергию , поддерживать ионные градиенты , содержать макромолекулы , а также хранить информацию и иметь способность к репликации . [2] Такого рода искусственная клетка еще не создана.
Однако в других случаях термин «искусственный» не подразумевает, что вся структура создана человеком, а вместо этого может относиться к идее о том, что определенные функции или структуры биологических клеток могут быть изменены, упрощены, заменены или дополнены с помощью синтетическая сущность.
В других областях термин «искусственная клетка» может относиться к любому компартменту, который чем-то напоминает биологическую клетку по размеру или структуре, но создан синтетически или даже полностью изготовлен из небиологических компонентов. Термин «искусственная клетка» также используется для структур прямого применения, таких как отсеки для доставки лекарств. Микроинкапсуляция обеспечивает метаболизм внутри мембраны, обмен малых молекул и предотвращение прохождения через нее крупных веществ. [3] [4] К основным преимуществам инкапсуляции относятся улучшение мимикрии в организме, повышение растворимости груза и снижение иммунных реакций . Примечательно, что искусственные клетки оказались клинически успешными при гемоперфузии . [5]
| Часть серии статей о |
| Синтетическая биология |
|---|
| Синтетические биологические схемы |
| Редактирование генома |
| Искусственные клетки |
| Ксенобиология |
| Другие темы |
Восходящая инженерия живых искусственных клеток
[ редактировать ]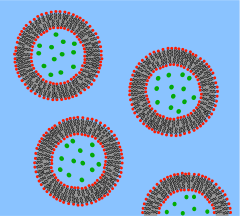
Немецкий патолог Рудольф Вирхов выдвинул идею, что жизнь не только возникает из клеток, но и каждая клетка происходит из другой клетки; « Все клетки и клетки ». [6] До сих пор большинство попыток создать искусственную клетку сводились только к созданию пакета, который может имитировать определенные задачи клетки. Достижения в области бесклеточных реакций транскрипции и трансляции позволяют экспрессировать многие гены , но эти усилия далеки от создания полностью работоспособной клетки.
Восходящий подход к созданию искусственной клетки предполагает создание протоклетки de novo , полностью из неживых материалов. Как следует из термина «клетка», одной из предпосылок является создание своего рода компартмента, который определяет индивидуальную клеточную единицу. Фосфолипидные мембраны являются очевидным выбором в качестве разделительных границ. [7] поскольку они действуют как селективные барьеры во всех живых биологических клетках. размером с клетку Ученые могут инкапсулировать биомолекулы в фосфолипидные везикулы и таким образом наблюдать, как эти молекулы действуют так же, как и в биологических клетках, и тем самым воссоздают определенные клеточные функции. [8] Подобным же образом функциональные биологические строительные блоки могут быть инкапсулированы в эти липидные компартменты для достижения синтеза (пусть и рудиментарных) искусственных клеток.
Предлагается создать фосфолипидный двухслойный везикулу с ДНК, способной к самовоспроизведению, используя синтетическую генетическую информацию. Тремя основными элементами таких искусственных клеток являются образование липидной мембраны , репликация ДНК и РНК посредством матричного процесса и сбор химической энергии для активного транспорта через мембрану. [9] [10] Основными препятствиями, которые предвидятся и с которыми приходится сталкиваться при создании этой предложенной протоклетки, являются создание минимальной синтетической ДНК, содержащей всю достаточную для жизни информацию, а также воспроизводство негенетических компонентов, которые являются неотъемлемой частью клеточного развития, таких как молекулярная самоорганизация. [11] Однако есть надежда, что такой подход «снизу вверх» позволит лучше понять фундаментальные вопросы организации на клеточном уровне и происхождения биологической жизни. До сих пор не была синтезирована ни одна полностью искусственная клетка, способная к самовоспроизведению с использованием молекул жизни, и эта цель все еще находится в отдаленном будущем, хотя различные группы в настоящее время работают над достижением этой цели. [12]
Другой метод, предложенный для создания протоклетки, более близко напоминает условия, которые , как полагают, присутствовали во время эволюции, известные как «первичный суп». Различные полимеры РНК можно было бы инкапсулировать в везикулы, и при таких малых граничных условиях можно было бы проверять химические реакции. [13]
Этика и споры
[ редактировать ]Исследования протоклеток вызвали разногласия и противоположные мнения, включая критику расплывчатого определения «искусственной жизни». [14] Создание базовой единицы жизни является наиболее насущной этической проблемой. [15] Наибольшее беспокойство по поводу протоклеток вызывает их потенциальная угроза здоровью человека и окружающей среде из-за неконтролируемой репликации. Однако искусственные клетки, созданные методом «сверху вниз», или любые другие манипулируемые формы существующих живых клеток, с гораздо большей вероятностью смогут существовать и размножаться за пределами лаборатории и, следовательно, представлять подобную угрозу.
Международное исследовательское сообщество
[ редактировать ]В середине 2010-х годов исследовательское сообщество начало осознавать необходимость унификации области исследований синтетических клеток, признавая, что задача создания целого живого организма из неживых компонентов выходит за рамки ресурсов одной страны. [16]
по созданию синтетических живых клеток, финансируемое NSF . Build-a-Cell В 2017 году было начато международное крупномасштабное исследовательское сотрудничество [17] Build-a-Cell провела девять междисциплинарных семинаров, открытых для всех заинтересованных, для обсуждения и определения будущего сообщества синтетических клеток. За инициативой Build-a-Cell последовали национальные организации по производству синтетических клеток в ряде других стран. В число этих национальных организаций входят FabriCell, [18] МаксСинБио [19] и БаСиК. [20] Европейские усилия по производству синтетических клеток были объединены в 2019 году в инициативу SynCellEU. [21]
Нисходящий подход к созданию минимальной живой клетки
[ редактировать ]Члены Института Дж. Крейга Вентера использовали нисходящий вычислительный подход, чтобы «выбить» гены в живом организме до минимального набора генов. [22] В 2010 году команде удалось создать реплицирующийся штамм (названный Mycoplasma Laboratorium ) Mycoplasma mycoides с использованием синтетически созданной ДНК, которая считается минимальным требованием для жизни и была вставлена в геномно пустую бактерию. [22] Есть надежда, что процесс нисходящего биосинтеза позволит внедрить новые гены, которые будут выполнять полезные функции, такие как выработка водорода в качестве топлива или улавливание избытка углекислого газа в атмосфере. [15] Множество регуляторных, метаболических и сигнальных сетей полностью не охарактеризованы. Эти нисходящие подходы имеют ограничения для понимания фундаментальной молекулярной регуляции, поскольку организмы-хозяева имеют сложный и не полностью определенный молекулярный состав. [23] В 2019 году была опубликована полная вычислительная модель всех путей в клетке Mycoplasma Syn3.0, представляющая собой первую полную модель in silico для живого минимального организма. [24]
Крупные инвестиции в биологию вложили такие крупные компании, как ExxonMobil , которая сотрудничает с Synthetic Genomics Inc ; Собственная биосинтетическая компания Крейга Вентера занимается разработкой топлива из водорослей. [25]
По состоянию на 2016 год Mycoplasmagentium является единственным организмом, используемым в качестве отправной точки для создания минимальной клетки, поскольку он имеет наименьший известный геном, который можно культивировать в лабораторных условиях; сорт дикого типа имеет 482, и удаление ровно 100 генов, считающихся несущественными, привело к созданию жизнеспособного штамма с улучшенными темпами роста. с уменьшенным геномом Escherichia coli считается более полезной, и были разработаны жизнеспособные штаммы с удаленным 15% генома. [26] : 29–30
Была создана разновидность искусственной клетки, в которой полностью синтетический геном был введен в опустошенные клетки-хозяева. [22] Хоть и не полностью искусственная, поскольку цитоплазматические компоненты , а также мембрана клетки-хозяина сохраняются, сконструированная клетка находится под контролем синтетического генома и способна к репликации .
Искусственные клетки для медицинского применения
[ редактировать ]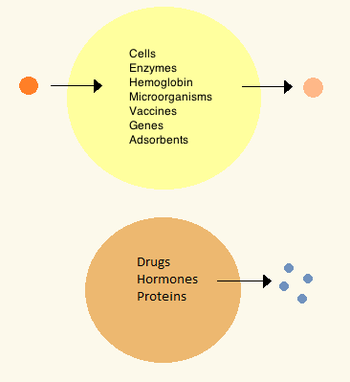
История
[ редактировать ]В 1960-х годах Томас Чанг разработал микрокапсулы, которые он позже назовет «искусственными клетками», поскольку они представляли собой отсеки размером с клетку, сделанные из искусственных материалов. [27] Эти клетки состояли из ультратонких мембран из нейлона, коллодия или сшитого белка, полупроницаемые свойства которых позволяли диффузию небольших молекул внутрь клетки и из нее. Эти клетки имели микронный размер и содержали клетки , ферменты , гемоглобин , магнитные материалы, адсорбенты и белки . [3]
Позже размеры искусственных клеток варьировались от сотен микрометров до нанометров и могли нести микроорганизмы, вакцины , гены , лекарства, гормоны и пептиды . [3] Первое клиническое применение искусственных клеток произошло при гемоперфузии путем инкапсуляции активированного угля . [28]
В 1970-х годах исследователи смогли ввести ферменты, белки и гормоны в биоразлагаемые микрокапсулы, что позже привело к клиническому использованию при таких заболеваниях, как синдром Леша-Нихана . [29] Хотя первоначальные исследования Чанга были сосредоточены на искусственных эритроцитах , только в середине 1990-х годов были разработаны биоразлагаемые искусственные эритроциты. [30] Искусственные клетки в биологической клеточной инкапсуляции впервые были использованы в клинике в 1994 году для лечения пациента с диабетом. [31] и с тех пор другие типы клеток, такие как гепатоциты , взрослые стволовые клетки и генно-инженерные клетки, были инкапсулированы и изучаются для использования в регенерации тканей. [32] [33]
Материалы
[ редактировать ]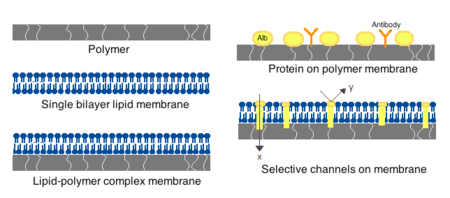
Мембраны для искусственных клеток могут быть изготовлены из простых полимеров , сшитых белков, липидных мембран или полимер-липидных комплексов. Кроме того, можно сконструировать мембраны для представления поверхностных белков, таких как альбумин , антигены , носители Na/K-АТФазы , или пор, таких как ионные каналы . Обычно используемые материалы для производства мембран включают гидрогелевые полимеры, такие как альгинат , целлюлоза и термопластичные полимеры, такие как гидроксиэтилметакрилат-метилметакрилат (ГЕМА-ММА), полиакрилонитрил-поливинилхлорид (ПАН-ПВХ), а также варианты вышеуказанных материалов. упомянул. [4] Используемый материал определяет проницаемость клеточной мембраны, которая для полимера зависит от того, насколько важна адекватная диффузия питательных веществ, отходов и других важных молекул. Гидрофильные полимеры обладают потенциалом биосовместимости и могут быть изготовлены в различных формах, включая полимерные мицеллы , золь-гель смеси, физические смеси, а также сшитые частицы и наночастицы. [4] Особый интерес представляют чувствительные к раздражителям полимеры, которые реагируют на изменения pH или температуры для использования в адресной доставке. Эти полимеры можно вводить в жидкой форме посредством макроскопической инъекции и затвердевать или превращаться в гель in situ из-за разницы в pH или температуре. Препараты наночастиц и липосом также обычно используются для инкапсуляции и доставки материалов. Основным преимуществом липосом является их способность сливаться с мембранами клеток и органелл .
Подготовка
[ редактировать ]Было разработано множество вариантов приготовления и инкапсуляции искусственных клеток. Обычно везикулы, такие как наночастицы , полимерсомы или липосомы синтезируются . Эмульсию обычно получают с использованием оборудования высокого давления, такого как гомогенизатор высокого давления или микрофлюидизатор . Ниже также описаны два метода микрокапсулирования нитроцеллюлозы.
Гомогенизация под высоким давлением
[ редактировать ]В гомогенизаторе высокого давления две жидкости в суспензии масло/жидкость проталкиваются через небольшое отверстие под очень высоким давлением. Этот процесс разделяет продукты и позволяет создавать чрезвычайно мелкие частицы размером всего 1 нм.
Микрофлюидизация
[ редактировать ]В этом методе используется запатентованный микрофлюидизатор для получения большего количества гомогенных суспензий, которые могут создавать частицы меньшего размера, чем гомогенизаторы. Гомогенизатор сначала используется для создания грубой суспензии, которую затем закачивают в микрофлюидизатор под высоким давлением. Затем поток разделяется на два потока, которые вступают в реакцию с очень высокими скоростями в камере взаимодействия до тех пор, пока не будет получен желаемый размер частиц. [34] Этот метод позволяет крупномасштабное производство фосфолипидных липосом и последующее наноинкапсулирование материалов.
Метод сброса
[ редактировать ]В этом методе раствор клеток по каплям добавляют в коллодиевый раствор нитрата целлюлозы. Когда капля проходит через коллодий, она покрывается мембраной благодаря свойствам межфазной полимеризации коллодия. Позже клетка оседает в парафин, где закрепляется мембрана, которую затем суспендируют с помощью солевого раствора. Капельный метод используется для создания крупных искусственных клеток, инкапсулирующих биологические клетки, стволовые клетки и генно-инженерные стволовые клетки.
Эмульсионный метод
[ редактировать ]Эмульсионный . метод отличается тем, что инкапсулируемый материал обычно меньшего размера и помещается на дно реакционной камеры, куда сверху добавляется коллодий и центрифугируется или перемешивается иным образом для создания эмульсии Инкапсулированный материал затем диспергируют и суспендируют в солевом растворе.
Клиническая значимость
[ редактировать ]Выпуск и доставка лекарств
[ редактировать ]Искусственные клетки, используемые для доставки лекарств, отличаются от других искусственных клеток, поскольку их содержимое предназначено для диффундирования из мембраны или для поглощения и переваривания клеткой-мишенью-хозяином. Часто используются субмикронные искусственные клетки с липидными мембранами, которые можно называть нанокапсулами, наночастицами, полимерсомами или другими вариациями этого термина. [35]
Была разработана термочувствительная система, позволяющая использовать термометры РНК для контроля времени и места высвобождения груза из искусственных клеток. [36] Это достигается за счет того, что искусственные клетки экспрессируют порообразующий белок — альфа-гемолизин — под контролем РНК-термометра, что позволяет связать высвобождение груза с изменениями температуры. [36]
Ферментная терапия
[ редактировать ]Ферментативная терапия активно изучается при генетических метаболических заболеваниях, при которых фермент чрезмерно или недостаточно экспрессируется, дефектен или вообще отсутствует. В случае недостаточной экспрессии или экспрессии дефектного фермента в организм вводится активная форма фермента для компенсации дефицита. С другой стороны, сверхэкспрессии ферментов можно противодействовать введением конкурирующего нефункционального фермента; то есть фермент, который превращает субстрат в неактивные продукты. Помещенные в искусственную клетку ферменты могут выполнять свою функцию в течение гораздо более длительного периода по сравнению со свободными ферментами. [3] и может быть дополнительно оптимизирован путем конъюгации полимера. [37]
Первым ферментом, изученным при инкапсуляции искусственных клеток, была аспарагиназа для лечения лимфосаркомы у мышей. Такое лечение задержало появление и рост опухоли . [38] Эти первоначальные результаты привели к дальнейшим исследованиям использования искусственных клеток для доставки ферментов при тирозин- зависимых меланомах . [39] Рост этих опухолей в большей степени зависит от тирозина , чем нормальных клеток, и исследования показали, что снижение системного уровня тирозина у мышей может ингибировать рост меланомы. [40] Использование искусственных клеток для доставки тирозиназы ; и фермент, который переваривает тирозин, обеспечивает лучшую стабильность фермента и эффективен при удалении тирозина без серьезных побочных эффектов, связанных с недостатком тирозина в рационе. [41]
Ферментная терапия искусственными клетками также представляет интерес для активации пролекарств, таких как ифосфамид, при некоторых видах рака. Искусственные клетки, инкапсулирующие фермент цитохрома p450 , который превращает это пролекарство в активное лекарство, можно адаптировать для накопления в карциноме поджелудочной железы или имплантировать искусственные клетки близко к месту опухоли. Здесь локальная концентрация активированного ифосфамида будет намного выше, чем в остальной части организма, что предотвращает системную токсичность . [42] Лечение было успешным у животных [43] и продемонстрировали удвоение медианы выживаемости среди пациентов с поздней стадией рака поджелудочной железы в клинических исследованиях фазы I/II и утроение годовой выживаемости. [42]
Генная терапия
[ редактировать ]При лечении генетических заболеваний генной терапии целью является вставка, изменение или удаление генов в клетках больного человека. Технология в значительной степени опирается на вирусные векторы , что вызывает опасения по поводу инсерционного мутагенеза и системного иммунного ответа , которые привели к гибели людей. [44] [45] и развитие лейкемии [46] [47] в клинических испытаниях. Обход необходимости в векторах путем использования голой или плазмидной ДНК в качестве собственной системы доставки также сталкивается с такими проблемами, как низкая эффективность трансдукции и плохое нацеливание на ткани при системном введении. [4]
Искусственные клетки были предложены в качестве невирусного вектора, с помощью которого генетически модифицированные неаутологичные клетки инкапсулируются и имплантируются для доставки рекомбинантных белков in vivo . [48] Эффективность этого типа иммуноизоляции была доказана на мышах благодаря доставке искусственных клеток, содержащих мышиный гормон роста , которые предотвратили задержку роста у мутантных мышей. [49] Несколько стратегий прошли клинические испытания на людях для лечения рака поджелудочной железы , бокового склероза и контроля боли. [4]
Гемоперфузия
[ редактировать ]Первое клиническое применение искусственных клеток произошло при гемоперфузии путем инкапсуляции активированного угля . [28] Активированный уголь обладает способностью адсорбировать многие крупные молекулы и уже давно известен своей способностью удалять токсичные вещества из крови при случайном отравлении или передозировке. Однако перфузия путем прямого введения угля токсична, поскольку приводит к эмболии и повреждению клеток крови с последующим удалением тромбоцитов. [50] Искусственные клетки позволяют токсинам диффундировать в клетку, сохраняя при этом опасный груз внутри своей ультратонкой мембраны. [28]
Искусственная клеточная гемоперфузия была предложена как менее затратный и более эффективный вариант детоксикации, чем гемодиализ . [3] при котором фильтрация крови происходит только за счет разделения размеров физической мембраной. При гемоперфузии тысячи адсорбирующих искусственных клеток удерживаются внутри небольшого контейнера за счет использования двух экранов на обоих концах, через которые перфузируется кровь пациента . По мере циркуляции крови токсины или лекарства диффундируют в клетки и удерживаются поглощающим материалом. Мембраны искусственных клеток намного тоньше тех, которые используются при диализе, а их небольшой размер означает, что они имеют большую площадь поверхности мембраны . Это означает, что часть клетки может иметь теоретический массоперенос, который в сто раз выше, чем у всей машины искусственной почки. [3] Устройство было признано рутинным клиническим методом для пациентов, лечившихся от случайного или суицидального отравления, но также было внедрено в качестве терапии при печеночной и почечной недостаточности , выполняя часть функций этих органов. [3] Гемоперфузия искусственных клеток также была предложена для использования при иммуноадсорбции, посредством которой антитела можно удалять из организма путем прикрепления иммуноадсорбирующего материала, такого как альбумин, к поверхности искусственных клеток. Этот принцип использовался для удаления антител группы крови из плазмы при трансплантации костного мозга. [51] и для лечения гиперхолестеринемии с помощью моноклональных антител низкой плотности для удаления липопротеинов . [52] Гемоперфузия особенно полезна в странах со слабой промышленностью по производству гемодиализа, поскольку устройства там, как правило, дешевле и используются у пациентов с почечной недостаточностью .
Инкапсулированные клетки
[ редактировать ]
Наиболее распространенным методом получения искусственных клеток является инкапсуляция клеток . Инкапсулированные клетки обычно достигаются путем создания капель контролируемого размера из жидкой клеточной суспензии , которые затем быстро затвердевают или гелеобразуют для обеспечения дополнительной стабильности. Стабилизация может быть достигнута за счет изменения температуры или за счет сшивки материала. [4] Микроокружение, в котором находится клетка, меняется при инкапсуляции. Обычно он переходит от монослоя к суспензии в полимерном каркасе внутри полимерной мембраны. Недостатком метода является то, что инкапсулирование клетки снижает ее жизнеспособность и способность к пролиферации и дифференцировке. [53] Далее, через некоторое время внутри микрокапсулы клетки образуют кластеры, которые подавляют обмен кислорода и метаболических отходов. [54] что приводит к апоптозу и некрозу , что ограничивает эффективность клеток и активирует иммунную систему хозяина .Искусственные клетки оказались успешными для трансплантации ряда клеток, включая островки Лангерганса, для диабета . лечения [55] клетки паращитовидной железы и клетки коры надпочечников.
Инкапсулированные гепатоциты
[ редактировать ]Нехватка донорских органов делает искусственные клетки ключевыми игроками в альтернативных методах лечения печеночной недостаточности . Использование искусственных клеток для трансплантации гепатоцитов продемонстрировало осуществимость и эффективность обеспечения функции печени на моделях заболеваний печени животных и биоискусственных устройствах печени . [56] Исследование началось с экспериментов, в которых гепатоциты были прикреплены к поверхности микроносителей. [57] и превратился в гепатоциты, которые инкапсулированы в трехмерную матрицу в виде микрокапель альгината , покрытых внешней оболочкой из полилизина . Ключевым преимуществом этого метода доставки является отсутствие необходимости иммуносупрессивной терапии на время лечения. Инкапсуляции гепатоцитов были предложены для использования в биоискусственной печени . Устройство состоит из цилиндрической камеры, внутри которой находятся изолированные гепатоциты, через которые плазма пациента циркулирует экстракорпорально по типу гемоперфузии . Поскольку микрокапсулы имеют высокое соотношение площади поверхности к объему , они обеспечивают большую поверхность для диффузии субстрата и могут вместить большое количество гепатоцитов. Лечение мышей с индуцированной печеночной недостаточностью показало значительное увеличение выживаемости. [56] Системы искусственной печени все еще находятся на ранней стадии разработки, но демонстрируют потенциал для пациентов, ожидающих трансплантации органов , или пока собственная печень пациента регенерирует в достаточной степени, чтобы возобновить нормальное функционирование. На данный момент клинические испытания с использованием систем искусственной печени и трансплантации гепатоцитов при терминальных стадиях заболеваний печени показали улучшение показателей здоровья, но еще не улучшили выживаемость. [58] Основными препятствиями являются непродолжительность жизни и агрегация искусственных гепатоцитов после трансплантации.Гепатоциты, инкапсулированные со стволовыми клетками, демонстрируют большую жизнеспособность в культуре и после имплантации. [59] и имплантация только искусственных стволовых клеток также продемонстрировала регенерацию печени. [60] В связи с этим возник интерес к использованию стволовых клеток для инкапсуляции в регенеративной медицине .
Инкапсулированные бактериальные клетки
[ редактировать ]Пероральный прием живых колоний бактериальных клеток был предложен и в настоящее время используется для модуляции кишечной микрофлоры . [61] профилактика диарейных заболеваний , [62] лечение инфекций H. Pylori , атопических воспалений, [63] непереносимость лактозы [64] и иммунная модуляция , [65] среди других. Предлагаемый механизм действия до конца не изучен, но считается, что он имеет два основных эффекта. Во-первых, это питательный эффект, при котором бактерии конкурируют с бактериями, продуцирующими токсины. Второй — санитарный эффект, который стимулирует устойчивость к колонизации и стимулирует иммунный ответ . [4] Пероральная доставка бактериальных культур часто является проблемой, поскольку они подвергаются воздействию иммунной системы и часто разрушаются при пероральном приеме. Искусственные клетки помогают решить эти проблемы, обеспечивая мимикрию в организме и избирательное или долгосрочное высвобождение, тем самым увеличивая жизнеспособность бактерий, достигающих желудочно-кишечной системы . [4] Кроме того, можно спроектировать инкапсуляцию живых бактериальных клеток, позволяющую диффузию небольших молекул, включая пептиды, в организм в терапевтических целях. [4] Мембраны, доказавшие свою эффективность для доставки бактерий, включают ацетат целлюлозы и варианты альгината . [4] Дополнительные области применения, возникшие в результате инкапсуляции бактериальных клеток, включают защиту от заражения M. Tuberculosis. [66] и активация клеток иммунной системы, секретирующих Ig. [67] Технология ограничена риском системных инфекций, неблагоприятной метаболической активности и риском переноса генов. [4] Однако более серьезной проблемой остается доставка достаточного количества жизнеспособных бактерий в интересующий участок. [4]
Искусственные клетки крови как переносчики кислорода
[ редактировать ]Наноразмерные переносчики кислорода используются как своего рода заменители эритроцитов , хотя в них отсутствуют другие компоненты эритроцитов. Они состоят из синтетической полимерсомы или искусственной мембраны, окружающей очищенный гемоглобин животного, человека или рекомбинантный гемоглобин . [68] В целом, доставка гемоглобина по-прежнему остается сложной задачей, поскольку он очень токсичен, если его доставлять без каких-либо модификаций. В некоторых клинических исследованиях наблюдались вазопрессорные эффекты. [69] [70]
Искусственные эритроциты
[ редактировать ]Исследовательский интерес к использованию искусственных клеток для получения крови возник после паники по поводу СПИДа в 1980-х годах. Помимо исключения возможности передачи заболеваний, искусственные эритроциты желательны, поскольку они устраняют недостатки, связанные с переливанием аллогенной крови, такие как тип крови, иммунные реакции и короткий срок хранения, составляющий 42 дня. Заменитель гемоглобина можно хранить при комнатной температуре, а не в холодильнике, более года. [3] Были предприняты попытки разработать полноценные рабочие эритроциты, которые содержат не только углеродный переносчик кислорода, но и ферменты, связанные с клеткой. Первая попытка была предпринята в 1957 году путем замены мембраны эритроцитов ультратонкой полимерной мембраной. [71] с последующей инкапсуляцией через липидную мембрану [72] а в последнее время — биоразлагаемую полимерную мембрану. [3] Биологическую мембрану эритроцитов, включающую липиды и связанные с ними белки, также можно использовать для инкапсуляции наночастиц и увеличения времени пребывания in vivo за счет обхода поглощения макрофагов и системного клиренса. [73]
Искусственные лейкополимерсомы
[ редактировать ]Лейкополимерсома – это полимерсома, обладающая адгезионными свойствами лейкоцита . [74] Полимерсомы представляют собой везикулы, состоящие из двухслойного листа, который может инкапсулировать множество активных молекул, таких как лекарства или ферменты . Добавляя к их мембранам адгезионные свойства лейкоцитов, можно заставить их замедляться или катиться вдоль эпителиальных стенок в быстро текущей кровеносной системе .
Нетрадиционные виды искусственных клеток
[ редактировать ]Электронная искусственная клетка
[ редактировать ]Концепция электронной искусственной клетки была расширена в серии из трех проектов ЕС, координируемых Джоном Маккаскиллом с 2004 по 2015 год.
Европейская комиссия спонсировала разработку программы программируемой искусственной эволюции клеток (PACE). [75] с 2004 по 2008 год, целью которого было заложить основу для создания «микроскопических самоорганизующихся, самовоспроизводящихся и эволюционирующих автономных объектов, построенных из простых органических и неорганических веществ, которые можно генетически запрограммировать для выполнения определенных функций». [75] для возможной интеграции в информационные системы. В рамках проекта PACE была разработана первая «Омега-машина» — микрофлюидная система жизнеобеспечения искусственных клеток, которая могла бы дополнять химически недостающие функции (как первоначально предлагалось Норманом Паккардом, Стин Расмуссеном, Марком Бидау и Джоном Маккаскиллом). Конечная цель состояла в том, чтобы создать эволюционирующую гибридную клетку в сложной программируемой микромасштабной среде. Затем функции Омега-машины можно было бы постепенно устранить, поставив перед химией искусственных клеток ряд разрешимых эволюционных проблем. В рамках проекта была достигнута химическая интеграция до уровня пар трех основных функций искусственных клеток (генетическая подсистема, система сдерживания и метаболическая система), а также созданы новые программируемые микрофлюидные среды с пространственным разрешением для интеграции сдерживания и генетической амплификации. [75] Проект привел к созданию Европейского центра живых технологий. [76]
После этого исследования в 2007 году Джон Маккаскилл предложил сосредоточиться на искусственной клетке с электронными дополнениями, названной «Электронная химическая ячейка». Ключевая идея заключалась в том, чтобы использовать массив параллельных электродов, соединенных с локально выделенными электронными схемами, в двумерной тонкой пленке, чтобы дополнить новые химические клеточные функции. Локальная электронная информация, определяющая схемы переключения и считывания электродов, может служить электронным геномом, дополняя молекулярную последовательную информацию в новых протоколах. Предложение об исследовании было успешно одобрено Европейской комиссией , и международная группа ученых, частично пересекающаяся с консорциумом ПАСЕ, начала в 2008–2012 годах работу над проектом «Электронные химические клетки». Проект продемонстрировал, среди прочего, что локальный транспорт определенных последовательностей с электронным управлением может использоваться в качестве искусственной системы пространственного контроля для генетической пролиферации будущих искусственных клеток, и что основные процессы метаболизма могут осуществляться с помощью электродных матриц с соответствующим покрытием.
Основным ограничением этого подхода, помимо первоначальных трудностей в освоении микромасштабной электрохимии и электрокинетики, является то, что электронная система взаимосвязана как жесткая неавтономная часть макроскопического оборудования. В 2011 году Маккаскилл предложил инвертировать геометрию электроники и химии: вместо помещения химических веществ в активную электронную среду поместить микроскопическую автономную электронику в химическую среду. Он организовал проект по созданию третьего поколения электронных искусственных клеток размером 100 мкм, которые могли бы самособираться из двух полуячеек «лаблеток», заключая в себе внутреннее химическое пространство, и функционировать с помощью активной электроники, питаемой от среды. они погружены в него. Такие клетки могут копировать как свое электронное, так и химическое содержимое и будут способны к эволюции в пределах ограничений, обеспечиваемых их специальными предварительно синтезированными микроскопическими строительными блоками. В сентябре 2012 года работа над этим проектом началась. [77]
Искусственные нейроны
[ редактировать ]Ведутся исследования и разработки в области физических искусственных нейронов – органических и неорганических.
Например, некоторые искусственные нейроны могут получать [78] [79] и высвобождают дофамин ( химические сигналы, а не электрические сигналы) и взаимодействуют с естественными клетками мышц и мозга крысы , что потенциально может быть использовано в BCI / протезировании . [80] [81]
малой мощности Биосовместимые мемристоры могут позволить создавать искусственные нейроны, которые функционируют при напряжениях биологических потенциалов действия и могут использоваться для непосредственной обработки биосенсорных сигналов , для нейроморфных вычислений и/или прямой связи с биологическими нейронами . [82] [83] [84]
Органические нейроморфные схемы, изготовленные из полимеров и покрытые богатым ионами гелем, позволяющим материалу переносить электрический заряд, как настоящие нейроны , были встроены в робота, что позволяет ему обучаться сенсомоторно в реальном мире, а не посредством моделирования или практически. [85] [86] Более того, искусственные шиповые нейроны, изготовленные из мягкого вещества (полимеров), могут работать в биологически значимых средах и обеспечивать синергетическую связь между искусственными и биологическими доменами. [87] [88]Дживану
[ редактировать ]Протоклетки Дживану представляют собой синтетические химические частицы, которые обладают клеточной структурой и, по-видимому, обладают некоторыми функциональными живыми свойствами. [89] Впервые синтезированный в 1963 году из простых минералов и основной органики под воздействием солнечного света , он до сих пор обладает некоторыми метаболическими способностями, наличием полупроницаемой мембраны , аминокислот , фосфолипидов , углеводов и РНК-подобных молекул. [89] Однако природа и свойства Дживану еще предстоит выяснить. [89] [90]
Полуискусственные клетки-киборги
[ редактировать ]См. также
[ редактировать ]- Протоклетка
- Синтетическая биология
- Искусственная жизнь
- Адресная доставка лекарств
- Респироцит
- Хемотон
- Дживану
Ссылки
[ редактировать ]- ^ Буддинг, Британская Колумбия, ван Хест Дж.К. (апрель 2017 г.). «Искусственные клетки: синтетические отсеки с реалистичной функциональностью и адаптивностью» . Отчеты о химических исследованиях . 50 (4): 769–777. doi : 10.1021/acs.accounts.6b00512 . ПМК 5397886 . ПМИД 28094501 .
- ^ Димер Д. (июль 2005 г.). «Гигантский шаг к искусственной жизни?». Тенденции в биотехнологии . 23 (7): 336–338. дои : 10.1016/j.tibtech.2005.05.008 . ПМИД 15935500 .
- ^ Перейти обратно: а б с д и ж г час я Чанг ТМ (2007). Искусственные клетки: биотехнология, наномедицина, регенеративная медицина, кровезаменители, биоинкапсуляция, клеточная/стволовая клеточная терапия . Хакенсак, Нью-Джерси: World Scientific. ISBN 978-981-270-576-1 . [ нужна страница ]
- ^ Перейти обратно: а б с д и ж г час я дж к л Пракаш С. (2007). Искусственные клетки, клеточная инженерия и терапия . Бока-Ратон, Флорида: Woodhead Publishing Limited. ISBN 978-1-84569-036-6 .
- ^ Гебелейн К.Г. (1983). Полимерные материалы и искусственные органы на основе симпозиума, организованного Отделом химии органических покрытий и пластмасс на 185-м заседании Американского химического общества . Вашингтон, округ Колумбия: Американское химическое общество. ISBN 978-0-8412-1084-4 . [ нужна страница ]
- ^ Вирхов Р.Л. (1858). Клеточная патология в ее обосновании физиологической и патологической гистологии . Двадцать лекций, прочитанных в феврале, марте и апреле 1858 г. (на немецком языке). Берлин: Издательство Августа Хиршвальда. п. хв.
- ^ Камия К., Такеучи С. (август 2017 г.). «Гигантское образование липосом для синтеза четко определенных искусственных клеток». Журнал химии материалов Б. 5 (30): 5911–5923. дои : 10.1039/C7TB01322A . ПМИД 32264347 .
- ^ Литчел Т., Швилле П. (май 2021 г.). «Восстановление белка внутри гигантских однослойных везикул». Ежегодный обзор биофизики . 50 : 525–548. doi : 10.1146/annurev-biophys-100620-114132 . ПМИД 33667121 . S2CID 232131463 .
- ^ Шостак Дж.В., Бартель Д.П., Луизи П.Л. (январь 2001 г.). «Синтезируя жизнь» . Природа . 409 (6818): 387–390. дои : 10.1038/35053176 . ПМИД 11201752 . S2CID 4429162 .
- ^ Похорилле А., Димер Д. (март 2002 г.). «Искусственные клетки: перспективы биотехнологии». Тенденции в биотехнологии . 20 (3): 123–128. дои : 10.1016/S0167-7799(02)01909-1 . hdl : 2060/20020043286 . ПМИД 11841864 .
- ^ Нуаро В., Маеда Ю.Т., Либхабер А. (март 2011 г.). «Развитие искусственной клетки: от самоорганизации к вычислениям и самовоспроизведению» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (9): 3473–3480. Бибкод : 2011PNAS..108.3473N . дои : 10.1073/pnas.1017075108 . ПМК 3048108 . ПМИД 21317359 .
- ^ Расмуссен С., Чен Л., Нильссон М., Абэ С. (лето 2003 г.). «Соединение неживой и живой материи». Искусственная жизнь . 9 (3): 269–316. CiteSeerX 10.1.1.101.1606 . дои : 10.1162/106454603322392479 . ПМИД 14556688 . S2CID 6076707 .
- ^ Гилберт В. (20 февраля 1986 г.). «Происхождение жизни: мир РНК» . Природа . 319 (6055): 618. Бибкод : 1986Natur.319..618G . дои : 10.1038/319618a0 . S2CID 8026658 .
- ^ Бедо М., Чёрч Г., Расмуссен С., Каплан А., Беннер С., Фюссенеггер М. и др. (май 2010 г.). «Жизнь после синтетической клетки». Природа . 465 (7297): 422–424. Бибкод : 2010Natur.465..422. . дои : 10.1038/465422a . ПМИД 20495545 . S2CID 27471255 .
- ^ Перейти обратно: а б Парк ЕС (2009). Бедау М.А. (ред.). Этика протоклеток, моральные и социальные последствия создания жизни в лаборатории ([Online-Ausg.] под ред.). Кембридж, Массачусетс: MIT Press. ISBN 978-0-262-51269-5 .
- ^ Светлиц, Айк (28 июля 2017 г.). «От химикатов к жизни: ученые пытаются построить клетки с нуля» . Стат . Проверено 4 декабря 2019 г.
- ^ «Построй ячейку» . Проверено 4 декабря 2019 г.
- ^ «ФабриСелл» . Проверено 8 декабря 2019 г.
- ^ «MaxSynBio - Исследовательская сеть Макса Планка в области синтетической биологии» . Проверено 8 декабря 2019 г.
- ^ «БаСик» . Проверено 8 декабря 2019 г.
- ^ «СинСелл ЕС» . Проверено 8 декабря 2019 г.
- ^ Перейти обратно: а б с Гибсон Д.Г., Гласс Дж.И., Лартиг С., Носков В.Н., Чуанг Р.Ю., Алгир М.А. и др. (июль 2010 г.). «Создание бактериальной клетки, управляемой химически синтезированным геномом». Наука . 329 (5987): 52–56. Бибкод : 2010Sci...329...52G . дои : 10.1126/science.1190719 . ПМИД 20488990 . S2CID 7320517 .
- ^ Армстронг Р. (сентябрь 2014 г.). «Проектирование с использованием протоклеток: применение новой технической платформы» . Жизнь . 4 (3): 457–490. Бибкод : 2014Life....4..457A . дои : 10.3390/life4030457 . ПМК 4206855 . ПМИД 25370381 .
- ^ Брейер М., Эрнест Т.М., Мерриман С., Уайз К.С., Сан Л., Лайнотт М.Р. и др. (январь 2019 г.). «Необходимый метаболизм для минимальной клетки» . электронная жизнь . 8 . дои : 10.7554/eLife.36842 . ПМК 6609329 . ПМИД 30657448 .
- ^ Шеридан С. (сентябрь 2009 г.). «Большие нефтяные деньги за водоросли» . Природная биотехнология . 27 (9): 783. doi : 10.1038/nbt0909-783 . ПМИД 19741613 . S2CID 205270805 .
- ^ Генеральный директорат ЕС по вопросам здравоохранения и потребителей (12 февраля 2016 г.). Мнение о синтетической биологии II: Методологии оценки риска и аспекты безопасности . Офис публикаций. дои : 10.2772/63529 . ISBN 9789279439162 .
- ^ Чанг Т.М. (октябрь 1964 г.). «Полупроницаемые микрокапсулы». Наука . 146 (3643): 524–525. Бибкод : 1964Sci...146..524C . дои : 10.1126/science.146.3643.524 . ПМИД 14190240 . S2CID 40740134 .
- ^ Перейти обратно: а б с Чанг ТМ (1996). «Редакционная статья: прошлые, настоящие и будущие перспективы 40-летия заменителей эритроцитов на основе гемоглобина». Искусственные клетки кровезаменителя Immobil Biotechnol . 24 : xxxvi. НАИД 10005526771 .
- ^ Палмор Р.М., Гудиер П., Рид Т., Чанг Т.М. (сентябрь 1989 г.). «Микроинкапсулированная ксантиноксидаза как экспериментальная терапия болезни Леша-Нихана». Ланцет . 2 (8664): 687–688. дои : 10.1016/s0140-6736(89)90939-2 . ПМИД 2570944 . S2CID 39716068 .
- ^ Чанг ТМ (1997). Заменители крови . Базель: Каргер. ISBN 978-3-8055-6584-4 . [ нужна страница ]
- ^ Сун-Шионг П., Хайнц Р.Э., Меридет Н., Яо QX, Яо З., Чжэн Т. и др. (апрель 1994 г.). «Инсулиновая независимость у пациента с диабетом 1 типа после трансплантации инкапсулированных островков». Ланцет . 343 (8903): 950–951. дои : 10.1016/S0140-6736(94)90067-1 . ПМИД 7909011 . S2CID 940319 .
- ^ Лю ЗК, Чанг ТМ (июнь 2003 г.). «Коэнкапсуляция гепатоцитов и стволовых клеток костного мозга: преобразование аммиака in vitro и снижение билирубина in vivo у крыс Ганна с гипербилирубемией». Международный журнал искусственных органов . 26 (6): 491–497. дои : 10.1177/039139880302600607 . ПМИД 12894754 . S2CID 12447199 .
- ^ Эбишер П., Шлюп М., Деглон Н., Джозеф Дж.М., Хирт Л., Хейд Б. и др. (июнь 1996 г.). «Интратекальная доставка CNTF с использованием инкапсулированных генетически модифицированных ксеногенных клеток пациентам с боковым амиотрофическим склерозом». Природная медицина . 2 (6): 696–699. дои : 10.1038/nm0696-696 . ПМИД 8640564 . S2CID 8049662 .
- ^ Вивье А., Виллемар Ж.К., Акерманн Х.В., Понселе Д. (1992). «Массовое производство кровезаменителей с использованием микрофлюидизатора». Биоматериалы, искусственные клетки и биотехнология иммобилизации . 20 (2–4): 377–397. дои : 10.3109/10731199209119658 . ПМИД 1391454 .
- ^ Джакария М.Г., Сорхдини П., Ян Д., Чжоу Ю., Минах С.А. (февраль 2022 г.). «Наночастицы, покрытые мембраной клеток легких, способные к усиленной интернализации и транслокации в эпителиальные клетки легких» . Международный фармацевтический журнал . 613 : 121418. doi : 10.1016/j.ijpharm.2021.121418 . ПМЦ 8792290 . ПМИД 34954003 .
- ^ Перейти обратно: а б Монк, Каролина; Элани, Юваль; Черони, Франческа (5 июля 2024 г.). «Генетически запрограммированные синтетические клетки для термочувствительного синтеза белка и высвобождения грузов» . Химическая биология природы : 1–7. дои : 10.1038/s41589-024-01673-7 . ISSN 1552-4469 .
- ^ Парк и др. 1981 год [ нужна полная цитата ] [ нужна страница ]
- ^ Чанг ТМ (январь 1971 г.). «Влияние полупроницаемых микрокапсул, содержащих L-аспарагиназу, на лимфосаркому 6C3HED in vivo». Природа . 229 (5280): 117–118. Бибкод : 1971Natur.229..117C . дои : 10.1038/229117a0 . ПМИД 4923094 . S2CID 4261902 .
- ^ Ю Б, Чанг ТМ (апрель 2004 г.). «Влияние длительного перорального приема полимерных микрокапсул, содержащих тирозиназу, на поддержание пониженного системного уровня тирозина у крыс». Журнал фармацевтических наук . 93 (4): 831–837. дои : 10.1002/jps.10593 . ПМИД 14999721 .
- ^ Медоуз Г.Г., Пирсон Х.Ф., Абдалла Р.М., Десаи П.Р. (август 1982 г.). «Диетическое влияние тирозина и фенилаланина на реакцию меланомы B16 на химиотерапию метиловым эфиром карбидопы-леводопы». Исследования рака . 42 (8): 3056–3063. ПМИД 7093952 .
- ^ Чанг ТМ (февраль 2004 г.). «Биоинкапсуляция искусственных клеток в макро, микро, нано и молекулярных измерениях: основная лекция». Искусственные клетки, кровезаменители и биотехнология . 32 (1): 1–23. дои : 10.1081/био-120028665 . ПМИД 15027798 . S2CID 37799530 .
- ^ Перейти обратно: а б Лёр М., Хаммель Ф., Фаульманн Г., Рингель Дж., Саллер Р., Хайн Дж. и др. (май 2002 г.). «Микроинкапсулированные, трансфицированные CYP2B1 клетки, активирующие ифосфамид в месте опухоли: волшебные пули 21 века». Химиотерапия и фармакология рака . 49 (Приложение 1): С21–С24. дои : 10.1007/s00280-002-0448-0 . ПМИД 12042985 . S2CID 10329480 .
- ^ Крегер Й.К., Бенц С., Хоффмейер А., Баго З., Бергмейстер Х., Гюнцбург В.Х. и др. (1999). «Внутриартериальная инстилляция микроинкапсулированных клеток, активирующих ифосфамид, в поджелудочную железу свиньи для направленного химиотерапевтического воздействия». Панкреатология . 3 (1): 55–63. дои : 10.1159/000069147 . ПМИД 12649565 . S2CID 23711385 .
- ^ Кармен И.Х. (апрель 2001 г.). «Смерть в лаборатории: политика последствий Гельсингера» . Молекулярная терапия . 3 (4): 425–428. дои : 10.1006/mthe.2001.0305 . ПМИД 11319902 .
- ^ Рэпер С.Э., Чирмул Н., Ли Ф.С., Вивел Н.А., Бэгг А., Гао Г.П. и др. (1 сентября 2003 г.). «Синдром фатального системного воспалительного ответа у пациента с дефицитом орнитинтранскарбамилазы после переноса аденовирусного гена». Молекулярная генетика и обмен веществ . 80 (1–2): 148–158. дои : 10.1016/j.ymgme.2003.08.016 . ПМИД 14567964 .
- ^ Каваццана-Кальво М., Хасейн-Бей С., де Сен-Базиль Г., Гросс Ф., Ивон Э., Нусбаум П. и др. (апрель 2000 г.). «Генная терапия тяжелого комбинированного иммунодефицита человека (SCID)-X1». Наука . 288 (5466): 669–672. Бибкод : 2000Sci...288..669C . дои : 10.1126/science.288.5466.669 . ПМИД 10784449 .
- ^ Хасейн-Бей-Абина С., Фон Калле С., Шмидт М., МакКормак М.П., Вульффраат Н., Лебулч П. и др. (октябрь 2003 г.). «LMO2-ассоциированная пролиферация клональных Т-клеток у двух пациентов после генной терапии SCID-X1». Наука . 302 (5644): 415–419. Бибкод : 2003Sci...302..415H . дои : 10.1126/science.1088547 . ПМИД 14564000 . S2CID 9100335 .
- ^ Чанг П.Л., Ван Раамсдонк Дж.М., Ортелано Дж., Барсум СК, Макдональд, Северная Каролина, Стокли Т.Л. (февраль 1999 г.). «Доставка гетерологичных белков in vivo с помощью микроинкапсулированных рекомбинантных клеток». Тенденции в биотехнологии . 17 (2): 78–83. дои : 10.1016/S0167-7799(98)01250-5 . ПМИД 10087608 .
- ^ аль-Хенди А., Ортелано Г., Танненбаум Г.С., Чанг П.Л. (февраль 1995 г.). «Коррекция дефекта роста у карликовых мышей с неаутологичными микроинкапсулированными миобластами - альтернативный подход к соматической генной терапии». Генная терапия человека . 6 (2): 165–175. дои : 10.1089/hum.1995.6.2-165 . ПМИД 7734517 .
- ^ Дунеа Г., Колфф В.Дж. (1965). «Клинический опыт использования искусственной почки с активированным углем Яцидиса» . Труды Американского общества искусственных внутренних органов . 11 : 178–182. дои : 10.1097/00002480-196504000-00035 . ПМИД 14329080 .
- ^ Бенсингер В.И., Бакнер К.Д., Клифт Р.А. (1985). «Иммуноадсорбция цельной крови антител анти-А или анти-В». Вокс Сангвинис . 48 (6): 357–361. дои : 10.1111/j.1423-0410.1985.tb00196.x . ПМИД 3892895 . S2CID 12777645 .
- ^ Ян Л., Ченг Ю, Ян ВР, Ю ЮТ (2004). «Экстракорпоральная иммуноадсорбция цельной крови при аутоиммунной миастении целлюлозным адсорбентом триптофана» . Искусственные клетки, кровезаменители и биотехнология . 32 (4): 519–528. дои : 10.1081/био-200039610 . ПМИД 15974179 . S2CID 7269229 .
- ^ Чанг П.Л. (1994). «Трансфекция ДНК, опосредованная фосфатом кальция». В Вольфе Дж.А. (ред.). Генная терапия . Бостон: Биркхаузер. стр. 157–179. дои : 10.1007/978-1-4684-6822-9_9 . ISBN 978-1-4684-6822-9 .
- ^ Понсе С., Ориве Дж., Гаскон А.Р., Эрнандес Р.М., Педрас Х.Л. (апрель 2005 г.). «Микрокапсулы, приготовленные из различных биоматериалов для иммобилизации GDNF, секретирующих фибробласты 3T3». Международный фармацевтический журнал . 293 (1–2): 1–10. doi : 10.1016/j.ijpharm.2004.10.028 . ПМИД 15778039 .
- ^ Кизилел С., Гарфинкель М., Опара Э. (декабрь 2005 г.). «Биоискусственная поджелудочная железа: прогресс и проблемы». Технология и терапия диабета . 7 (6): 968–985. дои : 10.1089/диа.2005.7.968 . ПМИД 16386103 .
- ^ Перейти обратно: а б Диксит В., Гитник Г. (27 ноября 2003 г.). «Биоискусственная печень: современное состояние» . Европейский журнал хирургии. Добавка . 164 (582): 71–76. дои : 10.1080/11024159850191481 . ПМИД 10029369 .
- ^ Деметриу А.А., Уайтинг Дж.Ф., Фельдман Д., Левенсон С.М., Чоудхури Н.Р., Мошиони А.Д. и др. (сентябрь 1986 г.). «Замещение функции печени у крыс путем трансплантации гепатоцитов, прикрепленных к микроносителю». Наука . 233 (4769): 1190–1192. Бибкод : 1986Sci...233.1190D . дои : 10.1126/science.2426782 . ПМИД 2426782 .
- ^ Сгрой А., Серр-Бенье В., Морель П., Бюлер Л. (февраль 2009 г.). «Какие клинические альтернативы трансплантации цельной печени? Текущее состояние искусственных устройств и трансплантации гепатоцитов» . Трансплантация . 87 (4): 457–466. дои : 10.1097/TP.0b013e3181963ad3 . ПМИД 19307780 .
- ^ Лю ZC, Чанг ТМ (март 2002 г.). «Повышение жизнеспособности трансплантированных гепатоцитов, когда гепатоциты совместно инкапсулируются со стволовыми клетками костного мозга с использованием нового метода» . Искусственные клетки, кровезаменители и биотехнология иммобилизации . 30 (2): 99–112. дои : 10.1081/био-120003191 . ПМИД 12027231 . S2CID 26667880 .
- ^ Педрас Дж.Л., Ориве Дж., ред. (2010). Терапевтическое применение клеточной микроинкапсуляции (Online-Ausg. Ed.). Нью-Йорк: Springer Science + Business Media. ISBN 978-1-4419-5785-6 .
- ^ Маттила-Сандхольм Т., Блюм С., Коллинз Дж.К., Криттенден Р., Де Вос В., Данн С. и др. (1 декабря 1999 г.). «Пробиотики: на пути к демонстрации эффективности». Тенденции в пищевой науке и технологиях . 10 (12): 393–399. дои : 10.1016/S0924-2244(00)00029-7 .
- ^ Хуанг Дж.С., Бусварош А., Ли Дж.В., Диас А., Дэвидсон Э.Дж. (ноябрь 2002 г.). «Эффективность использования пробиотиков при острой диарее у детей: метаанализ». Пищеварительные заболевания и науки . 47 (11): 2625–2634. дои : 10.1023/A:1020501202369 . ПМИД 12452406 . S2CID 207559325 .
- ^ Исолаури Э., Арвола Т., Сутас Ю., Мойланен Э., Салминен С. (ноябрь 2000 г.). «Пробиотики в лечении атопической экземы». Клиническая и экспериментальная аллергия . 30 (11): 1604–1610. дои : 10.1046/j.1365-2222.2000.00943.x . ПМИД 11069570 . S2CID 13524021 .
- ^ Линь М.Ю., Йен С.Л., Чен Ш. (январь 1998 г.). «Лечение нарушения переваривания лактозы путем употребления молока, содержащего лактобактерии». Пищеварительные заболевания и науки . 43 (1): 133–137. дои : 10.1023/А:1018840507952 . ПМИД 9508514 . S2CID 22890925 .
- ^ Гилл Х.С. (1 мая 1998 г.). «Стимуляция иммунной системы молочнокислыми культурами». Международный молочный журнал . 8 (5–6): 535–544. дои : 10.1016/S0958-6946(98)00074-0 .
- ^ Олдуэлл Ф.Е., Такер И.Г., де Лиль Г.В., Баддл Б.М. (январь 2003 г.). «Пероральная доставка Mycobacterium bovis BCG в липидной форме вызывает устойчивость к туберкулезу легких у мышей» . Инфекция и иммунитет . 71 (1): 101–108. дои : 10.1128/IAI.71.1.101-108.2003 . ПМК 143408 . ПМИД 12496154 .
- ^ Пак Дж.Х., Ум Дж.И., Ли Би.Дж., Го Дж.С., Пак С.И., Ким В.С., Ким П.Х. (сентябрь 2002 г.). «Инкапсулированные Bifidobacterium bifidum усиливают выработку IgA в кишечнике». Клеточная иммунология . 219 (1): 22–27. дои : 10.1016/S0008-8749(02)00579-8 . ПМИД 12473264 .
- ^ Ким Х.В., Greenburg AG (сентябрь 2004 г.). «Искусственные переносчики кислорода как заменители эритроцитов: избранный обзор и современное состояние». Искусственные органы . 28 (9): 813–828. дои : 10.1111/j.1525-1594.2004.07345.x . ПМИД 15320945 .
- ^ Нельсон DJ (1998). «Кровь и HemAssistTM (DCLHb): потенциально дополнительная терапевтическая команда». Ин Чанг ТМ (ред.). Заменители крови: принципы, методы, продукты и клинические испытания . Том. 2. Базель: Каргер. стр. 39–57.
- ^ Берхоп К.Е., Эстеп Т.Э. (2001). «Поражения миокарда, вызванные гемоглобином» . Искусственные клетки, кровезаменители и биотехнология . 29 (2): 101–106. дои : 10.1080/10731190108951271 . ПМЦ 3555357 .
- ^ «30-летие исследований искусственных эритроцитов». Искусственные клетки, кровезаменители и биотехнология . 16 (1–3): 1–9. 1 января 1988 г. doi : 10.3109/10731198809132551 .
- ^ Джорджевич Л., Миллер И.Ф. (май 1980 г.). «Синтетические эритроциты из гемоглобина, инкапсулированного в липиды». Экспериментальная гематология . 8 (5): 584–592. ПМИД 7461058 .
- ^ Ху С.М., Чжан Л., Арьял С., Чунг С., Фанг Р.Х., Чжан Л. (июль 2011 г.). «Полимерные наночастицы, замаскированные под мембрану эритроцитов, как биомиметическая платформа доставки» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (27): 10980–10985. Бибкод : 2011PNAS..10810980H . дои : 10.1073/pnas.1106634108 . ПМЦ 3131364 . ПМИД 21690347 .
- ^ Хаммер Д.А., Роббинс Г.П., Хаун Дж.Б., Лин Дж.Дж., Ци В., Смит Л.А. и др. (1 января 2008 г.). «Лейко-полимерсомы» . Фарадеевские дискуссии . 139 : 129–41, обсуждение 213–28, 419–20. Бибкод : 2008FaDi..139..129H . дои : 10.1039/B717821B . ПМЦ 2714229 . ПМИД 19048993 .
- ^ Перейти обратно: а б с «Программируемая искусственная эволюция клеток» (ПАСЕ)» . Консорциум ПАСЕ.
- ^ «Европейский центр живых технологий» . Европейский центр живых технологий. Архивировано из оригинала 14 декабря 2011 г.
- ^ «Микромасштабные химически активные электронные агенты» . Рурский университет в Бохуме.
- ^ Кляйнер, Курт (25 августа 2022 г.). «Сделать компьютерные чипы более похожими на клетки мозга» . Познаваемый журнал | Ежегодные обзоры . doi : 10.1146/knowable-082422-1 . Проверено 23 сентября 2022 г.
- ^ Кин, Скотт Т.; Лубрано, Клаудия; Каземзаде, Сетаре; Мелианас, Оружие; Тухман, Яаков; Полино, Джузеппина; Сконьямильо, Паола; Сина, Люциус; Саллео, Альберт; ван де Бургт, Йори; Санторо, Франческа (сентябрь 2020 г.). «Бигибридный синапс с пластичностью, опосредованной нейротрансмиттерами» . Природные материалы . 19 (9): 969–973. Бибкод : 2020NatMa..19..969K дои : 10.1038/s41563-020-0703-y . ISSN 1476-4660 . ПМИД 32541935 . S2CID 219691307 .
- Пресс-релиз университета: «Исследователи разрабатывают искусственный синапс, который работает с живыми клетками» . Стэнфордский университет черезmedicalxpress.com . Проверено 23 сентября 2022 г.
- ^ «Искусственный нейрон обменивается дофамином с клетками мозга крысы, как настоящий» . Новый учёный . Проверено 16 сентября 2022 г.
- ^ Wang, Ting; Wang, Ming; Wang, Jianwu; Yang, Le; Ren, Xueyang; Song, Gang; Chen, Shisheng; Yuan, Yuehui; Liu, Ruiqing; Pan, Liang; Li, Zheng; Leow, Wan Ru; Luo, Yifei; Ji, Shaobo; Cui, Zequn; He, Ke; Zhang, Feilong; Lv, Fengting; Tian, Yuanyuan; Cai, Kaiyu; Yang, Bowen; Niu, Jingyi; Zou, Haochen; Liu, Songrui; Xu, Guoliang; Fan, Xing; Hu, Benhui; Loh, Xian Jun; Wang, Lianhui; Chen, Xiaodong (8 August 2022). , /s41928-022-00803-0.hdl , Ван, Мин, Ян, Жэнь, Сюэян; Юань, Юэхуэй; Ли, Чжэн, Ван Лу; , Ифэй; Цуй, Цзэцюнь; Хэ, Чжан, Фейлун; Цай, Кайюй; , Голян Ляньхуэй Син ; 10356/163240 Ху . ; Бэньхуэй ; , Ван :
- ^ «Ученые создают крошечные устройства, которые работают как человеческий мозг» . Независимый . 20 апреля 2020 года. Архивировано из оригинала 24 апреля 2020 года . Проверено 17 мая 2020 г.
- ^ «Исследователи представляют электронику, которая имитирует человеческий мозг в эффективном обучении» . физ.орг . Архивировано из оригинала 28 мая 2020 года . Проверено 17 мая 2020 г.
- ^ Фу, Тианда; Гао, Хунъянь; Уорд, Лю, Сяорун; Ван, Чжунжуй, Е; Джошуа Ян, Дж.; Дерек Р.; Цзюнь (20 апреля 2020 г.). Бионапряженные мемристоры» . Nature Communications . 11 1): 1861. Бибкод : 2020NatCo..11.1861F . ( , « -у 7171104 .
- ^ Болахе, Саугат. «Робот Lego с органическим «мозгом» учится перемещаться по лабиринту» . Научный американец . Проверено 1 февраля 2022 г.
- ^ Краухаузен, Имке; Куцурас, Димитриос А.; Мелианас, Армантас; Кин, Скотт Т.; Либерт, Катарина; Ледансер, Адриен; Шиламантула, Раджендар; Джованнитти, Александр; Торричелли, Фабрицио; Маккаллох, Иэн; Блом, Пол ВМ; Саллео, Альберто; Бургт, Йори ван де; Гкупиденис, Пасхалис (декабрь 2021 г.). «Органическая нейроморфная электроника для сенсомоторной интеграции и обучения в робототехнике» . Достижения науки . 7 (50): eabl5068. Бибкод : 2021SciA....7.5068K . дои : 10.1126/sciadv.abl5068 . hdl : 10754/673986 . ПМЦ 8664264 . ПМИД 34890232 . S2CID 245046482 .
- ^ Саркар, Танмой; Либерт, Катарина; Павлу, Аристея; Фрэнк, Томас; Майлендер, Волкер; Маккалок, Иэн; Блом, Пол ВМ; Торричелли, Фабрицио; Гкупиденис, Пасхалис (7 ноября 2022 г.). «Органический искусственный импульсный нейрон для нейроморфного зондирования in situ и биоинтерфейса» . Природная электроника . 5 (11): 774–783. дои : 10.1038/s41928-022-00859-y . hdl : 10754/686016 . ISSN 2520-1131 . S2CID 253413801 .
- ^ «Искусственные нейроны имитируют биологические аналоги, обеспечивая синергетическое действие» . Природная электроника . 5 (11): 721–722. 10 ноября 2022 г. doi : 10.1038/s41928-022-00862-3 . ISSN 2520-1131 . S2CID 253469402 .
- ^ Перейти обратно: а б с Гроте М. (сентябрь 2011 г.). «Дживану, или« частицы жизни ». Подход Кришны Бахадура к исследованию происхождения жизни в 20 веке». Журнал биологических наук . 36 (4): 563–570. дои : 10.1007/s12038-011-9087-0 . ПМИД 21857103 . S2CID 19551399 .
- ^ Карен Л.Д., Поннамперума С. (1967). Обзор некоторых экспериментов по синтезу «Джевану» . Технический меморандум НАСА X-1439. Национальное управление по аэронавтике и исследованию космического пространства. CiteSeerX 10.1.1.691.9322 . OCLC 761398715 .
- ^ «Инженеры создали себе клетки-киборги» . Популярная механика . 11 января 2023 г. Проверено 13 января 2023 г.
- ^ « Бактерии «Киборги» доставляют источник зеленого топлива из солнечного света» . Новости Би-би-си . 22 августа 2017 г. Проверено 13 января 2023 г.
- ^ Пеплоу, Марк (17 октября 2005 г.). «Клетки киборга чувствуют влажность» . Природа . дои : 10.1038/news051017-3 . ISSN 1476-4687 .
- ^ Берри, Викас; Сараф, Рави Ф. (21 октября 2005 г.). «Самосборка наночастиц на живой бактерии: путь к изготовлению электронных устройств» . Angewandte Chemie, международное издание . 44 (41): 6668–6673. дои : 10.1002/anie.200501711 . ISSN 1433-7851 . ПМИД 16215974 . S2CID 15662656 .
- ^ «Бактерии-киборги превосходят растения в превращении солнечного света в полезные соединения (видео)» . Американское химическое общество . Проверено 13 января 2023 г.
- ^ Сакимото, Келси К.; Вонг, Эндрю Барнабас; Ян, Пейдун (01 января 2016 г.). «Самофотосенсибилизация нефотосинтезирующих бактерий для солнечно-химического производства» . Наука . 351 (6268): 74–77. Бибкод : 2016Sci...351...74S . дои : 10.1126/science.aad3317 . ISSN 0036-8075 . ПМИД 26721997 . S2CID 206642914 .
- ^ Корниенко Николай; Сакимото, Келси К.; Херлихи, Дэвид М.; Нгуен, Сон К.; Аливисатос, А. Пол; Харрис, Чарльз. Б.; Шварцберг, Адам; Ян, Пейдун (18 октября 2016 г.). «Спектроскопическое выяснение переноса энергии в гибридных неорганических и биологических организмах для солнечно-химического производства» . Труды Национальной академии наук . 113 (42): 11750–11755. Бибкод : 2016PNAS..11311750K . дои : 10.1073/pnas.1610554113 . ISSN 0027-8424 . ПМК 5081607 . ПМИД 27698140 .
- ^ Контрерас-Льяно, Луис Э.; Лю, Ю-Хан; Хенсон, Таннер; Мейер, Конари К.; Багдасарян, Офеля; Хан, Шахид; Лин, Чи-Лонг; Ван, Айджун; Ху, Че-Минг Дж.; Тан, Чименг (11 января 2023 г.). «Инженерия бактерий-киборгов посредством внутриклеточного гидрогелирования» . Передовая наука . 10 (9): 2204175. doi : 10.1002/advs.202204175 . ISSN 2198-3844 . ПМЦ 10037956 . ПМИД 36628538 . S2CID 255593443 .