Внехромосомная ДНК
Внехромосомная ДНК (сокращенно вкДНК) — это любая ДНК которая находится вне хромосом , внутри или снаружи ядра клетки , . Большая часть ДНК в индивидуальном геноме находится в хромосомах, содержащихся в ядре. Существует множество форм внехромосомной ДНК, и хотя некоторые из них выполняют важные биологические функции, [1] они также могут играть роль в развитии таких заболеваний, как рак. [2] [3] [4]
У прокариот невирусная внехромосомная ДНК преимущественно обнаруживается в плазмидах , тогда как у эукариот внехромосомная ДНК преимущественно обнаруживается в органеллах . [1] Митохондриальная ДНК является основным источником этой внехромосомной ДНК у эукариот. [5] Тот факт, что эта органелла содержит собственную ДНК, подтверждает гипотезу о том, что митохондрии возникли как бактериальные клетки, поглощенные предковыми эукариотическими клетками. [6] Внехромосомная ДНК часто используется в исследованиях репликации , поскольку ее легко идентифицировать и изолировать. [1]
Хотя внехромосомная кольцевая ДНК (вкДНК) обнаруживается в нормальных эукариотических клетках, внехромосомная ДНК (вкДНК) представляет собой отдельный объект, который был идентифицирован в ядрах раковых клеток и, как было показано, несет множество копий онкогенов- драйверов . [7] [8] [3] вкДНК считается основным механизмом амплификации генов , приводящим к образованию множества копий онкогенов-драйверов и очень агрессивному раку.
внехромосомная ДНК в цитоплазме Было обнаружено, что структурно отличается от ядерной ДНК. Цитоплазматическая ДНК менее метилирована , чем ДНК, находящаяся внутри ядра. Было также подтверждено, что последовательности цитоплазматической ДНК отличаются от ядерной ДНК в одном и том же организме, что показывает, что цитоплазматические ДНК не являются просто фрагментами ядерной ДНК. [9] Было показано, что в раковых клетках вкДНК преимущественно изолирована от ядра (см. [2] ).
Помимо ДНК, обнаруженной вне ядра клеток, инфицирование вирусными геномами также является примером внехромосомной ДНК.
Прокариотический
[ редактировать ]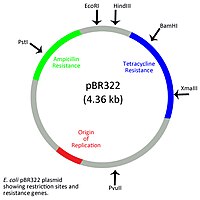
Хотя прокариотические организмы не имеют мембраносвязанного ядра, как эукариоты, они содержат нуклеоидную область, в которой находится основная хромосома. Внехромосомная ДНК существует у прокариот за пределами нуклеоидной области в виде кольцевых или линейных плазмид . Бактериальные плазмиды обычно представляют собой короткие последовательности, состоящие из сегментов длиной от 1 до нескольких сотен тысяч оснований (т.п.н.) и содержащие точку начала репликации, которая позволяет плазмиде реплицироваться независимо от бактериальной хромосомы. [10] Общее количество конкретной плазмиды внутри клетки называется числом копий и может варьироваться от двух копий на клетку до нескольких сотен копий на клетку. [11] Кольцевые бактериальные плазмиды классифицируются в соответствии с особыми функциями, которые обеспечивают гены, кодируемые плазмидой. Плазмиды фертильности, или f-плазмиды, позволяют конъюгации происходить , тогда как плазмиды устойчивости, или r-плазмиды, содержат гены, которые передают устойчивость к множеству различных антибиотиков, таких как ампициллин и тетрациклин. Плазмиды вирулентности содержат генетические элементы, необходимые бактериям для того, чтобы стать патогенными. Деградирующие плазмиды, которые содержат гены, которые позволяют бактериям разлагать различные вещества, такие как ароматические соединения и ксенобиотики . [12] Бактериальные плазмиды также могут участвовать в производстве пигментов, фиксации азота и устойчивости к тяжелым металлам. [13]
Природные кольцевые плазмиды можно модифицировать, чтобы они содержали множество генов устойчивости и несколько уникальных сайтов рестрикции , что делает их ценными инструментами в качестве векторов клонирования в биотехнологии. [10] Кольцевые бактериальные плазмиды также являются основой для производства ДНК-вакцин . Плазмидные ДНК-вакцины генетически модифицированы и содержат ген, кодирующий антиген или белок, продуцируемый патогенным вирусом, бактерией или другими паразитами. [14] После доставки в организм хозяина продукты плазмидных генов будут стимулировать как врожденный иммунный ответ , так и адаптивный иммунный ответ хозяина. Плазмиды перед доставкой часто покрывают каким-либо адъювантом для усиления иммунного ответа хозяина. [15]
Линейные бактериальные плазмиды были идентифицированы у нескольких видов бактерий-спирохет , в том числе представителей рода Borrelia (к которому принадлежит возбудитель болезни Лайма ), нескольких видов грамположительных почвенных бактерий рода Streptomyces , а также у грамотрицательных видов. Thiobacillus versutus — бактерия, окисляющая серу. линейные плазмиды прокариот Обнаружены , содержащие либо шпильку , либо ковалентно связанный белок, прикрепленный к теломерным концам молекулы ДНК. Богатые аденином и тимином шпильки бактерий Borrelia имеют размер от 5 тысяч пар оснований (т.п.н.) до более 200 т.п.н. [16] и содержат гены, ответственные за выработку группы основных поверхностных белков или антигенов бактерий, которые позволяют им уклоняться от иммунного ответа инфицированного хозяина. [17] Линейные плазмиды, которые содержат белок, ковалентно прикрепленный к 5'-концу нити ДНК, известны как инвертроны и могут иметь размер от 9 до более 600 т.п.н. и состоят из инвертированных концевых повторов . [16] Линейные плазмиды с ковалентно присоединенным белком могут способствовать бактериальной конъюгации и интеграции плазмид в геном. Эти типы линейных плазмид представляют собой самый большой класс внехромосомной ДНК, поскольку они присутствуют не только в некоторых бактериальных клетках, но и все линейные молекулы внехромосомной ДНК, обнаруженные в эукариотических клетках, также принимают эту инвертронную структуру с белком, прикрепленным к 5'-концу. [16] [17]
Длинные линейные « борги », которые встречаются вместе с видами архей , которые могут быть их хозяевами и имеют многие из их генов, могут быть неизвестной формой внехромосомных структур ДНК. [18] [19] [20]
Эукариотический
[ редактировать ]Митохондриальный
[ редактировать ]
Митохондрии , присутствующие в эукариотических клетках, содержат несколько копий митохондриальной ДНК (мтДНК) в митохондриальном матриксе . [21] У многоклеточных животных, включая человека, кольцевая хромосома мтДНК содержит 13 генов, кодирующих белки, входящие в электрон-транспортную цепь , и 24 гена митохондриальных РНК; эти гены разбиты на 2 гена рРНК и 22 гена тРНК . [22] Размер плазмиды мтДНК животного составляет примерно 16,6 т.п.н., и, хотя она содержит гены для синтеза тРНК и мРНК, белки, кодируемые ядерными генами, по-прежнему необходимы для репликации мтДНК или для трансляции митохондриальных белков. [23] Существует только одна область митохондриальной хромосомы, которая не содержит кодирующей последовательности, область размером 1 т.п.н., известная как D-петля , с которой связываются ядерные регуляторные белки. [22] Число молекул мтДНК на митохондрию варьируется от вида к виду, а также между клетками с разными энергетическими потребностями. Например, клетки мышц и печени содержат больше копий мтДНК на митохондрии, чем клетки крови и кожи. [23] Из-за близости цепи переноса электронов внутри внутренней мембраны митохондрий и продукции активных форм кислорода (АФК), а также из-за того, что молекула мтДНК не связана или не защищена гистонами, мтДНК более восприимчива к ДНК. повреждения, чем ядерная ДНК. [24] В тех случаях, когда повреждение мтДНК действительно происходит, ДНК может быть либо восстановлена с помощью путей эксцизионной репарации оснований , либо поврежденная молекула мтДНК разрушается (без повреждения митохондрии, поскольку на митохондрию приходится несколько копий мтДНК). [25]
Стандартный генетический код, с помощью которого транслируются ядерные гены, является универсальным, что означает, что каждая последовательность ДНК из трех оснований кодирует одну и ту же аминокислоту независимо от того, от какого вида происходит ДНК. Однако этот код достаточно универсален и несколько отличается в митохондриальной ДНК грибов, животных, простейших и растений. [21] Хотя большинство трехосновных последовательностей (кодонов) в мтДНК этих организмов кодируют те же аминокислоты, что и последовательности ядерного генетического кода, некоторые из них отличаются.
| Генетический код | Таблица перевода | задействован кодон ДНК | задействованный кодон РНК | Перевод с этим кодом | Сравнение с универсальным кодом |
|---|---|---|---|---|---|
| Митохондрии позвоночных | 2 | AGA | AGA | Ter (*) | Arg (R) |
AGG | AGG | Ter (*) | Arg (R) | ||
ATA | AUA | Met (M) | Ile (I) | ||
TGA | UGA | Trp (W) | Ter (*) | ||
| Дрожжевые митохондрии | 3 | ATA | AUA | Met (M) | Ile (I) |
CTT | CUU | Thr (T) | Leu (L) | ||
CTC | CUC | Thr (T) | Leu (L) | ||
CTA | CUA | Thr (T) | Leu (L) | ||
CTG | CUG | Thr (T) | Leu (L) | ||
TGA | UGA | Trp (W) | Ter (*) | ||
CGA | CGA | absent | Arg (R) | ||
CGC | CGC | absent | Arg (R) | ||
| Плесень, простейшие и кишечнополостные митохондрии | 4 и 7 | TGA | UGA | Trp (W) | Ter (*) |
| Митохондриальные беспозвоночных | 5 | AGA | AGA | Ser (S) | Arg (R) |
AGG | AGG | Ser (S) | Arg (R) | ||
ATA | AUA | Met (M) | Ile (I) | ||
TGA | UGA | Trp (W) | Ter (*) | ||
| Митохондрии иглокожих и плоских червей | 9 | AAA | AAA | Asn (N) | Lys (K) |
AGA | AGA | Ser (S) | Arg (R) | ||
AGG | AGG | Ser (S) | Arg (R) | ||
TGA | UGA | Trp (W) | Ter (*) | ||
| Асцидии митохондриальные | 13 | AGA | AGA | Gly (G) | Arg (R) |
AGG | AGG | Gly (G) | Arg (R) | ||
ATA | AUA | Met (M) | Ile (I) | ||
TGA | UGA | Trp (W) | Ter (*) | ||
| Альтернативные митохондрии плоских червей | 14 | AAA | AAA | Asn (N) | Lys (K) |
AGA | AGA | Ser (S) | Arg (R) | ||
AGG | AGG | Ser (S) | Arg (R) | ||
TAA | UAA | Tyr (Y) | Ter (*) | ||
TGA | UGA | Trp (W) | Ter (*) | ||
| Хлорофиковые митохондриальные | 16 | TAG | UAG | Leu (L) | Ter (*) |
| Трематода митохондриальная | 21 | TGA | UGA | Trp (W) | Ter (*) |
ATA | AUA | Met (M) | Ile (I) | ||
AGA | AGA | Ser (S) | Arg (R) | ||
AGG | AGG | Ser (S) | Arg (R) | ||
AAA | AAA | Asn (N) | Lys (K) | ||
| косая последовательность Митохондриальная | 22 | TCA | UCA | Ter (*) | Ser (S) |
TAG | UAG | Leu (L) | Ter (*) | ||
| Траустохитрий митохондриальный | 23 | TTA | UUA | Ter (*) | Leu (L) |
| Митохондрии птеробранхии | 24 | AGA | AGA | Ser (S) | Arg (R) |
AGG | AGG | Lys (K) | Arg (R) | ||
TGA | UGA | Trp (W) | Ter (*) |
| аминокислот Биохимические свойства | неполярный | полярный | базовый | кислый | Терминация: стоп-кодон |
Считается, что различия в кодировании являются результатом химических модификаций транспортных РНК , которые взаимодействуют с информационными РНК, образующимися в результате транскрипции последовательностей мтДНК. [26]
хлоропласт
[ редактировать ]Эукариотические хлоропласты , как и другие растительные пластиды , также содержат внехромосомные молекулы ДНК. Большинство хлоропластов хранят весь свой генетический материал в одной кольцевой хромосоме, однако у некоторых видов есть свидетельства наличия нескольких более мелких кольцевых плазмид . [27] [28] [29] Недавняя теория, ставящая под сомнение текущую стандартную модель кольцевой ДНК хлоропластов (хпДНК), предполагает, что хпДНК чаще может принимать линейную форму. [30] Одна молекула хпДНК может содержать от 100 до 200 генов. [31] и различаются по размеру от вида к виду. Размер хпДНК у высших растений составляет около 120–160 т.п.н. [21] Гены, обнаруженные в хпДНК, кодируют мРНК, которые отвечают за производство необходимых компонентов фотосинтетического пути , а также кодируют тРНК, рРНК , субъединицы РНК-полимеразы и субъединицы рибосомальных белков . [32] Как и мтДНК, хпДНК не является полностью автономной и зависит от продуктов ядерных генов для репликации и производства белков хлоропластов. Хлоропласты содержат несколько копий хпДНК, и их количество может варьироваться не только от вида к виду или от типа клетки к типу клеток, но также и внутри одной клетки в зависимости от возраста и стадии развития клетки. Например, содержание хпДНК в хлоропластах молодых клеток на ранних стадиях развития, когда хлоропласты имеют форму нечетких пропластид, намного выше, чем содержание хпДНК, когда эта клетка созревает и расширяется и содержит полностью зрелые пластиды. [33]
Круговой
[ редактировать ]Внехромосомная кольцевая ДНК (вкДНК) присутствует во всех эукариотических клетках , обычно происходит из геномной ДНК и состоит из повторяющихся последовательностей ДНК, обнаруженных как в кодирующих, так и в некодирующих областях хромосом. Размер EccDNA может варьироваться от менее 2000 пар оснований до более 20 000 пар оснований. [34] У растений вкДНК содержит повторяющиеся последовательности, подобные тем, которые встречаются в центромерных областях хромосом и в повторяющейся сателлитной ДНК. [35] Было показано, что у животных молекулы эккДНК содержат повторяющиеся последовательности, которые наблюдаются в сателлитной ДНК , 5S-рибосомальной ДНК и теломерной ДНК. [34] Некоторые организмы, такие как дрожжи, полагаются на репликацию хромосомной ДНК для производства вкДНК. [35] тогда как образование эккДНК может происходить у других организмов, таких как млекопитающие, независимо от процесса репликации. [36] Функция вкДНК широко не изучалась, но было высказано предположение, что производство элементов вкДНК из последовательностей геномной ДНК повышает пластичность эукариотического генома и может влиять на стабильность генома, старение клеток и эволюцию хромосом. [37]
В раковых клетках человека обычно наблюдается особый тип внехромосомной ДНК, обозначаемый как вкДНК. [2] [3] [4] вкДНК, обнаруженная в раковых клетках, содержит один или несколько генов, дающих селективное преимущество. вкДНК намного больше, чем вкДНК, и их можно увидеть с помощью световой микроскопии. Размер вкДНК при раке обычно варьируется от 1–3 МБ и выше. [2] Большие молекулы вкДНК были обнаружены в ядрах раковых клеток человека и, как было показано, несут множество копий онкогенов- драйверов , которые транскрибируются в опухолевых клетках. На основании этих данных считается, что вкДНК способствует росту рака.
Существуют специализированные инструменты, позволяющие идентифицировать вкДНК, такие как
- программное обеспечение, разработанное Полом Мишелем и Винет Бафна , которое позволяет идентифицировать вкДНК на микроскопических изображениях
- «Circle-Seq, метод физического выделения вкДНК из клеток, удаления любой оставшейся линейной ДНК с помощью ферментов и секвенирования оставшейся кольцевой ДНК», разработанный Биргитте Регенберг и ее командой из Копенгагенского университета. [38]
Популярный
[ редактировать ]Вирусная ДНК является примером внехромосомной ДНК. Понимание вирусных геномов очень важно для понимания эволюции и мутации вируса. [39] Некоторые вирусы, такие как ВИЧ и онкогенные вирусы , встраивают собственную ДНК в геном клетки-хозяина. [40] Вирусные геномы могут состоять из одноцепочечной ДНК ( оцДНК ), двухцепочечной ДНК ( дцДНК ) и могут находиться как в линейной, так и в кольцевой форме. [41]
Одним из примеров заражения вирусом, представляющим собой внехромосомную ДНК, является вирус папилломы человека ( ВПЧ ). Геном ДНК ВПЧ претерпевает три отдельные стадии репликации: становление, поддержание и амплификация. ВПЧ поражает эпителиальные клетки аногенитального тракта и полости рта. Обычно ВПЧ обнаруживается и уничтожается иммунной системой. Распознавание вирусной ДНК является важной частью иммунного ответа. Чтобы этот вирус сохранялся, кольцевой геном должен реплицироваться и наследоваться во время деления клеток. [42]
Распознавание клеткой-хозяином
[ редактировать ]Клетки могут распознавать чужеродную цитоплазматическую ДНК. Понимание путей распознавания имеет значение для профилактики и лечения заболеваний. [43] Клетки имеют сенсоры, которые могут специфически распознавать вирусную ДНК, например, путь Toll-подобного рецептора (TLR). [44]
Путь Толла был признан сначала у насекомых как путь, который позволяет определенным типам клеток действовать как сенсоры, способные обнаруживать различные бактериальные или вирусные геномы и PAMPS ( молекулярные структуры, связанные с патогенами ). Известно, что PAMP являются мощными активаторами передачи сигналов врожденного иммунитета . Существует около 10 человеческих Toll-подобных рецепторов (TLR). Различные TLR у человека обнаруживают разные PAMPS: липополисахариды с помощью TLR4 , вирусную дсРНК с помощью TLR3 , вирусную оцРНК с помощью TLR7 / TLR8 , вирусную или бактериальную неметилированную ДНК с помощью TLR9 . TLR9 эволюционировал для обнаружения ДНК CpG, обычно встречающейся в бактериях и вирусах, и для инициации производства IFN (интерферонов I типа) и других цитокинов . [44]
Наследование
[ редактировать ]
Наследование внехромосомной ДНК отличается от наследования ядерной ДНК, обнаруженной в хромосомах. В отличие от хромосом, вкДНК не содержит центромеры и, следовательно, демонстрирует неменделевский тип наследования, который приводит к образованию гетерогенных клеточных популяций. У человека практически вся цитоплазма наследуется от яйцеклетки матери. [45] По этой причине ДНК органелл, включая мтДНК, наследуется от матери. Мутации мтДНК или другой цитоплазматической ДНК также передаются по наследству от матери. Это однородительское наследование является примером неменделевского наследования . Растения также демонстрируют однородительское наследование мтДНК. Большинство растений наследуют мтДНК по материнской линии, за одним отмеченным исключением является секвойя вечнозеленая Sequoia sempervirens , которая наследует мтДНК по отцовской линии. [46]
Существуют две теории, почему отцовская мтДНК редко передается потомству. Во-первых, это просто тот факт, что отцовская мтДНК имеет более низкую концентрацию, чем материнская мтДНК, и поэтому ее невозможно обнаружить у потомства. Вторая, более сложная теория предполагает переваривание отцовской мтДНК для предотвращения ее наследования. Предполагается, что однородительское наследование мтДНК, которая имеет высокую частоту мутаций , может быть механизмом поддержания гомоплазмии цитоплазматической ДНК. [46]
Клиническое значение
[ редактировать ]Иногда называемые EE, внехромосомные элементы, связаны с геномной нестабильностью у эукариот. Малые полидисперсные ДНК (spcDNA), тип вкДНК, обычно обнаруживаются в связи с нестабильностью генома. SpcDNA происходят из повторяющихся последовательностей, таких как сателлитная ДНК , ретровирусоподобные элементы ДНК и мобильные элементы генома. Считается, что они являются продуктами перестройки генов.
Внехромосомная ДНК ( вкДНК ), обнаруживаемая при раке, исторически называлась двухминутными представляют собой парные хроматиновые тельца хромосомами (DM), которые под световой микроскопией . Двойные минутные хромосомы составляют ~ 30% спектра вкДНК, содержащего рак, включая отдельные тельца, и было обнаружено, что они содержат идентичное содержание генов, что и отдельные тельца. [3] Обозначение вкДНК охватывает все формы большой, содержащей онкоген, внехромосомной ДНК, обнаруженной в раковых клетках. Этот тип вкДНК обычно встречается в раковых клетках различной гистологии, но практически никогда не встречается в нормальных клетках. [3] Считается, что вкДНК образуется в результате двухцепочечных разрывов хромосом или чрезмерной репликации ДНК в организме. Исследования показывают, что в случаях рака и других геномных нестабильностей можно наблюдать более высокие уровни ЭЭ. [5]
Митохондриальная ДНК может играть роль в возникновении заболевания по-разному. Точечные мутации или альтернативное расположение генов мтДНК связаны с рядом заболеваний, поражающих сердце, центральную нервную систему , эндокринную систему , желудочно-кишечный тракт, глаза и почки. [22] Потеря количества мтДНК, присутствующей в митохондриях, может привести к целому подмножеству заболеваний, известных как синдромы митохондриального истощения (MDD), которые поражают печень, центральную и периферическую нервную систему, гладкие мышцы и слух у людей. [23] Результаты исследований, пытающихся связать количество копий мтДНК с риском развития некоторых видов рака, были неоднозначными, а иногда и противоречивыми. Были проведены исследования, которые показывают связь между повышенным и пониженным уровнем мтДНК и повышенным риском развития рака молочной железы . положительная связь между повышенными уровнями мтДНК и повышенным риском развития опухолей почек, Наблюдалась но, по-видимому, связи между уровнями мтДНК и развитием рака желудка не существует . [47]
Внехромосомная ДНК обнаружена у Apicomplexa , группы простейших . Малярийный возбудитель паразит (род Plasmodium), а также СПИДа ( Taxoplasma и Cryptosporidium ) являются членами группы Apicomplexa. Митохондриальная ДНК (мтДНК) была обнаружена у малярийного паразита. [48] У малярийных паразитов обнаружены две формы внехромосомной ДНК. Одна из них представляет собой линейную ДНК размером 6 т.п.н., а вторая — кольцевую ДНК размером 35 т.п.н. Эти молекулы ДНК были исследованы как потенциальные нуклеотидные сайты-мишени для антибиотиков . [49]
Роль вкДНК при раке
[ редактировать ]Амплификация генов является одним из наиболее распространенных механизмов активации онкогенов . Амплификации генов при раке часто происходят на внехромосомных кольцевых элементах. [50] [4] Одной из основных функций вкДНК при раке является обеспечение возможности опухоли быстро достигать большого количества копий от клетки к клетке , а также содействие быстрой и массовой генетической гетерогенности . [3] [8] Наиболее часто амплифицированные онкогены при раке обнаруживаются в вкДНК и, как было показано, являются очень динамичными, реинтегрируясь в ненативные хромосомы в виде гомогенных областей окрашивания (HSR). [51] [3] и изменение количества копий и состава в ответ на различные медикаментозные методы лечения. [52] [7] [53]
вкДНК ответственна за большое количество более поздних и наиболее серьезных видов рака, а также за устойчивость к противораковым препаратам. [54]
Круглая форма вкДНК существенно отличается от линейной структуры хромосомной ДНК, что влияет на патогенез рака . [55] Онкогены , кодируемые вкДНК, обладают огромным транскрипционным потенциалом, входя в 1% лучших генов во всем транскриптоме . В отличие от бактериальных плазмид или митохондриальной ДНК, вкДНК хроматинизирована и содержит высокий уровень активных меток гистонов, но мало репрессивных меток гистонов. вкДНК В архитектуре хроматина отсутствует уплотнение высшего порядка, которое присутствует в хромосомной ДНК, и она является одной из наиболее доступных ДНК во всем раковом геноме.
ВкДНК могут быть сгруппированы внутри ядра, которое можно назвать хабами вкДНК. [56] В пространственном отношении концентраторы вкДНК могут вызывать межмолекулярные взаимодействия энхансер-ген, способствуя сверхэкспрессии онкогенов.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Раш М.Г., Мисра Р. (ноябрь 1985 г.). «Внехромосомная ДНК у эукариот». Плазмида . 14 (3): 177–91. дои : 10.1016/0147-619X(85)90001-0 . ПМИД 3912782 .
- ^ Перейти обратно: а б с д Верхаак Р.Г., Бафна В., Мишель П.С. (май 2019 г.). «Внехромосомная амплификация онкогенов в патогенезе и эволюции опухолей» . Обзоры природы. Рак . 19 (5): 283–288. дои : 10.1038/s41568-019-0128-6 . ПМЦ 7168519 . ПМИД 30872802 .
- ^ Перейти обратно: а б с д и ж г Тернер К.М., Дешпанде В., Бейтер Д., Кога Т., Русерт Дж., Ли С. и др. (март 2017 г.). «Внехромосомная амплификация онкогенов стимулирует эволюцию опухолей и генетическую гетерогенность» . Природа . 543 (7643): 122–125. Бибкод : 2017Natur.543..122T . дои : 10.1038/nature21356 . ПМЦ 5334176 . ПМИД 28178237 .
- ^ Перейти обратно: а б с «Рак может быть вызван ДНК вне хромосом» . Журнал «Ученый»® . Проверено 05 октября 2021 г.
- ^ Перейти обратно: а б Каттлер Ф., Май С. (февраль 2007 г.). «Образование неслучайных экстрахромосомных элементов в процессе развития, дифференцировки и онкогенеза». Семинары по биологии рака . 17 (1): 56–64. дои : 10.1016/j.semcancer.2006.10.007 . ПМИД 17116402 .
- ^ Альбертс Б., Брэй Д., Хопкин К., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2014). Основная клеточная биология (Четвертое изд.). Нью-Йорк, Нью-Йорк, США: Garland Science. п. 449. ИСБН 978-0-8153-4454-4 .
- ^ Перейти обратно: а б Натансон Д.А., Джини Б., Моттахеде Дж., Висней К., Кога Т., Гомес Г. и др. (январь 2014 г.). «Сопротивление таргетной терапии, опосредованное динамической регуляцией внехромосомной мутантной ДНК EGFR» . Наука . 343 (6166): 72–6. Бибкод : 2014Sci...343...72N . дои : 10.1126/science.1241328 . ПМК 4049335 . ПМИД 24310612 .
- ^ Перейти обратно: а б деКарвалью А.С., Ким Х., Пуассон Л.М., Винн М.Э., Мюллер С., Черба Д. и др. (май 2018 г.). «Диссогласительное наследование хромосомных и внехромосомных элементов ДНК способствует динамическому развитию заболевания при глиобластоме» . Природная генетика . 50 (5): 708–717. дои : 10.1038/s41588-018-0105-0 . ПМЦ 5934307 . ПМИД 29686388 .
- ^ Кох Дж., Фогт Г., Киссель В. (май 1983 г.). «Цитоплазматическая ДНК структурно отличается от ядерной ДНК». Die Naturwissenschaften . 70 (5): 252–4. Бибкод : 1983NW.....70..252K . дои : 10.1007/BF00405447 . ПМИД 6877387 . S2CID 9721603 .
- ^ Перейти обратно: а б Нельсон Д. (2008). Ленингерские принципы биохимии . Нью-Йорк: WH Freeman and Company. стр. 307–308 . ISBN 978-0-7167-7108-1 .
- ^ Уотсон Дж (2007). Рекомбинантная РНК: гены и геномы – краткий курс . Нью-Йорк: WH Freeman and Company. п. 81. ИСБН 978-0-7167-2866-5 .
- ^ Диб Дж.Р., Либл В., Вагенкнехт М., Фариас М.Е., Мейнхардт Ф. (январь 2013 г.). «Внехромосомные генетические элементы микрококка». Прикладная микробиология и биотехнология . 97 (1): 63–75. дои : 10.1007/s00253-012-4539-5 . ПМИД 23138713 . S2CID 5623260 .
- ^ Барнум С. (2005). Биотехнология. Введение . Калифорния: Брукс / Коул. стр. 62–63. ISBN 978-0-495-11205-1 .
- ^ Ледди диджей, Вайнер Д.Б. (2006). «От плазмид к защите: обзор ДНК-вакцин против инфекционных заболеваний». Международные обзоры иммунологии . 25 (3–4): 99–123. дои : 10.1080/08830180600785827 . ПМИД 16818367 . S2CID 38432882 .
- ^ Онкудон CM, Хо Дж, Данкуа МК (март 2011 г.). «Смягчение надвигающегося кризиса вакцин: производство и доставка вакцин на основе плазмид» (PDF) . Критические обзоры по биотехнологии . 31 (1): 32–52. дои : 10.3109/07388551.2010.483460 . ПМИД 20879832 . S2CID 207467603 .
- ^ Перейти обратно: а б с Хиннебуш Дж., Тилли К. (декабрь 1993 г.). «Линейные плазмиды и хромосомы бактерий» . Молекулярная микробиология . 10 (5): 917–22. дои : 10.1111/j.1365-2958.1993.tb00963.x . ПМИД 7934868 . S2CID 23852021 .
- ^ Перейти обратно: а б Мейнхардт Ф., Шаффрат Р., Ларсен М. (апрель 1997 г.). «Микробные линейные плазмиды». Прикладная микробиология и биотехнология . 47 (4): 329–36. дои : 10.1007/s002530050936 . ПМИД 9163946 . S2CID 8092364 .
- ^ Танец, Эмбер (16 июля 2021 г.). «Массивные структуры ДНК «боргов» озадачивают ученых» . Природа . 595 (7869): 636. Бибкод : 2021Natur.595..636D . дои : 10.1038/d41586-021-01947-3 . S2CID 236001172 .
- ^ Эндрю, Шекспир, Уильям Гурр (30 июля 2021 г.). «Ранее не обнаруженные ДНК-«борги» обнаружены на водно-болотных угодьях Калифорнии» . Независимый . Проверено 13 августа 2021 г.
{{cite news}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Аль-Шайеб, Басем; Шельмерих, Мари К.; Вест-Робертс, Джейкоб; Валентин-Альварадо, Луис Э.; Сачдева, Рохан; Маллен, Сьюзен; Критс-Кристоф, Александр; Уилкинс, Майкл Дж.; Уильямс, Кеннет Х.; Дудна, Дженнифер А.; Банфилд, Джиллиан Ф. (10 июля 2021 г.). «Борги — это гигантские внехромосомные элементы, способные усиливать окисление метана» . bioRxiv : 2021.07.10.451761. дои : 10.1101/2021.07.10.451761 . S2CID 235812990 . Проверено 13 августа 2021 г.
- ^ Перейти обратно: а б с Лодиш Х (2013). Молекулярно-клеточная биология, 7-е издание . Нью-Йорк: WH Freeman and Company. стр. 245–251. ISBN 978-1-4641-2398-6 .
- ^ Перейти обратно: а б с Чиннери П.Ф., Тернбулл Д.М. (июль 1999 г.). «Митохондриальная ДНК и болезни» . Ланцет . 354 Приложение 1 (9176): SI17-21. дои : 10.1016/S0140-6736(99)90244-1 . ПМИД 10437851 . S2CID 38869885 .
- ^ Перейти обратно: а б с Диммок Д., Тан Л.И., Шмитт Э.С., Вонг Л.Дж. (июль 2010 г.). «Количественная оценка синдрома истощения митохондриальной ДНК». Клиническая химия . 56 (7): 1119–27. дои : 10.1373/clinchem.2009.141549 . ПМИД 20448188 .
- ^ Бор В.А., Энсон Р.М. (август 1999 г.). «Пути восстановления митохондриальной ДНК». Журнал биоэнергетики и биомембран . 31 (4): 391–8. дои : 10.1023/А:1005484004167 . PMID 10665528 . S2CID 43100873 .
- ^ Бендич А.Дж. (июнь 2010 г.). «Митохондриальная ДНК, ДНК хлоропластов и истоки развития эукариотических организмов» . Биология Директ . 5 (42): 42. дои : 10.1186/1745-6150-5-42 . ПМК 2907347 . ПМИД 20587059 .
- ^ Бернт М., Брабанд А., Шируотер Б., Штадлер П.Ф. (ноябрь 2013 г.). «Генетические аспекты эволюции митохондриального генома». Молекулярная филогенетика и эволюция . 69 (2): 328–38. дои : 10.1016/j.ympev.2012.10.020 . ПМИД 23142697 .
- ^ Клегг М.Т., Гаут Б.С., Жир Г.Х., Мортон Б.Р. (июль 1994 г.). «Скорости и закономерности эволюции ДНК хлоропластов» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (15): 6795–801. Бибкод : 1994PNAS...91.6795C . дои : 10.1073/pnas.91.15.6795 . ПМЦ 44285 . ПМИД 8041699 .
- ^ Лилли Дж.В., Хэви М.Дж., Джексон С.А., Цзян Дж. (февраль 2001 г.). «Цитогеномный анализ выявляет структурную пластичность генома хлоропластов высших растений» . Растительная клетка . 13 (2): 245–54. дои : 10.1105/tpc.13.2.245 . ПМЦ 102240 . ПМИД 11226183 .
- ^ Аронссон Х., Санделиус А.С. (2009). Взаимодействие хлоропластов с окружающей средой ([Онлайн-Аусг.]. Под ред.). Берлин: Шпрингер. п. 18. ISBN 978-3540686965 .
- ^ Бендич А.Дж. (июль 2004 г.). «Круглые хромосомы хлоропластов: великая иллюзия» . Растительная клетка . 16 (7): 1661–6. дои : 10.1105/tpc.160771 . ПМК 514151 . ПМИД 15235123 .
- ^ Ван Ю, Дин Дж, Дэниел Х, Ху Х, Ли Икс (сентябрь 2012 г.). «Анализ мотивов раскрывает возможную совместную регуляцию генов хлоропластов и ядерных генов, кодирующих белки хлоропластов». Молекулярная биология растений . 80 (2): 177–87. дои : 10.1007/s11103-012-9938-6 . ПМИД 22733202 . S2CID 18567678 .
- ^ Пфальц Дж., Пфанншмидт Т. (апрель 2013 г.). «Основные нуклеоидные белки на раннем этапе развития хлоропластов». Тенденции в науке о растениях . 18 (4): 186–94. doi : 10.1016/j.tplants.2012.11.003 . ПМИД 23246438 .
- ^ Роуэн Б.А., Бендич А.Дж. (2009). «Потеря ДНК хлоропластов по мере взросления листьев: факт или артефакт?» . Журнал экспериментальной ботаники . 60 (11): 3005–10. дои : 10.1093/jxb/erp158 . ПМИД 19454766 .
- ^ Перейти обратно: а б Коэн С., Хубен А., Сигал Д. (март 2008 г.). «Внехромосомная кольцевая ДНК, полученная из тандемно повторяющихся геномных последовательностей растений» . Заводской журнал . 53 (6): 1027–34. дои : 10.1111/j.1365-313X.2007.03394.x . ПМИД 18088310 .
- ^ Коэн З., Лави С. (июль 2009 г.). Салливан Б.А. (ред.). «Независимое от репликации образование внехромосомной кольцевой ДНК в бесклеточной системе млекопитающих» . ПЛОС ОДИН . 4 (7): е6126. Бибкод : 2009PLoSO...4.6126C . дои : 10.1371/journal.pone.0006126 . ПМЦ 2699479 . ПМИД 19568438 .
- ^ Коэн С., Агмон Н., Соболь О., Сигал Д. (март 2010 г.). «Внехромосомные круги сателлитных повторов и 5S рибосомальная ДНК в клетках человека» . Мобильная ДНК . 1 (1): 11. дои : 10.1186/1759-8753-1-11 . ПМЦ 3225859 . ПМИД 20226008 .
- ^ «Любопытные круги ДНК, из-за которых так сложно лечить рак» . cen.acs.org . Проверено 2 октября 2021 г.
- ^ Санхуан Р., Небот М.Р., Кирико Н., Мански Л.М., Белшоу Р. (октябрь 2010 г.). «Темпы вирусных мутаций» . Журнал вирусологии . 84 (19): 9733–48. дои : 10.1128/JVI.00694-10 . ПМЦ 2937809 . ПМИД 20660197 .
- ^ Сильверторн ДУ (2007). Физиология человека . Писон/Бенджамин Каммингс.
- ^ «Вирусные геномы» .
- ^ Лоренц Л.Д., Ривера Кардона Дж., Ламберт П.Ф. (октябрь 2013 г.). Роман А (ред.). «Инактивация р53 спасает сохранение геномов ДНК ВПЧ высокого риска с дефицитом экспрессии E6» . ПЛОС Патогены . 9 (10): e1003717. дои : 10.1371/journal.ppat.1003717 . ПМЦ 3812038 . ПМИД 24204267 .
- ^ Барбер Г.Н. (сентябрь 2011 г.). «Пути врожденного иммунитета цитоплазматической ДНК». Иммунологические обзоры . 243 (1): 99–108. дои : 10.1111/j.1600-065X.2011.01051.x . ПМИД 21884170 . S2CID 205826027 .
- ^ Перейти обратно: а б Барбер Г.Н. (февраль 2011 г.). «Пути восприятия ДНК врожденного иммунитета: STING, AIMII и регуляция выработки интерферона и воспалительных реакций» . Современное мнение в иммунологии . 23 (1): 10–20. дои : 10.1016/j.coi.2010.12.015 . ПМЦ 3881186 . ПМИД 21239155 .
- ^ Гриффитс Эй Джей (2000). Введение в генетический анализ . Нью-Йорк: WHFreeman.
- ^ Перейти обратно: а б Сато М., Сато К. (август 2013 г.). «Материнское наследование митохондриальной ДНК с помощью различных механизмов элиминации отцовской митохондриальной ДНК» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1833 (8): 1979–84. дои : 10.1016/j.bbamcr.2013.03.010 . ПМИД 23524114 .
- ^ Тьягараджан Б., Ван Р., Нельсон Х., Барсело Х., Ко В.П., Юань Дж.М. (июнь 2013 г.). Бай Ю (ред.). «Число копий митохондриальной ДНК связано с риском рака молочной железы » ПЛОС ОДИН . 8 (6): e65968. Бибкод : 2013PLoSO...865968T . дои : 10.1371/journal.pone.0065968 . ПМЦ 3680391 . ПМИД 23776581 .
- ^ Уилсон Р.Дж., Уильямсон Д.Х. (март 1997 г.). «Внехромосомная ДНК в апикомплексе» . Обзоры микробиологии и молекулярной биологии . 61 (1): 1–16. дои : 10.1128/ммбр.61.1.1-16.1997 . ПМК 232597 . ПМИД 9106361 .
- ^ Кризи А., Мендис К., Карлтон Дж., Уильямсон Д., Уилсон И., Картер Р. (май 1994 г.). «Материнское наследование внехромосомной ДНК у малярийных паразитов». Молекулярная и биохимическая паразитология . 65 (1): 95–8. дои : 10.1016/0166-6851(94)90118-X . ПМИД 7935632 .
- ^ Ким Х., Нгуен Н.П., Тернер К., Ву С., Гуджар А.Д., Любек Дж. и др. (август 2020 г.). «Внехромосомная ДНК связана с амплификацией онкогенов и плохим исходом при множественных видах рака» . Природная генетика . 52 (8): 891–897. дои : 10.1038/s41588-020-0678-2 . ПМК 7484012 . ПМИД 32807987 .
- ^ Сторлацци К.Т., Лоноче А., Гуастадисени М.К., Тромбетта Д., Д'Аддаббо П., Даниэле Г. и др. (сентябрь 2010 г.). «Амплификация генов в виде двойных минут или гомогенно окрашенных областей в солидных опухолях: происхождение и структура» . Геномные исследования . 20 (9): 1198–206. дои : 10.1101/гр.106252.110 . ПМЦ 2928498 . ПМИД 20631050 .
- ^ Фон Хофф Д.Д., МакГилл-младший, Форсет Б.Дж., Дэвидсон К.К., Брэдли Т.П., Ван Девантер Д.Р., Валь Г.М. (сентябрь 1992 г.). «Устранение экстрахромосомно амплифицированных генов MYC из опухолевых клеток человека снижает их онкогенность» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (17): 8165–9. Бибкод : 1992PNAS...89.8165V . дои : 10.1073/pnas.89.17.8165 . ПМК 49877 . ПМИД 1518843 .
- ^ Сюй К., Дин Л., Чанг Т.С., Шао Ю., Чан Дж., Малдер Х. и др. (январь 2019 г.). «Структура и эволюция двойных минут в диагностике и рецидивах опухолей головного мозга» . Акта Нейропатологика . 137 (1): 123–137. дои : 10.1007/s00401-018-1912-1 . ПМК 6338707 . ПМИД 30267146 .
- ^ Маккай, Робин; Роуз, Джей Си; Чен, CY; Пичугин Ю.; Се, Л.; Тан, Дж.; Хунг, КЛ; Йост, Кентукки; Ши, К.; Эрб, МЛ; Раджкумар, У.; Ву, С.; Ташнер-Мандл, С.; Бернкопф, М.; Суонтон, К.; Лю, З.; Хуанг, В.; Чанг, Хай; Бафна, В.; Хенссен, АГ; Вернер, Б.; Мишель, П.С. (18 февраля 2023 г.). « ДНК «злодея Бонда» может изменить лечение рака, говорят ученые» . Наблюдатель . 54 (10): 1527–1533. дои : 10.1038/s41588-022-01177-x . ПМЦ 9534767 . ПМИД 36123406 .
- ^ Ву С., Тернер К.М., Нгуен Н., Равирам Р., Эрб М., Сантини Дж. и др. (ноябрь 2019 г.). «Круговая вкДНК способствует доступности хроматина и высокой экспрессии онкогенов» . Природа . 575 (7784): 699–703. Бибкод : 2019Natur.575..699W . дои : 10.1038/s41586-019-1763-5 . ПМЦ 7094777 . ПМИД 31748743 .
- ^ Хунг, король Л.; Йост, Кэтрин Э.; Се, Лянци; Ши, Цюаньмин; Хельмсауэр, Константин; Любек, Йенс; Шёпфлин, Роберт; Ланге, Джошуа Т.; Чаморро Гонсалес, Росио; Вайзер, Наташа Э.; Чен, Селин (декабрь 2021 г.). «Концентраторы вкДНК управляют совместной межмолекулярной экспрессией онкогенов» . Природа . 600 (7890): 731–736. Бибкод : 2021Natur.600..731H . дои : 10.1038/s41586-021-04116-8 . ISSN 1476-4687 . ПМЦ 9126690 . ПМИД 34819668 .
Дальнейшее чтение
[ редактировать ]- Богенхаген Д.Ф. (2012). «Структура нуклеоида митохондриальной ДНК». Biochimica et Biophysica Acta (BBA) - Механизмы регуляции генов . 1819 (9–10): 914–20. дои : 10.1016/j.bbagrm.2011.11.005 . ПМИД 22142616 .
- Кара А., Рейц М.С. (сентябрь 1997 г.). «Новый взгляд на роль внехромосомной ретровирусной ДНК». Лейкемия . 11 (9): 1395–9. дои : 10.1038/sj.leu.2400776 . ПМИД 9305590 . S2CID 12624364 .
- Коэн С., Якоби К., Сигал Д. (июнь 2003 г.). «Внехромосомная кольцевая ДНК тандемно повторяющихся геномных последовательностей у дрозофилы» . Геномные исследования . 13 (6А): 1133–45. дои : 10.1101/гр.907603 . ПМК 403641 . ПМИД 12799349 .
- Коэн С., Мечали М. (декабрь 2002 г.). «Формирование внехромосомных кругов из теломерной ДНК у Xenopus laevis» . Отчеты ЭМБО . 3 (12): 1168–74. doi : 10.1093/embo-reports/kvf240 . ПМК 1308322 . ПМИД 12446568 .
- Колозимо А., Гуида В., Палка Г., Даллапиккола Б. (июнь 2002 г.). «Внехромосомные гены: мощный инструмент в подходах к таргетированию генов» . Генная терапия . 9 (11): 679–82. дои : 10.1038/sj.gt.3301749 . ПМИД 12032686 .
- Каммингс Д. (1979). Внехромосомная ДНК . Нью-Йорк: Academic Press Inc.
- Гебель В. (август 1970 г.). «Исследование внехромосомных элементов ДНК. Репликация колициногенного фактора Col E1 у двух термочувствительных мутантов Escherichia coli, дефектных по репликации ДНК» . Европейский журнал биохимии . 15 (2): 311–20. дои : 10.1111/j.1432-1033.1970.tb01009.x . ПМИД 4926129 .
- Джабаджи-Харе SH, Burger G, Forget L, Lang BF (май 1994 г.). «Внехромосомные плазмиды фитопатогенного гриба Rhizoctonia solani». Современная генетика . 25 (5): 423–31. дои : 10.1007/BF00351781 . ПМИД 8082188 . S2CID 20902405 .
- Преер-младший (1971). «Внехромосомное наследование: наследственные симбионты, митохондрии, хилоропласты». Ежегодный обзор генетики . 5 : 361–406. дои : 10.1146/annurev.ge.05.120171.002045 . ПМИД 16097660 .
- Шибата Ю., Кумар П., Слой Р., Уиллкокс С., Гаган Дж. Р., Гриффит Дж. Д., Датта А. (апрель 2012 г.). «Внехромосомные микроДНК и хромосомные микроделеции в нормальных тканях» . Наука . 336 (6077): 82–6. Бибкод : 2012Sci...336...82S . дои : 10.1126/science.1213307 . ПМК 3703515 . ПМИД 22403181 .
- Слоан Д.Б. (декабрь 2013 г.). «Одно кольцо, чтобы управлять всеми? Секвенирование генома дает новое понимание модели «главного круга» структуры митохондриальной ДНК растений» . Новый фитолог . 200 (4): 978–85. дои : 10.1111/nph.12395 . ПМИД 24712049 . S2CID 13445964 .
- Ватве М.М., Даханукар Н., Ватве М.Г. (февраль 2010 г.). Гетц В.М. (ред.). «Социобиологический контроль количества копий плазмид у бактерий» . ПЛОС ОДИН . 5 (2): е9328. Бибкод : 2010PLoSO...5.9328W . дои : 10.1371/journal.pone.0009328 . ПМЦ 2827543 . ПМИД 20195362 .