Митохондриальный матрикс
| Клеточная биология | |
|---|---|
| митохондрия | |
 Компоненты типичной митохондрии
3 Ламели
4 Митохондриальная ДНК |
В митохондриях матрикс – это пространство внутри внутренней мембраны . Слово «матрица» происходит от того факта, что это пространство вязкое по сравнению с относительно водной цитоплазмой. Митохондриальный матрикс содержит митохондриальную ДНК , рибосомы , растворимые ферменты , небольшие органические молекулы, нуклеотидные кофакторы и неорганические ионы . [1] Ферменты в матриксе облегчают реакции, ответственные за производство АТФ , такие как цикл лимонной кислоты , окислительное фосфорилирование , окисление пирувата и бета-окисление жирных кислот . [1]
Состав матрицы, основанный на ее структуре и содержании, создает среду, которая позволяет анаболическим и катаболическим благоприятно протекать путям. Цепь переноса электронов и ферменты матрикса играют большую роль в цикле лимонной кислоты и окислительном фосфорилировании . Цикл лимонной кислоты производит НАДН и ФАДН2 посредством окисления, которые будут восстанавливаться при окислительном фосфорилировании с образованием АТФ . [2] [3]
Цитозольный компартмент межмембранного пространства имеет более высокое содержание воды: белка, около 3,8 мкл/мг белка по сравнению с содержанием в митохондриальном матриксе, где такие уровни обычно составляют около 0,8 мкл/мг белка. [4] Неизвестно, как митохондрии поддерживают осмотический баланс внутренней митохондриальной мембраны, хотя мембрана содержит аквапорины , которые, как полагают, являются проводниками регулируемого транспорта воды. Митохондриальный матрикс имеет pH около 7,8, что выше pH межмембранного пространства митохондрий, составляющего около 7,0–7,4. [5] Митохондриальная ДНК была открыта Нэшем и Маргит в 1963 году. В митохондриальном матриксе присутствует от одной до многих двухцепочечных, преимущественно кольцевых ДНК. Митохондриальная ДНК составляет 1% от общей ДНК клетки. Он богат содержанием гуанина и цитозина и у человека имеет материнское происхождение. Митохондрии млекопитающих имеют 55s рибосомы.
Состав
[ редактировать ]Метаболиты
[ редактировать ]Матрикс является хозяином широкого спектра метаболитов, участвующих в процессах внутри матрикса. Цикл лимонной кислоты включает ацил-КоА , пируват , ацетил-КоА , цитрат , изоцитрат , α-кетоглутарат , сукцинил-КоА , фумарат , сукцинат , L -малат и оксалоацетат . [2] В цикле мочевины используются L -орнитин , карбамоилфосфат и L -цитруллин . [4] Цепь переноса электронов окисляет коферменты НАДН и ФАДН2 . В синтезе белка используются митохондриальная ДНК , РНК и тРНК . [5] В регуляции процессов используются ионы ( Ca 2+ / К + / Мг + ). [6] присутствующими в матрице, являются CO 2 , H 2 O , O 2 , АТФ , АДФ и Pi Дополнительными метаболитами , . [1]
Ферменты
[ редактировать ]Ферменты, отвечающие за процессы, происходящие в матрице. Цикл лимонной кислоты облегчается пируватдегидрогеназой , цитратсинтазой , аконитазой , изоцитратдегидрогеназой , α-кетоглутаратдегидрогеназой , сукцинил-КоА-синтетазой , фумаразой и малатдегидрогеназой . [2] Цикл мочевины облегчается карбамоилфосфатсинтетазой I и орнитинтранскарбамилазой . [4] В β-окислении используются пируваткарбоксилаза , ацил-КоА-дегидрогеназа и β-кетотиолаза . [1] Производство аминокислот обеспечивается трансаминазами . [7] Метаболизм аминокислот опосредован протеазами , такими как протеаза препоследовательности . [8]
Компоненты внутренней мембраны
[ редактировать ]Внутренняя мембрана представляет собой фосфолипидный бислой , содержащий комплексы окислительного фосфорилирования. который содержит цепь переноса электронов , которая находится на кристах внутренней мембраны и состоит из четырех белковых комплексов и АТФ-синтазы . Этими комплексами являются комплекс I (НАДН: кофермент Q оксидоредуктаза), комплекс II (сукцинат: кофермент Q оксидоредуктаза), комплекс III (коэнзим Q: цитохром с оксидоредуктаза) и комплекс IV (цитохром с оксидаза). [6]
Контроль внутренней мембраны над составом матрицы
[ редактировать ]Цепь переноса электронов отвечает за установление pH и электрохимического градиента , который облегчает выработку АТФ посредством перекачки протонов. Градиент также обеспечивает контроль концентрации таких ионов, как Ca. 2+ обусловлен мембранным потенциалом митохондрий. [1] Мембрана позволяет только неполярным молекулам, таким как CO 2 и O 2 , и небольшим незаряженным полярным молекулам, таким как H 2 O. проникать в матрицу Молекулы входят и выходят из митохондриального матрикса посредством транспортных белков и переносчиков ионов . Молекулы затем могут покинуть митохондрии через порины . [9] Эти приписываемые характеристики позволяют контролировать концентрации ионов и метаболитов, необходимых для регуляции, и определяют скорость производства АТФ. [10] [11]
Процессы
[ редактировать ]Цикл лимонной кислоты
[ редактировать ]После гликолиза цикл лимонной кислоты активируется за счет выработки ацетил-КоА. Окисление пирувата пируватдегидрогеназой в матриксе приводит к образованию CO 2 , ацетил-КоА и НАДН. Бета-окисление жирных кислот служит альтернативным путем катаболизма , который производит ацетил-КоА, НАДН и ФАДН 2 . [1] Производство ацетил-КоА запускает цикл лимонной кислоты, в то время как вырабатываемые коферменты используются в цепи переноса электронов . [11]
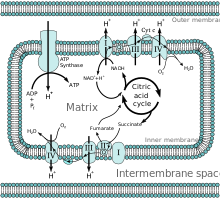
Все ферменты цикла лимонной кислоты находятся в матриксе (например, цитратсинтаза , изоцитратдегидрогеназа , α-кетоглутаратдегидрогеназа , фумараза и малатдегидрогеназа ), за исключением сукцинатдегидрогеназы , которая находится на внутренней мембране и является частью белкового комплекса II в матриксе. цепь переноса электронов . Цикл производит коферменты НАДН и ФАДН 2 посредством окисления углерода в двух циклах. Окисление НАДН и ФАДН 2 приводит к образованию ГТФ из сукцинил-КоА-синтетазы. [2]
Окислительное фосфорилирование
[ редактировать ]НАДН и ФАДН 2 производятся в матриксе или транспортируются через порины и транспортные белки, чтобы подвергнуться окислению посредством окислительного фосфорилирования. [1] НАДН и ФАДН 2 подвергаются окислению в цепи переноса электронов путем переноса электронов для регенерации НАД. + и ФАД . Протоны втягиваются в межмембранное пространство за счет энергии электронов, проходящих через цепь переноса электронов. Четыре электрона наконец принимаются кислородом в матрице, завершая цепь переноса электронов. Протоны возвращаются в митохондриальный матрикс через белок АТФ-синтазу . Энергия используется для вращения АТФ-синтазы, которая облегчает прохождение протона, производя АТФ. Разница pH между матриксом и межмембранным пространством создает электрохимический градиент, благодаря которому АТФ-синтаза может благоприятно передавать протон в матрикс. [6]
Цикл мочевины
[ редактировать ]Первые два этапа цикла мочевины происходят в митохондриальном матриксе клеток печени и почек. На первом этапе аммиак превращается в карбамоилфосфат за счет взаимодействия двух молекул АТФ. Этому этапу способствует карбамоилфосфатсинтетаза I. На втором этапе, которому способствует орнитин-транскарбамилаза, превращаются карбамоилфосфат и орнитин в цитруллин . После этих начальных шагов цикл мочевины продолжается во внутреннем мембранном пространстве до тех пор, пока орнитин снова не попадет в матрикс через транспортный канал, чтобы продолжить первый этап внутри матрикса. [12]
Трансаминирование
[ редактировать ]α-Кетоглутарат и оксалоацетат могут превращаться в аминокислоты внутри матрикса в процессе трансаминирования . Этим реакциям способствуют трансаминазы, которые производят аспартат и аспарагин из оксалоацетата. Трансаминирование α-кетоглутарата приводит к образованию глутамата , пролина и аргинина . Эти аминокислоты затем используются либо внутри матрикса, либо транспортируются в цитозоль для производства белков. [7] [13]
Регулирование
[ редактировать ]Регуляция внутри матрицы в первую очередь контролируется концентрацией ионов, концентрацией метаболитов и энергетическим зарядом. Наличие ионов, таких как Ca 2+ контролировать различные функции цикла лимонной кислоты. в матриксе активирует пируватдегидрогеназу , изоцитратдегидрогеназу и α-кетоглутаратдегидрогеназу , что увеличивает скорость реакции в цикле. [14] Концентрация интермедиатов и коферментов в матриксе также увеличивает или снижает скорость продукции АТФ за счет анаплеротического и катаплеротического эффектов. НАДН может действовать как ингибитор , α-кетоглутарата изоцитратдегидрогеназы , цитратсинтазы и пируватдегидрогеназы . Концентрация оксалоацетата, в частности, поддерживается на низком уровне, поэтому любые колебания этой концентрации способствуют ускорению цикла лимонной кислоты. [2] Производство АТФ также служит средством регуляции, действуя как ингибитор изоцитратдегидрогеназы, пируватдегидрогеназы, белковых комплексов цепи переноса электронов и АТФ-синтазы. АДФ действует как активатор . [1]
Синтез белка
[ редактировать ]Митохондрии содержат собственный набор ДНК, используемый для производства белков, участвующих в цепи переноса электронов. Митохондриальная ДНК кодирует только около тринадцати белков, которые используются в процессинге митохондриальных транскриптов, рибосомальных белков , рибосомальной РНК , транспортной РНК и белковых субъединиц , обнаруженных в белковых комплексах цепи переноса электронов. [15] [16]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г Воэт, Дональд; Воэт, Джудит; Пратт, Шарлотта (2013). Основы биохимии жизни на молекулярном уровне . Нью-Йорк: John Wiley & Sons, Inc., стр. 582–584. ISBN 978-1118129180 .
- ^ Jump up to: а б с д и Страйер, Л; Берг, Дж; Тимочко, Дж. Л. (2002). Биохимия . Сан-Франциско: WH Freeman. стр. 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773. ISBN 978-0-7167-4684-3 .
- ^ Митчелл, Питер; Мойл, Дженнифер (14 января 1967 г.). «Хемиосмотическая гипотеза окислительного фосфорилирования». Природа . 213 (5072): 137–139. Бибкод : 1967Natur.213..137M . дои : 10.1038/213137a0 . ПМИД 4291593 . S2CID 4149605 .
- ^ Jump up to: а б с Соболь, С; Шольц, Р; Фрейсл, М; Элберс, Р; Хелдт, HW (1976). Распределение метаболитов между митохондриями и цитозолем перфузируемой печени . Нью-Йорк: Эльзевир. стр. 29–40. ISBN 978-0-444-10925-5 .
- ^ Jump up to: а б Порчелли, Анна Мария; Гелли, Анна; Занна, Клаудия; Пинтон, Паоло; Риццуто, Росарио; Руголо, Микела (28 января 2005 г.). «Разница pH на внешней митохондриальной мембране, измеренная с помощью мутанта зеленого флуоресцентного белка». Связь с биохимическими и биофизическими исследованиями . 326 (4): 799–804. дои : 10.1016/j.bbrc.2004.11.105 . ПМИД 15607740 .
- ^ Jump up to: а б с Димрот, П.; Каим, Г.; Мэтью, У. (1 января 2000 г.). «Решающая роль мембранного потенциала для синтеза АТФ с помощью F (1) F (о) АТФ-синтаз». Журнал экспериментальной биологии . 203 (Часть 1): 51–59. дои : 10.1242/jeb.203.1.51 . ISSN 0022-0949 . ПМИД 10600673 .
- ^ Jump up to: а б Кармен, А.; Вроблевски Ф.; Ладью, Дж. С. (1 января 1955 г.). «Активность трансаминаз в крови человека» . Журнал клинических исследований . 34 (1): 126–131. дои : 10.1172/JCI103055 . ISSN 0021-9738 . ПМК 438594 . ПМИД 13221663 .
- ^ Кинг, Джон В.; Лян, Вэньгуан Г.; Шерпельц, Кэтрин П.; Шиллинг, Александр Б.; Мередит, Стивен С.; Тан, Вэй-Джен (8 июля 2014 г.). «Молекулярные основы распознавания и деградации субстратов протеазой препоследовательности человека» . Структура . 22 (7): 996–1007. doi : 10.1016/j.str.2014.05.003 . ISSN 1878-4186 . ПМК 4128088 . ПМИД 24931469 .
- ^ Альбертс, Брюс; Джонсон, Александр; Льюис, Джулиан; Робертс, Кейт; Питерс, Уолтер; Рафф, Мартин (1994). Молекулярная биология клетки . Нью-Йорк: ISBN Garland Publishing Inc. 978-0-8153-3218-3 .
- ^ Андерсон, С.; Банкир, AT; Баррелл, Б.Г.; де Брёйн, МХЛ; Коулсон, Арканзас; Друэн, Дж.; Эперон, ИЦ; Нирлих, ДП; Роу, бакалавр (9 апреля 1981 г.). «Последовательность и организация митохондриального генома человека». Природа . 290 (5806): 457–465. Бибкод : 1981Natur.290..457A . дои : 10.1038/290457a0 . ПМИД 7219534 . S2CID 4355527 .
- ^ Jump up to: а б Ючи, С.; Лин, ECC (1 июля 1993 г.). «Адаптация Escherichia coli к окислительно-восстановительной среде путем экспрессии генов». Молекулярная микробиология . 9 (1): 9–15. дои : 10.1111/j.1365-2958.1993.tb01664.x . ISSN 1365-2958 . ПМИД 8412675 . S2CID 39165641 .
- ^ Тухман, Мендель; Планте, Роберт Дж. (1 января 1995 г.). «Мутации и полиморфизмы в гене орнитинтранскарбамилазы человека: дополнение к обновлению мутаций» . Человеческая мутация . 5 (4): 293–295. дои : 10.1002/humu.1380050404 . ISSN 1098-1004 . ПМИД 7627182 . S2CID 2951786 .
- ^ Кирш, Джек Ф.; Эйхеле, Грегор; Форд, Джеффри К.; Винсент, Майкл Г.; Янсониус, Йохан Н .; Геринг, Хайнц; Кристен, Филипп (15 апреля 1984 г.). «Механизм действия аспартатаминотрансферазы, предложенный на основе ее пространственной структуры». Журнал молекулярной биологии . 174 (3): 497–525. дои : 10.1016/0022-2836(84)90333-4 . ПМИД 6143829 .
- ^ Дентон, Ричард М.; Рэндл, Филип Дж.; Бриджес, Барбара Дж.; Купер, Рональд Х.; Керби, Алан Л.; Паск, Хелен Т.; Северсон, Дэвид Л.; Стэнсби, Дэвид; Уайтхаус, Сьюзен (1 октября 1975 г.). «Регуляция пируватдегидрогеназы млекопитающих». Молекулярная и клеточная биохимия . 9 (1): 27–53. дои : 10.1007/BF01731731 . ISSN 0300-8177 . ПМИД 171557 . S2CID 27367543 .
- ^ Фокс, Томас Д. (1 декабря 2012 г.). «Синтез, импорт и сборка митохондриального белка» . Генетика . 192 (4): 1203–1234. дои : 10.1534/genetics.112.141267 . ISSN 0016-6731 . ПМЦ 3512135 . ПМИД 23212899 .
- ^ Гривелл, Луизиана; Пель, HJ (1994). «Синтез белка в митохондриях» (PDF) . Мол. Биол. Представитель . 19 (3): 183–194. дои : 10.1007/bf00986960 . ПМИД 7969106 . S2CID 21200502 .