Пируваткарбоксилаза
| Пируваткарбоксилаза | |||
|---|---|---|---|
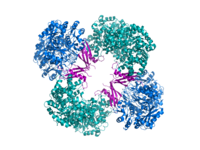
 Кристаллографическая структура пируваткарбоксилазы из Rhizobium etli : домен биотинкарбоксилазы (синий); аллостерический связывающий домен (зеленый); биотинсвязывающий домен (красный); и домен карбоксилтрансферазы (оранжевый) [1] | |||
| Идентификаторы | |||
| Номер ЕС. | 6.4.1.1 | ||
| Номер CAS. | 9014-19-1 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Пируваткарбоксилтрансфераза | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | PYR_CT | ||
| Пфам | PF00682 | ||
| ИнтерПро | ИПР000891 | ||
| PROSITE | PDOC50991 | ||
| |||
| Пируваткарбоксилаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ПК | ||
| ген NCBI | 5091 | ||
| HGNC | 8636 | ||
| МОЙ БОГ | 608786 | ||
| RefSeq | НМ_000920 | ||
| ЮниПрот | P11498 | ||
| Другие данные | |||
| Номер ЕС | 6.4.1.1 | ||
| Локус | Хр. 11 q11-q13.1 | ||
| |||
| ПК | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ПК , пируваткарбоксилаза, ПХБ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 608786 ; МГИ : 97520 ; Гомологен : 5422 ; GeneCards : ПК ; ОМА : ПК – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Пируваткарбоксилаза ( PC ), кодируемая геном PC, — фермент ( EC 6.4.1.1 ) лигаз класса , катализирующий (в зависимости от вида) физиологически необратимые реакции. [ нужна ссылка ] карбоксилирование пирувата оксалоацетата с образованием ( ОАА ).
Реакция, которую он катализирует:
- пируват + HCO −
3 + АТФ → оксалоацетат + АДФ + Ф
Это важная анаплеротическая реакция , в ходе которой из пирувата образуется оксалоацетат. Фермент представляет собой митохондриальный белок , содержащий биотина . простетическую группу [1] требующие магния или марганца и ацетил-КоА .
Пируваткарбоксилаза была впервые обнаружена в 1959 году в Университете Кейс Вестерн Резерв М.Ф. Аттером и Д.Б. Кичем. [6] [7] С тех пор он был обнаружен у множества прокариот и эукариот, включая грибы, бактерии, растения и животные. [8] У млекопитающих ПК играет решающую роль в глюконеогенезе и липогенезе, в биосинтезе нейромедиаторов и в индуцированной глюкозой секреции инсулина островками поджелудочной железы. Оксалоацетат, продуцируемый ПК, является важным промежуточным продуктом, который используется в этих путях биосинтеза. [9] У млекопитающих ПК экспрессируется тканеспецифичным образом, причем его активность наиболее высока в печени и почках (глюконеогенные ткани), в жировой ткани и лактирующей молочной железе (липогенные ткани), а также в островках поджелудочной железы. Активность умеренная в головном мозге, сердце и надпочечниках, наименьшая — в лейкоцитах и фибробластах кожи. [10]
Структура
[ редактировать ]Структурные исследования ПК проводились с помощью электронной микроскопии , ограниченного протеолиза , а также путем клонирования и газового секвенирования генов и кДНК, кодирующей фермент. Наиболее хорошо охарактеризованные формы активного ПК состоят из четырех идентичных субъединиц, расположенных в тетраэдроподобной структуре. Каждая субъединица содержит один фрагмент биотина, действующий как качающееся плечо для транспортировки углекислого газа к каталитическому сайту, который образуется на границе раздела между соседними мономерами. Каждая субъединица функционального тетрамера содержит четыре домена: домен карбоксилирования биотина (BC), домен транскарбоксилирования (CT), домен карбоксильного носителя биотина (BCCP) и недавно названный домен тетрамеризации PC (PT). [11] [12] Из двух наиболее полных доступных кристаллических структур были визуализированы асимметричная и симметричная формы белка. [13] Тетрамер Staphylococcus aureus в комплексе с коферментом-активатором А обладает высокой симметрией, обладая симметрией 222, что подтверждено крио-ЭМ исследованиями. [12] В отличие от Rhizobium etli , тетрамер в комплексе с этил-КоА, негидролизуемым аналогом ацетил-КоА , обладает только одной линией симметрии. [13]
Пируваткарбоксилаза использует ковалентно присоединенный кофактор биотина , который катализирует АТФ -зависимое карбоксилирование пирувата до оксалоацетата в две стадии. Биотин первоначально карбоксилируется в активном центре BC под действием АТФ и бикарбоната. Карбоксильная группа впоследствии переносится карбоксибиотином во второй активный сайт в домене CT, где пируват карбоксилируется с образованием оксалоацетата. Домен BCCP передает привязанный кофактор между двумя удаленными активными сайтами. Аллостерический сайт связывания в ПК представляет собой мишень для модификаторов активности, которые могут быть полезны при лечении ожирения или диабета II типа, а механистические знания, полученные в результате полного структурного описания RePC (R. etli), позволяют проводить детальные исследования отдельных индивидуумов. каталитический и регуляторный центры фермента. [13]
Механизм реакции
[ редактировать ]
( А ) АТФ-зависимое карбоксилирование биотина (домен BC);
( Б ) Транскарбоксилирование пирувата (домен CT).
Механизм реакции можно разделить на две частичные реакции (см. рисунок справа). В первой реакции АТФ карбоксилируется с образованием углефосфорного ангидрида. − ТЕМ( − О)Р(=О)О–С(=О)О − ], который, в свою очередь, карбоксилирует кофактор биотина , который ковалентно связан с остатком лизина домена BCCP. [8] Углекислый фосфорный ангидрид разлагается на диоксид углерода и фосфат перед атакой молекулы биотина, связанной с ферментом. У большинства видов эта реакция требует ацетил-КоА в качестве аллостерического активатора, связывающегося с доменом PT. [12] Во второй реакции, протекающей в CT-домене соседнего мономера, углекислый газ переносится на молекулу-акцептор — пируват с образованием оксалоацетата. Реакция протекает через удаление протона из пирувата с помощью еще неидентифицированного остатка в активном центре с образованием енолятного промежуточного продукта. Затем промежуточный енолят атакует CO 2 , временно высвобождаемый из связанной с ферментом молекулы биотина. Полученный оксалоацетат высвобождается. Молекула биотина протонируется вышеупомянутым остатком активного центра и высвобождается из активного центра домена CT для рекарбоксилирования. [12] [13] Основной регулятор активности фермента ацетил-КоА стимулирует расщепление АТФ в первой частичной реакции, а также, как было показано, вызывает конформационные изменения в тетрамерной структуре фермента. [9]
Функция
[ редактировать ]Во время глюконеогенеза пируваткарбоксилаза участвует в синтезе фосфоенолпирувата (ФЕП) из пирувата . Пируват сначала преобразуется пируваткарбоксилазой в оксалоацетат (ОАА) в митохондриях, что требует гидролиза одной молекулы АТФ . Затем ОАА декарбоксилируется и одновременно фосфорилируется, что катализируется одной из двух изоформ фосфоенолпируваткарбоксикиназы (PEPCK) либо в цитозоле , либо в митохондриях с образованием PEP. В обычных глюконеогенных условиях ОАА превращается в ПЭП с помощью митохондриальной PEPCK; полученный PEP затем транспортируется из митохондриального матрикса с помощью системы переносчиков анионов, [14] и превращается в глюкозу цитозольными глюконеогенными ферментами. Однако во время голодания, когда концентрация НАДН в цитозоле низкая, а уровень НАДН в митохондриях высок, оксалоацетат можно использовать в качестве челнока восстанавливающих эквивалентов. Таким образом, ОАА превращается в малат под действием митохондриальной малатдегидрогеназы (МДГ). После экспорта в цитозоль малат снова превращается в ОАА с сопутствующим снижением НАД. + ; ОАА впоследствии превращается в ПЭП, который доступен для глюконеогенеза в цитозоле вместе с транспортируемым восстанавливающим эквивалентом НАДН. [1]
Очень высокие уровни активности ПК вместе с высокой активностью других глюконеогенных ферментов, включая PEPCK , фруктозо-1,6-бисфосфатазу и глюкозо-6-фосфатазу в коре печени и почек, позволяют предположить, что основная роль ПК заключается в участии в глюконеогенезе у эти органы. Во время голодания или голодания, когда эндогенная глюкоза необходима для определенных тканей (мозга, лейкоцитов и мозгового вещества почек), экспрессия ПК и других глюконеогенных ферментов повышается. [15] Было показано, что у крыс и мышей изменение статуса питания влияет на активность ПК печени. [16] Голодание способствует выработке глюкозы в печени, поддерживаемой увеличением потока пирувата, а также увеличению активности ПК и концентрации белка; диабет аналогичным образом увеличивает глюконеогенез за счет усиленного поглощения субстрата и увеличения потока через ПК печени у мышей и крыс. [17] [18] Подобно другим глюконеогенным ферментам, ПК положительно регулируется глюкагоном и глюкокортикоидами, но отрицательно регулируется инсулином . [8] Еще раз подтверждая ключевую роль ПК в глюконеогенезе, у молочного скота, который обладает способностью к поглощению гексозы при адекватном уровне питания, ПК и связанный с ним глюконеогенный фермент PEPCK заметно повышаются во время перехода к лактации, что предполагает поддержку синтеза лактозы для производства молока. [19]
Помимо роли ПК в глюконеогенезе, ПК выполняет анаплеротическую роль (реакция, катализируемая ферментами, которая может пополнять запасы промежуточных продуктов в цикле трикарбоновых кислот) для цикла трикарбоновых кислот (необходимого для получения оксалоацетата), когда промежуточные соединения удаляются для различных биосинтетического назначения.
Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «Гликолиз-Глюконеогенез_WP534» .
Регулирование
[ редактировать ]Пируваткарбоксилаза аллостерически регулируется ацетил-КоА , Mg - АТФ и пируватом . [20]
Клиническое значение
[ редактировать ]В качестве перекрестка между углеводным и липидным обменом необходимо координировать экспрессию пируваткарбоксилазы в глюконеогенных тканях, жировых тканях и островках поджелудочной железы. В условиях переедания уровни ПК в β-клетках поджелудочной железы увеличиваются, что приводит к увеличению цикла пирувата в ответ на хронически повышенный уровень глюкозы . [21] Напротив, уровни ферментов ПК в печени снижаются под действием инсулина ; [22] в периоды избыточного питания ткань адипоцитов разрастается с экстремальной экспрессией ПК и других липогенных ферментов. [10] [23] Печеночный контроль уровня глюкозы по-прежнему регулируется в ситуации чрезмерного питания, но при диабете 2 типа, вызванном ожирением, регуляция периферических уровней глюкозы больше не регулируется инсулином.У с диабетом 2 типа крыс хроническое воздействие глюкозы на β-клетки из-за периферической резистентности к инсулину приводит к снижению активности фермента ПК и уменьшению цикла пирувата . [24] [25] Продолжающееся перепроизводство глюкозы гепатоцитами вызывает резкое изменение экспрессии генов в β-клетках со значительным увеличением количества обычно подавленных генов и эквивалентным снижением экспрессии мРНК инсулина, ионных насосов, необходимых для секреции инсулина, и метаболических ферментов, связанных с секрецией инсулина. включая пируваткарбоксилазу. [26] [27] Одновременно в жировой ткани развивается резистентность к инсулину, что приводит к накоплению триацилглицеринов и неэтерифицированных жирных кислот в кровообращении ; это не только еще больше ухудшает функцию β-клеток, [27] [28] но также дальнейшее снижение экспрессии ПК. [29] [30] Эти изменения приводят к снижению фенотипа β-клеток при декомпенсированном диабете.
Дефицит пируваткарбоксилазы может вызвать лактоацидоз в результате лактата . накопления [31] Обычно избыток пирувата направляется в глюконеогенез путем превращения пирувата в оксалоацетат , но из-за дефицита фермента избыток пирувата вместо этого превращается в лактат . Поскольку ключевая роль глюконеогенеза заключается в поддержании уровня сахара в крови , дефицит пируваткарбоксилазы также может привести к гипогликемии .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с PDB : 2QF7 ; Джитрапакди С., Сент-Морис М., Рэймент I, Клеланд В.В., Уоллес Дж.К., Эттвуд П.В. (август 2008 г.). «Строение, механизм и регуляция пируваткарбоксилазы» . Биохим. Дж . 413 (3): 369–87. дои : 10.1042/BJ20080709 . ПМЦ 2859305 . ПМИД 18613815 .
- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000173599 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000024892 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Аттер М.Ф., Кич Д.Б. (май 1960 г.). «Образование оксалоацетата из пирувата и углекислого газа» . Ж. Биол. Хим . 235 : PC17–8. дои : 10.1016/S0021-9258(18)69442-6 . ПМИД 13840551 .
- ^ Коэн Н.Д., Биген Х., Аттер М.Ф., Ригли Н.Г. (март 1979 г.). «Повторное исследование электронно-микроскопического проявления пируваткарбоксилазы из куриной печени» . Ж. Биол. Хим . 254 (5): 1740–7. дои : 10.1016/S0021-9258(17)37835-3 . ПМИД 762171 .
- ^ Перейти обратно: а б с Джитрапакди С., Видал-Пуч А., Уоллес Дж. К. (апрель 2006 г.). «Анаплеротическая роль пируваткарбоксилазы в тканях млекопитающих» . Клетка. Мол. Наука о жизни . 63 (7–8): 843–54. дои : 10.1007/s00018-005-5410-y . ПМЦ 11136034 . ПМИД 16505973 . S2CID 850667 .
- ^ Перейти обратно: а б Джитрапакди С., Незич М.Г., Кэссиди А.И., Хью-Гудалл Ю., Уоллес Дж.К. (июль 2002 г.). «Молекулярное клонирование и доменная структура куриной пируваткарбоксилазы». Биохим. Биофиз. Рез. Коммун . 295 (2): 387–93. дои : 10.1016/S0006-291X(02)00651-4 . ПМИД 12150961 .
- ^ Перейти обратно: а б Джитрапакди С., Уокер М.Э., Уоллес Дж.К. (июнь 1996 г.). «Идентификация новых альтернативно сплайсированных мРНК пируваткарбоксилазы с расходящимися 5'-нетранслируемыми областями, которые экспрессируются тканеспецифичным образом». Биохим. Биофиз. Рез. Коммун . 223 (3): 695–700. дои : 10.1006/bbrc.1996.0958 . ПМИД 8687459 .
- ^ Кондо С., Накадзима И., Сугио С., Ён-Бяо Дж., Суэда С., Кондо Х. (март 2004 г.). «Структура биотинкарбоксилазной субъединицы пируваткарбоксилазы из Aquifex aeolicus при разрешении 2,2 А». Акта Кристаллогр. Д. 60 (Часть 3): 486–92. Бибкод : 2004AcCrD..60..486K . дои : 10.1107/S0907444904000423 . ПМИД 14993673 .
- ^ Перейти обратно: а б с д Ю Л.П., Сян С., Лассо Г., Гил Д., Валле М., Тонг Л. (июнь 2009 г.). «Симметричный тетрамер пируваткарбоксилазы S. aureus в комплексе с коферментом А» . Структура . 17 (6): 823–32. дои : 10.1016/j.str.2009.04.008 . ПМЦ 2731552 . ПМИД 19523900 .
- ^ Перейти обратно: а б с д Сент-Морис М., Рейнхардт Л., Суринья К.Х., Эттвуд П.В., Уоллес Дж.К., Клеланд В.В., Рэймент I (август 2007 г.). «Доменная архитектура пируваткарбоксилазы, биотинзависимого многофункционального фермента». Наука . 317 (5841): 1076–9. Бибкод : 2007Sci...317.1076S . дои : 10.1126/science.1144504 . ПМИД 17717183 . S2CID 34738991 .
- ^ Старк Р., Паскель Ф., Турку А. и др. (2009). «Цикл фосфоенолпирувата через митохондриальную фосфоенолпируваткарбоксикиназу связывает анаплероз и митохондриальный ГТФ с секрецией инсулина» . Журнал биологической химии . 284 (39): 26578–26590. дои : 10.1074/jbc.M109.011775 . ПМЦ 2785346 . ПМИД 19635791 .
- ^ Ротман Д.Л., Магнуссон И., Кац Л.Д., Шульман Р.Г., Шульман Г.И. (октябрь 1991 г.). «Количественное определение гликогенолиза и глюконеогенеза в печени у людей натощак с помощью ЯМР 13С». Наука . 254 (5031): 573–6. Бибкод : 1991Sci...254..573R . дои : 10.1126/science.1948033 . ПМИД 1948033 .
- ^ Бизо М.Э., Шорт С., Трешер Дж.С., Коммерфорд С.Р., Уиллис В.Т., Пальясотти М.Дж. (2001). «Увеличенная пропускная способность пирувата объясняет вызванное диетой усиление глюконеогенеза in vitro ». Являюсь. Дж. Физиол. Регул. Интегр. Комп. Физиол . 281 (2): R427–R433. дои : 10.1152/ajpregu.2001.281.2.R427 . ПМИД 11448844 . S2CID 10376355 .
- ^ Сальто Р., Сола М., Олисер Ф.Дж., Варгас А.М. (декабрь 1996 г.). «Влияние голодания, диабета и интоксикации четыреххлористым углеродом на уровни пируваткарбоксилазы коры почек и печени крыс». Арх. Физиол. Биохим . 104 (7): 845–850. CiteSeerX 10.1.1.378.3073 . дои : 10.1076/apab.104.7.845.13111 . ПМИД 9127680 .
- ^ Большой В., Бейлот М. (июнь 1999 г.). «Модификации активности цикла лимонной кислоты и глюконеогенеза при диабете, индуцированном стрепозотоцином, и эффектах метформина». Диабет . 48 (6): 1251–1257. дои : 10.2337/диабет.48.6.1251 . ПМИД 10342812 .
- ^ Гринфилд Р.Б., Чецава М.Ю., Донкин С.С. (2002). «Изменение экспрессии мРНК глюконеогенных ферментов в печени молочного скота при переходе к лактации» . Журнал молочной науки . 83 (6): 1228–1236. doi : 10.3168/jds.S0022-0302(00)74989-7 . ПМИД 10877388 .
- ^ Валле М (2017). « Пируваткарбоксилаза, строение и функции» . Макромолекулярные белковые комплексы . Субклеточная биохимия. Том. 83. стр. 291–322. дои : 10.1007/978-3-319-46503-6_11 . ISBN 978-3-319-46501-2 . ПМИД 28271481 .
- ^ Лю Ю.К., Хан Дж., Эпштейн П.Н., Лонг Ю.С. (декабрь 2005 г.). «Усиленная пролиферация β-клеток крысы в 60% островков, подвергшихся панкреатэктомии, за счет увеличения метаболического потока глюкозы через путь пируваткарбоксилазы». Являюсь. Дж. Физиол. Эндокринол. Метаб . 288 (3): E471–E478. дои : 10.1152/ajpendo.00427.2004 . ПМИД 15507531 .
- ^ Девернь Б., Михалик Л., Вали В. (апрель 2006 г.). «Транскрипционная регуляция метаболизма». Физиол. Преподобный . 86 (2): 465–514. doi : 10.1152/physrev.00025.2005 . ПМИД 16601267 .
- ^ Линч С.Дж., МакКолл К.М., Биллингсли М.Л., Болен Л.М., Хренюк С.П., Мартин Л.Ф., Уиттерс Л.А., Ваннуччи С.Дж. (май 1992 г.). «Пируваткарбоксилаза при генетическом ожирении». Являюсь. Дж. Физиол . 262 (5, ч. 1): E608–E618. дои : 10.1152/ajpendo.1992.262.5.E608 . ПМИД 1375435 .
- ^ Макдональд М.Дж., Тан Дж., Полонский К.С. (ноябрь 1996 г.). «Низкая митохондриальная глицеринфосфатдегидрогеназа и пируваткарбоксилаза в островках поджелудочной железы диабетических жирных крыс Цукера». Диабет . 45 (11): 1626–1630. дои : 10.2337/диабет.45.11.1626 . ПМИД 8866570 .
- ^ Макдональд М.Дж., Эфендик С., Остенсон К.Г. (июль 1996 г.). «Нормализация инсулином низких митохондриальных глицеринфосфатдегидрогеназы и пируваткарбоксилазы в островках поджелудочной железы крысы ГК». Диабет . 45 (7): 886–890. дои : 10.2337/диабет.45.7.886 . ПМИД 8666138 .
- ^ Лэйбатт Д.Р., Гландт М., Сюй Г., Ан Ю.Б., Триведи Н., Боннер-Вейр С., Вейр Г.К. (январь 2003 г.). «Критическое снижение массы β-клеток со временем приводит к двум различным последствиям: адаптация с нарушением толерантности к глюкозе или декомпенсированный диабет» . Ж. Биол. Хим . 278 (5): 2997–3005. дои : 10.1074/jbc.M210581200 . ПМИД 12438314 .
- ^ Перейти обратно: а б Пуату В., Робертсон Р.П. (февраль 2002 г.). «Вторичная недостаточность β-клеток при диабете 2 типа – конвергенция глюкотоксичности и липотоксичности» . Эндокринология . 143 (2): 339–342. дои : 10.1210/endo.143.2.8623 . ПМИД 11796484 .
- ^ Баучер А., Лу Д., Берджесс С.К., Теламак-Поттс С., Дженсен М.В., Малдер Х., Ван М.Ю., Унгер Р.Х., Шерри А.Д., Ньюгард С.Б. (2004). «Биохимический механизм липид-индуцированного нарушения глюкозо-стимулируемой секреции инсулина и его отмены аналогом малата» . Ж. Биол. Хим . 279 (26): 27263–27271. дои : 10.1074/jbc.M401167200 . ПМИД 15073188 .
- ^ Буш А.К., Кордери Д., Денайер Г.С., Байден Т.Дж. (апрель 2002 г.). «Профилирование экспрессии генов, регулируемых пальмитатом и олеатом, дает новое представление о влиянии хронического воздействия на функцию β-клеток поджелудочной железы» . Диабет . 51 (4): 977–987. дои : 10.2337/диабет.51.4.977 . ПМИД 11916915 .
- ^ Иидзука К., Накадзима Х., Намба М., Миягава Дж., Миядзаки Дж., Ханафуса Т., Мацудзава Ю. (январь 2002 г.). «Метаболические последствия длительного воздействия β-клеток поджелудочной железы на свободные жирные кислоты с особым упором на нечувствительность к глюкозе». Биохим. Биофиз. Акта . 1586 (1): 23–31. дои : 10.1016/s0925-4439(01)00082-5 . ПМИД 11781146 .
- ^ Гарсия-Касорла А, Рабье Д, Туати Дж, Шадефо-Векеманс Б, Марсак С, де Лонле П, Саудубрей ЖМ (январь 2006 г.). «Дефицит пируваткарбоксилазы: метаболические характеристики и новые неврологические аспекты». Энн. Нейрол . 59 (1): 121–7. дои : 10.1002/ana.20709 . ПМИД 16278852 . S2CID 21367897 .