НК1
| НК1 | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | HK1 , HK1-ta, HK1-tb, HK1-tc, HKD, HKI, HMSNR, HXK1, гексокиназа 1, HK, гексокиназа, RP79, NEDVIBA | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 142600 ; МГИ : 96103 ; Гомологен : 100530 ; Генные карты : HK1 ; ОМА : HK1 – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Гексокиназа-1 (НК1) — это фермент , который у человека кодируется НК1 геном на хромосоме 10. Гексокиназа фосфорилирует глюкозу с образованием глюкозо-6-фосфата (G6P), что является первым этапом большинства путей метаболизма глюкозы. Этот ген кодирует повсеместно распространенную форму гексокиназы, которая локализуется на внешней мембране митохондрий . Мутации в этом гене связаны с гемолитической анемией из-за дефицита гексокиназы. Альтернативный сплайсинг этого гена приводит к образованию пяти вариантов транскрипта, которые кодируют различные изоформы , некоторые из которых являются тканеспецифичными. Каждая изоформа имеет отдельный N-конец ; остальная часть белка идентична для всех изоформ. Описан шестой вариант транскрипта, но из-за наличия нескольких стоп-кодонов считается, что он не кодирует белок. [предоставлено RefSeq, апрель 2009 г.] [5]
Структура
[ редактировать ]HK1 является одной из четырех высоко гомологичных изоформ гексокиназы в клетках млекопитающих. [6] [7]
Ген
[ редактировать ]Ген HK1 занимает примерно 131 т.п.н. и состоит из 25 экзонов . Альтернативный сплайсинг его 5'-экзонов приводит к образованию разных транскриптов в разных типах клеток: экзоны 1-5 и экзон 8 (экзоны Т1-6) являются экзонами, специфичными для семенников; экзон 6, расположенный примерно на 15 т.п.н. ниже экзонов, специфичных для семенников, представляет собой эритроид -специфичный экзон (экзон R); а экзон 7, расположенный примерно на 2,85 т.п.н. ниже экзона R, является первым 5'-экзоном повсеместно экспрессируемой изоформы HK1. Более того, экзон 7 кодирует поринсвязывающий домен (PBD), консервативный в HK1 генах млекопитающих. Между тем, оставшиеся 17 экзонов являются общими для всех изоформ HK1.
Помимо экзона R, участок проксимального промотора , содержащий элемент GATA, сайт SP1, CCAAT и Ets-связывающий мотив. для экспрессии HK-R в эритроидных клетках необходим [6]
Белок
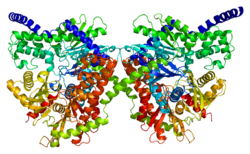
[ редактировать ]Этот ген кодирует гомодимер массой 100 кДа с регуляторным N-концевым доменом (1-475), каталитическим С-концевым доменом (остатки 476-917) и альфа-спиралью, соединяющей две его субъединицы. [6] [8] [9] [10] Оба терминальных домена состоят из большого и малого субдомена. Гибкая область С-концевого большого субдомена ( остатки 766–810) может принимать различные положения и, как предполагается, взаимодействует с основанием АТФ . Более того, глюкоза и G6P связываются в непосредственной близости с N- и C-концевыми доменами и стабилизируют общее конформационное состояние C-концевого домена. [8] [9] Согласно одной модели, G6P действует как аллостерический ингибитор, который связывает N-концевой домен для стабилизации его закрытой конформации, что затем стабилизирует конформацию C-концевого гибкого субдомена, блокирующую АТФ. Вторая модель утверждает, что G6P действует как активный ингибитор, который стабилизирует закрытую конформацию и конкурирует с АТФ за С-концевой сайт связывания. [8] Результаты нескольких исследований показывают, что С-конец способен оказывать как каталитическое, так и регуляторное действие. [11] Между тем, гидрофобный N-конец сам по себе лишен ферментативной активности, но содержит регуляторный сайт G6P и PBD, который отвечает за стабильность белка и связывание с внешней митохондриальной мембраной (OMM). [6] [12] [10] [13]
Функция
[ редактировать ]Являясь одной из двух митохондриальных изоформ гексокиназы и членом семейства сахаркиназ, HK1 катализирует и лимитирующую скорость первую обязательную стадию метаболизма глюкозы, которая представляет собой АТФ-зависимое фосфорилирование глюкозы до G6P. [8] [7] [10] [14] Физиологические уровни G6P могут регулировать этот процесс, ингибируя HK1 по принципу отрицательной обратной связи , хотя неорганический фосфат (P i ) может ослабить ингибирование G6P. [8] [12] [10] Однако, в отличие от HK2 и HK3 , сам HK1 не регулируется напрямую с помощью Pi , что лучше соответствует его повсеместной катаболической роли. [7] Фосфорилируя глюкозу, HK1 эффективно предотвращает выход глюкозы из клетки и, таким образом, участвует в энергетическом метаболизме. [8] [13] [12] [10] Более того, его локализация и прикрепление к ОММ способствует соединению гликолиза с митохондриальным окислительным фосфорилированием , что значительно увеличивает выработку АТФ за счет прямой переработки митохондриального АТФ/АДФ для удовлетворения энергетических потребностей клетки. [14] [10] [15] В частности, связанный с OMM HK1 связывается с VDAC1 , вызывая открытие переходной поры митохондриальной проницаемости и высвобождая митохондриальный АТФ для дальнейшего стимулирования гликолитического процесса. [10] [7]
Другой важной функцией HK1, связанного с OMM, является выживание клеток и защита от окислительного повреждения . [14] [7] Активация Akt киназы опосредуется сочетанием HK1-VDAC1 как часть внутриклеточного сигнального пути фосфатидил-инозитол-3-киназы (PI3)/выживания клеток Akt, опосредованного фактором роста, что предотвращает высвобождение цитохрома c и последующий апоптоз. [14] [6] [10] [7] Фактически, есть доказательства того, что связывание VDAC антиапоптотическим HK1 и проапоптотической креатинкиназой являются взаимоисключающими, что указывает на то, что отсутствие HK1 позволяет креатинкиназы связывать и открывать VDAC. [7] Более того, HK1 продемонстрировал антиапоптотическую активность , противодействуя белкам Bcl-2, расположенным в OMM, что затем ингибирует TNF -индуцированный апоптоз. [6] [13]
В префронтальной коре HK1 предположительно образует белковый комплекс с EAAT2 , Na+/K+-АТФазой и аконитазой , функция которого заключается в удалении глутамата из перисинаптического пространства и поддержании низких базальных уровней в синаптической щели . [15]
В частности, HK1 является наиболее широко экспрессируемой изоформой из четырех гексокиназ и конститутивно экспрессируется в большинстве тканей, хотя в основном он обнаруживается в головном мозге , почках и эритроцитах (эритроцитах). [6] [8] [13] [7] [15] [10] [16] Его высокое содержание в сетчатке , особенно во внутреннем сегменте фоторецепторов, внешнем плексиформном слое, внутреннем ядерном слое, внутреннем плексиформном слое и слое ганглиозных клеток, свидетельствует о его решающей метаболической цели. [17] Он также экспрессируется в клетках, полученных из гемопоэтических стволовых клеток , таких как эритроциты, лейкоциты и тромбоциты , а также в эритроидных клетках-предшественниках. [6] Следует отметить, что HK1 является единственной изоформой гексокиназы, обнаруженной в клетках и тканях, функции которых наиболее сильно зависят от метаболизма глюкозы, включая мозг, эритроциты, тромбоциты, лейкоциты и фибробласты . [18] У крыс это также преобладающая гексокиназа в тканях плода, вероятно, из-за их конститутивного использования глюкозы. [12] [16]
Клиническое значение
[ редактировать ]Мутации в этом гене связаны с типом 4H болезни Шарко-Мари-Тута , также известной как наследственная моторная и сенсорная нейропатия типа Рассе (HMSNR). [19] Также было обнаружено, что изменения в гексокиназе 1 вызывают как легкие, так и тяжелые формы врожденного гиперинсулинизма. [20] [21] [22] Из-за решающей роли HK1 в гликолизе дефицит гексокиназы был идентифицирован как причина эритроэнзимопатий, связанных с наследственной несфероцитарной гемолитической анемией (HNSHA). Аналогично, дефицит HK1 приводит к головного мозга повреждению белого вещества , порокам развития и задержке психомоторного развития, а также к латентному сахарному диабету и панмиелопатии . [6] Между тем, HK1 высоко экспрессируется при раке , а его антиапоптотические эффекты наблюдаются в клетках гепатомы с высоким гликолизом . [13] [6]
Нейродегенеративные расстройства
[ редактировать ]HK1 может быть причинно связан с настроением и психотическими расстройствами , включая униполярную депрессию (УПД), биполярное расстройство (ПРЛ) и шизофрению , благодаря своей роли в энергетическом метаболизме и выживании клеток. Например, накопление лактата в мозге пациентов с ПРЛ и ШЗЗ потенциально является результатом отделения HK1 от ОММ и, как следствие, гликолиза от окислительного фосфорилирования митохондрий. В случае SCHZ уменьшение прикрепления HK1 к OMM в теменной коре головного мозга приводило к снижению способности обратного захвата глутамата и, таким образом, к перераспределению глутамата из синапсов . Высвобожденный глутамат активирует экстрасинаптические рецепторы глутамата, что приводит к изменению структуры и функции глутаматных цепей, синаптической пластичности , дисфункции лобной коры и, в конечном итоге, к когнитивным дефицитам, характерным для SCHZ. [15] Аналогичным образом, отслойка митохондрий Hk1 связана с гипотиреозом , который включает в себя аномальное развитие мозга и повышенный риск депрессии , в то время как его прикрепление приводит к росту нейронов . [14] При болезни Паркинсона отсоединение HK1 от VDAC посредством паркин -опосредованного убиквитилирования и деградации нарушает MPTP в деполяризованных митохондриях, следовательно, блокируя митохондриальную локализацию Паркина и останавливая гликолиз. [7] Необходимы дальнейшие исследования, чтобы определить относительную отслойку HK1, необходимую в различных типах клеток при различных психических расстройствах. Это исследование также может способствовать разработке методов лечения, направленных на устранение причин отслоения, от генных мутаций до вмешательства таких факторов, как бета-амилоидный пептид и инсулин . [14]
Пигментный ретинит
[ редактировать ]Гетерозиготная миссенс - мутация в гене HK1 (изменение в положении 847 глутамата на лизин) связана с пигментным ретинитом . [23] [17] Поскольку эта замещающая мутация расположена далеко от известных функциональных сайтов и не ухудшает гликолитическую активность фермента, вполне вероятно, что мутация действует посредством другого биологического механизма, уникального для сетчатки. [23] Примечательно, что исследования на сетчатке мышей выявили взаимодействия между Hk1, митохондриальным металлочапероном Cox11 и белком-шапероном Ranbp2, которые служат для поддержания нормального метаболизма и функционирования сетчатки. Таким образом, мутация может нарушить эти взаимодействия и привести к деградации сетчатки. [17] Альтернативно, эта мутация может действовать посредством антиапоптотической функции фермента, поскольку нарушение регуляции ассоциации гексокиназа-митохондрии рецепторами инсулина может вызвать апоптоз фоторецепторов и дегенерацию сетчатки. [23] [17] В этом случае лечение, сохраняющее ассоциацию гексокиназы и митохондрий, может служить потенциальным терапевтическим подходом. [17]
Взаимодействия
[ редактировать ]Известно, что HK1 взаимодействует с:
Интерактивная карта маршрутов
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «Гликолиз-Глюконеогенез_WP534» .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000156515 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000037012 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ген Энтрез: гексокиназа HK1 1» .
- ^ Перейти обратно: а б с д и ж г час я дж Мураками К., Канно Х., Танкабелик Дж., Фуджи Х. (2002). «Экспрессия генов и биологическое значение гексокиназы в эритроидных клетках». Акта гематологическая . 108 (4): 204–209. дои : 10.1159/000065656 . ПМИД 12432216 . S2CID 23521290 .
- ^ Перейти обратно: а б с д и ж г час я дж к Окацу К., Иемура С., Кояно Ф., Го Э., Кимура М., Нацумэ Т. и др. (ноябрь 2012 г.). «Митохондриальная гексокиназа HKI является новым субстратом убиквитинлигазы Паркина». Связь с биохимическими и биофизическими исследованиями . 428 (1): 197–202. дои : 10.1016/j.bbrc.2012.10.041 . ПМИД 23068103 .
- ^ Перейти обратно: а б с д и ж г Алешин А.Е., Цзэн С., Буренков Г.П., Бартуник Х.Д., Фромм Х.Ю., Гонзатко Р.Б. (январь 1998 г.). «Механизм регуляции гексокиназы: новые данные о кристаллической структуре рекомбинантной гексокиназы головного мозга человека в комплексе с глюкозой и глюкозо-6-фосфатом» . Структура . 6 (1): 39–50. дои : 10.1016/s0969-2126(98)00006-9 . ПМИД 9493266 .
- ^ Перейти обратно: а б Алешин А.Е., Кирби С., Лю Х, Буренков Г.П., Бартуник Х.Д., Фромм Х.Дж., Гонзатко Р.Б. (март 2000 г.). «Кристаллические структуры мутантной мономерной гексокиназы I обнаруживают множественные сайты связывания АДФ и конформационные изменения, имеющие отношение к аллостерической регуляции». Журнал молекулярной биологии . 296 (4): 1001–1015. дои : 10.1006/jmbi.1999.3494 . ПМИД 10686099 .
- ^ Перейти обратно: а б с д и ж г час я Роби Р.Б., Хэй Н. (август 2006 г.). «Митохондриальные гексокиназы, новые медиаторы антиапоптотического действия факторов роста и Akt» . Онкоген . 25 (34): 4683–4696. дои : 10.1038/sj.onc.1209595 . ПМИД 16892082 .
- ^ Карденас М.Л., Корниш-Боуден А. , Урета Т. (март 1998 г.). «Эволюция и регуляторная роль гексокиназ» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1401 (3): 242–264. дои : 10.1016/s0167-4889(97)00150-x . ПМИД 9540816 .
- ^ Перейти обратно: а б с д Принц Р.Л., Осава Х., Ардехали Х., Кох С., Граннер Д.К. (февраль 1997 г.). «Ген гексокиназы II: структура, регуляция и организация промотора». Труды Биохимического общества . 25 (1): 107–112. дои : 10.1042/bst0250107 . ПМИД 9056853 .
- ^ Перейти обратно: а б с д и Шиндлер А., Фоли Э. (декабрь 2013 г.). «Гексокиназа 1 блокирует сигналы апоптоза в митохондриях». Сотовая сигнализация . 25 (12): 2685–2692. дои : 10.1016/j.cellsig.2013.08.035 . ПМИД 24018046 .
- ^ Перейти обратно: а б с д и ж Регенольд В.Т., Пратт М., Неккалапу С., Шапиро П.С., Кристиан Т., Фискум Г. (январь 2012 г.). «Митохондриальное отслоение гексокиназы 1 при настроении и психотических расстройствах: последствия для энергетического метаболизма мозга и нейротрофической передачи сигналов». Журнал психиатрических исследований . 46 (1): 95–104. doi : 10.1016/j.jpsychires.2011.09.018 . ПМИД 22018957 .
- ^ Перейти обратно: а б с д и ж г Шан Д., Маунт Д., Мур С., Арутюнян В., Мидор-Вудрафф Дж.Х., МакКаллумсмит Р.Э. (апрель 2014 г.). «Аномальное распределение гексокиназы 1 предполагает нарушение комплекса транспортных белков глутамата при шизофрении» . Исследования шизофрении . 154 (1–3): 1–13. doi : 10.1016/j.schres.2014.01.028 . ПМК 4151500 . ПМИД 24560881 .
- ^ Перейти обратно: а б Рид С., Мастерс С (1985). «О свойствах развития и тканевых взаимодействиях гексокиназы». Механизмы старения и развития . 31 (2): 197–212. дои : 10.1016/s0047-6374(85)80030-0 . ПМИД 4058069 . S2CID 40877603 .
- ^ Перейти обратно: а б с д и Ван Ф., Ван Ю., Чжан Б., Чжао Л., Любасюк В., Ван К. и др. (октябрь 2014 г.). «Миссенс-мутация в HK1 приводит к аутосомно-доминантному пигментному ретиниту» . Исследовательская офтальмология и визуальные науки . 55 (11): 7159–7164. дои : 10.1167/iovs.14-15520 . ПМЦ 4224578 . ПМИД 25316723 .
- ^ Гьесинг А.П., Нильсен А.А., Брандслунд И., Кристенсен С., Сандбек А., Йоргенсен Т. и др. (июль 2011 г.). «Исследование генетического варианта HK1 в связи с количественными метаболическими особенностями и распространенностью диабета 2 типа» . BMC Медицинская генетика . 12:99 . дои : 10.1186/1471-2350-12-99 . ПМК 3161933 . ПМИД 21781351 .
- ^ Интернет-менделевское наследование у человека (OMIM): 605285
- ^ Хьюат Т.И., Джонсон М.Б., Фланаган С.В. (7 июля 2022 г.). «Врожденный гиперинсулинизм: современные лабораторные подходы к генетической диагностике гетерогенного заболевания» . Границы эндокринологии . 13 : 873254. дои : 10.3389/fendo.2022.873254 . ПМК 9302115 . ПМИД 35872984 .
- ^ Розенфельд Э., Гангули А., Де Леон Д.Д. (декабрь 2019 г.). «Врожденный гиперинсулинизм: генетические и клинические характеристики» . Американский журнал медицинской генетики. Часть C. Семинары по медицинской генетике . 181 (4): 682–692. дои : 10.1002/ajmg.c.31737 . ПМЦ 7229866 . ПМИД 31414570 .
- ^ Майорана А, Лепри ФР, Новелли А, Диониси-Вичи С (29 марта 2022 г.). «Панельное тестирование метаболических генов гипогликемии» . Границы эндокринологии . 13 : 826167. дои : 10.3389/fendo.2022.826167 . ПМК 9001947 . ПМИД 35422763 .
- ^ Перейти обратно: а б с Салливан Л.С., Кобольдт Д.С., Боун С.Дж., Лэнг С., Блэнтон С.Х., Кадена Е. и др. (сентябрь 2014 г.). «Доминантная мутация гексокиназы 1 (HK1) вызывает пигментный ретинит» . Исследовательская офтальмология и визуальные науки . 55 (11): 7147–7158. дои : 10.1167/iovs.14-15419 . ПМК 4224580 . ПМИД 25190649 .
Дальнейшее чтение
[ редактировать ]- Даниэле А., Альтруда Ф., Ферроне М., Силенго Л., Ромео Г., Арчидиаконо Н., Рокки М. (1992). «Картирование гена гексокиназы 1 человека с 10q11----qter». Наследственность человека . 42 (2): 107–110. дои : 10.1159/000154049 . ПМИД 1572668 .
- Маньяни М., Бьянки М., Касабьянка А., Стокки В., Даниэле А., Альтруда Ф. и др. (июль 1992 г.). «Рекомбинантная человеческая мини-гексокиназа каталитически активна и регулируется гексозо-6-фосфатами» . Биохимический журнал . 285 (Часть 1): 193–199. дои : 10.1042/bj2850193 . ПМЦ 1132765 . ПМИД 1637300 .
- Маньяни М., Серафини Дж., Бьянки М., Касабьянка А., Стокки В. (январь 1991 г.). «Микрогетерогенность человеческой гексокиназы I типа обусловлена различными аминоконцевыми последовательностями» . Журнал биологической химии . 266 (1): 502–505. дои : 10.1016/S0021-9258(18)52464-9 . ПМИД 1985912 .
- Адамс В., Гриффин Л.Д., Гелб Б.Д., Маккейб Э.Р. (июнь 1991 г.). «Протеинкиназная активность гексокиназы мозга крысы». Связь с биохимическими и биофизическими исследованиями . 177 (3): 1101–1106. дои : 10.1016/0006-291X(91)90652-N . ПМИД 2059200 .
- Мураками К., Блей Ф., Тилтон В., Симэн С., Пиомелли С. (февраль 1990 г.). «Изофермент гексокиназы, специфичный для эритроцитов человека (HKR)» . Кровь . 75 (3): 770–775. дои : 10.1182/blood.V75.3.770.770 . ПМИД 2297576 .
- Ниши С., Сейно С., Белл Г.И. (декабрь 1988 г.). «Человеческая гексокиназа: последовательности амино- и карбоксильных половин гомологичны». Связь с биохимическими и биофизическими исследованиями . 157 (3): 937–943. дои : 10.1016/S0006-291X(88)80964-1 . ПМИД 3207429 .
- Райксен Г., Аккерман Дж.В., ван ден Уолл Бэйк А.В., Хофстеде Д.П., Стаал Г.Е. (январь 1983 г.). «Генерализованный дефицит гексокиназы в клетках крови больного несфероцитарной гемолитической анемией» . Кровь . 61 (1): 12–18. дои : 10.1182/blood.V61.1.12.12 . ПМИД 6848140 .
- Бьянки М., Маньяни М. (1995). «Мутации гексокиназы, вызывающие несфероцитарную гемолитическую анемию». Клетки крови, молекулы и болезни . 21 (1): 2–8. дои : 10.1006/bcmd.1995.0002 . ПМИД 7655856 .
- Блахли-Дайсон Э., Замбронич Э.Б., Ю.Х., Адамс В., Маккейб Э.Р., Адельман Дж. и др. (январь 1993 г.). «Клонирование и функциональная экспрессия в дрожжах двух человеческих изоформ внешнего мембранного канала митохондрий, потенциалзависимого анионного канала» . Журнал биологической химии . 268 (3): 1835–1841. дои : 10.1016/S0021-9258(18)53930-2 . ПМИД 8420959 .
- Алешин А.Е., Цзэн С., Фромм Х.Дж., Гонзатко Р.Б. (август 1996 г.). «Кристаллизация и предварительный рентгеноструктурный анализ гексокиназы головного мозга человека» . Письма ФЭБС . 391 (1–2): 9–10. дои : 10.1016/0014-5793(96)00688-6 . ПМИД 8706938 . S2CID 44367910 .
- Висконти П.Е., Олдс-Кларк П., Мосс С.Б., Калаб П., Трэвис А.Дж., де лас Эрас М., Копф Г.С. (январь 1996 г.). «Свойства и локализация тирозинфосфорилированной формы гексокиназы в сперме мыши». Молекулярное воспроизводство и развитие . 43 (1): 82–93. doi : 10.1002/(SICI)1098-2795(199601)43:1<82::AID-MRD11>3.0.CO;2-6 . ПМИД 8720117 . S2CID 30206768 .
- Мори С., Накамура Н., Уэлч Дж.Э., Шиота К., Эдди Э.М. (май 1996 г.). «Специфическая для семенников экспрессия мРНК уникальной человеческой гексокиназы 1 типа, лишенной поринсвязывающего домена» . Молекулярное воспроизводство и развитие . 44 (1): 14–22. doi : 10.1002/(SICI)1098-2795(199605)44:1<14::AID-MRD2>3.0.CO;2-W . ПМИД 8722688 . S2CID 28880251 .
- Мураками К., Пиомелли С. (февраль 1997 г.). «Идентификация кДНК изофермента гексокиназы, специфичного для эритроцитов человека» . Кровь . 89 (3): 762–766. дои : 10.1182/blood.V89.3.762 . ПМИД 9028305 .
- Руццо А., Андреони Ф., Маньяни М. (январь 1998 г.). «В гене гексокиназы человека присутствует эритроид-специфичный экзон» . Кровь . 91 (1): 363–364. дои : 10.1182/blood.V91.1.363 . ПМИД 9414310 .
- Трэвис А.Дж., Фостер Дж.А., Розенбаум Н.А., Висконти П.Е., Гертон Г.Л., Копф Г.С., Мосс С.Б. (февраль 1998 г.). «Нацеливание специфичной для зародышевых клеток гексокиназы типа 1, лишенной поринсвязывающего домена, в митохондрии, а также в головку и фиброзную оболочку мышиных сперматозоидов» . Молекулярная биология клетки . 9 (2): 263–276. дои : 10.1091/mbc.9.2.263 . ПМК 25249 . ПМИД 9450953 .
- Алешин А.Е., Цзэн С., Буренков Г.П., Бартуник Х.Д., Фромм Х.Ю., Гонзатко Р.Б. (январь 1998 г.). «Механизм регуляции гексокиназы: новые данные о кристаллической структуре рекомбинантной гексокиназы головного мозга человека в комплексе с глюкозой и глюкозо-6-фосфатом» . Структура . 6 (1): 39–50. дои : 10.1016/S0969-2126(98)00006-9 . ПМИД 9493266 .
- Руццо А., Андреони Ф., Маньяни М. (апрель 1998 г.). «Структура гена гексокиназы человека типа I и нуклеотидная последовательность 5'-фланкирующей области» . Биохимический журнал . 331 (Часть 2): 607–613. дои : 10.1042/bj3310607 . ПМЦ 1219395 . ПМИД 9531504 .
- Алешин А.Е., Цзэн С., Бартуник Х.Д., Фромм Х.Дж., Гонзатко Р.Б. (сентябрь 1998 г.). «Регуляция гексокиназы I: кристаллическая структура рекомбинантной гексокиназы головного мозга человека в комплексе с глюкозой и фосфатом». Журнал молекулярной биологии . 282 (2): 345–357. дои : 10.1006/jmbi.1998.2017 . ПМИД 9735292 .
- Мураками К., Канно Х., Мива С., Пиомелли С. (июнь 1999 г.). «Изофермент HKR человека: организация гена гексокиназы I, эритроид-специфического промотора и сайта инициации транскрипции» . Молекулярная генетика и обмен веществ . 67 (2): 118–130. дои : 10.1006/mgme.1999.2842 . ПМИД 10356311 .











