Альдолаза А
| АЛДО | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ALDOA , ALDA, GSD12, HEL-S-87p, альдолаза, фруктозобисфосфат А, альдолаза А | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 103850 ; МГИ : 87994 ; Гомологен : 141054 ; GeneCards : ALDOA ; ОМА : АЛДОА – ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| фруктозо-бисфосфатальдолаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 4.1.2.13 | ||
| Номер CAS. | 9024-52-6 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Альдолаза А ( ALDOA или ALDA ), также известная как фруктозо-бисфосфатальдолаза, представляет собой фермент , который у человека кодируется геном ALDOA на хромосоме 16.
Белок, кодируемый этим геном, представляет собой гликолитический фермент, который катализирует обратимое превращение фруктозо-1,6-бисфосфата в глицеральдегид-3-фосфат (G3P) и дигидроксиацетонфосфат (DHAP). Три изозима альдолазы (A, B и C), кодируемые тремя разными генами, по-разному экспрессируются во время развития. Альдолаза А обнаруживается в развивающемся эмбрионе и вырабатывается в еще больших количествах в мышцах взрослого человека. Экспрессия альдолазы А подавляется в печени, почках и кишечнике взрослых и аналогична уровням альдолазы С в мозге и других нервных тканях. Дефицит альдолазы А связан с миопатией и гемолитической анемией . Альтернативный сплайсинг и использование альтернативного промотора приводят к образованию множества вариантов транскрипта. Родственные псевдогены были идентифицированы на хромосомах 3 и 10. [5]
Структура
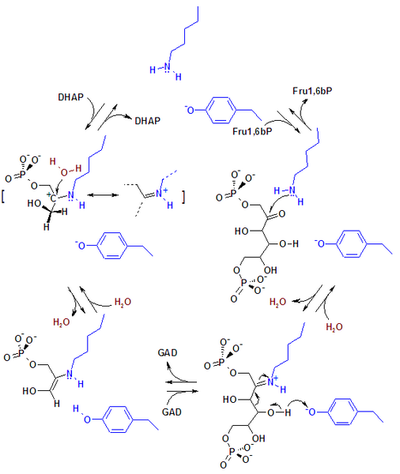
[ редактировать ]ALDOA представляет собой гомотетрамер и один из трех изоферментов альдолазы (A, B и C), кодируемых тремя разными генами. [6] [7] Ген ALDOA содержит 8 экзонов и 5'- UTR IB. [7] ключевые аминокислоты, Идентифицированы ответственные за его каталитическую функцию. Остаток тогда как Lys146, как предполагается , Tyr363 действует как кислотно-основной катализатор протонирования C3 субстрата , стабилизирует отрицательный заряд образующегося конъюгатного основания Tyr363 и напряженную конфигурацию C-конца . Остаток Glu187 участвует во многих функциях, включая катализ альдолазы FBP, кислотно-основной катализ во время связывания субстрата, дегидратацию и расщепление субстрата. [8] Хотя ALDOA локализуется в ядре, у него отсутствуют какие-либо известные сигналы ядерной локализации (NLS). [9]
Механизм
[ редактировать ]В альдолазе млекопитающих ключевыми каталитическими аминокислотными остатками, участвующими в реакции, являются лизин и тирозин . Тирозин действует как эффективный акцептор водорода, тогда как лизин ковалентно связывает и стабилизирует промежуточные соединения. Многие бактерии используют два магния иона вместо лизина. [ нужна ссылка ]
| β- D - фруктозо-1,6-фосфат | фруктозо-бисфосфатальдолаза | D - глицеральдегид-3-фосфат | дигидроксиацетонфосфат | ||
 |  | + |  | ||
 | |||||
Соединение C05378 в базе данных KEGG Pathway. Фермент 4.1.2.13 в базе данных путей KEGG . Соединение C00111 в базе данных KEGG Pathway. Соединение C00118 в базе данных KEGG Pathway.
Нумерация атомов углерода указывает на судьбу атомов углерода в соответствии с их положением во фруктозо-6-фосфате.
Функция
[ редактировать ]АЛДОА является ключевым ферментом четвертой стадии гликолиза, а также обратного пути глюконеогенеза . Он катализирует обратимое превращение фруктозо-1,6-бисфосфата в глицеральдегид-3-фосфат и дигидроксиацетонфосфат путем альдольного разрыва связи C3–C4. В результате он играет решающую роль в АТФ биосинтезе . [6] [8] [9] [10] [11] ALDOA также способствует другим функциям «подработки», таким как поддержание мышц, регуляция формы и подвижности клеток, поперечно-полосатых мышц сокращение , организация актинового цитоскелета и регуляция пролиферации клеток. [6] [9] [10] ALDOA, вероятно, регулирует ремоделирование актинового цитоскелета посредством взаимодействия с цитогезином-2 (ARNO) и Arf6. [10]
ALDOA повсеместно экспрессируется в большинстве тканей, хотя преимущественно экспрессируется в развивающихся эмбрионах и мышцах взрослого человека. [6] [11] В лимфоцитах ALDOA является преобладающей изоформой альдолазы. [11] Внутри клетки ALDOA обычно локализуется в цитоплазме , но может локализоваться и в ядре во время синтеза ДНК S-фазы клеточного цикла . Эта ядерная локализация регулируется протеинкиназами AKT и p38 . Предполагается, что ядро служит резервуаром для ALDOA в условиях низкого содержания глюкозы. [9] АЛДОА также обнаружена в митохондриях . [11]
АЛДОА регулируется субстратами энергетического обмена глюкозой , лактатом и глютамином . [9] В тучных клетках человека (ТК) ALDOA подвергается посттрансляционной регуляции посредством белка тирозина нитрования , что может изменять его относительное сродство к FBP и/или IP3 . IP3 и PLC Это изменение затем влияет на сигнальные каскады в IgE-зависимых ответах. [11]
Клиническое значение
[ редактировать ]Альдолаза А (ALDOA) высоко экспрессируется при множественных видах рака, включая плоскоклеточную карциному легких (LSCC), рак почки и гепатоцеллюлярную карциному . Предполагается, что сверхэкспрессия ALDOA усиливает гликолиз в этих опухолевых клетках, способствуя их росту. При LSCC усиление его регуляции коррелирует с метастазированием и плохим прогнозом, тогда как понижение его регуляции снижает подвижность опухолевых клеток и онкогенез . Таким образом, ALDOA может быть потенциальным биомаркером LSCC и мишенью для терапевтических препаратов. [6]
Дефицит альдолазы А — редкое аутосомно- рецессивное заболевание, связанное с гемолизом и сопровождающееся слабостью, мышечными болями и миопатией . [7]
Интерактивная карта маршрутов
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «Гликолиз-Глюконеогенез_WP534» .
Взаимодействия
[ редактировать ]Было показано, что альдолаза А взаимодействует с:
- ПЛД2 , [12]
- актин , [11]
- GLUT4 , [13]
- фосфолипаза D2, [13]
- легкая цепь 8 динеина , [13]
- анионообменник эритроцитов, белок Band 3, [13]
- рианодиновый рецептор , [11]
- Цитогезин-2 , [10] и
- V-АТФаза (Н+-АТФаза вакуолярного типа). [10]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000149925 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000030695 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ген Энтреза: ALDOA-альдолаза А, фруктозо-бисфосфат» .
- ^ Jump up to: а б с д и Ду С, Гуань З, Хао Л, Сун Ю, Ван Л, Гун Л, Лю Л, Ци Икс, Хоу З, Шао С (2014). «Фруктозо-бисфосфатальдолаза а является потенциальным метастазирующим маркером плоскоклеточного рака легких и способствует онкогенезу и миграции клеток легких» . ПЛОС ОДИН . 9 (1): e85804. Бибкод : 2014PLoSO...985804D . дои : 10.1371/journal.pone.0085804 . ПМЦ 3900443 . ПМИД 24465716 .
- ^ Jump up to: а б с Яо Д.С., Толан Д.Р., Мюррей М.Ф., Харрис Д.Д., Даррас Б.Т., Гева А., Нойфельд Э.Дж. (15 марта 2004 г.). «Гемолитическая анемия и тяжелый рабдомиолиз, вызванные сложными гетерозиготными мутациями гена эритроцитарного/мышечного изофермента альдолазы, ALDOA (Arg303X/Cys338Tyr)» . Кровь . 103 (6): 2401–3. дои : 10.1182/кровь-2003-09-3160 . ПМИД 14615364 .
- ^ Jump up to: а б Титтманн К. (декабрь 2014 г.). «Милые братья и сестры с разными лицами: пересмотр механизмов FBP и альдолазы F6P, трансальдолазы, транскетолазы и фосфокетолазы в свете последних структурных данных». Биоорганическая химия . 57 : 263–80. дои : 10.1016/j.bioorg.2014.09.001 . ПМИД 25267444 .
- ^ Jump up to: а б с д и Мамчур П., Гамиан А., Колодзей Дж., Дзигель П., Ракус Д. (декабрь 2013 г.). «Ядерная локализация альдолазы А коррелирует с пролиферацией клеток». Биохимия и биофизика Acta (BBA) - Исследования молекулярных клеток . 1833 (12): 2812–2 дои : 10.1016/j.bbamcr.2013.07.013 . ПМИД 23886627 .
- ^ Jump up to: а б с д и Меркулова М., Уртадо-Лоренцо А., Хосокава Х., Чжуан З., Браун Д., Аусиелло Д.А., Маршанский В. (июнь 2011 г.). «Альдолаза напрямую взаимодействует с ARNO и модулирует морфологию клеток и распределение кислых везикул» . Американский журнал физиологии. Клеточная физиология . 300 (6): C1442-55. doi : 10.1152/ajpcell.00076.2010 . ПМК 3118619 . ПМИД 21307348 .
- ^ Jump up to: а б с д и ж г Секар Ю, Мун ТК, Слупский С.М., Бефус А.Д. (1 июля 2010 г.). «Белковое тирозиновое нитрование альдолазы в тучных клетках: возможный путь опосредованной оксидом азота регуляции функции тучных клеток» . Журнал иммунологии . 185 (1): 578–87. doi : 10.4049/jimmunol.0902720 . ПМИД 20511553 .
- ^ Ким Дж.Х., Ли Сукмук, Ким Чон Хван, Ли Тэхун Джи, Хирата Масато, Со Панн-Гилл , Рю Сон Хо (март 2002 г.). «Фосфолипаза D2 напрямую взаимодействует с альдолазой через ее домен PH». Биохимия . 41 (10). США: 3414–21. дои : 10.1021/bi015700a . ISSN 0006-2960 . ПМИД 11876650 .
- ^ Jump up to: а б с д Сен-Жан М., Изард Т., Сигуш Дж. (11 мая 2007 г.). «Гидрофобный карман в активном центре гликолитической альдолазы опосредует взаимодействие с белком синдрома Вискотта-Олдрича» . Журнал биологической химии . 282 (19): 14309–15. дои : 10.1074/jbc.m611505200 . ПМИД 17329259 .
Дальнейшее чтение
[ редактировать ]- Пфлайдерер Г., Тёнер М., Ваксмут Э.Д. (1976). «Гистологическое исследование мономерного состава альдолазы клеток почки человека и гипернефроидной карциномы». Вклад в патологию . 156 (3): 266–79. дои : 10.1016/s0005-8165(75)80166-1 . ПМИД 766744 .
- Ребейн-Тёнер М., Пфляйдерер Г. (1977). «Изменения в образце изофермента альдолазы во время развития почек и тонкой кишки человека, продемонстрированные в экстрактах органов и срезах тканей». З. Физиол Хоппе-Зейлера. Хим . 358 (2): 169–80. дои : 10.1515/bchm2.1977.358.1.169 . ПМИД 844801 .
- Ваксмут ЭД (1976). «Дифференциация эпителиальных клеток тощей кишки человека: локализация и количественное определение изоферментов аминопептидазы, щелочной фосфатазы и альдолазы в срезах тканей». Гистохимия . 48 (2): 101–9. дои : 10.1007/BF00494548 . ПМИД 955981 . S2CID 6347675 .
- Ли К.Н., Максвелл, М.К., Паттерсон М.К. и др. (1992). «Идентификация субстратов трансглутаминазы в клетках рака толстой кишки HT29: использование 5-(биотинамидо) пентиламина в качестве специфичного для трансглутаминазы зонда». Биохим. Биофиз. Акта . 1136 (1): 12–6. дои : 10.1016/0167-4889(92)90078-П . ПМИД 1353685 .
- Доусон С.Дж., Уайт, Лос-Анджелес (1992). «Лечение эндокардита, вызванного Haemophilus aphrophilus, ципрофлоксацином». Дж. Заразить . 24 (3): 317–20. дои : 10.1016/S0163-4453(05)80037-4 . ПМИД 1602151 .
- Мукаи Т., Арай Ю., Яцуки Х. и др. (1991). «Дополнительный промотор функционирует в гене альдолазы А человека, но не в крысе». Евро. Дж. Биохим . 195 (3): 781–7. дои : 10.1111/j.1432-1033.1991.tb15766.x . ПМИД 1999195 .
- Гамблин С.Дж., Дэвис Г.Дж., Граймс Дж.М. и др. (1991). «Активность и специфичность альдолаз человека». Дж. Мол. Биол . 219 (4): 573–6. дои : 10.1016/0022-2836(91)90650-У . ПМИД 2056525 .
- Вертесси Б.Г., Орос Ф., Овади Дж. (1991). «Модуляция взаимодействия между альдолазой и глицеринфосфатдегидрогеназой с помощью фруктозофосфатов». Биохим. Биофиз. Акта . 1078 (2): 236–42. дои : 10.1016/0167-4838(91)90564-г . ПМИД 2065091 .
- Такасаки Ю, Такахаси И, Мукаи Т, Хори К (1990). «Человеческая альдолаза А пациента с гемолитической анемией с заменой Asp-128----Gly: характеристики фермента, вырабатываемого в E. coli, трансфицированной экспрессирующей плазмидой pHAAD128G». Дж. Биохим . 108 (2): 153–7. doi : 10.1093/oxfordjournals.jbchem.a123174 . ПМИД 2229018 .
- Гамблин С.Дж., Купер Б., Миллар Дж.Р. и др. (1990). «Кристаллическая структура альдолазы мышц человека при разрешении 3,0 А». ФЭБС Летт . 262 (2): 282–6. дои : 10.1016/0014-5793(90)80211-Z . ПМИД 2335208 . S2CID 46133456 .
- Киши Х., Мукаи Т., Хироно А. и др. (1988). «Дефицит человеческой альдолазы А, связанный с гемолитической анемией: термолабильная альдолаза из-за мутации одного основания» . Учеб. Натл. акад. наук. США . 84 (23): 8623–7. Бибкод : 1987PNAS...84.8623K . дои : 10.1073/pnas.84.23.8623 . ПМК 299598 . ПМИД 2825199 .
- Иззо П., Костанцо П., Лупо А. и др. (1987). «Новый человеческий вид мРНК альдолазы А из фибробластов». Евро. Дж. Биохим . 164 (1): 9–13. дои : 10.1111/j.1432-1033.1987.tb10984.x . ПМИД 3030757 .
- Инагаки Х., Хаймото Х., Хосода С., Като К. (1988). «Альдолаза С локализуется в нейроэндокринных клетках». Эксперименты . 44 (9): 749–51. дои : 10.1007/BF01959149 . ПМИД 3046960 . S2CID 10109239 .
- Фримонт П.С., Данбар Б., Фотергилл-Гилмор Л.А. (1988). «Полная аминокислотная последовательность фруктозо-бисфосфатальдолазы скелетных мышц человека» . Биохим. Дж . 249 (3): 779–88. дои : 10.1042/bj2490779 . ПМЦ 1148774 . ПМИД 3355497 .
- Иззо П., Костанцо П., Лупо А. и др. (1988). «Ген альдолазы А человека. Структурная организация и тканеспецифическая экспрессия с помощью нескольких промоторов и альтернативной обработки мРНК» . Евро. Дж. Биохим . 174 (4): 569–78. дои : 10.1111/j.1432-1033.1988.tb14136.x . ПМИД 3391172 .
- Мэр П., Гаутрон С., Хаким В. и др. (1988). «Характеристика трех необязательных промоторов в 5'-области гена альдолазы А человека». Дж. Мол. Биол . 197 (3): 425–38. дои : 10.1016/0022-2836(87)90556-0 . ПМИД 3441006 .
- Кукита А., Ёсида М.К., Фукусигэ С. и др. (1987). «Молекулярное картирование гена человеческой альдолазы А (ALDOA) на хромосоме 16». Хм. Жене . 76 (1): 20–6. дои : 10.1007/BF00283044 . ПМИД 3570299 . S2CID 162055 .
- Толан Д.Р., Никлас Дж., Брюс Б.Д., Лебо Р.В. (1987). «Эволюционное значение расположения хромосом альдолазы-A, -B, -C и -псевдогенов человека» . Являюсь. Дж. Хум. Жене . 41 (5): 907–24. ПМЦ 1684339 . ПМИД 3674018 .
- Сакакибара М., Мукаи Т., Хори К. (1985). «Нуклеотидная последовательность клона кДНК альдолазы человека: информационная РНК в печени». Биохим. Биофиз. Рез. Коммун . 131 (1): 413–20. дои : 10.1016/0006-291X(85)91818-2 . ПМИД 3840020 .
- Овади Дж., Мохамед Осман ИР, Батке Дж. (1983). «Взаимодействие диссоциируемой глицерин-3-фосфатдегидрогеназы и фруктозо-1,6-бисфосфатальдолазы. Количественный анализ с помощью внешнего флуоресцентного зонда» . Евро. Дж. Биохим . 133 (2): 433–7. дои : 10.1111/j.1432-1033.1983.tb07482.x . ПМИД 6406231 .
Внешние ссылки
[ редактировать ]- http://pdbdev.sdsc.edu:48346/pdb/molecules/pdb50_5.html [ постоянная мертвая ссылка ]
- Фруктозо-бисфосфат + альдолаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- АЛДО
- ЕС 4.1.2.13
- человека Расположение генома ALDOA и ALDOA страница сведений о гене в браузере генома UCSC .
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для человеческой фруктозо-бисфосфатальдолазы А.