Фосфофруктокиназа 2
| 6-фосфофрукто-2-киназа | |||
|---|---|---|---|
 Димер 6-фосфофрукто-2-киназы, сердце человека | |||
| Идентификаторы | |||
| Номер ЕС. | 2.7.1.105 | ||
| Номер CAS. | 78689-77-7 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| 6ПФ2К | |||
|---|---|---|---|
 кристаллическая структура печени человека 6-фосфофрукто-2-киназа/фруктозо-2,6-бисфосфатаза | |||
| Идентификаторы | |||
| Символ | 6ПФ2К | ||
| Пфам | PF01591 | ||
| Пфам Клан | CL0023 | ||
| ИнтерПро | ИПР013079 | ||
| PROSITE | PDOC00158 | ||
| СКОП2 | 1биф / СКОПе / СУПФАМ | ||
| |||
| 6-фосфофрукто-2-киназа/фруктозо-бисфосфатаза-2 | |||
|---|---|---|---|
 Структура ПФК2. Показаны: киназный домен (голубой) и фосфатазный домен (зеленый). | |||
| Идентификаторы | |||
| Символ | 6ПФ2К | ||
| Пфам | PF01591 | ||
| ИнтерПро | ИПР013079 | ||
| PROSITE | PDOC00158 | ||
| СКОП2 | 1биф / СКОПе / СУПФАМ | ||
| |||
| фруктозо-бисфосфатаза-2 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | FBPase-2 | ||
| Пфам | PF00316 | ||
| ИнтерПро | ИПР028343 | ||
| PROSITE | PDOC00114 | ||
| |||
Фосфофруктокиназа-2 ( 6-фосфофрукто-2-киназа , PFK-2 ) или фруктозобисфосфатаза-2 ( FBPase-2 ) представляет собой фермент , косвенно ответственный за регулирование скорости гликолиза и глюконеогенеза в клетках. Он катализирует образование и деградацию важного аллостерического регулятора, фруктозо-2,6-бисфосфата (Fru-2,6-P 2 ) из субстрата фруктозо-6-фосфата . Fru-2,6-P 2 способствует определяющей скорость стадии гликолиза, поскольку он активирует фермент фосфофруктокиназу 1 в пути гликолиза и ингибирует фруктозо-1,6-бисфосфатазу 1 в глюконеогенезе. [1] Поскольку Fru-2,6-P 2 по-разному регулирует гликолиз и глюконеогенез, он может действовать как ключевой сигнал для переключения между противоположными путями. [1] Поскольку PFK-2 производит Fru-2,6-P 2 в ответ на гормональные сигналы, метаболизм можно контролировать более чутко и эффективно, чтобы он соответствовал гликолитическим потребностям организма. [2] Этот фермент участвует в фруктозы и метаболизме маннозы . Фермент важен для регуляции обмена печени углеводного в и в наибольших количествах содержится в печени, почках и сердце . У млекопитающих несколько генов часто кодируют разные изоформы, каждая из которых отличается тканевым распределением и ферментативной активностью. [3] Описанное здесь семейство имеет сходство с АТФ - управляемыми фосфофруктокиназами; однако они имеют небольшое сходство последовательностей , хотя несколько остатков кажутся ключевыми для их взаимодействия с фруктозо-6-фосфатом . [4]
PFK-2 известен как «бифункциональный фермент» из-за его примечательной структуры: хотя оба домена расположены на одном гомодимере белка , два его домена действуют как независимо функционирующие ферменты. [5] Один конец служит киназным доменом (для PFK-2), а другой конец действует как фосфатазный домен (FBPase-2). [6]
У млекопитающих генетические механизмы кодируют различные изоформы PFK-2 для удовлетворения специфических потребностей тканей. Хотя общая функция остается прежней, изоформы имеют небольшие различия в ферментативных свойствах и контролируются разными методами регуляции; эти различия обсуждаются ниже. [7]
Структура
[ редактировать ]Мономеры бифункционального белка четко разделены на два функциональных домена. Киназный домен расположен на N-конце. [8] Он состоит из центрального шестинитевого β-листа с пятью параллельными нитями и антипараллельной краевой нити, окруженных семью α-спиралями. [6] Домен содержит нуклеотидсвязывающую складку (nbf) на С-конце первой β-цепи. [9] Домен PFK-2, по-видимому, тесно связан с суперсемейством мононуклеотидсвязывающих белков, включая аденилатциклазу . [10]
С другой стороны, домен фосфатазы расположен на С-конце. [11] Он напоминает семейство белков, включающее фосфоглицератмутазы и кислые фосфатазы. [10] [12] Домен имеет смешанную α/β-структуру с шестицепочечным центральным β-листом и дополнительным α-спиральным субдоменом, который покрывает предполагаемый активный сайт молекулы. [6] Наконец, N-концевая область модулирует активность PFK-2 и FBPase2 и стабилизирует димерную форму фермента. [12] [13]
Хотя это центральное каталитическое ядро остается консервативным во всех формах PFK-2, в изоформах существуют небольшие структурные вариации в результате различных аминокислотных последовательностей или альтернативного сплайсинга. [14] За некоторыми незначительными исключениями, размер ферментов PFK-2 обычно составляет около 55 кДа. [1]
Исследователи предполагают, что уникальная бифункциональная структура этого фермента возникла в результате слияния генов первичной бактериальной PFK-1 и первичной мутазы/фосфатазы. [15]
Функция
[ редактировать ]Основная функция этого фермента заключается в синтезе или разрушении аллостерического регулятора Fru-2,6-P 2 в ответ на гликолитические потребности клетки или организма, как показано на прилагаемой диаграмме.
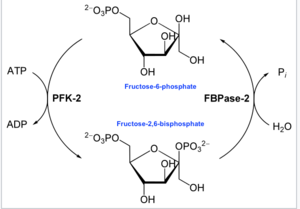
В энзимологии 6-фосфофрукто-2-киназа ( КФ 2.7.1.105 ) представляет собой фермент катализирующий , химическую реакцию :
- АТФ + бета-D-фруктозо-6-фосфат АДФ + бета-D-фруктозо-2,6-бисфосфат [16]
Таким образом, киназный домен гидролизует АТФ, фосфорилируя углерод-2 фруктозо-6-фосфата, образуя Fru-2,6-P 2 и АДФ . В ходе реакции образуется промежуточный фосфогистидин. [17]
- На другом конце домен фруктозо-2,6-бисфосфат-2-фосфатазы ( EC 3.1.3.46 ) дефосфорилирует Fru-2,6-P 2 с добавлением воды. Противоположная химическая реакция:
- бета-D-фруктозо-2,6-бисфосфат + H 2 O D-фруктозо-6-фосфат + фосфат [18]
Из-за двойных функций фермента его можно разделить на несколько семейств. Согласно классификации по киназной реакции, этот фермент принадлежит к семейству трансфераз , в частности к тем, которые переносят фосфорсодержащие группы ( фосфотрансферазы ) со спиртовой группой в качестве акцептора. [16] С другой стороны, фосфатазная реакция характерна для семейства гидролаз , особенно тех, которые действуют на моноэфирные связи фосфорной кислоты. [18]
Регулирование
[ редактировать ]Почти во всех изоформах PFK-2 подвергается ковалентной модификации посредством фосфорилирования/дефосфорилирования на основе гормональной передачи сигналов клетки. Фосфорилирование определенного остатка может вызвать сдвиг, который стабилизирует функцию либо киназного, либо фосфатазного домена. Таким образом, этот регулирующий сигнал контролирует, будет ли F-2,6-P 2 синтезироваться или разлагаться. [19]
Более того, аллостерическая регуляция PFK2 очень похожа на регуляцию PFK1 . [20] Высокие уровни АМФ или фосфатной группы указывают на низкоэнергетическое зарядовое состояние и, таким образом, стимулируют PFK2. С другой стороны, высокая концентрация фосфоенолпирувата (PEP) и цитрата означает, что существует высокий уровень биосинтетического предшественника и, следовательно, ингибирует PFK2. В отличие от PFK1, PFK2 не зависит от концентрации АТФ. [21]
изоферменты
[ редактировать ]Белковые изоферменты — это ферменты, которые катализируют одну и ту же реакцию, но кодируются разными аминокислотными последовательностями и поэтому имеют небольшие различия в характеристиках белков. У человека четыре гена, кодирующие белки фосфофруктокиназы 2, включают PFKFB-1 , PFKFB2 , PFKFB3 и PFKFB4 . [5]
На сегодняшний день сообщалось о множестве изоформ этого белка у млекопитающих, причем различия увеличиваются либо за счет транскрипции различных ферментов, либо за счет альтернативного сплайсинга. [22] [23] [24] Хотя структурное ядро, которое катализирует реакцию PFK-2/FBPase-2, высоко консервативно среди изоформ, основные различия возникают из-за сильно варьирующихся фланкирующих последовательностей на амино- и карбоксильных концах изоформ. [14] Поскольку эти области часто содержат сайты фосфорилирования, изменения в аминокислотном составе или концевой длине могут привести к совершенно разным кинетикам и характеристикам ферментов. [1] [14] Каждый вариант отличается первичной тканью экспрессии, реакцией на регуляцию протеинкиназы и соотношением активности киназного/фосфатазного домена. [25] Хотя в ткани может присутствовать несколько типов изозимов, изозимы идентифицируются по их первичной тканевой экспрессии и ткани, обнаруженной ниже. [26]
PFKB1: печень, мышцы и плод.
[ редактировать ]| 6-фосфофрукто-2-киназа:ПФКБ1 | |||
|---|---|---|---|
 Кристаллическая структура 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы печени человека | |||
| Идентификаторы | |||
| Номер ЕС. | 2.7.1.105 | ||
| Номер CAS. | 78689-77-7 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Этот ген, расположенный на Х-хромосоме, является наиболее известным из четырех генов, особенно потому, что он кодирует тщательно изученный фермент печени. [22] Вариабельный сплайсинг мРНК PFKB1 дает три разных промотора (L, M и F) и, следовательно, три тканеспецифических варианта, которые различаются регуляцией: [27]
- L-тип: ткань печени
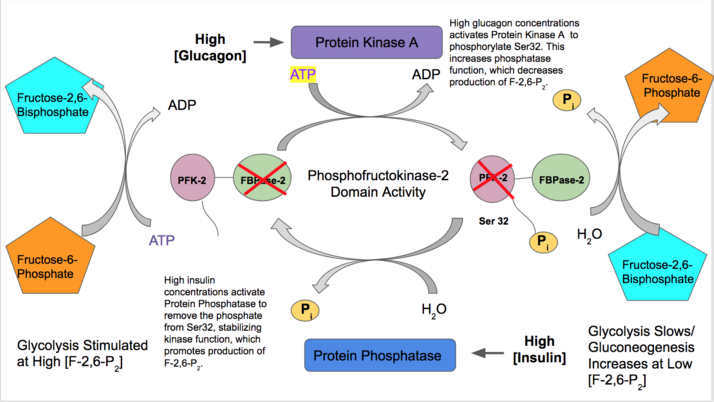
- Инсулин активирует функцию PFK-2 печени, указывая на то, что большое количество глюкозы в крови доступно для гликолиза. Инсулин активирует протеинфосфатазу , которая дефосфорилирует комплекс PFK-2 и вызывает благоприятную активность PFK-2. Затем PFK-2 увеличивает выработку F-2,6-P 2. Поскольку этот продукт аллостерически активирует PFK-1, он активирует гликолиз и ингибирует глюконеогенез. [28]
- Напротив, глюкагон увеличивает активность FBPазы-2. При низких концентрациях глюкозы в крови глюкагон запускает сигнальный каскад цАМФ и, в свою очередь, протеинкиназа А (ПКА) фосфорилирует серин 32 вблизи N-конца. Это инактивирует способность бифункционального фермента действовать как киназа и стабилизирует активность фосфатазы. Таким образом, глюкагон снижает концентрацию F-2,6-P 2, замедляет скорость гликолиза и стимулирует путь глюконеогенеза. [29] [30]
- М-тип: скелетная мышечная ткань; F-тип: фибробласты и ткани плода. [31]
- В отличие от большинства других тканей PFK-2, PFK-2 как в скелетных мышцах, так и в тканях плода регулируется исключительно концентрацией фруктозо-6-фосфата. В их первом экзоне нет регуляторных сайтов, которые требуют фосфорилирования/дефосфорилирования, чтобы спровоцировать изменение функции. Высокие концентрации F-6-P активируют функцию киназы и увеличивают скорость гликолиза, тогда как низкие концентрации F-6-P стабилизируют действие фосфатазы. [27]
| 6-фосфофрукто-2-киназа:ПФКБ2 | |||
|---|---|---|---|
 Димер 6-фосфофрукто-2-киназы, ткань сердца человека | |||
| Идентификаторы | |||
| Номер ЕС. | 2.7.1.105 | ||
| Номер CAS. | 78689-77-7 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
PFKB2: Сердечный (H-тип)
[ редактировать ]Ген PFKB2 расположен на хромосоме 1. [32] Когда циркулируют более высокие концентрации адреналина и/или гормона инсулина, активируется путь протеинкиназы А, который фосфорилирует либо серин 466, либо серин 483 на С-конце. [3] Альтернативно, протеинкиназа B также может фосфорилировать эти регуляторные сайты, которые являются частью домена FBPase-2. [33] Когда этот остаток серина фосфорилируется, функция FBPase-2 инактивируется и стабилизируется большая активность PFK-2. [27]
PFKB3: мозговой, плацентарный и индуцибельный.
[ редактировать ]PFKB3 расположен на хромосоме 10 и транскрибирует две основные изоформы: индуцибельный тип и повсеместный тип. [34] Эти формы отличаются альтернативным сплайсингом экзона 15 на С-конце. [35] Однако они схожи в том, что в обоих случаях глюкагон активирует путь циклического АМФ; это приводит к тому, что протеинкиназа A, протеинкиназа C или AMP-активируемая протеинкиназа фосфорилирует регуляторный остаток серина 461 на C-конце для стабилизации функции киназы PFK-2. [36] Кроме того, обе изоформы, транскрибируемые с этого гена, отличаются особенно высоким, доминирующим уровнем киназной активности, о чем свидетельствует соотношение активностей киназы/фосфатазы, равное 700 (тогда как изоферменты печени, сердца и семенников соответственно имеют PFK-2/FBPase- 2 передаточных числа: 1,5, 80 и 4). [37] Следовательно, PFKB3, в частности, последовательно производит большие количества F-2,6-P 2 и поддерживает высокие скорости гликолиза. [37] [38]
- I-тип: Индуцируемый
- U-тип: вездесущий; [40] также известный как плацентарный [41] или мозг [42] [43]
- Хотя они обнаруживаются по отдельности в тканях плаценты, β-островков поджелудочной железы или головного мозга, различные изоформы кажутся идентичными. [21] Ткани, в которых он был обнаружен, требуют большого количества энергии для функционирования, что может объяснить преимущество PFKB3 в таком высоком соотношении активности киназы и фосфатазы. [37] [44]
- Изоформа головного мозга, в частности, имеет длинные N- и C-концевые области, так что этот тип почти в два раза больше, чем типичный PFK-2, около 110 кДа. [45]
PFKB4: Яичко (Т-тип)
[ редактировать ]Ген PFKB4, расположенный на хромосоме 3, экспрессирует PFK-2 в ткани семенников человека. [46] Ферменты PFK-2, кодируемые PFK-4, сравнимы с ферментами печени по размеру (около 54 кДа) и, как и мышечная ткань, не содержат сайта фосфорилирования протеинкиназы. [40] Хотя меньше исследований прояснило механизмы регуляции этой изоформы, исследования подтвердили, что модификация множественных факторов транскрипции в 5'-фланкирующей области регулирует степень экспрессии PFK-2 в развивающейся ткани семенников. [26] Эта изоформа особенно важна как модифицированная и гиперэкспрессируемая для выживания клеток рака простаты. [47]
Клиническое значение
[ редактировать ]Поскольку это семейство ферментов поддерживает скорость гликолиза и глюконеогенеза, оно представляет большой потенциал терапевтического действия для контроля метаболизма, особенно в диабетических и раковых клетках. [6] [25] Данные также показывают, что все гены PFK-2 (хотя реакция гена PFKB3 остается наиболее резкой) были активированы из-за ограничения кислорода. [48] Было обнаружено, что контроль активности PFK-2/FBP-азы2 связан с функционированием сердца, особенно при ишемии , и контролем гипоксии . [49] Исследователи предполагают, что эта отзывчивая характеристика генов PFK-2 может быть сильной эволюционной физиологической адаптацией. [48] Однако многие типы раковых клеток человека (включая рак легких, молочной железы, толстой кишки, поджелудочной железы и яичников) демонстрируют сверхэкспрессию PFK3 и/или PFK4; это изменение метаболизма, вероятно, играет роль в эффекте Варбурга . [25] [50]
Наконец, ген Pfkfb2, кодирующий белок PFK2/FBPase2, связан с предрасположенностью к шизофрении . [51]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Курланд И.Я., Пилкис С.Ю. (июнь 1995 г.). «Ковалентный контроль 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы: понимание ауторегуляции бифункционального фермента» . Белковая наука . 4 (6): 1023–37. дои : 10.1002/pro.5560040601 . ПМК 2143155 . ПМИД 7549867 .
- ^ Ленцен С. (май 2014 г.). «Свежий взгляд на гликолиз и регуляцию глюкокиназы: история и современное состояние» . Журнал биологической химии . 289 (18): 12189–94. дои : 10.1074/jbc.R114.557314 . ПМК 4007419 . ПМИД 24637025 .
- ^ Jump up to: а б Хейне-Суньер Д., Диас-Гильен М.А., Ланге А.Х., Родригес де Кордова С. (май 1998 г.). «Последовательность и структура гена изоформы сердца 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы человека (PFKFB2)» . Европейский журнал биохимии . 254 (1): 103–10. дои : 10.1046/j.1432-1327.1998.2540103.x . ПМИД 9652401 .
- ^ Ван X, Дэн Z, Кемп Р.Г. (сентябрь 1998 г.). «Основной остаток метионина, участвующий в связывании субстрата фосфофруктокиназами». Биохим. Биофиз. Рез. Коммун . 250 (2): 466–8. дои : 10.1006/bbrc.1998.9311 . ПМИД 9753654 .
- ^ Jump up to: а б Райдер М.Х., Бертран Л., Вертоммен Д., Михельс П.А., Руссо Г.Г., Хюэ Л. (август 2004 г.). «6-фосфофрукто-2-киназа/фруктозо-2,6-бисфосфатаза: борьба с бифункциональным ферментом, контролирующим гликолиз» . Биохимический журнал . 381 (Часть 3): 561–79. дои : 10.1042/BJ20040752 . ПМЦ 1133864 . ПМИД 15170386 .
- ^ Jump up to: а б с д Хаземанн К.А., Иштван Э.С., Уеда К., Дайзенхофер Дж. (сентябрь 1996 г.). «Кристаллическая структура бифункционального фермента 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы обнаруживает четкую гомологию доменов» . Структура . 4 (9): 1017–29. дои : 10.1016/S0969-2126(96)00109-8 . ПМИД 8805587 .
- ^ Ацуми Т., Нисио Т., Нива Х., Такеучи Дж., Бандо Х., Симидзу С., Ёсиока Н., Букала Р., Койке Т. (декабрь 2005 г.). «Экспрессия индуцибельных изоформ 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы/PFKFB3 в адипоцитах и их потенциальная роль в гликолитической регуляции» . Диабет . 54 (12): 3349–57. дои : 10.2337/диабет.54.12.3349 . ПМИД 16306349 .
- ^ Курланд И., Чепмен Б., Ли Ю.Х., Пилкис С. (август 1995 г.). «Эволюционная реинжиниринг активного центра фосфофруктокиназы: ARG-104 не стабилизирует переходное состояние 6-фосфофрукто-2-киназы». Связь с биохимическими и биофизическими исследованиями . 213 (2): 663–72. дои : 10.1006/bbrc.1995.2183 . ПМИД 7646523 .
- ^ Уокер Дж. Э., Сарасте М., Рансуик М. Дж., Гей, Нью-Джерси (1982). «Отдаленно родственные последовательности в альфа- и бета-субъединицах АТФ-синтазы, миозина, киназ и других АТФ-требующих ферментов и общая складка, связывающая нуклеотиды» . Журнал ЭМБО . 1 (8): 945–51. дои : 10.1002/j.1460-2075.1982.tb01276.x . ПМК 553140 . ПМИД 6329717 .
- ^ Jump up to: а б Енджеяс М.Ю. (2000). «Структура, функции и эволюция фосфоглицератмутаз: сравнение с фруктозо-2,6-бисфосфатазой, кислой фосфатазой и щелочной фосфатазой» . Прогресс биофизики и молекулярной биологии . 73 (2–4): 263–87. дои : 10.1016/S0079-6107(00)00007-9 . ПМИД 10958932 .
- ^ Ли Л., Лин К., Пилкис Дж., Коррейя Дж.Дж., Пилкис С.Дж. (октябрь 1992 г.). «Печеночная 6-фосфофрукто-2-киназа/фруктозо-2,6-бисфосфатаза. Роль основных остатков поверхностной петли в связывании субстрата с доменом фруктозо-2,6-бисфосфатазы» . Журнал биологической химии . 267 (30): 21588–94. дои : 10.1016/S0021-9258(19)36651-7 . ПМИД 1328239 .
- ^ Jump up to: а б Страйер Л., Берг Дж.М., Тимочко Дж.Л. (2008). «Баланс между гликолизом и глюконеогенезом в печени чувствителен к концентрации глюкозы в крови». Биохимия (вкладыш) . Сан-Франциско: WH Freeman. стр. 466–467. ISBN 978-1-4292-3502-0 .
- ^ Томинага Н., Минами Й., Сакакибара Р., Уеда К. (июль 1993 г.). «Значение аминоконца семенников крысы фруктозо-6-фосфат, 2-киназа:фруктозо-2,6-бисфосфатаза» . Журнал биологической химии . 268 (21): 15951–7. дои : 10.1016/S0021-9258(18)82344-4 . ПМИД 8393455 .
- ^ Jump up to: а б с Эль-Маграби М.Р., Ното Ф., Ву Н., Манес Н. (сентябрь 2001 г.). «6-фосфофрукто-2-киназа / фруктозо-2,6-бисфосфатаза: подходящая структура в семействе тканеспецифичных ферментов». Текущее мнение о клиническом питании и метаболической помощи . 4 (5): 411–8. дои : 10.1097/00075197-200109000-00012 . ПМИД 11568503 . S2CID 6638455 .
- ^ Базан Дж. Ф., Флеттерик Р. Дж., Пилкис С. Дж. (декабрь 1989 г.). «Эволюция бифункционального фермента: 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы» . Труды Национальной академии наук Соединенных Штатов Америки . 86 (24): 9642–6. Бибкод : 1989PNAS...86.9642B . дои : 10.1073/pnas.86.24.9642 . ПМК 298557 . ПМИД 2557623 .
- ^ Jump up to: а б «ЭНЗИМНАЯ запись 2.7.1.105» . энзим.expasy.org . Проверено 24 марта 2018 г.
- ^ «6-фосфофрукто-2-киназа (IPR013079)» . ИнтерПро . ЭМБЛ-ЭБИ . Проверено 25 марта 2018 г.
- ^ Jump up to: а б «ЭНЗИМНАЯ запись 3.1.3.46» . энзим.expasy.org . Проверено 25 марта 2018 г.
- ^ Окар Д.А., Мансано А., Наварро-Сабате А., Риера Л., Бартронс Р., Ланге А.Дж. (январь 2001 г.). «PFK-2/FBPase-2: создатель и разрушитель незаменимого биофактора фруктозо-2,6-бисфосфата». Тенденции биохимических наук . 26 (1): 30–5. дои : 10.1016/S0968-0004(00)01699-6 . ПМИД 11165514 .
- ^ Ван Шафтинген Э., Херс Х.Г. (август 1981 г.). «Фосфофруктокиназа 2: фермент, образующий фруктозо-2,6-бисфосфат из фруктозо-6-фосфата и АТФ». Связь с биохимическими и биофизическими исследованиями . 101 (3): 1078–84. дои : 10.1016/0006-291X(81)91859-3 . ПМИД 6458291 .
- ^ Jump up to: а б Рос С., Шульце А (февраль 2013 г.). «Балансировка гликолитического потока: роль 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы в метаболизме рака» . Рак и обмен веществ . 1 (1): 8. дои : 10.1186/2049-3002-1-8 . ПМК 4178209 . ПМИД 24280138 .
- ^ Jump up to: а б Дарвилл М.И., Крепин К.М., Хью Л., Руссо Г.Г. (сентябрь 1989 г.). «5'-фланкирующая последовательность и структура гена, кодирующего крысиную 6-фосфофрукто-2-киназу/фруктозо-2,6-бисфосфатазу» . Труды Национальной академии наук Соединенных Штатов Америки . 86 (17): 6543–7. Бибкод : 1989PNAS...86.6543D . дои : 10.1073/pnas.86.17.6543 . ПМЦ 297880 . ПМИД 2549541 .
- ^ Цучия Ю., Уеда К. (май 1994 г.). «МРНК фруктозо-6-P,2-киназы бычьего сердца: фруктозо-2,6-бисфосфатазы и структура гена». Архив биохимии и биофизики . 310 (2): 467–74. дои : 10.1006/abbi.1994.1194 . ПМИД 8179334 .
- ^ Саката Дж., Абэ Ю., Уеда К. (август 1991 г.). «Молекулярное клонирование ДНК, экспрессия и характеристика семенников крысы фруктозо-6-фосфат,2-киназа:фруктозо-2,6-бисфосфатаза» . Журнал биологической химии . 266 (24): 15764–70. дои : 10.1016/S0021-9258(18)98475-9 . ПМИД 1651918 .
- ^ Jump up to: а б с Новелласдемунт Л., Тато И., Наварро-Сабате А., Руис-Меана М., Мендес-Лукас А., Пералес Х.К., Гарсиа-Дорадо Д., Вентура Ф., Бартронс Р., Роза Х.Л. (апрель 2013 г.). «Акт-зависимая активация сердечного изофермента 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы (PFKFB2) аминокислотами» . Журнал биологической химии . 288 (15): 10640–51. дои : 10.1074/jbc.M113.455998 . ПМЦ 3624444 . ПМИД 23457334 .
- ^ Jump up to: а б Гомес М., Мансано А., Наварро-Сабате А., Дюран Дж., Обах М., Пералес Х.К., Бартронс Р. (январь 2005 г.). «Специфическая экспрессия гена pfkfb4 в зародышевых клетках сперматогоний и анализ его 5'-фланкирующей области». Письма ФЭБС . 579 (2): 357–62. дои : 10.1016/j.febslet.2004.11.096 . ПМИД 15642344 . S2CID 33170865 .
- ^ Jump up to: а б с Салвей Дж.Г. (2017). Метаболизм вкратце . Уайли-Блэквелл. ISBN 978-0-470-67471-0 .
- ^ Хюэ Л., Райдер М.Х., Руссо Г.Г. (1990). «Фруктозо-2,6-бисфосфат во внепеченочных тканях». В Пилкисе С.Дж. (ред.). Фруктозо-2,6-бисфосфат . Бока-Ратон, Флорида: CRC Press. стр. 173–193. ISBN 978-0-8493-4795-5 .
- ^ Пилкис С.Дж., Эль-Маграби М.Р., Клаус Т.Х. (1988). «Гормональная регуляция печеночного глюконеогенеза и гликолиза». Ежегодный обзор биохимии . 57 : 755–83. дои : 10.1146/annurev.bi.57.070188.003543 . ПМИД 3052289 .
- ^ Маркер А.Дж., Колосия А.Д., Таулер А., Соломон Д.Х., Кайр Ю., Ланге А.Дж., Эль-Маграби М.Р., Пилкис С.Дж. (апрель 1989 г.). «Глюкокортикоидная регуляция экспрессии генов печеночной 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы» . Журнал биологической химии . 264 (12): 7000–4. дои : 10.1016/S0021-9258(18)83531-1 . ПМИД 2540168 .
- ^ Косин-Роджер Дж., Верния С., Альварес М.С., Кукарелла С., Боска Л., Мартин-Санс П., Фернандес-Альварес А.Дж., Касадо М. (февраль 2013 г.). «Идентификация нового варианта мРНК Pfkfb1 в печени плода крысы». Связь с биохимическими и биофизическими исследованиями . 431 (1): 36–40. дои : 10.1016/j.bbrc.2012.12.109 . hdl : 11336/19538 . ПМИД 23291237 .
- ^ Дарвилл М.И., Чикри М., Лебо Э., Хюэ Л., Руссо Г.Г. (август 1991 г.). «Крысиный ген, кодирующий сердечную 6-фосфофрукто-2-киназу/фруктозо-2,6-бисфосфатазу» . Письма ФЭБС . 288 (1–2): 91–4. дои : 10.1016/0014-5793(91)81009-W . ПМИД 1652483 . S2CID 34116121 .
- ^ Марсин А.С., Бертран Л., Райдер М.Х., Депре Дж., Болойе С., Винсент М.Ф., Ван ден Берге Дж., Карлинг Д., Хюэ Л. (октябрь 2000 г.). «Фосфорилирование и активация сердечной PFK-2 с помощью AMPK играет роль в стимуляции гликолиза во время ишемии» . Современная биология . 10 (20): 1247–55. Бибкод : 2000CBio...10.1247M . дои : 10.1016/S0960-9822(00)00742-9 . ПМИД 11069105 . S2CID 7920767 .
- ^ Риера Л., Мансано А., Наварро-Сабате А., Пералес Х.К., Бартронс Р. (апрель 2002 г.). «Инсулин индуцирует экспрессию гена PFKFB3 в клетках аденокарциномы толстой кишки человека HT29» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1589 (2): 89–92. дои : 10.1016/S0167-4889(02)00169-6 . ПМИД 12007784 .
- ^ Марсин А.С., Бузен С., Бертран Л., Хюэ Л. (август 2002 г.). «Стимуляция гликолиза гипоксией в активированных моноцитах опосредуется АМФ-активируемой протеинкиназой и индуцибельной 6-фосфофрукто-2-киназой» . Журнал биологической химии . 277 (34): 30778–83. дои : 10.1074/jbc.M205213200 . ПМИД 12065600 .
- ^ Jump up to: а б с Сакакибара Р., Като М., Окамура Н., Накагава Т., Комада Ю., Томинага Н., Симодзё М., Фукасава М. (июль 1997 г.). «Характеристика плацентарной фруктозо-6-фосфаты, 2-киназы/фруктозо-2,6-бисфосфатазы человека» . Журнал биохимии . 122 (1): 122–8. doi : 10.1093/oxfordjournals.jbchem.a021719 . ПМИД 9276680 .
- ^ Манес Н.П., Эль-Маграби М.Р. (июнь 2005 г.). «Киназная активность 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы головного мозга человека регулируется посредством ингибирования фосфоенолпируватом». Архив биохимии и биофизики . 438 (2): 125–36. дои : 10.1016/j.abb.2005.04.011 . ПМИД 15896703 .
- ^ Чесни Дж., Митчелл Р., Бениньи Ф., Бахер М., Шпигель Л., Аль-Абед Ю., Хан Дж. Х., Мец К., Букала Р. (март 1999 г.). «Индуцибельный генный продукт 6-фосфофрукто-2-киназы с элементом нестабильности, богатым AU: роль в гликолизе опухолевых клеток и эффект Варбурга» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (6): 3047–52. Бибкод : 1999PNAS...96.3047C . дои : 10.1073/pnas.96.6.3047 . ПМЦ 15892 . ПМИД 10077634 .
- ^ Jump up to: а б Мансано А., Роза Х.Л., Вентура Ф., Перес Дж.Х., Надаль М., Эстивилл Х., Амбросио С., Хил Дж., Бартронс Р. (1998). «Молекулярное клонирование, экспрессия и хромосомная локализация повсеместно экспрессируемого гена 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы человека (PFKFB3)». Цитогенетика и клеточная генетика . 83 (3–4): 214–7. дои : 10.1159/000015181 . ПМИД 10072580 . S2CID 23221556 .
- ^ Сакаи А., Като М., Фукасава М., Исигуро М., Фуруя Э., Сакакибара Р. (март 1996 г.). «Клонирование кДНК, кодирующей новый изофермент фруктозо-6-фосфата, 2-киназы/фруктозо-2,6-бисфосфатазы из плаценты человека». Журнал биохимии . 119 (3): 506–11. doi : 10.1093/oxfordjournals.jbchem.a021270 . ПМИД 8830046 .
- ^ Вентура Ф., Амбросио С., Бартронс Р., Эль-Маграби М.Р., Ланге А.Дж., Пилкис С.Дж. (апрель 1995 г.). «Клонирование и экспрессия каталитического ядра 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы бычьего мозга». Связь с биохимическими и биофизическими исследованиями . 209 (3): 1140–8. дои : 10.1006/bbrc.1995.1616 . ПМИД 7733968 .
- ^ Бандо Х, Ацуми Т, Нисио Т, Нива Х, Мисима С, Симидзу С, Ёсиока Н, Букала Р, Койке Т (август 2005 г.). «Фосфорилирование семейства гликолитических регуляторов 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы/PFKFB3 при раке человека» . Клинические исследования рака . 11 (16): 5784–92. дои : 10.1158/1078-0432.CCR-05-0149 . ПМИД 16115917 .
- ^ Риера Л., Обач М., Наварро-Сабате А., Дюран Дж., Пералес Х.К., Виньялс Ф., Роза Х.Л., Вентура Ф., Бартронс Р. (август 2003 г.). «Регуляция повсеместно встречающейся 6-фосфофрукто-2-киназы с помощью протеолитического пути убиквитин-протеасома во время дифференцировки миогенных клеток C2C12» . Письма ФЭБС . 550 (1–3): 23–9. дои : 10.1016/S0014-5793(03)00808-1 . ПМИД 12935880 . S2CID 41726316 .
- ^ Вентура Ф., Роза Дж.Л., Амбросио С., Пилкис С.Дж., Бартронс Р. (сентябрь 1992 г.). «6-фосфофрукто-2-киназа/фруктозо-2,6-бисфосфатаза бычьего мозга. Доказательства наличия нейроспецифического изофермента» . Журнал биологической химии . 267 (25): 17939–43. дои : 10.1016/S0021-9258(19)37133-9 . hdl : 2445/177133 . ПМИД 1325453 .
- ^ Мансано А., Перес Х.Х., Надаль М., Эстивилл Х., Ланге А., Бартронс Р. (март 1999 г.). «Клонирование, экспрессия и хромосомная локализация гена 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы семенников человека». Джин . 229 (1–2): 83–9. дои : 10.1016/S0378-1119(99)00037-2 . ПМИД 10095107 .
- ^ Рос С., Сантос Ч.Р., Моко С., Баенке Ф., Келли Г., Хауэлл М., Замбони Н., Шульце А. (апрель 2012 г.). «Функциональный метаболический скрининг идентифицирует 6-фосфофрукто-2-киназу/фруктозо-2,6-бифосфатазу 4 как важный регулятор выживания клеток рака простаты» . Открытие рака . 2 (4): 328–43. дои : 10.1158/2159-8290.CD-11-0234 . ПМИД 22576210 .
- ^ Jump up to: а б Минченко О., Опентанова И. и Каро Дж. (2003). Гипоксическая регуляция экспрессии семейства генов 6-фосфофрукто-2-киназы/фруктозы-2, 6-бисфосфатазы (PFKFB-1-4) in vivo. Письма ФЕБС , 554 (3), 264–270.
- ^ Ван К., Донти Р.В., Ван Дж., Ланге А.Дж., Уотсон Л.Дж., Джонс С.П., Эпштейн П.Н. (июнь 2008 г.). «6-фосфофрукто-2-киназа/фруктозо-2,6-бисфосфатаза с дефицитом сердечной фосфатазы увеличивает гликолиз, гипертрофию и устойчивость миоцитов к гипоксии» . Американский журнал физиологии. Физиология сердца и кровообращения . 294 (6): H2889–97. дои : 10.1152/ajpheart.91501.2007 . ПМК 4239994 . ПМИД 18456722 .
- ^ Минченко О.Г., Опентанова И.Л., Огура Т., Минченко Д.О., Комисаренко С.В., Каро Дж., Эсуми Х (2005). «Экспрессия и чувствительность к гипоксии 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы 4 в линиях злокачественных клеток молочной железы» . Акта Биохимика Полоника . 52 (4): 881–8. дои : 10.18388/abp.2005_3402 . ПМИД 16025159 .
- ^ Стоун В.С., Фараоне С.В., Су Дж., Тарбокс С.И., Ван Эрдевег П., Цуанг М.Т. (май 2004 г.). «Доказательства связи между регуляторными ферментами гликолиза и шизофренией в мультиплексном образце» . Американский журнал медицинской генетики. Часть B. Нейропсихиатрическая генетика . 127Б (1): 5–10. дои : 10.1002/ajmg.b.20132 . ПМИД 15108172 . S2CID 2420843 .
- Ван Шафтинген Э., Херс Х.Г. (1981). «Фосфофруктокиназа 2: фермент, образующий фруктозо-2,6-бисфосфат из фруктозо-6-фосфата и АТФ». Биохим. Биофиз. Рез. Коммун . 101 (3): 1078–84. дои : 10.1016/0006-291X(81)91859-3 . ПМИД 6458291 .
Внешние ссылки
[ редактировать ]- Фруктоза + 2,6-бисфосфатаза Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- 6-фосфофруктокиназа Arabidopsis thaliana на сайте genome.jp
В эту статью включен текст из общественного достояния Pfam и InterPro IPR013079.
