Гексокиназа
| Гексокиназа | |||
|---|---|---|---|
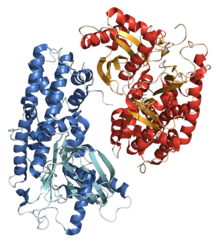 | |||
| Идентификаторы | |||
| Номер ЕС. | 2.7.1.1 | ||
| Номер CAS. | 9001-51-8 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| гексокиназа 1 | |||
|---|---|---|---|
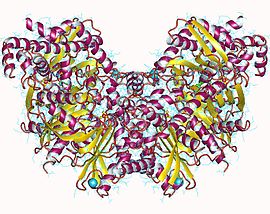 Гексокиназа 1, гомодимер, человек | |||
| Идентификаторы | |||
| Символ | НК1 | ||
| ген NCBI | 3098 | ||
| HGNC | 4922 | ||
| МОЙ БОГ | 142600 | ||
| RefSeq | НМ_000188 | ||
| ЮниПрот | P19367 | ||
| Другие данные | |||
| Локус | Хр. 10 q22 | ||
| |||
| гексокиназа 2 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ГК2 | ||
| ген NCBI | 3099 | ||
| HGNC | 4923 | ||
| МОЙ БОГ | 601125 | ||
| RefSeq | НМ_000189 | ||
| ЮниПрот | P52789 | ||
| Другие данные | |||
| Локус | Хр. 2 стр. 13 | ||
| |||
| гексокиназа 3 (лейкоциты) | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ГК3 | ||
| ген NCBI | 3101 | ||
| HGNC | 4925 | ||
| МОЙ БОГ | 142570 | ||
| RefSeq | НМ_002115 | ||
| ЮниПрот | P52790 | ||
| Другие данные | |||
| Локус | 5 q35.2 | ||
| |||
| Гексокиназа_1 | |||
|---|---|---|---|
 кристаллическая структура глюкокиназы человека | |||
| Идентификаторы | |||
| Символ | Гексокиназа_1 | ||
| Пфам | PF00349 | ||
| Пфам Клан | CL0108 | ||
| ИнтерПро | ИПР022672 | ||
| PROSITE | PDOC00370 | ||
| СКОП2 | 1cza / SCOPe / СУПФАМ | ||
| |||
| Гексокиназа_2 | |||
|---|---|---|---|
 Комплекс гексокиназы I типа мозга крысы с глюкозой и ингибитором глюкозо-6-фосфата | |||
| Идентификаторы | |||
| Символ | Гексокиназа_2 | ||
| Пфам | PF03727 | ||
| Пфам Клан | CL0108 | ||
| ИнтерПро | ИПР022673 | ||
| PROSITE | PDOC00370 | ||
| СКОП2 | 1cza / SCOPe / СУПФАМ | ||
| |||
Гексокиназа , — это фермент который необратимо фосфорилирует гексозы (шестиуглеродные сахара ), образуя гексозофосфат. У большинства организмов глюкоза является важнейшим субстратом гексокиназ, а глюкозо-6-фосфат важнейшим продуктом является . Гексокиназа обладает способностью переносить неорганическую фосфатную группу с АТФ на субстрат.
Гексокиназу не следует путать с глюкокиназой , которая представляет собой специфическую гексокиназу, обнаруженную в печени. Все гексокиназы способны фосфорилировать несколько гексоз, но гексокиназу IV(D) часто ошибочно называют глюкокиназой, хотя она не более специфична в отношении глюкозы, чем другие изоферменты млекопитающих. [3]
Вариация
[ редактировать ]Гены , кодирующие гексокиназу, были обнаружены во всех сферах жизни и существуют среди множества видов, от бактерий , дрожжей и растений до человека и других позвоночных животных . Ферменты дрожжей, растений и позвоночных демонстрируют явные доказательства гомологии последовательностей, но ферменты бактерий могут быть неродственными. [4]
Их классифицируют как актиновые складчатые белки, имеющие общее ядро сайта связывания АТФ , окруженное более вариабельными последовательностями, которые определяют сродство к субстрату и другие свойства.
могут встречаться несколько изоферментов гексокиназы, выполняющих различные функции У одного вида .
Реакция
[ редактировать ]Внутриклеточные реакции, опосредованные гексокиназами, можно классифицировать как:
- Гексоза-CH 2 OH + MgATP 2−
→ Гексоза-CH 2 O-PO 2−
3 + МгАДФ −
+ Ч +
где гексоза-CH 2 OH представляет собой любую из нескольких гексоз (например, глюкозы), которые содержат доступную группу -CH 2 OH. 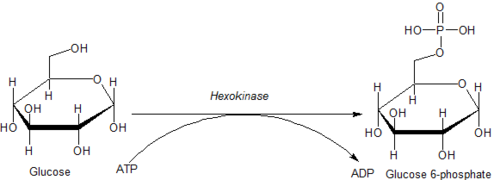
Последствия фосфорилирования гексозы
[ редактировать ]Фосфорилирование гексозы, такой как глюкоза, часто ограничивает ее ряд внутриклеточных метаболических процессов, таких как гликолиз или синтез гликогена . Это связано с тем, что фосфорилированные гексозы заряжены и, следовательно, их труднее выводить из клетки.
У пациентов с эссенциальной фруктозурией метаболизм фруктозы гексокиназой до фруктозо-6-фосфата является основным методом метаболизма фруктозы, поступающей с пищей; этот путь не имеет существенного значения у нормальных людей.
Размер различных изоформ
[ редактировать ]Размер большинства бактериальных гексокиназ составляет около 50 кДа. Многоклеточные организмы, включая растения и животные, часто имеют более одной изоформы гексокиназы. Большинство из них имеют размер около 100 кДа и состоят из двух половин (N- и C-концевых), которые имеют большую гомологию последовательностей. Это предполагает эволюционное происхождение путем дупликации и слияния предковой гексокиназы массой 50 кДа, аналогичной таковой у бактерий.
Типы гексокиназы млекопитающих
[ редактировать ]Существует четыре важных млекопитающих изофермента гексокиназы ( EC 2.7.1.1 ), которые различаются по внутриклеточному расположению и кинетике в зависимости от различных субстратов и условий, а также физиологических функций. Они были обозначены гексокиназами A, B, C и D на основании их электрофоретической подвижности. [5] Альтернативные названия гексокиназ I, II, III и IV (соответственно). [6] предложенные позже, широко используются.
Гексокиназы I, II и III
[ редактировать ]Гексокиназы I, II и III относят к низкоKm - изоферментам из-за высокого сродства к глюкозе (ниже 1 мМ). Гексокиназы I и II следуют кинетике Михаэлиса-Ментена при физиологических концентрациях субстратов. [ нужна ссылка ] Все три сильно ингибируются их продуктом, глюкозо-6-фосфатом . Молекулярная масса составляет около 100 кДа. Каждый состоит из двух одинаковых половин массой 50 кДа, но только у гексокиназы II обе половины имеют функциональные активные центры.
- Гексокиназа I/A обнаруживается во всех тканях млекопитающих и считается «ферментом домашнего хозяйства», на который не влияют большинство физиологических, гормональных и метаболических изменений.
- Гексокиназа II/B представляет собой основной регулируемый изофермент во многих типах клеток, уровень которой увеличивается при многих видах рака. Это гексокиназа, обнаруженная в мышцах и сердце. Гексокиназа II также расположена на внешней мембране митохондрий, поэтому она может иметь прямой доступ к АТФ. [7] Относительная удельная активность гексокиназы II увеличивается с ростом pH, по крайней мере, в диапазоне pH от 6,9 до 8,5. [8]
- Гексокиназа III/C субстратно ингибируется глюкозой в физиологических концентрациях. О регуляторных характеристиках этого изофермента известно мало.
Гексокиназа IV («глюкокиназа»)
[ редактировать ]Гексокиназа IV млекопитающих, также называемая глюкокиназой , отличается от других гексокиназ кинетикой и функциями.
Расположение фосфорилирования на субклеточном уровне происходит при транслокации глюкокиназы между и ядром клеток печени цитоплазмой . Глюкокиназа может фосфорилировать глюкозу только в том случае, если концентрация этого субстрата достаточно высока; он не следует кинетике Анри – Михаэлиса – Ментен и не имеет K m ; Он является полунасыщенным при концентрациях глюкозы, в 100 раз превышающих концентрации гексокиназ I, II и III.
Гексокиназа IV является мономерной, массой около 50 кДа, проявляет положительную кооперативность с глюкозой и не ингибируется аллостерически своим продуктом, глюкозо-6-фосфатом. [4]
Гексокиназа IV присутствует в печени , поджелудочной железе , гипоталамусе , тонком кишечнике и, возможно, некоторых других нейроэндокринных клетках и играет важную регуляторную роль в метаболизме углеводов . В β-клетках поджелудочной железы островков он служит сенсором глюкозы для контроля высвобождения инсулина и аналогичным образом контролирует высвобождение глюкагона в α-клетках . В гепатоцитах печени глюкокиназа реагирует на изменения уровня глюкозы в окружающей среде увеличением или уменьшением синтеза гликогена.
В гликолизе
[ редактировать ]Глюкоза уникальна тем, что она может использоваться для производства АТФ всеми клетками как в присутствии, так и в отсутствие молекулярного кислорода (О 2 ). Первым этапом гликолиза является фосфорилирование глюкозы гексокиназой.
| Д – Глюкоза | Гексокиназа | α- D - Глюкозо-6-фосфат | |
 |  | ||
| СПС | АДП | ||
 | |||
Соединение C00031 в базе данных KEGG Pathway. Фермент 2.7.1.1 в базе данных KEGG Pathway. Соединение C00668 в базе данных KEGG Pathway. Реакция R01786 в базе данных KEGG Pathway.
Катализируя фосфорилирование глюкозы с образованием глюкозо-6-фосфата, гексокиназы поддерживают нисходящий градиент концентрации, который способствует облегченному транспорту глюкозы в клетки. Эта реакция также инициирует все физиологически значимые пути утилизации глюкозы, включая гликолиз и пентозофосфатный путь . [9] Добавление заряженной фосфатной группы в положение 6 гексоз также обеспечивает «захват» глюкозы и аналогов глюкозы 2-дезоксигексозы (например, 2-дезоксиглюкозы и 2-фтор-2-дезоксиглюкозы) внутри клеток, поскольку заряженные гексозофосфаты не могут легко проникают через клеточную мембрану.
Ассоциация с митохондриями
[ редактировать ]Гексокиназы I и II могут физически связываться с внешней поверхностью внешней мембраны митохондрий посредством специфического связывания с порином или потенциал-зависимым анионным каналом. Эта ассоциация обеспечивает прямой доступ гексокиназы к АТФ, вырабатываемому митохондриями, который является одним из двух субстратов гексокиназы. Митохондриальная гексокиназа сильно повышена в быстро растущих клетках злокачественных опухолей, ее уровень в 200 раз выше, чем в нормальных тканях. Было продемонстрировано, что митохондриально-связанная гексокиназа является движущей силой. [10] из-за чрезвычайно высоких скоростей гликолиза, которые происходят в опухолевых клетках аэробно (так называемый эффект Варбурга, описанный Отто Генрихом Варбургом в 1930 году).
Дефицит
[ редактировать ]Дефицит гексокиназы — генетическое аутосомно-рецессивное заболевание, вызывающее хроническую гемолитическую анемию. Хроническая гемолитическая анемия вызвана мутацией гена, кодирующего гексокиназу. Мутация вызывает снижение активности гексокиназы и, следовательно, дефицит гексокиназы. [11]
См. также
[ редактировать ]- Аллостерия – регуляция активности ферментов.
- Ферментативный катализ - Катализ химических реакций ферментами.
- Гибкий компоновщик — белок без фиксированной трехмерной структуры.
- Флуоресцентные биосенсоры глюкозы
- Глюкокиназа – фермент, участвующий в регуляции углеводного обмена.
- Гликолиз - серия взаимосвязанных биохимических реакций.
- Гликоген - полимер глюкозы, используемый в качестве хранилища энергии у животных.
- Глюкозо-6-фосфатаза - страницы ферментов
- Поглощение гексозофосфата - группа транспортных белков.
- Инсулин – пептидный гормон
- Динамика белковых доменов - изучение того, как белки движутся и меняют форму.
- Гибкость белка - самостабильный участок белковой цепи, который складывается независимо от остальных.
Ссылки
[ редактировать ]- ^ PDB : 3O08 ; Кюттнер Э.Б., Кеттнер К., Кейм А., Свергун Д.И., Волке Д. (2010). «Кристаллическая структура димера KlHxk1 в кристаллической форме I» . дои : 10.2210/pdb3o08/pdb .
- ^ Кюттнер, Э. Бартоломеус; Кеттнер, Карина; Кейм, Антье; Свергун Дмитрий Игоревич; Волке, Даниэла; Певец, Дэвид; Хоффманн, Ральф; Мюллер, Ева-Кристина; Отто, Альбрехт; Кригель, Томас М.; Стретер, Норберт (2010). «Кристаллическая структура гексокиназы KlHxk1 Kluyveromyces Lactis» . Журнал биологической химии . 285 (52). Эльзевир Б.В.: 41019–41033. дои : 10.1074/jbc.m110.185850 . ISSN 0021-9258 . ПМК 3003401 .
- ^ Карденас, Мария Луз; Рабажил, Э.; Нимейер, Х. (1984). «Фруктоза является хорошим субстратом для глюкокиназы печени крысы (гексокиназы D)» . Биохимический журнал . 222 (2): 363–370. дои : 10.1042/bj2220363 . ПМК 1144187 . ПМИД 6477520 .
- ^ Перейти обратно: а б Карденас, Мария Луз; Корниш-Боуден, А.; Урета, Т. (1998). «Эволюция и регуляторная роль гексокиназ». Биохимика и биофизика Acta . 1401 (3): 242–264. дои : 10.1016/S0167-4889(97)00150-X . ПМИД 9540816 .
- ^ Гонсалес, К.; Санчес, Р.; Урета, Т.; Нимейер, Х. (1964). «Множественные молекулярные формы АТФ: гексозо-6-фосфотрансферазы из печени крысы». Связь с биохимическими и биофизическими исследованиями . 16 (4): 347–352. дои : 10.1016/0006-291X(64)90038-5 . ПМИД 5871820 .
- ^ Катцен, ХМ; Содерманн, Д.Д.; Нитовский, HM (1965). «Кинетические и электрофоретические доказательства множественных форм активности глюкозо-АТФ-фосфотрансферазы из культур клеток человека и печени крыс». Связь с биохимическими и биофизическими исследованиями . 19 (3): 377–382. дои : 10.1016/0006-291X(65)90472-9 . ПМИД 14317406 .
- ^ «Данные о гексокиназе по Uniprot» . uniprot.org .
- ^ Шимчикова Д., Хенеберг П. (август 2019 г.). «Определение щелочного оптимума pH глюкокиназы человека благодаря АТФ-опосредованной коррекции систематических ошибок в результатах ферментных анализов» . Научные отчеты . 9 (1): 11422. Бибкод : 2019НатСР...911422С . дои : 10.1038/s41598-019-47883-1 . ПМК 6684659 . ПМИД 31388064 .
- ^ Роби, РБ; Хэй, Н. (2006). «Митохондриальные гексокиназы, новые медиаторы антиапоптотического действия факторов роста и Akt». Онкоген . 25 (34): 4683–96. дои : 10.1038/sj.onc.1209595 . ПМИД 16892082 . S2CID 25230246 .
- ^ Бустаманте Э., Педерсен П. (1977). «Высокий аэробный гликолиз клеток гепатомы крысы в культуре: роль митохондриальной гексокиназы» . Труды Национальной академии наук . 74 (9): 3735–9. Бибкод : 1977PNAS...74.3735B . дои : 10.1073/pnas.74.9.3735 . ПМК 431708 . ПМИД 198801 .
- ^ «Дефицит гексокиназы» . Энерка . Архивировано из оригинала 8 августа 2020 года . Проверено 6 апреля 2017 г.









