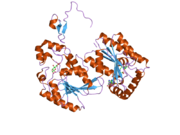ПФКФБ3
| ПФКФБ3 | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | PFKFB3 , IPFK2, PFK2, iPFK-2, 6-фосфофрукто-2-киназа/фруктозо-2,6-бифосфатаза 3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 605319 ; МГИ : 2181202 ; Гомологен : 88708 ; Генные карты : PFKFB3 ; ОМА : PFKFB3 — ортологи | |||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
PFKFB3 — это ген , который кодирует 6-фосфофрукто-2-киназа/фруктозо-2,6-бифосфатаза 3 фермент у человека. [5] [6] [7] Это один из 4 идентифицированных в настоящее время тканеспецифичных изоферментов PFKFB (PFKFB1-4). [8]
Ген
[ редактировать ]Ген PFKFB3 картирован в единственном локусе на хромосоме 10 (10p15-p14). [5] [6] Он занимает область размером 32,5 КБ с открытой рамкой считывания длиной 5675 бит. По оценкам, он состоит из 19 экзонов, из которых 15 экспрессируются регулярно. [8] Наблюдался альтернативный сплайсинг вариабельного COOH-концевого домена, приводящий к образованию 6 различных изоформ, называемых UBI2K1–UBI2K6 у людей. [9] Другая номенклатура также признает две широкие категории изоформ PFKFB3, называемые «индуцибельными» и «повсеместными». [10] Индуцибельная изоформа белка iPFK2 названа так потому, что было показано, что ее экспрессия индуцируется гипоксическими условиями.
Предполагается, что промотор PFKFB3 будет содержать несколько сайтов связывания, включая сайты связывания Sp-1 и AP-2. Он также содержит мотивы связывания E-box, ядерного фактора-1 (NF-1) и элемента ответа на прогестерон. Показано, что экспрессия промотора индуцируется эфирами форбола и передачей сигналов циклической АМФ-зависимой протеинкиназы. [10]
Структура
[ редактировать ]Четыре изоформы PFKFB имеют высокую (85%) гомологию последовательностей «2-Kase/2-Pase core», но обладают разными свойствами, основанными на вариабельных N- и C-концевых регуляторных доменах и вариациях остатков, окружающих активные центры. [11] Индуцибельная изоформа PFKFB3 обладает более высокой «2-казной» (киназной) активностью, чем другие изоформы, из-за фосфорилирования Ser-460 с помощью PKA или AMP-зависимой протеинкиназы. [11] Высокая «2-Kase» активность PFKFB3 также обусловлена отсутствием специфического Ser, который фосфорилируется в других изоформах PFKFB для снижения киназной активности. [12]
Первичный белок, кодируемый PFKFB3 , iPFK2, состоит из 590 аминокислот. Он имеет прогнозируемую молекулярную массу 66,9 кДа и изоэлектрическую точку 8,64. [8] Кристаллическая структура была определена в 2006 году: [11]
- Исследователь обнаружил, что iPFK2 имеет N-концевую структуру бета-шпильки, которая обеспечивает связывание фруктозо-6-фосфата с активным центром посредством взаимодействия с доменом «2-Pase» белка. Внутри iPFK2 есть два активных кармана для фруктозо-2,6-бисфосфатазы и 6-фосфофрукто-2-киназы, которые структурно различны. Активный центр F-2,6-BP структурно открыт, тогда как активный карман 6-фосфофрукто-2-киназы более жесткий. Эта жесткость позволяет независимо связывать F-6-P и АТФ с повышенным сродством, чем у других изоформ.
Функция
[ редактировать ]iPFK2 превращает фруктозо-6-фосфат во фруктозо-2,6-бисP (F2,6BP). F2,6BP является «мощным» аллостерическим активатором 6-фосфофруктокиназы-1 (PFK-1), стимулирующим гликолиз. Нажмите, чтобы увидеть изображение функции PFFKB3. [ постоянная мертвая ссылка ] .
Роль в нейрональной эксайтотоксичности
[ редактировать ]В нейронах метаболизм глюкозы посредством гликолиза обычно ниже, чем в астроцитах. Согласно гипотезе лактатного челнока от астроцитов к нейронам, поглощение глюкозы паренхимой головного мозга происходит преимущественно астроцитами, которые впоследствии выделяют лактат для использования нейронами. [13] В нейронах глюкоза метаболизируется преимущественно по пентозофосфатному пути (ПФП), который необходим для регенерации НАДФН(Н+) и поддержания окислительно-восстановительного статуса нейронов. Это нейрональное метаболическое переключение определяется активностью PFKFB3. В нейронах содержание белка PFKFB3 незначительно из-за непрерывной протеасомной деградации фермента. [14] Однако перевозбуждение N-метил-D-аспартатного подтипа глутаматных рецепторов (NMDAR), известное как эксайтотоксичность, стабилизирует белок PFKFB3 в нейронах, что приводит к перенаправлению потока глюкозы с PPP на гликолиз, за которым следует низкая доступность НАДФН(Н+) для правильная регенерация GSH; в конечном итоге это приводит к окислительному стрессу и гибели нейронов. Замалчивание PFKFB3 с помощью небольшой интерферирующей РНК в нейронах in vitro предотвращает увеличение АФК и апоптотическую смерть, вызванную экситотоксическим стимулом. [15] Фармакологическое ингибирование PFKFB3 in vitro также защищает нейроны от апоптоза, индуцированного перевозбуждением NMDAR, а также от нейротоксичности , индуцированной β-амилоидным пептидом . При использовании in vivo на мышиной модели ишемического инсульта ингибитор PFKFB3 облегчает двигательную дискоординацию и инфаркт головного мозга. [16]
Связь с раком
[ редактировать ]Эффект Варбурга
[ редактировать ]Эффект Варбурга , предложенный Отто Варбугом в 1956 году. [17] описывает усиление гликолиза в большинстве раковых клеток, даже в присутствии кислорода. Высокая скорость гликолиза сопровождается усилением ферментации молочной кислоты, обеспечивая дополнительные питательные вещества для роста раковых клеток и онкогенеза.
PFKFB3 связан с эффектом Варбурга, поскольку его активность увеличивает скорость гликолиза. Было обнаружено, что уровень PFKFB3 повышается при многих видах рака, включая рак толстой кишки, молочной железы, яичников и щитовидной железы. [18] Снижение метилирования PFKFB3 также обнаруживается при некоторых видах рака, вызывая переход на гликолитический путь, который поддерживает рост рака. [19]
Сигнальный путь гипоксии
[ редактировать ]Экспрессия PFKFB3 индуцируется гипоксией. [20] Промотор PFKFB3 содержит сайты связывания, называемые элементами ответа на гипоксию (HRE), которые рекрутируют связывание индуцируемого гипоксией фактора-1 (HIF-1). [21]
Передача сигналов гипоксии посредством стабилизации HIF-1α усиливает транскрипцию генов, которые обеспечивают выживание в условиях низкого содержания кислорода. Эти гены включают ферменты гликолиза, такие как PFKFB3, которые обеспечивают синтез АТФ без кислорода, и фактор роста эндотелия сосудов (VEGF), который способствует ангиогенезу.
Клеточный цикл и апоптоз
[ редактировать ]Совсем недавно было обнаружено, что PFKFB3 способствует прогрессированию клеточного цикла (пролиферации клеток) и подавляет апоптоз путем регулирования циклин-зависимой киназы 1 (Cdk-1). Было обнаружено, что синтез F2,6BP в ядре PFKFB3 регулирует Cdk-1, тогда как цитозольный PFKFB3 активирует PFK-1. Ядерный PFKFB3 активирует Cdk1 для фосфорилирования сайта Thr-187 p27, вызывая снижение уровней p27. [22] [23] Снижение уровня p27 обеспечивает защиту от апоптоза и прогрессирования клеток через контрольную точку фазы G1/S. Эти результаты установили значительную связь между выживаемостью и пролиферацией раковых клеток PFKFB3.
Циркадные часы
[ редактировать ]Нарушение регуляции циркадных часов связано со многими типами рака. [24] Экспрессия PFKFB3 демонстрирует циркадный ритм, который различен в раковых и нераковых клетках. [25] В частности, было обнаружено, что циркадный фактор транскрипции « CLOCK » связывается с промотором PFKFB3 в подлинном сайте «E-box», увеличивая транскрипцию в раковых клетках.
- Ингибирование PFKFB3 с помощью 3PO оказалось успешным в снижении роста рака и усилении апоптоза, но только в определенные моменты времени циркадного цикла. Это открытие подчеркивает необходимость временного ингибирования PFKFB3 при лечении рака. Теперь следует учитывать роль ингибирования PFKFB3 в этом процессе, принимая во внимание недавнюю информацию о том, что 3PO не является ингибитором PFKFB3 (3PO был неактивен в анализе ингибирования киназы PFKFB3 (IC50 > 100 мкМ)) [26] (см. соответствующее обсуждение в § Маломолекулярные ингибиторы PFKFB3 )
Дополнительные связи с раком
[ редактировать ]- PFKFB3 активируется прогестинами в клетках рака молочной железы [27]
- PFKFB3 способствует ангиогенезу
- Замалчивание PFKFB3 нарушает ангиогенез. Гликолиз, управляемый PFKFB3, подавляет про-стебельковую активность Notch. PFKFB3 регулирует поведение кончиковых и стебельчатых клеток и компартментализируется с F-актином. [28]
Противораковая терапевтическая стратегия
[ редактировать ]Ингибирование PFKFB3 анализируется как потенциальная противораковая терапия. Наиболее ярким примером является клиническое исследование Advanced Cancer Therapeutics (ACT) с PFK158, улучшенной версией 3PO, ингибитора PFKFB3. [29] Однако, похоже, что дальнейшая разработка была прекращена из-за неутешительных результатов фазы I (см. также обсуждение соединений ACT в § Маломолекулярные ингибиторы PFKFB3 ). [30]
Маломолекулярные ингибиторы PFKFB3
[ редактировать ]В настоящее время разрабатываются несколько низкомолекулярных ингибиторов PFKFB3.
Долгое время считалось, что небольшая молекула 3-(3-пиридинил)-1-(4-пиридинил)-2-пропен-1-он (3PO) является ингибитором PFKFB3 и используется в качестве ингибитора PFKFB3 во многих научных публикациях. . 3PO снижает поглощение глюкозы и увеличивает аутофагию. [31] В настоящее время исследования изучают различные производные 3PO (например, PFKF15). [32] в попытке повысить их эффективность в качестве противораковой терапии, но данные о том, что производные 3PO на самом деле являются ингибиторами PFKFB3, также недоступны.
Недавнее исследование одной из ведущих фармацевтических компаний AstraZeneca и CRT Discovery Laboratories крупнейшей в мире независимой благотворительной организации по исследованию рака Cancer Research UK показало, что 3PO неактивен в анализе ингибирования киназы PFKFB3 (IC50 > 100 мкМ). [26] Кристаллические структуры 3PO, а также его аналогов PFK15 и PFK158 с ферментом PFKFB3 также отсутствуют. Выводы AstraZeneca и Cancer Research UK относительно 3PO не оспариваются ни разработчиками 3PO с 7 апреля 2015 года.
Эффективность двух известных ингибиторов PFKFB3, а именно AZ67 (от AstraZeneca и CRT Discovery Laboratories) [26] ) и PFK158, улучшенное, но структурно близкое производное 3PO, недавно были исследованы на предмет их способности снижать выработку F2,6BP в клетках A549. Оба соединения (AZ67 и PFK158) были способны снижать клеточные уровни F2,6BP дозозависимым образом, при этом IC50 составляла 0,51 мкМ и 5,90 мкМ соответственно. Чтобы проверить, является ли снижение клеточных уровней F2,6BP результатом прямого ингибирования PFKFB3, оба соединения были опробованы в ферментативном бесклеточном анализе. Исследование показало, что AZ67 ингибирует ферментативную активность PFKFB3 с IC50 0,018 мкМ, что соответствует ранее опубликованным результатам. Однако PFK158 не оказывал влияния на ферментативную активность PFKFB3 ни в одной из протестированных концентраций (до 100 мкМ). Соответственно, хотя PFK158 способен снижать F2,6BP и гликолитический поток, эксперименты показывают, что эти эффекты не обусловлены ферментативным ингибированием PFKFB3. [16]
В совокупности эти результаты ставят под сомнение ряд научных исследований и публикаций, в которых 3PO и его производные (такие как PFKF158) использовались в качестве ингибитора PFKFB3.
В 2018 году Кансера сообщил о разработке и характеристике KAN0438241 (и его пролекарства KAN0438757) как мощного и высокоселективного ингибитора PFKFB3 и радиосенсибилизатора. [33]
Другие пути, связанные с PFKFB3
[ редактировать ]Аутофагия
[ редактировать ]Повышенная активность PFKFB3 ускоряет выработку АФК как конечного продукта гликолиза и, таким образом, увеличивает аутофагию. Аналогичным образом было обнаружено, что ингибирование PFKFB3 вызывает аутофагию. [34] [35]
Аутофагия может продлить выживание клеток в условиях низкого энергопотребления. Это открытие было обнаружено в отношении ревматоидного артрита. [36] Было обнаружено, что Т-клетки RA не способны активировать аутофагию, и эксперименты по нокауту сделали PFKFB3 вышестоящим регулятором этого процесса.
Сигнальный путь инсулина
[ редактировать ]PFKFB3 был идентифицирован при киномном скрининге как регулятор инсулина/IGF-1. Было обнаружено, что подавление PFKFB3 снижает стимулируемое инсулином поглощение глюкозы, транслокацию GLUT4 и передачу сигналов Akt в адипоцитах 3T3-L1. Сверхэкспрессия вызывала инсулинзависимое фосфорилирование Akt и субстратов Akt. [37]
Экспрессия PFKFB3 увеличивается в жировых тканях во время адипогенеза , но было показано, что длительное воздействие инсулина снижает экспрессию PFKFB3. Считается, что это происходит из-за механизма отрицательной обратной связи с участием инсулина. [38]
p38/MK2 Сигнальный путь стресса
[ редактировать ]Было обнаружено, что p38 MAPK увеличивает активность PFKFB3 посредством (1) активации транскрипции PFKFB3 в ответ на стрессовые стимулы и (2) посттрансляционного фосфорилирования iPFK2 по Ser-461. [39] [40]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000170525 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000026773 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б Николл Дж., Гамильтон Дж.А., Сазерленд Г.Р. , Сазерленд Р.Л., Уоттс К.К. (апрель 1997 г.). «Третья человеческая изоформа 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы (PFKFB3) отображает положение 10p14-p15». Хромосомные исследования . 5 (2): 150. дои : 10.1023/A:1018482511456 . ПМИД 9146922 . S2CID 34088792 .
- ^ Jump up to: а б Мансано А., Роза Х.Л., Вентура Ф., Перес Дж.Х., Надаль М., Эстивилл Х. и др. (март 1999 г.). «Молекулярное клонирование, экспрессия и хромосомная локализация повсеместно экспрессируемого гена 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы человека (PFKFB3)». Цитогенетика и клеточная генетика . 83 (3–4): 214–7. дои : 10.1159/000015181 . ПМИД 10072580 . S2CID 23221556 .
- ^ «Ген Энтреза: PFKFB3 6-фосфофрукто-2-киназа/фруктозо-2,6-бифосфатаза 3» .
- ^ Jump up to: а б с Малькнехт У., Чесни Дж., Хельцер Д., Букала Р. (октябрь 2003 г.). «Клонирование и хромосомная характеристика гена 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы-3 (PFKFB3, iPFK2)». Международный журнал онкологии . 23 (4): 883–91. дои : 10.3892/ijo.23.4.883 . ПМИД 12963966 .
- ^ Кесслер Р., Эшрих К. (март 2001 г.). «Сплайсинг-изоформы повсеместно распространенной 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы в мозге человека». Исследования мозга. Молекулярные исследования мозга . 87 (2): 190–5. дои : 10.1016/s0169-328x(01)00014-6 . ПМИД 11245921 .
- ^ Jump up to: а б Наварро-Сабате А, Мансано А, Риера Л, Роза ХЛ, Вентура Ф, Бартронс Р (февраль 2001 г.). «Повсеместный ген 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы человека (PFKFB3): характеристика промотора и геномная структура». Джин . 264 (1): 131–8. дои : 10.1016/S0378-1119(00)00591-6 . ПМИД 11245987 .
- ^ Jump up to: а б с Ким С.Г., Манес Н.П., Эль-Маграби М.Р., Ли Ю.Х. (февраль 2006 г.). «Кристаллическая структура индуцируемой гипоксией формы 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы (PFKFB3): возможная новая мишень для терапии рака» . Журнал биологической химии . 281 (5): 2939–44. дои : 10.1074/jbc.M511019200 . ПМИД 16316985 .
- ^ Сакакибара Р., Като М., Окамура Н., Накагава Т., Комада Ю., Томинага Н. и др. (июль 1997 г.). «Характеристика плацентарной фруктозо-6-фосфата, 2-киназы/фруктозо-2,6-бисфосфатазы человека». Журнал биохимии . 122 (1): 122–8. doi : 10.1093/oxfordjournals.jbchem.a021719 . ПМИД 9276680 .
- ^ Маджистретти П.Дж., Сорг О., Ю.Н., Мартин Дж.Л., Пеллерин Л. (1993). «Нейротрансмиттеры регулируют энергетический обмен в астроцитах: значение для метаболического обмена между нервными клетками». Дев Нейроски . 15 (3–51): 306–12. дои : 10.1159/000111349 . ПМИД 7805583 .
- ^ Эрреро-Мендес А., Алмейда А., Фернандес Э., Маэстре С., Монкада С., Боланьос ХП (июнь 2009 г.). «Биоэнергетический и антиоксидантный статус нейронов контролируется непрерывной деградацией ключевого гликолитического фермента с помощью APC/C-Cdh1». Nat Cell Biol . 11 (6): 747–52. дои : 10.1038/ncb1881 . ПМИД 19448625 . S2CID 19519317 .
- ^ Родригес-Родригес П., Фернандес Э., Алмейда А., Боланьос ХП (октябрь 2012 г.). «Экситотоксический стимул стабилизирует PFKFB3, вызывая пентозофосфатный путь к переключению гликолиза и нейродегенерации» . Гибель клеток отличается . 19 (10): 1582–9. дои : 10.1038/cdd.2012.33 . ПМЦ 3438489 . ПМИД 22421967 .
- ^ Jump up to: а б Бурмистрова О, Олиас-Архона А, Лапреса Р, Хименес-Бласко Д, Еремеева Т, Шишов Д и др. (август 2019 г.). «Нацеливание на PFKFB3 облегчает церебральную ишемию-реперфузию повреждений у мышей» . Научные отчеты . 9 (1): 11670. Бибкод : 2019NatSR...911670B . дои : 10.1038/s41598-019-48196-z . ПМК 6691133 . ПМИД 31406177 .
 Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 . - ^ Варбург О. (февраль 1956 г.). «О происхождении раковых клеток». Наука . 123 (3191): 309–14. Бибкод : 1956Sci...123..309W . дои : 10.1126/science.123.3191.309 . ПМИД 13298683 .
- ^ Ацуми Т., Чесни Дж., Мец С., Ленг Л., Доннелли С., Макита З. и др. (октябрь 2002 г.). «Высокая экспрессия индуцибельной 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы (iPFK-2; PFKFB3) при раке человека». Исследования рака . 62 (20): 5881–7. ПМИД 12384552 .
- ^ Ямамото Т., Такано Н., Ишивата К., Омура М., Нагахата Ю., Мацуура Т. и др. (март 2014 г.). «Снижение метилирования PFKFB3 в раковых клетках переводит глюкозу в сторону пентозофосфатного пути» . Природные коммуникации . 5 : 3480. Бибкод : 2014NatCo...5.3480Y . дои : 10.1038/ncomms4480 . ПМЦ 3959213 . ПМИД 24633012 .
- ^ Минченко А, Лещинский И, Опентанова И, Санг Н, Сринивас В, Армстед В, Каро Дж (февраль 2002 г.). «Индуцируемая гипоксией фактор-1 экспрессия гена 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы-3 (PFKFB3). Его возможная роль в эффекте Варбурга» . Журнал биологической химии . 277 (8): 6183–7. дои : 10.1074/jbc.M110978200 . ПМЦ 4518871 . ПМИД 11744734 .
- ^ Обах М., Наварро-Сабате А., Каро Дж., Конг Х., Дюран Дж., Гомес М. и др. (декабрь 2004 г.). «Промотор гена 6-фосфофрукто-2-киназы (pfkfb3) содержит индуцируемые гипоксией сайты связывания фактора-1, необходимые для трансактивации в ответ на гипоксию» . Журнал биологической химии . 279 (51): 53562–70. дои : 10.1074/jbc.M406096200 . hdl : 2445/181308 . PMID 15466858 .
- ^ Ялчин А., Клем Б.Ф., Симмонс А., Лейн А., Нельсон К., Клем А.Л. и др. (сентябрь 2009 г.). «Ядерное нацеливание 6-фосфофрукто-2-киназы (PFKFB3) увеличивает пролиферацию посредством циклин-зависимых киназ» . Журнал биологической химии . 284 (36): 24223–32. дои : 10.1074/jbc.M109.016816 . ПМК 2782016 . ПМИД 19473963 .
- ^ Ялчин А., Клем Б.Ф., Имберт-Фернандес Ю., Озджан С.К., Пекер С., О'Нил Дж. и др. (июль 2014 г.). «6-фосфофрукто-2-киназа (PFKFB3) способствует прогрессированию клеточного цикла и подавляет апоптоз посредством Cdk1-опосредованного фосфорилирования p27» . Смерть клеток и болезни . 5 (7): e1337. дои : 10.1038/cddis.2014.292 . ПМК 4123086 . ПМИД 25032860 .
- ^ Саввидис С., Кутсилиерис М. (декабрь 2012 г.). «Нарушение циркадных ритмов в биологии рака» . Молекулярная медицина . 18 (1): 1249–60. дои : 10.2119/molmed.2012.00077 . ПМЦ 3521792 . ПМИД 22811066 .
- ^ Чен Л., Чжао Дж., Тан К., Ли Х., Чжан С., Ю Р. и др. (апрель 2016 г.). «PFKFB3 Контроль роста рака путем реагирования на сигналы циркадных часов» . Научные отчеты . 6 : 24324. Бибкод : 2016NatSR...624324C . дои : 10.1038/srep24324 . ПМЦ 4832144 . ПМИД 27079271 .
- ^ Jump up to: а б с Бойд С., Брукфилд Дж.Л., Кричлоу С.Е., Камминг И.А., Кертис Н.Дж., Дебрецени Дж. и др. (апрель 2015 г.). «Структурный дизайн мощных и селективных ингибиторов метаболической киназы PFKFB3». Журнал медицинской химии . 58 (8): 3611–25. doi : 10.1021/acs.jmedchem.5b00352 . ПМИД 25849762 .
- ^ Новелласдемунт Л., Обач М., Миллан-Флур Л., Эппл А., Вентура Ф., Роуз Дж.Л. и др. (март 2012 г.). «Прогестины активируют 6-фосфофрукто-2-киназу/фруктозо-2,6-бисфосфатазу 3 (PFKFB3) в клетках рака молочной железы». Биохимический журнал . 442 (2): 345–56. дои : 10.1042/BJ20111418 . hdl : 10261/87967 . ПМИД 22115192 .
- ^ Де Бок К., Джорджиаду М., Шорс С., Кучнио А., Вонг Б.В., Кантельмо А.Р. и др. (август 2013 г.). «Роль гликолиза, управляемого PFKFB3, в прорастании сосудов» . Клетка . 154 (3): 651–63. дои : 10.1016/j.cell.2013.06.037 . ПМИД 23911327 .
- ^ «Открытое многоцентровое исследование фазы 1 с увеличением дозы ACT-PFK-158, 2HCl у пациентов с поздними стадиями солидных злокачественных новообразований» . 22 июня 2015 г.
- ^ «Неутешительные испытания лекарств от рака ставят под угрозу будущее местной биотехнологической фирмы – инсайдер Луисвилля» . Архивировано из оригинала 16 августа 2019 г. Проверено 16 августа 2019 г.
- ^ Кларер А.С., О'Нил Дж., Имберт-Фернандес Ю., Клем А., Эллис С.Р., Кларк Дж. и др. (январь 2014 г.). «Ингибирование 6-фосфофрукто-2-киназы (PFKFB3) вызывает аутофагию как механизм выживания» . Рак и обмен веществ . 2 (1): 2. дои : 10.1186/2049-3002-2-2 . ПМЦ 3913946 . ПМИД 24451478 .
- ^ Клем Б.Ф., О'Нил Дж., Тапольски Г., Клем А.Л., Имберт-Фернандес Ю., Керр Д.А. и др. (август 2013 г.). «Нацеливание на 6-фосфофрукто-2-киназу (PFKFB3) как терапевтическая стратегия против рака» . Молекулярная терапия рака . 12 (8): 1461–70. doi : 10.1158/1535-7163.MCT-13-0097 . ПМЦ 3742633 . ПМИД 23674815 .
- ^ Густафссон Н.М., Фернегорд К., Бонагас Н., Ниноу А.Х., Грот П., Виита Э. и др. (сентябрь 2018 г.). «Нацеливание на PFKFB3 радиосенсибилизирует раковые клетки и подавляет гомологичную рекомбинацию» . Природные коммуникации . 9 (1): 3872. Бибкод : 2018NatCo...9.3872G . дои : 10.1038/s41467-018-06287-x . ПМК 6155239 . ПМИД 30250201 .
- ^ Кларер А.С., О'Нил Дж., Имберт-Фернандес Ю., Клем А., Эллис С.Р., Кларк Дж. и др. (январь 2014 г.). «Ингибирование 6-фосфофрукто-2-киназы (PFKFB3) вызывает аутофагию как механизм выживания» . Рак и обмен веществ . 2 (1): 2. дои : 10.1186/2049-3002-2-2 . ПМЦ 3913946 . ПМИД 24451478 .
- ^ Ян З., Горонзи Дж.Дж., Вейанд К.М. (февраль 2014 г.). «Гликолитический фермент PFKFB3/фосфофруктокиназа регулирует аутофагию» . Аутофагия . 10 (2): 382–3. дои : 10.4161/auto.27345 . ПМК 5079104 . ПМИД 24351650 .
- ^ Ян З., Фуджи Х., Мохан С.В., Горонзи Дж.Дж., Вейанд К.М. (сентябрь 2013 г.). «Дефицит фосфофруктокиназы нарушает выработку АТФ, аутофагию и окислительно-восстановительный баланс в Т-клетках ревматоидного артрита» . Журнал экспериментальной медицины . 210 (10): 2119–34. дои : 10.1084/jem.20130252 . ПМЦ 3782046 . ПМИД 24043759 .
- ^ Трефели С., Ху П.С., Крайсер Дж.Р., Чаудхури Р., Фазакерли Д.Д., Паркер Б.Л. и др. (октябрь 2015 г.). «Киномный скрининг идентифицирует PFKFB3 и метаболизм глюкозы как важные регуляторы сигнального пути инсулина/инсулиноподобного фактора роста (IGF)-1» . Журнал биологической химии . 290 (43): 25834–46. дои : 10.1074/jbc.M115.658815 . ПМЦ 4646237 . ПМИД 26342081 .
- ^ Ацуми Т., Нисио Т., Нива Х., Такеучи Дж., Бандо Х., Симидзу С. и др. (декабрь 2005 г.). «Экспрессия индуцибельных изоформ 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы/PFKFB3 в адипоцитах и их потенциальная роль в гликолитической регуляции» . Диабет . 54 (12): 3349–57. дои : 10.2337/диабет.54.12.3349 . ПМИД 16306349 .
- ^ Новелласдемунт Л., Булто Л., Мансано А., Вентура Ф., Роза Дж.Л., Вертоммен Д. и др. (июнь 2013 г.). «Активация PFKFB3 в раковых клетках по пути p38/MK2 в ответ на стрессовые стимулы». Биохимический журнал . 452 (3): 531–43. дои : 10.1042/bj20121886 . ПМИД 23548149 .
- ^ Боланьос JP (июнь 2013 г.). «Адаптация гликолиза к пролиферации раковых клеток: путь MAPK фокусируется на PFKFB3». Биохимический журнал . 452 (3): e7-9. дои : 10.1042/bj20130560 . ПМИД 23725459 .
Дальнейшее чтение
[ редактировать ]- Сакаи А., Като М., Фукасава М., Исигуро М., Фуруя Э., Сакакибара Р. (март 1996 г.). «Клонирование кДНК, кодирующей новый изофермент фруктозо-6-фосфата, 2-киназы/фруктозо-2,6-бисфосфатазы из плаценты человека». Журнал биохимии . 119 (3): 506–11. doi : 10.1093/oxfordjournals.jbchem.a021270 . ПМИД 8830046 .
- Гамильтон Дж. А., Каллаган М. Дж., Сазерленд Р. Л., Уоттс К. К. (апрель 1997 г.). «Идентификация PRG1, нового прогестин-чувствительного гена с гомологией последовательности 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы» . Молекулярная эндокринология . 11 (4): 490–502. дои : 10.1210/mend.11.4.9909 . ПМИД 9092801 .
- Сакакибара Р., Като М., Окамура Н., Накагава Т., Комада Ю., Томинага Н. и др. (июль 1997 г.). «Характеристика плацентарной фруктозо-6-фосфата, 2-киназы/фруктозо-2,6-бисфосфатазы человека». Журнал биохимии . 122 (1): 122–8. doi : 10.1093/oxfordjournals.jbchem.a021719 . ПМИД 9276680 .
- Сканлан М.Дж., Гордан Дж.Д., Уильямсон Б., Стокерт Э., Бандер Н.Х., Джонджинил В. и др. (ноябрь 1999 г.). «Антигены, распознаваемые аутологичными антителами у пациентов с почечно-клеточным раком». Международный журнал рака . 83 (4): 456–64. doi : 10.1002/(SICI)1097-0215(19991112)83:4<456::AID-IJC4>3.0.CO;2-5 . ПМИД 10508479 . S2CID 21839750 .
- Фукасава М., Такаяма Э., Синомия Н., Окумура А., Рокутанда М., Ямамото Н., Сакакибара Р. (январь 2000 г.). «Идентификация промоторной области гена плацентарной 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы человека». Связь с биохимическими и биофизическими исследованиями . 267 (3): 703–8. дои : 10.1006/bbrc.1999.2022 . ПМИД 10673355 .
- Кесслер Р., Эшрих К. (март 2001 г.). «Сплайсинг-изоформы повсеместно распространенной 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы в мозге человека». Исследования мозга. Молекулярные исследования мозга . 87 (2): 190–5. дои : 10.1016/S0169-328X(01)00014-6 . ПМИД 11245921 .
- Риера Л., Обач М., Наварро-Сабате А., Дюран Дж., Пералес Х.К., Виньялс Ф. и др. (август 2003 г.). «Регуляция повсеместно встречающейся 6-фосфофрукто-2-киназы с помощью протеолитического пути убиквитин-протеасома во время дифференцировки миогенных клеток C2C12». Письма ФЭБС . 550 (1–3): 23–9. дои : 10.1016/S0014-5793(03)00808-1 . ПМИД 12935880 . S2CID 41726316 .
- Обах М., Наварро-Сабате А., Каро Дж., Конг Х., Дюран Дж., Гомес М. и др. (декабрь 2004 г.). «Промотор гена 6-фосфофрукто-2-киназы (pfkfb3) содержит индуцируемые гипоксией сайты связывания фактора-1, необходимые для трансактивации в ответ на гипоксию» . Журнал биологической химии . 279 (51): 53562–70. дои : 10.1074/jbc.M406096200 . hdl : 2445/181308 . PMID 15466858 .
- Манес Н.П., Эль-Маграби М.Р. (июнь 2005 г.). «Киназная активность 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы головного мозга человека регулируется посредством ингибирования фосфоенолпируватом». Архив биохимии и биофизики . 438 (2): 125–36. дои : 10.1016/j.abb.2005.04.011 . ПМИД 15896703 .
- Минченко О.Г., Огура Т., Опентанова И.Л., Минченко Д.О., Эсуми Х. (декабрь 2005 г.). «Сплайсинг-изоформа 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы-4: экспрессия и гипоксическая регуляция». Молекулярная и клеточная биохимия . 280 (1–2): 227–34. дои : 10.1007/s11010-005-8009-6 . ПМИД 16311927 . S2CID 23500518 .