Геном человека
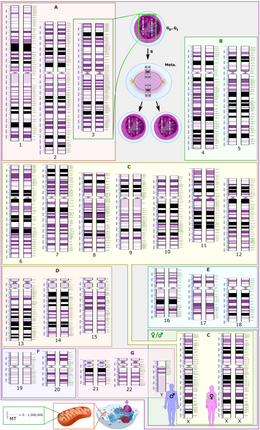 Схематическое изображение диплоидного кариотипа человека , показывающее организацию генома в хромосомы, а также аннотированные полосы и поддиапазоны, как видно на G-диапазоне . На этом рисунке показаны как женская (XX), так и мужская (XY) версии 23-й пары хромосом. Хромосомные изменения во время клеточного цикла отображаются вверху по центру. Митохондриальный геном показан в масштабе внизу слева. |
Геном человека полный набор последовательностей нуклеиновых кислот человека представляет собой , закодированных в виде ДНК в 23 парах хромосом в ядрах клеток и в небольшой молекуле ДНК, обнаруженной в отдельных митохондриях . Их обычно рассматривают отдельно как ядерный геном и митохондриальный геном . [1] человека Геномы включают как последовательности ДНК, кодирующие белки, так и различные типы ДНК, не кодирующие белки . Последняя представляет собой разнообразную категорию, которая включает ДНК, кодирующую нетранслируемую РНК, например, рибосомальную РНК , транспортную РНК , рибозимы , малые ядерные РНК и несколько типов регуляторных РНК . Он также включает промоторы и связанные с ними генно-регуляторные элементы , ДНК, играющую структурные и репликационные роли, такие как каркасные области , теломеры , центромеры и точки начала репликации , а также большое количество мобильных элементов , встроенную вирусную ДНК, нефункциональные псевдогены и простые , очень повторяющиеся последовательности . Интроны составляют значительную часть некодирующей ДНК . Часть этой некодирующей ДНК представляет собой нефункциональную мусорную ДНК , например, псевдогены, но единого мнения относительно общего количества мусорной ДНК нет.
Хотя последовательность человеческого генома была полностью определена путем секвенирования ДНК в 2022 году, она еще не до конца понята. Большинство, но не все, гены были идентифицированы с помощью сочетания высокопроизводительных экспериментальных и биоинформатических подходов, однако еще предстоит проделать большую работу для дальнейшего выяснения биологических функций их белковых и РНК- продуктов (в частности, аннотация полной версии CHM13v2). .0 последовательность все еще продолжается [2] ).
Размер генома человека [ править ]
В 2003 году ученые сообщили о секвенировании 85% всего генома человека, но по состоянию на 2020 год по крайней мере 8% все еще отсутствует. [ нужна ссылка ] В 2021 году ученые сообщили о секвенировании полного женского генома (то есть без Y-хромосомы). [3] [4] Эта последовательность идентифицировала 19 969 последовательностей, кодирующих белок , что составляет примерно 1,5% генома, и в общей сложности 63 494 гена, большинство из которых являются некодирующими генами РНК. [4] Геном состоит из регуляторных последовательностей ДНК , LINE , SINE , интронов которых еще и последовательностей, функция не определена. , Y-хромосома человека состоящая примерно из 62,5 х 10 6 пары оснований из другой клеточной линии, обнаруженные у всех мужчин, были полностью секвенированы в январе 2022 года. [5]
Текущая версия стандартного эталонного генома называется GRCh38.p14 (июль 2023 г.). Он состоит из 22 аутосом плюс одна копия Х-хромосомы и одна копия Y-хромосомы. Он содержит примерно 3,1 миллиарда пар оснований (3,1 Гб или 3,1 х 10 9 б.п.). [6] Это представляет собой размер составного генома, основанный на данных нескольких людей, но является хорошим показателем типичного количества ДНК в гаплоидном наборе хромосом. Большинство клеток человека диплоидны, поэтому содержат в два раза больше ДНК.
проект справочника по пангеному человека. В 2023 году был опубликован [7] Он основан на 47 геномах людей разной этнической принадлежности. [7] В настоящее время разрабатываются планы по созданию улучшенного эталонного образца, охватывающего еще больше биоразнообразия из еще более широкой выборки. [7]
Хотя между геномами человеческих особей существуют существенные различия (порядка 0,1% за счет однонуклеотидных вариантов [8] и 0,6% при учете делений ), [9] они значительно меньше, чем различия между людьми и их ближайшими ныне живущими родственниками, бонобо и шимпанзе (~1,1% фиксированных однонуклеотидных вариантов). [10] и 4% с учетом промежутков). [11]
и содержание Молекулярная организация генов
Общая длина эталонного генома человека не отражает последовательность какого-либо конкретного человека. Геном состоит из 22 пар хромосом, называемых аутосомами , плюс 23-я пара половых хромосом (XX) у женщин и (XY) у мужчин. Все эти хромосомы представляют собой большие линейные молекулы ДНК, содержащиеся в ядре клетки. Текущая версия эталонного генома человека включает по одной копии каждой аутосомы плюс одну копию двух половых хромосом (X и Y). Общий объем ДНК составляет 3,1 миллиарда пар оснований (3,1 Гб). [12]
кодирующие белки , Гены
Последовательности, кодирующие белок, представляют собой наиболее широко изученный и наиболее понятный компонент генома человека. Эти последовательности в конечном итоге приводят к производству всех белков человека , хотя некоторые биологические процессы (например, перестройки ДНК и альтернативный сплайсинг пре-мРНК ) могут привести к производству гораздо большего количества уникальных белков, чем количество генов, кодирующих белки.
Геном человека содержит от 19 000 до 20 000 генов, кодирующих белки. [13] [14] [15] [16] Эти гены содержат в среднем 10 интронов, а средний размер интрона составляет около 6 т.п.н. (6000 п.н.). [17] Это означает, что средний размер гена, кодирующего белок, составляет около 62 т.п.н., и эти гены занимают около 40% генома. [18]
Последовательности экзонов состоят из кодирующей ДНК и нетранслируемых областей (UTR) на обоих концах зрелой мРНК. Общий объем кодирующей ДНК составляет около 1-2% генома. [19] [17]
Многие люди делят геном на кодирующую и некодирующую ДНК, исходя из идеи, что кодирующая ДНК является наиболее важным функциональным компонентом генома. Около 98-99% человеческого генома представляет собой некодирующую ДНК.
Некодирующие гены [ править ]
Некодирующие молекулы РНК играют в клетках множество важных ролей, особенно во многих реакциях синтеза белка и процессинга РНК . Некодирующие РНК включают тРНК , рибосомальные РНК, микроРНК , мяРНК и другие гены некодирующих РНК, включая около 60 000 длинных некодирующих РНК (днРНК). [20] [21] [22] [23] Хотя количество известных генов днРНК продолжает расти, а точное их количество в геноме человека еще не определено, многие из них считаются нефункциональными. [24]
Многие нкРНК являются критическими элементами регуляции и экспрессии генов. Некодирующая РНК также участвует в эпигенетике, транскрипции, сплайсинге РНК и механизме трансляции. Роль РНК в генетической регуляции и заболеваниях открывает новый потенциальный уровень неисследованной сложности генома. [25]
Псевдогены [ править ]
Псевдогены — это неактивные копии генов, кодирующих белок, часто образующиеся в результате дупликации генов , которые стали нефункциональными из-за накопления инактивирующих мутаций. Число псевдогенов в геноме человека составляет порядка 13 000. [26] а в некоторых хромосомах почти столько же, сколько функциональных генов, кодирующих белок. Дупликация генов является основным механизмом, посредством которого создается новый генетический материал в ходе молекулярной эволюции .
Например, семейство генов обонятельных рецепторов является одним из наиболее документированных примеров псевдогенов в геноме человека. Более 60 процентов генов этого семейства у человека являются нефункциональными псевдогенами. Для сравнения, только 20 процентов генов в семействе генов обонятельных рецепторов мыши являются псевдогенами. Исследования показывают, что это видоспецифическая характеристика, поскольку все наиболее близкие приматы имеют пропорционально меньше псевдогенов. Это генетическое открытие помогает объяснить менее острое обоняние у людей по сравнению с другими млекопитающими. [27]
ДНК Регуляторные последовательности
Геном человека имеет множество различных регуляторных последовательностей , которые имеют решающее значение для контроля экспрессии генов . По консервативным оценкам, эти последовательности составляют 8% генома. [28] однако экстраполяции проекта ENCODE показывают, что 20 [29] -40% [30] генома представляет собой регуляторную последовательность гена. Некоторые типы некодирующей ДНК представляют собой генетические «переключатели», которые не кодируют белки, но регулируют, когда и где экспрессируются гены (так называемые энхансеры ). [31]
Регуляторные последовательности известны с конца 1960-х годов. [32] Первая идентификация регуляторных последовательностей в геноме человека была основана на технологии рекомбинантной ДНК. [33] Позже, с появлением геномного секвенирования, идентификация этих последовательностей могла быть сделана с помощью эволюционной консервации. Эволюционная ветвь между приматами и мышью , например, произошла 70–90 миллионов лет назад. [34] Таким образом, компьютерные сравнения последовательностей генов, которые идентифицируют консервативные некодирующие последовательности, будут указывать на их важность в таких функциях, как регуляция генов. [35]
Другие геномы были секвенированы с той же целью, чтобы помочь методам сохранения, например, геном рыбы-фугу . [36] Однако регуляторные последовательности исчезают и повторно эволюционируют в ходе эволюции с высокой скоростью. [37] [38] [39]
С 2012 года усилия сместились в сторону поиска взаимодействий между ДНК и регуляторными белками с помощью метода ChIP-Seq , или пробелов, в которых ДНК не упакована гистонами ( сайты гиперчувствительности к ДНКазе ), оба из которых указывают, где находятся активные регуляторные последовательности в исследуемый тип клеток. [28]
ДНК Повторяющиеся последовательности
Повторяющиеся последовательности ДНК составляют примерно 50% генома человека. [40]
Около 8% генома человека состоит из тандемных массивов ДНК или тандемных повторов, повторяющихся последовательностей низкой сложности, которые имеют множество соседних копий (например, «CAGCAGCAG...»). [41] Тандемные последовательности могут иметь разную длину: от двух нуклеотидов до десятков нуклеотидов. Эти последовательности сильно различаются даже среди близкородственных людей, поэтому используются для генеалогического тестирования ДНК и судебно-медицинского анализа ДНК . [42]
Повторяющиеся последовательности, состоящие менее чем из десяти нуклеотидов (например, динуклеотидный повтор (AC) n ), называются микросателлитными последовательностями. Среди микросателлитных последовательностей особое значение имеют тринуклеотидные повторы, поскольку иногда они встречаются в кодирующих участках генов белков и могут приводить к генетическим нарушениям. Например, болезнь Хантингтона возникает в результате экспансии тринуклеотидного повтора (CAG) n в гене Хантингтина на хромосоме 4 человека. Теломеры (концы линейных хромосом) заканчиваются микросателлитным гексануклеотидным повтором последовательности (TTAGGG) n . [ нужна ссылка ]
Тандемные повторы более длинных последовательностей (массивы повторяющихся последовательностей длиной 10–60 нуклеотидов) называются минисателлитами . [43]
Мобильные генетические элементы , последовательности ДНК, которые могут реплицироваться и вставлять свои копии в другие места генома хозяина, являются распространенным компонентом генома человека. Самая распространенная линия транспозонов Alu насчитывает около 50 000 активных копий. [44] и может быть вставлен во внутригенные и межгенные области. [45] Еще одна линия, LINE-1, имеет около 100 активных копий на геном (количество варьируется у разных людей). [46] Вместе с нефункциональными остатками старых транспозонов они составляют более половины всей ДНК человека. [47] Транспозоны, которые иногда называют «прыгающими генами», сыграли важную роль в формировании человеческого генома. Некоторые из этих последовательностей представляют собой эндогенные ретровирусы , ДНК-копии вирусных последовательностей, которые навсегда интегрировались в геном и теперь передаются последующим поколениям.
Мобильные элементы в геноме человека можно разделить на ретротранспозоны LTR (8,3% от общего генома), SINE (13,1% от общего генома), включая элементы Alu , LINE (20,4% от общего генома), SVA (SINE- VNTR -Alu) и ДНК-транспозоны класса II (2,9% от общего генома).
Мусорная ДНК [ править ]
Не существует единого мнения о том, что представляет собой «функциональный» элемент генома, поскольку генетики, биологи-эволюционисты и молекулярные биологи используют разные определения и методы. [48] [49] Из-за неоднозначности терминологии возникли разные школы мысли. [50] В эволюционных определениях «функциональная» ДНК, кодирующая она или некодирующая, способствует приспособленности организма и, следовательно, поддерживается отрицательным эволюционным давлением, тогда как «нефункциональная» ДНК не приносит пользы организму и, следовательно, под нейтральным селективным давлением. Этот тип ДНК был описан как мусорная ДНК. [51] [52] В генетических определениях «функциональная» ДНК связана с тем, как сегменты ДНК проявляются по фенотипу, а «нефункциональная» связана с эффектами потери функции на организм. [48] В биохимических определениях «функциональная» ДНК относится к последовательностям ДНК, которые определяют молекулярные продукты (например, некодирующие РНК) и биохимические активности, играющие механистическую роль в регуляции генов или генома (т. е. последовательности ДНК, которые влияют на активность клеточного уровня, такую как тип клетки, состояние и молекулярная структура). процессы). [53] [48] В литературе нет единого мнения относительно количества функциональной ДНК, поскольку, в зависимости от того, как понимать «функцию», по оценкам, до 90% генома человека, вероятно, представляет собой нефункциональную ДНК (мусорную ДНК). [54] до 80% генома, вероятно, функционально. [55] Также возможно, что мусорная ДНК может приобрести функцию в будущем и, следовательно, может сыграть роль в эволюции. [56] но это, вероятно, происходит очень редко. [51] Наконец, ДНК, которая вредна для организма и находится под отрицательным селективным давлением, называется ДНК-мусором. [52]
Секвенирование [ править ]
Первые последовательности генома человека были опубликованы в почти полном черновом виде в феврале 2001 года Проектом « Геном человека». [57] и корпорация Celera . [58] О завершении проекта секвенирования генома человека было объявлено в 2004 году с публикацией проекта последовательности генома, в результате чего в последовательности остался всего 341 пробел, представляющий собой сильно повторяющуюся и другую ДНК, которую невозможно было секвенировать с помощью доступных в то время технологий. [59] Геном человека был первым из всех позвоночных, секвенирование которого было практически завершено, и по состоянию на 2018 год диплоидные геномы более миллиона отдельных людей были определены с использованием секвенирования следующего поколения . [60]
Эти данные используются во всем мире в биомедицинской науке , антропологии , криминалистике и других отраслях науки. Такие геномные исследования привели к прогрессу в диагностике и лечении заболеваний, а также к новым открытиям во многих областях биологии, включая эволюцию человека . [ нужна ссылка ]
К 2018 году общее количество генов было увеличено как минимум до 46 831. [61] плюс еще 2300 генов микроРНК . [62] Опрос населения 2018 года выявил еще 300 миллионов оснований генома человека, которых не было в эталонной последовательности. [63] До получения полной последовательности генома оценки количества человеческих генов варьировались от 50 000 до 140 000 (с некоторыми неясностями относительно того, включали ли эти оценки гены, не кодирующие белки). [64] По мере улучшения качества последовательности генома и методов идентификации генов, кодирующих белки, [59] количество признанных генов, кодирующих белок, упало до 19 000–20 000. [65]
В 2022 году консорциум «Теломеры к теломерам» (T2T) сообщил о полной последовательности женского генома человека. [4] заполнение всех пробелов в Х-хромосоме (2020 г.) и 22 аутосомах (май 2021 г.). [4] [66] Ранее несеквенированные части содержат гены иммунного ответа , которые помогают адаптироваться к инфекциям и выживать, а также гены, которые важны для прогнозирования реакции на лекарства . [67] Полная последовательность генома человека также позволит лучше понять формирование человека как индивидуального организма и то, как люди различаются между собой и другими видами. [67]
Хотя о «завершении» проекта генома человека было объявлено в 2001 году, [68] оставались сотни пробелов, причем около 5–10% всей последовательности оставались неопределенными. Недостающая генетическая информация находилась в основном в повторяющихся гетерохроматических областях и вблизи центромер и теломер областях , кодирующих гены , а также в некоторых эухроматических . [69] В 2015 году осталось 160 эухроматических пробелов, когда были определены последовательности, охватывающие еще 50 ранее не секвенированных регионов. [70] Только в 2020 году была определена первая по-настоящему полная последовательность теломер-теломеры человеческой хромосомы, а именно Х-хромосомы . [71] Год спустя была получена первая полная последовательность теломер-теломер аутосомной хромосомы человека, хромосомы 8 . [72] Полный геном человека (без Y-хромосомы) был опубликован в 2021 году, а с Y-хромосомой - в январе 2022 года. [4] [3] [73]
проект справочника по пангеному человека. В 2023 году был опубликован [7] Он основан на 47 геномах людей разной этнической принадлежности. [7] В настоящее время разрабатываются планы по созданию улучшенного эталонного образца, охватывающего еще больше биоразнообразия из еще более широкой выборки. [7]
Геномные вариации у людей [ править ]
Эталонный геном человека [ править ]
За исключением однояйцевых близнецов, у всех людей наблюдаются значительные различия в последовательностях геномной ДНК. человека Эталонный геном (HRG) используется в качестве эталонной стандартной последовательности.
Есть несколько важных моментов, касающихся эталонного генома человека:
- HRG представляет собой гаплоидную последовательность. Каждая хромосома представлена один раз.
- HRG представляет собой составную последовательность и не соответствует ни одному реальному человеческому индивидууму.
- HRG периодически обновляется для исправления ошибок, неясностей и неизвестных «пробелов».
- HRG никоим образом не представляет собой «идеального» или «совершенного» человека. Это просто стандартизированное представление или модель, используемая для сравнительных целей.
Консорциум геномных ссылок отвечает за обновление HRG. Версия 38 была выпущена в декабре 2013 года. [74]
Измерение генетических человека вариаций
Большинство исследований генетических вариаций человека были сосредоточены на однонуклеотидных полиморфизмах (SNP), которые представляют собой замены в отдельных основаниях хромосомы. По оценкам большинства анализов, SNP встречаются в среднем в 1 из 1000 пар оснований в эухроматическом геноме человека, хотя они не встречаются с одинаковой плотностью. Отсюда следует популярное утверждение о том, что «мы все, независимо от расы , генетически на 99,9% одинаковы». [75] хотя это было бы несколько оговорено большинством генетиков. Например, сейчас считается, что гораздо большая часть генома участвует в изменении количества копий . [76] Крупномасштабные совместные усилия по каталогизации вариаций SNP в геноме человека предпринимаются в рамках Международного проекта HapMap . [ нужна ссылка ]
Геномные локусы и длина определенных типов небольших повторяющихся последовательностей сильно варьируются от человека к человеку, что является основой технологий снятия отпечатков пальцев ДНК и технологий ДНК-тестирования отцовства . Гетерохроматические . части человеческого генома, общая численность которых составляет несколько сотен миллионов пар оснований, также считаются весьма изменчивыми в пределах человеческой популяции (они настолько повторяющиеся и настолько длинные, что их невозможно точно секвенировать с помощью современных технологий) Эти регионы содержат мало генов, и неясно, является ли какой-либо значительный фенотипический эффект результатом типичных вариаций повторов или гетерохроматина.
Большинство грубых геномных мутаций в зародышевых клетках гамет , вероятно, приводят к образованию нежизнеспособных эмбрионов; однако ряд заболеваний человека связан с крупномасштабными геномными аномалиями. Синдром Дауна , синдром Тернера и ряд других заболеваний возникают в результате нерасхождения целых хромосом. Раковые клетки часто имеют анеуплоидию хромосом и плеч хромосом, хотя причинно-следственная связь между анеуплоидией и раком не установлена.
вариаций геномных Картирование человека
В то время как последовательность генома перечисляет порядок каждого основания ДНК в геноме, карта генома определяет ориентиры. Карта генома менее детальна, чем последовательность генома, и помогает перемещаться по геному. [77] [78]
Примером карты вариаций является HapMap, разрабатываемая Международным проектом HapMap . HapMap — это карта гаплотипов человеческого генома, «которая будет описывать общие закономерности изменения последовательностей ДНК человека». [79] Он каталогизирует закономерности небольших вариаций генома, включающие отдельные буквы или основания ДНК.
В мае 2008 года исследователи опубликовали первую основанную на последовательностях карту крупномасштабных структурных изменений человеческого генома в журнале Nature . [80] [81] Крупномасштабные структурные вариации — это различия в геноме людей, которые варьируются от нескольких тысяч до нескольких миллионов оснований ДНК; некоторые из них представляют собой увеличение или потерю участков последовательности генома, а другие проявляются как перестановки участков последовательности. Эти вариации включают различия в количестве копий определенного гена, делеций, транслокаций и инверсий.
вариация Структурная
Структурные вариации относятся к генетическим вариантам, которые затрагивают более крупные сегменты человеческого генома, в отличие от точечных мутаций . Часто структурные варианты (SV) определяются как варианты из 50 пар оснований (п.н.) или более, такие как делеции, дупликации, вставки, инверсии и другие перегруппировки. Около 90% структурных вариантов представляют собой некодирующие делеции, но у большинства людей таких делеций более тысячи; размер делеций варьируется от десятков пар оснований до десятков тысяч пар оснований. [82] В среднем люди являются носителями ~3 редких структурных вариантов, которые изменяют кодирующие области, например удаляют экзоны . Около 2% людей являются носителями ультраредких структурных вариантов мегабазового масштаба, особенно перестроек. То есть миллионы пар оснований могут быть инвертированы внутри хромосомы; «Сверхредкие» означает, что они встречаются только у отдельных лиц или членов их семей и, следовательно, возникли совсем недавно. [82]
в геноме человека Частота SNP
Однонуклеотидные полиморфизмы (SNP) не встречаются однородно в геноме человека. Фактически, существует огромное разнообразие в частоте SNP между генами, что отражает разное селективное давление на каждый ген, а также разные скорости мутаций и рекомбинации по всему геному. Однако исследования SNP смещены в сторону кодирующих областей, и полученные на их основе данные вряд ли отражают общее распределение SNP по геному. Таким образом, протокол Консорциума SNP был разработан для идентификации SNP без предвзятости в отношении кодирующих областей, а 100 000 SNP Консорциума в целом отражают разнообразие последовательностей в хромосомах человека. Консорциум SNP стремится увеличить количество SNP, идентифицированных в геноме, до 300 000 к концу первого квартала 2001 года. [83]

Изменения в некодирующей последовательности и синонимичные изменения в кодирующей последовательности обычно встречаются чаще, чем несинонимические изменения, что отражает большее селективное давление, снижающее разнообразие в положениях, определяющих идентичность аминокислот. Переходные изменения встречаются чаще, чем трансверсии, при этом CpG-динуклеотиды демонстрируют самую высокую частоту мутаций, предположительно из-за дезаминирования. [ нужна ссылка ]
Персональные геномы [ править ]
Последовательность личного генома — это (почти) полная последовательность пар химических оснований, составляющих ДНК одного человека. Поскольку медицинское лечение оказывает различное воздействие на разных людей из-за генетических вариаций, таких как однонуклеотидный полиморфизм (SNP), анализ личных геномов может привести к персонализированному медицинскому лечению, основанному на индивидуальных генотипах. [84]
Первой последовательность личного генома, которая была определена, была последовательность Крейга Вентера в 2007 году. Персональные геномы не секвенировались в рамках общедоступного проекта «Геном человека» с целью защиты личности добровольцев, предоставивших образцы ДНК. Эта последовательность была получена из ДНК нескольких добровольцев из разных групп населения. [85] возглавляемой Вентером, Однако в начале работы по секвенированию генома Celera Genomics, было принято решение перейти от секвенирования составного образца к использованию ДНК одного человека, которым, как позже выяснилось, был сам Вентер. Таким образом, последовательность человеческого генома Celera, опубликованная в 2000 году, в основном принадлежала одному человеку. Последующая замена ранних комплексных данных и определение диплоидной последовательности, представляющей оба набора хромосом , а не гаплоидной последовательности, о которой первоначально сообщалось, позволили выпустить первый личный геном. [86] В апреле 2008 года строительство Джеймса Уотсона было завершено . В 2009 году Стивен Квейк опубликовал свою собственную последовательность генома, полученную с помощью секвенатора его собственной разработки Heliscope. [87] Команда из Стэнфорда под руководством Юана Эшли опубликовала концепцию медицинской интерпретации генома человека, реализованную на геноме Quake, и впервые приняла медицинские решения на основе всего генома. [88] Эта команда еще больше расширила подход к семейству Уэст, первому семейству, секвенированному в рамках программы персонального секвенирования генома Illumina. [89] С тех пор были опубликованы сотни последовательностей личного генома. [90] в том числе Десмонда Туту , [91] [92] и палеоэскимоса . [93] В 2012 году были обнародованы полные последовательности генома двух семейных трио из 1092 геномов. [8] В ноябре 2013 года испанская семья сделала четыре персональных набора данных экзома (около 1% генома) общедоступными под лицензией общественного достояния Creative Commons . [94] [95] Проект «Персональный геном» (начатый в 2005 году) является одним из немногих, кто сделал общедоступными как последовательности генома, так и соответствующие медицинские фенотипы. [96] [97]
Секвенирование отдельных геномов выявило уровни генетической сложности, которые раньше не оценивались. Персональная геномика помогла выявить значительный уровень разнообразия человеческого генома, обусловленный не только SNP, но и структурными вариациями. Однако применение таких знаний для лечения болезней и в области медицины находится только в самом начале. [98] Секвенирование экзома становится все более популярным в качестве инструмента, помогающего в диагностике генетических заболеваний, поскольку экзом составляет лишь 1% геномной последовательности, но на его долю приходится примерно 85% мутаций, которые вносят значительный вклад в развитие заболевания. [99]
Человеческие нокауты [ править ]
У людей нокауты генов естественным образом возникают в виде гетерозиготных или гомозиготных нокаутов генов с потерей функции . Эти нокауты часто трудно различить, особенно в гетерогенном генетическом фоне. Их также трудно найти, поскольку они встречаются на низких частотах.

В популяциях с высоким уровнем кровного родства , таких как страны с высоким уровнем браков двоюродных братьев и сестер, наблюдается самая высокая частота нокаутов гомозиготных генов. К таким группам населения относятся Пакистан, Исландия и амиши. Эти популяции с высоким уровнем родительского родства стали объектами исследований на людях, которые помогли определить функцию определенных генов у людей. Выделяя конкретные нокауты, исследователи могут использовать фенотипический анализ этих людей, чтобы охарактеризовать нокаутированный ген.

Нокауты определенных генов могут вызывать генетические заболевания, потенциально иметь положительные эффекты или даже не приводить к полному отсутствию фенотипического эффекта. Однако определение фенотипического эффекта нокаута у людей может оказаться сложной задачей. Проблемы с характеристикой и клинической интерпретацией нокаутов включают трудности с определением вариантов ДНК, определением нарушения функции белка (аннотация) и рассмотрением степени влияния мозаицизма на фенотип. [100]
Одним из крупных исследований, посвященных нокаутам людей, является исследование риска инфаркта миокарда в Пакистане. Было обнаружено, что люди с гетерозиготным нокаутом гена потери функции гена APOC3 имели более низкие уровни триглицеридов в крови после употребления пищи с высоким содержанием жиров по сравнению с людьми без мутации. Однако у людей с гомозиготным нокаутом гена потери функции гена APOC3 наблюдался самый низкий уровень триглицеридов в крови после теста на жировую нагрузку, поскольку они не производят функционального белка APOC3. [101]
Генетические нарушения человека [ править ]
Большинство аспектов биологии человека включают как генетические (наследственные), так и негенетические (окружающие факторы) факторы. Некоторые унаследованные вариации влияют на аспекты нашей биологии, которые не являются медицинскими по своей природе (рост, цвет глаз, способность ощущать вкус или запах определенных соединений и т. д.). Более того, некоторые генетические нарушения вызывают заболевание только в сочетании с соответствующими факторами окружающей среды (например, диетой). С учетом этих оговорок генетические нарушения можно охарактеризовать как клинически определяемые заболевания, вызванные вариациями последовательностей геномной ДНК. В самых простых случаях заболевание может быть связано с вариацией одного гена. Например, муковисцидоз вызван мутациями гена CFTR и является наиболее распространенным рецессивным заболеванием в популяциях европеоидной расы, известно более 1300 различных мутаций. [102]
Мутации в определенных генах, вызывающие заболевания, обычно тяжелые с точки зрения функции генов и редки, поэтому генетические нарушения также редки в индивидуальном порядке. Однако, поскольку существует множество генов, которые могут вызывать генетические нарушения, в совокупности они составляют значительный компонент известных заболеваний, особенно в педиатрической медицине. Молекулярно охарактеризованными генетическими нарушениями являются те, для которых идентифицирован основной причинный ген. зарегистрировано около 2200 таких расстройств В настоящее время в базе данных OMIM . [102]
Исследования генетических нарушений часто проводятся посредством семейных исследований. В некоторых случаях используются популяционные подходы, особенно в случае так называемых популяций-основателей, например, в Финляндии, Французской Канаде, Юте, Сардинии и т. д. Диагностику и лечение генетических нарушений обычно проводит врач генетик - . прошел обучение в области клинической/медицинской генетики. Результаты проекта «Геном человека», вероятно, повысят доступность генетического тестирования на генетические заболевания и, в конечном итоге, улучшат лечение. Родители могут пройти обследование на наличие наследственных заболеваний и проконсультироваться о последствиях, вероятности наследования и о том, как избежать или улучшить его у своих потомков.
Существует множество различных видов вариаций последовательности ДНК: от полных дополнительных или отсутствующих хромосом до изменений отдельных нуклеотидов. Обычно предполагается, что большая часть естественно возникающих генетических вариаций в человеческих популяциях фенотипически нейтральна, т.е. оказывает незначительное или вообще не обнаруживается влияние на физиологию индивидуума (хотя могут существовать незначительные различия в приспособленности, определяемые в течение эволюционного периода времени). Генетические нарушения могут быть вызваны любым или всеми известными типами вариаций последовательностей. Чтобы молекулярно охарактеризовать новое генетическое заболевание, необходимо установить причинно-следственную связь между конкретным вариантом геномной последовательности и исследуемым клиническим заболеванием. Подобные исследования составляют область молекулярной генетики человека.
С появлением проекта «Геном человека» и Международного проекта HapMap стало возможным исследовать тонкие генетические влияния на многие распространенные заболевания, такие как диабет, астма, мигрень, шизофрения и т. д. Хотя некоторые причинно-следственные связи были установлены между вариантами геномных последовательностей в определенные гены и некоторые из этих заболеваний, часто широко освещаемые в средствах массовой информации, обычно не считаются генетическими нарушениями сами по себе , поскольку их причины сложны и включают множество различных генетических факторов и факторов окружающей среды. Таким образом, в отдельных случаях могут возникнуть разногласия по поводу того, следует ли называть конкретное заболевание генетическим заболеванием.
Среди дополнительных генетических нарушений следует упомянуть синдром Каллмана и синдром Пфайффера (ген FGFR1), дистрофию роговицы Фукса (ген TCF4), болезнь Гиршпрунга (гены RET и FECH), синдром Барде-Бидля 1 (гены CCDC28B и BBS1), синдром Барде-Бидля 10. (ген BBS10) и лице-лопаточно-плечевая мышечная дистрофия 2-го типа (гены D4Z4 и SMCHD1). [103]
Секвенирование генома теперь позволяет сузить геном до определенных мест, чтобы более точно обнаружить мутации, которые приведут к генетическому заболеванию. Варианты числа копий (CNV) и однонуклеотидные варианты (SNV) также можно обнаружить одновременно с секвенированием генома с помощью более новых доступных процедур секвенирования, называемых секвенированием следующего поколения (NGS). [104] При этом анализируется лишь небольшая часть генома, около 1–2%. Результаты этого секвенирования можно использовать для клинической диагностики генетического состояния, включая синдром Ашера , заболевание сетчатки, нарушения слуха, диабет, эпилепсию, болезнь Ли , наследственный рак, нервно-мышечные заболевания, первичные иммунодефициты, тяжелый комбинированный иммунодефицит (ТКИД) и заболевания митохондрий. [105] NGS также можно использовать для выявления носителей заболеваний еще до зачатия. Заболевания, которые можно обнаружить с помощью этого секвенирования, включают болезнь Тея-Сакса , синдром Блума , болезнь Гоше , болезнь Канавана , семейную дизавтономию , муковисцидоз, спинальную мышечную атрофию и синдром хрупкой Х-хромосомы . Следующее секвенирование генома можно сузить, чтобы конкретно искать болезни, более распространенные среди определенных этнических групп населения. [106]
| Беспорядок | Распространенность | Задействована хромосома или ген |
|---|---|---|
| Хромосомные состояния | ||
| Синдром Дауна | 1:600 | Хромосома 21 |
| синдром Клайнфельтера | 1:500–1000 самцов | Дополнительная Х-хромосома |
| синдром Тернера | 1:2000 самок | Потеря Х-хромосомы |
| Серповидноклеточная анемия | 1 из 50 рождений в некоторых частях Африки; реже в других местах | β-глобин (на хромосоме 11) |
| Синдром Блума | 1:48000 евреев-ашкенази | БЛМ |
| Рак | ||
| молочной железы / Рак яичников (восприимчивость) | ~5% случаев этих типов рака | БРЦА1, БРЦА2 |
| FAP (наследственная неполипозная палочка) | 1:3500 | БТР |
| синдром Линча | 5–10% всех случаев рака кишечника | МЛХ1, МШ2, МШ6, ПМС2 |
| Анемия Фанкони | 1:130000 рождений | ФАНКК |
| Неврологические состояния | ||
| болезнь Гентингтона | 1:20000 | Хантингтин |
| Болезнь Альцгеймера – раннее начало | 1:2500 | ПС1 , ПС2 , приложение |
| Тай-Сакс | 1:3600 рождений у евреев-ашкенази | Ген HEXA (на хромосоме 15) |
| болезнь Канавана | 2,5% восточноевропейского еврейского происхождения | Ген ASPA (на хромосоме 17) |
| Семейная дисавтономия | 600 известных случаев во всем мире с момента открытия | Ген IKBKAP (на хромосоме 9) |
| Синдром ломкой Х-хромосомы | 1,4:10000 у мужчин, 0,9:10000 у женщин. | Ген FMR1 (на Х-хромосоме) |
| Муколипидоз IV типа | От 1:90 до 1:100 у евреев-ашкенази. | МКОЛН1 |
| Другие условия | ||
| Муковисцидоз | 1:2500 | ЦФТР |
| мышечная дистрофия Дюшенна | 1:3500 мальчики | Дистрофин |
| Мышечная дистрофия Беккера | 1,5–6:100 000 самцов | МДД |
| Бета-талассемия | 1:100000 | ГББ |
| Врожденная гиперплазия надпочечников | 1:280 у коренных американцев и эскимосов-юпиков 1:15000 у американских европеоидов | CYP21A2 |
| Болезнь накопления гликогена I типа. | 1:100000 рождений в Америке | G6PC |
| Болезнь мочи кленового сиропа | 1:180000 в США 1:176 в общинах меннонитов и амишей 1:250000 в Австрии | BCKDHA, BCKDHB, DBT, DLD |
| Болезнь Нимана-Пика, SMPD1-ассоциированная | 1200 случаев по всему миру | СМПД1 |
| синдром Ашера | 1:23000 в США 1:28000 в Норвегии 1:12500 в Германии | CDH23, CLRN1, DFNB31, GPR98, MYO7A, PCDH15, USH1C, USH1G, USH2A |
Эволюция [ править ]
−10 — – −9 — – −8 — – −7 — – −6 — – −5 — – −4 — – −3 — – −2 — – −1 — – 0 — | ( О. praegens ) ( О. тугененсис ) ( Ар. кадабба ) ( Ар. ramidus ) |
| ||||||||||||||||||||||||||||
Сравнительные геномные исследования геномов млекопитающих показывают, что примерно 5% генома человека сохранилось в результате эволюции с момента расхождения существующих линий примерно 200 миллионов лет назад, содержащих подавляющее большинство генов. [107] [108] Опубликованный геном шимпанзе отличается от генома человека на 1,23% при прямом сравнении последовательностей. [109] Около 20% этой цифры приходится на вариации внутри каждого вида, в результате чего сохраняется лишь ~1,06% последовательного расхождения между людьми и шимпанзе в общих генах. [110] Однако эта разница между нуклеотидами затмевается той частью каждого генома, которая не является общей, включая около 6% функциональных генов, которые уникальны как для людей, так и для шимпанзе. [111]
Другими словами, значительные наблюдаемые различия между людьми и шимпанзе могут быть обусловлены скорее различиями на уровне генома в количестве, функциях и экспрессии генов, чем изменениями последовательности ДНК в общих генах. Действительно, даже у людей было обнаружено ранее недооцененное количество вариаций числа копий (CNV), которое может составлять до 5–15% человеческого генома. Другими словами, у людей может быть +/- 500 000 000 пар оснований ДНК, причем некоторые из них являются активными генами, другие инактивированы или активны на разных уровнях. Полное значение этого открытия еще предстоит выяснить. В среднем типичный ген, кодирующий белок человека, отличается от своего ортолога шимпанзе только двумя аминокислотными заменами; почти треть человеческих генов имеют точно такую же трансляцию белка, как и их ортологи шимпанзе. Основное различие между этими двумя геномами заключается в хромосоме 2 человека , которая эквивалентна продукту слияния хромосом 12 и 13 шимпанзе. [112] (позже переименованные в хромосомы 2А и 2В соответственно).
люди претерпели необычайную потерю генов обонятельных рецепторов В ходе недавней эволюции , что объясняет наше относительно грубое обоняние по сравнению с большинством других млекопитающих. Эволюционные данные свидетельствуют о том, что появление цветового зрения у людей и некоторых других видов приматов уменьшило потребность в обонянии. [113]
В сентябре 2016 года ученые сообщили, что, основываясь на генетических исследованиях ДНК человека, всех неафриканцев в современном мире можно отнести к одной популяции , покинувшей Африку между 50 000 и 80 000 лет назад. [114]
Митохондриальная ДНК [ править ]
человека Митохондриальная ДНК представляет огромный интерес для генетиков, поскольку она, несомненно, играет роль в митохондриальных заболеваниях . Это также проливает свет на эволюцию человека; например, анализ вариаций митохондриального генома человека привел к предположению о недавнем общем предке всех людей по материнской линии (см. Митохондриальная Ева ).
Из-за отсутствия системы проверки ошибок копирования, [115] митохондриальная ДНК (мтДНК) имеет более высокую скорость изменения, чем ядерная ДНК. Эта в 20 раз более высокая частота мутаций позволяет использовать мтДНК для более точного отслеживания материнской родословной. [ нужна ссылка ] Исследования мтДНК в популяциях позволили проследить древние пути миграции, такие как миграция коренных американцев из Сибири. [116] или полинезийцы из юго-восточной Азии . [ нужна ссылка ] Его также использовали, чтобы показать, что неандертальцев . в европейской смеси генов, унаследованной исключительно по материнской линии, нет никаких следов ДНК [117] Из-за ограничительного типа наследования мтДНК «все или ничего» этот результат (отсутствие следов мтДНК неандертальцев) был бы вероятен, если бы не было большого процента предков неандертальцев или не было сильного положительного отбора для этой мтДНК. Например, если вернуться на 5 поколений назад, только один из 32 предков человека внес свой вклад в мтДНК этого человека, поэтому, если один из этих 32 был чистым неандертальцем, ожидаемые ~ 3% аутосомной ДНК этого человека будут иметь неандертальское происхождение, но они будут иметь вероятность ~97% отсутствия следов мтДНК неандертальца. [ нужна ссылка ]
Эпигеном [ править ]
Эпигенетика описывает множество особенностей человеческого генома, которые выходят за рамки его первичной последовательности ДНК, такие как хроматина упаковка , модификации гистонов и метилирование ДНК , и которые важны для регуляции экспрессии генов, репликации генома и других клеточных процессов. Эпигенетические маркеры усиливают и ослабляют транскрипцию определенных генов, но не влияют на реальную последовательность нуклеотидов ДНК. Метилирование ДНК является основной формой эпигенетического контроля над экспрессией генов и одной из наиболее изученных тем эпигенетики. В процессе развития профиль метилирования ДНК человека претерпевает существенные изменения. В клетках ранней зародышевой линии геном имеет очень низкий уровень метилирования. Эти низкие уровни обычно описывают активные гены. По мере развития родительские метки импринтинга приводят к увеличению активности метилирования. [118] [119]
Эпигенетические закономерности можно выявить как между тканями внутри человека, так и между самими людьми. Идентичные гены, имеющие различия только в эпигенетическом состоянии, называются эпиаллелями . Эпиаллели можно разделить на три категории: те, которые непосредственно определяются генотипом человека, те, на которые влияет генотип, и те, которые полностью независимы от генотипа. На эпигеном также существенно влияют факторы окружающей среды. Диета, токсины и гормоны влияют на эпигенетическое состояние. Исследования диетических манипуляций показали, что диеты с дефицитом метила связаны с гипометилированием эпигенома. Такие исследования подтверждают, что эпигенетика является важным связующим звеном между окружающей средой и геномом. [120]
См. также [ править ]
Ссылки [ править ]
- ^ Браун Т.А. (2002). Геном человека (2-е изд.). Оксфорд: Вили-Лисс.
- ^ «Аннотационный отчет Homo sapiens» . www.ncbi.nlm.nih.gov . Проверено 17 апреля 2022 г.
- ^ Jump up to: Перейти обратно: а б «CHM13 T2T v1.1 – Геном – Сборка – NCBI» . www.ncbi.nlm.nih.gov . Проверено 26 июля 2021 г.
- ^ Jump up to: Перейти обратно: а б с д и Нурк С., Корен С., Ри А., Раутиайнен М., Бзикадзе А.В., Михеенко А. и др. (апрель 2022 г.). «Полная последовательность человеческого генома» . Наука . 376 (6588): 44–53. Бибкод : 2022Sci...376...44N . дои : 10.1126/science.abj6987 . ПМЦ 9186530 . ПМИД 35357919 . S2CID 247854936 .
- ^ Ри А., Нурк С., Чехова М., Хойт С.Дж., Тейлор Дж., Альтемос Н. и др. (сентябрь 2023 г.). «Полная последовательность Y-хромосомы человека» . Природа . 621 (7978): 344–354. Бибкод : 2023Natur.621..344R . дои : 10.1038/s41586-023-06457-y . ПМЦ 10752217 . ПМИД 37612512 .
Поступила 2 декабря 2022 г.
- ^ «Сборка человека и аннотация генов» . Ансамбль . 2022 . Проверено 28 февраля 2024 г.
- ^ Jump up to: Перейти обратно: а б с д и ж Ляо В.В., Асри М., Эблер Дж., Дорр Д., Хаукнесс М., Хики Г. и др. (май 2023 г.). «Проект справочника по пангеному человека» . Природа . 617 (7960): 312–324. Бибкод : 2023Natur.617..312L . дои : 10.1038/s41586-023-05896-x . ПМЦ 10172123 . ПМИД 37165242 .
- ^ Jump up to: Перейти обратно: а б Абекасис Г.Р., Аутон А., Брукс Л.Д., ДеПристо М.А., Дурбин Р.М., Handsaker RE и др. (ноябрь 2012 г.). «Интегрированная карта генетических вариаций 1092 геномов человека» . Природа . 491 (7422): 56–65. Бибкод : 2012Natur.491...56T . дои : 10.1038/nature11632 . ПМК 3498066 . ПМИД 23128226 .
- ^ Аутон А., Брукс Л.Д., Дурбин Р.М., Гаррисон Э.П., Канг Х.М., Корбел Д.О. и др. (октябрь 2015 г.). «Глобальный справочник по генетическим вариациям человека» . Природа . 526 (7571): 68–74. Бибкод : 2015Natur.526...68T . дои : 10.1038/nature15393 . ПМК 4750478 . ПМИД 26432245 .
- ^ Консорциум анализа секвенирования шимпанзе (сентябрь 2005 г.). «Исходная последовательность генома шимпанзе и сравнение с геномом человека» . Природа . 437 (7055): 69–87. Бибкод : 2005Natur.437...69. . дои : 10.1038/nature04072 . ПМИД 16136131 . S2CID 2638825 .
- ^ Варки А., Альтейде Т.К. (декабрь 2005 г.). «Сравнение геномов человека и шимпанзе: поиск иголок в стоге сена» . Геномные исследования . 15 (12): 1746–1758. дои : 10.1101/гр.3737405 . ПМИД 16339373 .
- ^ «Сборка генома человека» . Ансамбль . Проверено 23 января 2024 г.
- ^ Абаскаль Ф., Хуан Д., Юнгрейс И., Мартинес Л., Ригау М., Родригес Х.М. и др. (2018). «Неясные концы: почти каждый пятый человеческий ген все еще имеет неопределенный статус кодирования» . Исследования нуклеиновых кислот . 46 (14): 7070–7084. дои : 10.1093/nar/gky587 . ПМК 6101605 . ПМИД 29982784 .
- ^ Хатье К., Мюльхаузен С., Симм Д., Киллмар М. (2019). «Геном человека, кодирующий белок: аннотирование высоко висящих плодов». Биоэссе . 41 (11): 1900066. doi : 10.1002/bies.201900066 . ПМИД 31544971 .
- ^ Оменн Г.С., Лейн Л., Общий СМ, Кристеа И.М., Корралес Ф.Дж., Линдског С. и др. (2020). «Исследования человеческого протеома достигли важной вехи: >90% предсказанных человеческих белков теперь достоверно обнаружены, согласно проекту человеческого протеома HUPO» . Журнал исследований протеома . 19 (12): 4735–4746. doi : 10.1021/acs.jproteome.0c00485 . hdl : 10261/229720 . ПМЦ 7718309 . ПМИД 32931287 .
- ^ Амарал П., Карбонелл-Сала С., Де Ла Вега Ф.М., Файал Т., Франкиш А., Гингерас Т. и др. (2023). «Состояние каталога генов человека» . Природа . 622 (7981): 41–47. arXiv : 2303.13996 . Бибкод : 2023Natur.622...41A . дои : 10.1038/s41586-023-06490-x . ПМЦ 10575709 . ПМИД 37794265 .
- ^ Jump up to: Перейти обратно: а б Пиовесан А, Антонарос Ф, Витале Л, Стрипполи П, Пеллери МК, Каракаузи М (2019). «Гены, кодирующие человеческие белки, и статистика особенностей генов в 2019 году» . Исследовательские заметки BMC . 12 (1): 315. дои : 10.1186/s13104-019-4343-8 . ПМЦ 6549324 . ПМИД 31164174 .
- ^ Фрэнсис В.Р., Верхайде Г. (июнь 2017 г.). «Аналогичные соотношения интронов и межгенной последовательности в геномах животных» . Геномная биология и эволюция . 9 (6): 1582–1598. дои : 10.1093/gbe/evx103 . ПМЦ 5534336 . ПМИД 28633296 .
- ^ Хатье К., Мюльхаузен С., Симм Д., Киллмар М. (2019). «Геном человека, кодирующий белок: аннотирование высоко висящих плодов». Биоэссе . 41 (11): 1900066. doi : 10.1002/bies.201900066 . ПМИД 31544971 .
- ^ Пенниси Э (сентябрь 2012 г.). «Геномика. Проект ENCODE пишет панегирик мусорной ДНК». Наука . 337 (6099): 1159–1161. дои : 10.1126/science.337.6099.1159 . ПМИД 22955811 .
- ^ Айер М.К., Никнафс Ю.С., Малик Р., Сингхал У., Саху А., Хосоно Ю. и др. (март 2015 г.). «Ландшафт длинных некодирующих РНК в транскриптоме человека» . Природная генетика . 47 (3): 199–208. дои : 10.1038/ng.3192 . ПМЦ 4417758 . ПМИД 25599403 .
- ^ Эдди С.Р. (декабрь 2001 г.). «Некодирующие РНК-гены и современный мир РНК». Обзоры природы Генетика . 2 (12): 919–929. дои : 10.1038/35103511 . ПМИД 11733745 . S2CID 18347629 .
- ^ Манагадзе Д., Лобковский А.Е., Вольф Ю.И., Шабалина С.А., Рогозин И.Б., Кунин Е.В. (2013). «Огромный, сохранившийся линком млекопитающих» . PLOS Вычислительная биология . 9 (2): e1002917. Бибкод : 2013PLSCB...9E2917M . дои : 10.1371/journal.pcbi.1002917 . ПМЦ 3585383 . ПМИД 23468607 .
- ^ Палаццо AF, Ли ES (2015). «Некодирующая РНК: что функционально, а что мусор?» . Границы генетики . 6 :2. дои : 10.3389/fgene.2015.00002 . ПМК 4306305 . ПМИД 25674102 .
- ^ Маттик Дж.С., Макунин И.В. (апрель 2006 г.). «Некодирующая РНК» . Молекулярная генетика человека . 15 (Спецификация № 1): R17–29. дои : 10.1093/hmg/ddl046 . ПМИД 16651366 .
- ^ Пей Б., Сису С., Франкиш А., Ховальд С., Хабеггер Л., Му XJ и др. (2012). «Ресурс псевдогена GENCODE» . Геномная биология . 13 (9): С51. дои : 10.1186/gb-2012-13-9-r51 . ПМЦ 3491395 . ПМИД 22951037 .
- ^ Гилад Ю., Ман О., Паабо С., Lancet D (март 2003 г.). «Специфическая для человека утрата генов обонятельных рецепторов» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (6): 3324–3327. Бибкод : 2003PNAS..100.3324G . дои : 10.1073/pnas.0535697100 . ПМК 152291 . ПМИД 12612342 .
- ^ Jump up to: Перейти обратно: а б Бернштейн Б.Е., Бирни Э., Данэм И., Грин Э.Д., Гюнтер С., Снайдер М. (сентябрь 2012 г.). «Комплексная энциклопедия элементов ДНК в геноме человека» . Природа . 489 (7414): 57–74. Бибкод : 2012Natur.489...57T . дои : 10.1038/nature11247 . ПМЦ 3439153 . ПМИД 22955616 .
- ^ Бирни Э. (5 сентября 2012 г.). «КОДИРОВАТЬ: Мои собственные мысли» . Блог Юэна: Биоинформатик в целом .
- ^ Стаматояннопулос Х.А. (сентябрь 2012 г.). «Что кодирует наш геном?» . Геномные исследования . 22 (9): 1602–1611. дои : 10.1101/гр.146506.112 . ПМЦ 3431477 . ПМИД 22955972 .
- ^ Кэрролл С.Б., Гомпель Н., Прюдом Б. (май 2008 г.). «Регулирование эволюции». Научный американец . 298 (5): 60–67. Бибкод : 2008SciAm.298e..60C . doi : 10.1038/scientificamerican0508-60 . ПМИД 18444326 .
- ^ Миллер Дж. Х., Иппен К., Скайф Дж. Г., Беквит Дж. Р. (1968). «Промоторно-операторная область лак-оперона Escherichia coli». Дж. Мол. Биол . 38 (3): 413–420. дои : 10.1016/0022-2836(68)90395-1 . ПМИД 4887877 .
- ^ Райт С., Розенталь А., Флавелл Р., Гросвельд Ф. (1984). «Последовательности ДНК, необходимые для регулируемой экспрессии генов бета-глобина в клетках мышиной эритролейкемии». Клетка . 38 (1): 265–273. дои : 10.1016/0092-8674(84)90548-8 . ПМИД 6088069 . S2CID 34587386 .
- ^ Ней М, Сюй П, Глазко Г (февраль 2001 г.). «Оценка времени расхождения мультибелковых последовательностей для нескольких видов млекопитающих и нескольких отдаленно родственных организмов» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (5): 2497–2502. Бибкод : 2001PNAS...98.2497N . дои : 10.1073/pnas.051611498 . ПМК 30166 . ПМИД 11226267 .
- ^ Лутс Г.Г., Локсли Р.М., Бланкеспур С.М., Ван З.Э., Миллер В., Рубин Э.М. и др. (апрель 2000 г.). «Идентификация координатного регулятора интерлейкинов 4, 13 и 5 путем сравнения последовательностей между видами». Наука . 288 (5463): 136–140. Бибкод : 2000Sci...288..136L . дои : 10.1126/science.288.5463.136 . ПМИД 10753117 . Резюме. Архивировано 6 ноября 2009 г. в Wayback Machine.
- ^ Менье М. «Геноскоп и Уайтхед объявляют о высокой степени покрытия последовательностей генома Tetraodon nigroviridis» . Геноскоп. Архивировано из оригинала 16 октября 2006 года . Проверено 12 сентября 2006 г.
- ^ Ромеро И.Г., Рувинский И., Гилад Ю. (июль 2012 г.). «Сравнительные исследования экспрессии генов и эволюции регуляции генов» . Обзоры природы Генетика . 13 (7): 505–516. дои : 10.1038/nrg3229 . ПМК 4034676 . ПМИД 22705669 .
- ^ Шмидт Д., Уилсон М.Д., Баллестер Б., Швали П.С., Браун Г.Д., Маршалл А. и др. (май 2010 г.). «ChIP-seq пяти позвоночных раскрывает эволюционную динамику связывания факторов транскрипции» . Наука . 328 (5981): 1036–1040. Бибкод : 2010Sci...328.1036S . дои : 10.1126/science.1186176 . ПМК 3008766 . ПМИД 20378774 .
- ^ Уилсон М.Д., Барбоза-Морайс Н.Л., Шмидт Д., Конбой С.М., Вейнс Л., Тыбулевич В.Л. и др. (октябрь 2008 г.). «Видоспецифическая транскрипция у мышей, несущих 21 хромосому человека» . Наука . 322 (5900): 434–438. Бибкод : 2008Sci...322..434W . дои : 10.1126/science.1160930 . ПМЦ 3717767 . ПМИД 18787134 .
- ^ Треанген Т.Дж., Зальцберг С.Л. (январь 2012 г.). «Повторяющаяся ДНК и секвенирование нового поколения: вычислительные проблемы и решения» . Обзоры природы Генетика . 13 (1): 36–46. дои : 10.1038/nrg3117 . ПМЦ 3324860 . ПМИД 22124482 .
- ^ Дуитама Дж., Заблоцкая А., Жмайель Р., Янсен А., Белет С., Вермееш Дж.Р. и др. (май 2014 г.). «Крупномасштабный анализ изменчивости тандемных повторов в геноме человека» . Исследования нуклеиновых кислот . 42 (9): 5728–5741. дои : 10.1093/nar/gku212 . ПМК 4027155 . ПМИД 24682812 .
- ^ Пирс Б.А. (2012). Генетика: концептуальный подход (4-е изд.). Нью-Йорк: WH Freeman. стр. 538–540. ISBN 978-1-4292-3250-0 .
- ^ «миниспутник, значения сущ., этимология и многое другое | Оксфордский словарь английского языка» . www.oed.com . Проверено 8 октября 2023 г.
- ^ Беннетт Э.А., Келлер Х., Миллс Р.Э., Шмидт С., Моран Дж.В., Вайхенридер О. и др. (декабрь 2008 г.). «Активные Alu-ретротранспозоны в геноме человека» . Геномные исследования . 18 (12): 1875–1883. дои : 10.1101/гр.081737.108 . ПМЦ 2593586 . ПМИД 18836035 .
- ^ Лян К. Х., Йе КТ (2013). «Сеть ограничения экспрессии генов, опосредованная смысловыми и антисмысловыми последовательностями Alu, расположенными на белково-кодирующих информационных РНК» . БМК Геномика . 14 :325. дои : 10.1186/1471-2164-14-325 . ПМЦ 3655826 . ПМИД 23663499 .
- ^ Бруга Б., Шустак Дж., Бэдж Р.М., Лутц-Пригге С., Фарли А.Х., Моран Дж.В. и др. (апрель 2003 г.). «Горячие L1 отвечают за основную часть ретротранспозиции в человеческой популяции» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (9): 5280–5285. Бибкод : 2003PNAS..100.5280B . дои : 10.1073/pnas.0831042100 . ПМК 154336 . ПМИД 12682288 .
- ^ Бартон Н.Х., Бриггс Д.Е., Эйзен Дж.А., Гольдштейн Д.Б., Патель Н.Х. (2007). Эволюция . Колд-Спринг-Харбор, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор. ISBN 978-0-87969-684-9 . [ нужна страница ]
- ^ Jump up to: Перейти обратно: а б с Келлис М., Уолд Б., Снайдер М.П., Бернштейн Б.Е., Кундадже А., Маринов Г.К. и др. (апрель 2014 г.). «Определение функциональных элементов ДНК в геноме человека» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (17): 6131–6138. Бибкод : 2014PNAS..111.6131K . дои : 10.1073/pnas.1318948111 . ПМК 4035993 . ПМИД 24753594 .
- ^ Линквист С., Дулитл В.Ф., Палаццо AF (апрель 2020 г.). «Разъяснение слова на букву F в геномике» . ПЛОС Генетика . 16 (4): e1008702. дои : 10.1371/journal.pgen.1008702 . ПМЦ 7153884 . ПМИД 32236092 .
- ^ Дулиттл WF (декабрь 2018 г.). «Мы просто не можем и дальше столь расплывчато относиться к «функции» » . Геномная биология . 19 (1): 223. дои : 10.1186/s13059-018-1600-4 . ПМК 6299606 . ПМИД 30563541 .
- ^ Jump up to: Перейти обратно: а б Граур Д (2017). «Мусорная ДНК: нефункциональная часть человеческого генома». Эволюция генома человека I. Эволюционные исследования. Токио: Спрингер. стр. 19–60. arXiv : 1601.06047 . дои : 10.1007/978-4-431-56603-8_2 . ISBN 978-4-431-56603-8 . S2CID 17826096 .
- ^ Jump up to: Перейти обратно: а б Пенья С.Д. (2021). «Обзор генома человека: кодирующая ДНК и некодирующая ДНК» . В Хаддаде, Лос-Анджелес (ред.). Структура генома человека, функции и клинические аспекты . Чам: Спрингер Природа. стр. 5–7. ISBN 978-3-03-073151-9 .
- ^ Абаскаль Ф., Акоста Р., Аддлман Н.Дж., Адриан Дж. и др. (30 июля 2020 г.). «Расширенные энциклопедии элементов ДНК в геномах человека и мыши» . Природа . 583 (7818): 699–710. Бибкод : 2020Natur.583..699E . дои : 10.1038/s41586-020-2493-4 . ПМК 7410828 . ПМИД 32728249 .
С функциональной точки зрения функциональные элементы определяются как дискретные, линейно упорядоченные особенности последовательности, которые определяют молекулярные продукты (например, гены, кодирующие белки, или некодирующие РНК) или биохимические активности, имеющие механистическую роль в регуляции генов или генома (например, промоторы или усилители транскрипции).
- ^ Граур Д (июль 2017 г.). «Верхний предел функциональной доли генома человека» . Геномная биология и эволюция . 9 (7): 1880–1885. дои : 10.1093/gbe/evx121 . ПМК 5570035 . ПМИД 28854598 . Разместить резюме в: Ле Пейдж М (17 июля 2017 г.). «В конце концов, по крайней мере 75 процентов нашей ДНК на самом деле представляет собой бесполезный мусор» . НовыйУченый .
- ^ Данэм И., Кундадже А., Олдред С.Ф., Коллинз П.Дж., Дэвис К.А., Дойл Ф. и др. (Консорциум проекта ENCODE) (сентябрь 2012 г.). «Комплексная энциклопедия элементов ДНК в геноме человека» . Природа . 489 (7414): 57–74. Бибкод : 2012Natur.489...57T . дои : 10.1038/nature11247 . ПМЦ 3439153 . ПМИД 22955616 .
Эти данные позволили нам определить биохимические функции для 80% генома, в частности за пределами хорошо изученных областей, кодирующих белок.
. - ^ Андольфатто П. (октябрь 2005 г.). «Адаптивная эволюция некодирующей ДНК у дрозофилы». Природа . 437 (7062): 1149–52. Бибкод : 2005Natur.437.1149A . дои : 10.1038/nature04107 . ПМИД 16237443 . S2CID 191219 . Разместить резюме в: «Исследование UCSD показывает, что «мусорная» ДНК имеет эволюционное значение» . ScienceDaily . Роквилл, доктор медицины. 20 октября 2005 г.
- ^ «Международный консорциум по секвенированию генома человека публикует результаты секвенирования и анализа генома человека» . Национальный институт исследования генома человека . Национальные институты здравоохранения, Министерство здравоохранения и человеческих ресурсов США. 12 февраля 2001 г.
- ^ Пенниси Э. (февраль 2001 г.). «Геном человека». Наука . 291 (5507): 1177–1180. дои : 10.1126/science.291.5507.1177 . ПМИД 11233420 . S2CID 38355565 .
- ^ Jump up to: Перейти обратно: а б Международный консорциум по секвенированию генома человека (октябрь 2004 г.). «Завершение эухроматической последовательности генома человека» . Природа . 431 (7011): 931–945. Бибкод : 2004Natur.431..931H . дои : 10.1038/nature03001 . ПМИД 15496913 .
- ^ Молтени М (19 ноября 2018 г.). «Теперь вы можете секвенировать весь свой геном всего за 200 долларов» . Проводной .
- ^ Саэй ТД (17 сентября 2018 г.). «Пересчет человеческих генов увеличивает это число как минимум до 46 831» . Новости науки .
- ^ Аллес Дж., Фельманн Т., Фишер У., Бакес С., Галата В., Минет М. и др. (апрель 2019 г.). «Оценка общего количества истинных микроРНК человека» . Исследования нуклеиновых кислот . 47 (7): 3353–3364. дои : 10.1093/nar/gkz097 . ПМК 6468295 . ПМИД 30820533 .
- ^ Чжан С. (28 ноября 2018 г.). «В геноме человека отсутствуют 300 миллионов букв ДНК». Атлантика .
- ^ Уэйд Н. (23 сентября 1999 г.). «Количество человеческих генов оценивается в 140 000, что является значительным увеличением» . Нью-Йорк Таймс .
- ^ Эзкурдиа И., Хуан Д., Родригес Дж.М., Франкиш А., Дикханс М., Харроу Дж. и др. (ноябрь 2014 г.). «Множество данных свидетельствует о том, что может существовать всего лишь 19 000 генов, кодирующих человеческие белки» . Молекулярная генетика человека . 23 (22): 5866–5878. дои : 10.1093/hmg/ddu309 . ПМК 4204768 . ПМИД 24939910 .
- ^ Райтон К. (февраль 2021 г.). «Заполнение пробелов между теломерами» . Вехи природы: геномное секвенирование : S21.
- ^ Jump up to: Перейти обратно: а б «Ученые впервые секвенировали полный геном человека» . CNN . 31 марта 2022 г. Проверено 1 апреля 2022 г.
- ^ Ландер Э.С., Линтон Л.М., Биррен Б., Нусбаум С., Зоди М.К., Болдуин Дж. и др. (февраль 2001 г.). «Первичное секвенирование и анализ генома человека» . Природа . 409 (6822): 860–921. Бибкод : 2001Natur.409..860L . дои : 10.1038/35057062 . hdl : 2027.42/62798 . ПМИД 11237011 .
- ^ Чжан С. (28 ноября 2018 г.). «В геноме человека отсутствуют 300 миллионов букв ДНК» . Атлантика . Проверено 16 августа 2019 г.
- ^ Чейссон М.Дж., Хаддлстон Дж., Деннис М.Ю., Судмант П.Х., Малиг М., Хормоздиари Ф. и др. (январь 2015 г.). «Разрешение сложности генома человека с помощью секвенирования одиночных молекул» . Природа . 517 (7536): 608–611. Бибкод : 2015Natur.517..608C . дои : 10.1038/nature13907 . ПМК 4317254 . ПМИД 25383537 .
- ^ Мига К.Х. , Корен С., Ри А., Фольгер М.Р., Гершман А., Бзикадзе А. и др. (сентябрь 2020 г.). «Сборка теломер-теломеры полной Х-хромосомы человека» . Природа . 585 (7823): 79–84. Бибкод : 2020Природа.585...79М . дои : 10.1038/s41586-020-2547-7 . ПМЦ 7484160 . ПМИД 32663838 .
- ^ Логсдон Г.А., Фоллгер М.Р., Се П., Мао Ю., Лисковых М.А., Корен С. и др. (май 2021 г.). «Структура, функции и эволюция полной 8-й хромосомы человека» . Природа . 593 (7857): 101–107. Бибкод : 2021Natur.593..101L . дои : 10.1038/s41586-021-03420-7 . ПМЦ 8099727 . ПМИД 33828295 .
- ^ «Список геномов – Геном – NCBI» . www.ncbi.nlm.nih.gov . Проверено 26 июля 2021 г.
- ^ НКБИ . «GRCh38 – hg38 – Геном – Сборка» . ncbi.nlm.nih.gov . Проверено 15 марта 2019 г.
- ^ «из обращения Билла Клинтона о положении страны в 2000 году» . Архивировано из оригинала 21 февраля 2017 года . Проверено 14 июня 2007 г.
- ^ Редон Р., Исикава С., Фитч К.Р., Фейк Л., Перри Г.Х., Эндрюс Т.Д. и др. (ноябрь 2006 г.). «Глобальные различия в количестве копий в геноме человека» . Природа . 444 (7118): 444–454. Бибкод : 2006Natur.444..444R . дои : 10.1038/nature05329 . ПМЦ 2669898 . ПМИД 17122850 .
- ^ «Что такое геном?» . Genomenewsnetwork.org. 15 января 2003 года . Проверено 31 мая 2009 г.
- ^ «Информационный бюллетень: Картирование генома: Путеводитель по генетическому шоссе, которое мы называем геномом человека» . Национальный центр биотехнологической информации . Национальная медицинская библиотека США, Национальные институты здравоохранения. 29 марта 2004 г. Архивировано из оригинала 19 июля 2010 г. Проверено 31 мая 2009 г.
- ^ «О проекте» . Международный проект HapMap . Архивировано из оригинала 15 мая 2008 года . Проверено 31 мая 2009 г.
- ^ «Выпуск 2008 года: исследователи создали первую карту последовательностей крупномасштабных структурных изменений в геноме человека» . genome.gov . Проверено 31 мая 2009 г.
- ^ Кидд Дж.М., Купер Г.М., Донахью В.Ф., Хайден Х.С., Сампас Н., Грейвс Т. и др. (май 2008 г.). «Картирование и секвенирование структурных вариаций восьми геномов человека» . Природа . 453 (7191): 56–64. Бибкод : 2008Natur.453...56K . дои : 10.1038/nature06862 . ПМЦ 2424287 . ПМИД 18451855 .
- ^ Jump up to: Перейти обратно: а б Абель Х.Дж., Ларсон Д.Э., Регье А.А., Чианг С., Дас И., Канчи К.Л. и др. (июль 2020 г.). «Картирование и характеристика структурных изменений в 17 795 геномах человека» . Природа . 583 (7814): 83–89. Бибкод : 2020Natur.583...83A . дои : 10.1038/s41586-020-2371-0 . ПМЦ 7547914 . ПМИД 32460305 .
- ^ Грей IC, Кэмпбелл Д.А., Сперр Н.К. (2000). «Однонуклеотидные полиморфизмы как инструменты генетики человека» . Молекулярная генетика человека . 9 (16): 2403–2408. дои : 10.1093/hmg/9.16.2403 . ПМИД 11005795 .
- ^ Лай Э (июнь 2001 г.). «Применение технологий SNP в медицине: извлеченные уроки и будущие задачи» . Геномные исследования . 11 (6): 927–929. дои : 10.1101/гр.192301 . ПМИД 11381021 .
- ^ «Завершение проекта генома человека: часто задаваемые вопросы» . genome.gov . Проверено 31 мая 2009 г.
- ^ Певица Э (4 сентября 2007 г.). «Геном Крейга Вентера» . Обзор технологий Массачусетского технологического института . Проверено 25 мая 2010 г.
- ^ Пушкарев Д., Нефф Н.Ф., Quake SR (сентябрь 2009 г.). «Одномолекулярное секвенирование индивидуального генома человека» . Природная биотехнология . 27 (9): 847–850. дои : 10.1038/nbt.1561 . ПМК 4117198 . ПМИД 19668243 .
- ^ Эшли Э.А., Бьютт А.Дж., Уилер М.Т., Чен Р., Кляйн Т.Е., Дьюи Ф.Е. и др. (май 2010 г.). «Клиническая оценка с учетом личного генома» . Ланцет . 375 (9725): 1525–1535. дои : 10.1016/S0140-6736(10)60452-7 . ПМЦ 2937184 . ПМИД 20435227 .
- ^ Дьюи Ф.Е., Чен Р., Кордеро С.П., Ормонд К.Е., Калешу С., Карчевски К.Дж. и др. (сентябрь 2011 г.). «Поэтапный полногеномный генетический риск в семейном квартете с использованием эталонной последовательности основного аллеля» . ПЛОС Генетика . 7 (9): e1002280. дои : 10.1371/journal.pgen.1002280 . ПМК 3174201 . ПМИД 21935354 .
- ^ «Complete Genomics добавляет 29 полных наборов данных секвенирования генома человека с высоким охватом в свой общедоступный геномный репозиторий» (пресс-релиз).
- ^ Образец I (17 февраля 2010 г.). «Геном Десмонда Туту секвенирован в рамках исследования генетического разнообразия» . Хранитель .
- ^ Шустер С.К., Миллер В., Ратан А., Томшо Л.П., Джардин Б., Кассон Л.Р. и др. (февраль 2010 г.). «Полные геномы койсанов и банту из южной Африки» . Природа . 463 (7283): 943–947. Бибкод : 2010Natur.463..943S . дои : 10.1038/nature08795 . ПМК 3890430 . ПМИД 20164927 .
- ^ Расмуссен М., Ли Ю., Линдгрин С., Педерсен Дж.С., Альбрехтсен А., Мольтке И. и др. (февраль 2010 г.). «Последовательность древнего человеческого генома вымершего палеоэскимоса» . Природа . 463 (7282): 757–762. Бибкод : 2010Natur.463..757R . дои : 10.1038/nature08835 . ПМЦ 3951495 . ПМИД 20148029 .
- ^ Корпус М. , Кариасо М., Колетта А., Вайс Д., Харрисон А.П., Моран Ф. и др. (12 ноября 2013 г.). «Полный общедоступный набор данных по семейной геномике». биоRxiv 10.1101/000216 .
- ^ Корпус М (июнь 2013 г.). «Краудсорсинг корпасомы» . Исходный код по биологии и медицине . 8 (1): 13. дои : 10.1186/1751-0473-8-13 . ПМК 3706263 . ПМИД 23799911 .
- ^ Мао К., Чиотлос С., Чжан Р.Ю., Болл М.П., Чин Р., Карневали П. и др. (октябрь 2016 г.). «Полные геномные последовательности и экспериментально поэтапные гаплотипы более 100 персональных геномов» . ГигаСайенс . 5 (1): 42. дои : 10.1186/s13742-016-0148-z . ПМК 5057367 . ПМИД 27724973 .
- ^ Цай Б., Ли Б., Кига Н., Тусберг Дж., Бергквист Т., Чен Ю.К. и др. (сентябрь 2017 г.). «Сопоставление фенотипов с целыми геномами: уроки, извлеченные из четырех итераций проблем сообщества проекта личного генома» . Человеческая мутация . 38 (9): 1266–1276. дои : 10.1002/humu.23265 . ПМЦ 5645203 . ПМИД 28544481 .
- ^ Гонзага-Хореги С., Лупски-младший, Гиббс Р.А. (2012). «Секвенирование генома человека в здоровье и болезни» . Ежегодный обзор медицины . 63 : 35–61. doi : 10.1146/annurev-med-051010-162644 . ПМК 3656720 . ПМИД 22248320 .
- ^ Чой М., Шолл У.И., Джи В., Лю Т., Тихонова И.Р., Зумбо П. и др. (ноябрь 2009 г.). «Генетическая диагностика путем захвата всего экзома и массового параллельного секвенирования ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (45): 19096–19101. Бибкод : 2009PNAS..10619096C . дои : 10.1073/pnas.0910672106 . ПМЦ 2768590 . ПМИД 19861545 .
- ^ Jump up to: Перейти обратно: а б Нарасимхан В.М., Сюэ Ю., Тайлер-Смит С. (апрель 2016 г.). «Человеческие нокаут-носители: мертвые, больные, здоровые или улучшенные?» . Тенденции молекулярной медицины . 22 (4): 341–351. doi : 10.1016/j.molmed.2016.02.006 . ПМЦ 4826344 . ПМИД 26988438 .
- ^ Салехин Д., Натараджан П., Армян И.М., Чжао В., Рашид А., Хетарпал С.А. и др. (апрель 2017 г.). «Человеческие нокауты и фенотипический анализ в когорте с высоким уровнем кровного родства» . Природа . 544 (7649): 235–239. Бибкод : 2017Natur.544..235S . дои : 10.1038/nature22034 . ПМК 5600291 . ПМИД 28406212 .
- ^ Jump up to: Перейти обратно: а б Хамош А., Скотт А.Ф., Амбергер Дж., Боккини С., Валле Д., МакКьюсик В.А. (январь 2002 г.). «Онлайн-менделевское наследование у человека (OMIM), база знаний о человеческих генах и генетических нарушениях» . Исследования нуклеиновых кислот . 30 (1): 52–55. дои : 10.1093/нар/30.1.52 . ПМК 99152 . ПМИД 11752252 .
- ^ Кацанис Н. (ноябрь 2016 г.). «Континуум причинно-следственной связи генетических нарушений человека» . Геномная биология . 17 (1): 233. дои : 10.1186/s13059-016-1107-9 . ПМК 5114767 . ПМИД 27855690 .
- ^ Алексеев Ю.О., Фазели Р., Ян С., Басран Р., Махер Т., Миллер Н.С. и др. (2018). «Учебник по секвенированию следующего поколения: как он работает и что он может делать?» . Академическая патология . 5 : 2374289518766521. doi : 10.1177/2374289518766521 . ПМЦ 5944141 . ПМИД 29761157 .
- ^ Вонг Дж.К. (2017). «Обзор клинической полезности секвенирования следующего поколения в молекулярной диагностике генетических нарушений человека». В Вонге LJ (ред.). Клиническая молекулярная диагностика генетических заболеваний человека на основе секвенирования нового поколения . Чам: Международное издательство Springer. стр. 1–11. дои : 10.1007/978-3-319-56418-0_1 . ISBN 978-3-319-56416-6 .
- ^ Федик А., Чжан Дж (2017). «Следующее поколение проверки носителей». В Вонге LJ (ред.). Клиническая молекулярная диагностика генетических заболеваний человека на основе секвенирования нового поколения . Чам: Международное издательство Springer. стр. 339–354. дои : 10.1007/978-3-319-56418-0_16 . ISBN 978-3-319-56416-6 .
- ^ Уотерстон Р.Х., Линдблад-Тох К., Бирни Э., Роджерс Дж., Абриль Дж.Ф., Агарвал П. и др. (декабрь 2002 г.). «Первичное секвенирование и сравнительный анализ генома мыши» . Природа . 420 (6915): 520–562. Бибкод : 2002Natur.420..520W . дои : 10.1038/nature01262 . PMID 12466850 .
доля небольших (50–100 п.н.) сегментов в геноме млекопитающих, находящихся в процессе (очищающего) отбора, можно оценить примерно в 5%. Эта пропорция намного выше, чем можно объяснить только последовательностями, кодирующими белки, а это означает, что геном содержит множество дополнительных функций (таких как нетранслируемые области, регуляторные элементы, гены, не кодирующие белки, и хромосомные структурные элементы), которые отбираются по биологическим функциям. .
- ^ Бирни Э., Стаматояннопулос Х.А., Дутта А., Гиго Р., Гингерас Т.Р., Маргулис Э.Х. и др. (июнь 2007 г.). «Идентификация и анализ функциональных элементов в 1% генома человека в рамках пилотного проекта ENCODE» . Природа . 447 (7146): 799–816. Бибкод : 2007Natur.447..799B . дои : 10.1038/nature05874 . ПМК 2212820 . ПМИД 17571346 .
- ^ Консорциум анализа секвенирования шимпанзе (сентябрь 2005 г.). «Исходная последовательность генома шимпанзе и сравнение с геномом человека» . Природа . 437 (7055): 69–87. Бибкод : 2005Natur.437...69. . дои : 10.1038/nature04072 . ПМИД 16136131 .
Мы подсчитали, что расхождение нуклеотидов по всему геному между человеком и шимпанзе составляет 1,23%, что подтверждает недавние результаты более ограниченных исследований.
- ^ Консорциум анализа секвенирования шимпанзе (сентябрь 2005 г.). «Исходная последовательность генома шимпанзе и сравнение с геномом человека» . Природа . 437 (7055): 69–87. Бибкод : 2005Natur.437...69. . дои : 10.1038/nature04072 . ПМИД 16136131 .
по нашим оценкам, полиморфизм составляет 14–22% наблюдаемой скорости расхождения и, таким образом, фиксированное расхождение составляет ~ 1,06% или меньше.
- ^ Демут Дж.П., Де Би Т., Стажич Дж.Е., Кристианини Н., Хан М.В. (2006). «Эволюция семейств генов млекопитающих» . ПЛОС ОДИН . 1 (1): е85. Бибкод : 2006PLoSO...1...85D . дои : 10.1371/journal.pone.0000085 . ПМЦ 1762380 . ПМИД 17183716 .
Наши результаты показывают, что люди и шимпанзе различаются по крайней мере на 6% (1418 из 22000 генов) по набору генов, что резко контрастирует с часто цитируемой разницей в 1,5% между ортологичными нуклеотидными последовательностями.
- ^ Консорциум анализа секвенирования шимпанзе (сентябрь 2005 г.). «Исходная последовательность генома шимпанзе и сравнение с геномом человека» . Природа . 437 (7055): 69–87. Бибкод : 2005Natur.437...69. . дои : 10.1038/nature04072 . ПМИД 16136131 .
Человеческая хромосома 2 возникла в результате слияния двух предковых хромосом, которые остались отдельными в линии шимпанзе.
Олсон М.В., Варки А. (январь 2003 г.). «Секвенирование генома шимпанзе: понимание эволюции человека и болезней». Обзоры природы Генетика . 4 (1): 20–28. дои : 10.1038/nrg981 . ПМИД 12509750 . S2CID 205486561 .Крупномасштабное секвенирование генома шимпанзе уже неминуемо.
- ^ Гилад Ю., Вибе В., Пшеворски М., Ланцет Д., Паабо С. (январь 2004 г.). «Потеря генов обонятельных рецепторов совпадает с приобретением полного трехцветного зрения у приматов» . ПЛОС Биология . 2 (1): Е5. doi : 10.1371/journal.pbio.0020005 . ПМК 314465 . ПМИД 14737185 .
Наши результаты показывают, что ухудшение обонятельного репертуара происходило одновременно с приобретением полного трихроматического цветового зрения у приматов.
- ^ Циммер С (21 сентября 2016 г.). «Как мы сюда попали: ДНК указывает на единственную миграцию из Африки» . Нью-Йорк Таймс . Проверено 22 сентября 2016 г.
- ^ Коупленд WC (январь 2012 г.). «Дефекты репликации митохондриальной ДНК и болезни человека» . Критические обзоры по биохимии и молекулярной биологии . 47 (1): 64–74. дои : 10.3109/10409238.2011.632763 . ПМК 3244805 . ПМИД 22176657 .
- ^ Нильсен Р., Эйки Дж. М., Якобссон М., Притчард Дж. К., Тишкофф С., Виллерслев Э. (январь 2017 г.). «Отслеживание заселения мира посредством геномики» . Природа . 541 (7637): 302–310. Бибкод : 2017Natur.541..302N . дои : 10.1038/nature21347 . ПМЦ 5772775 . ПМИД 28102248 .
- ^ Сайкс Б. (9 октября 2003 г.). «Митохондриальная ДНК и история человечества» . Геном человека. Архивировано из оригинала 7 сентября 2015 года . Проверено 19 сентября 2006 г.
- ^ Мистели Т (февраль 2007 г.). «За пределами последовательности: клеточная организация функций генома» . Клетка . 128 (4): 787–800. дои : 10.1016/j.cell.2007.01.028 . ПМИД 17320514 . S2CID 9064584 .
- ^ Бернштейн Б.Е., Мейснер А., Ландер Э.С. (февраль 2007 г.). «Эпигеном млекопитающих» . Клетка . 128 (4): 669–681. дои : 10.1016/j.cell.2007.01.033 . ПМИД 17320505 . S2CID 2722988 .
- ^ Шин А.Дж., Джуниен С. (май – июнь 2012 г.). «[Эпигенетика, взаимодействие между окружающей средой и генами: роль в сложных заболеваниях]». Revue Médicale de Liège . 67 (5–6): 250–257. ПМИД 22891475 .
Внешние ссылки [ править ]
- Аннотированная (версия 110) программа просмотра генома T2T-CHM13 v2.0
- Полный геном человека T2T-CHM13 v2.0 (без пробелов)
- Ensembl Проект браузера Ensembl Genome
- Средство просмотра геномных данных Национальной медицинской библиотеки (ГРВ)
- Браузер генома UCSC с использованием T2T-CHM13 v2.0
- Uniprot: список генов на хромосоме
- Проект «Геном человека»
- Национальный институт исследования генома человека
- Национальное управление геномики общественного здравоохранения
- Простой просмотрщик генома человека