Интрон
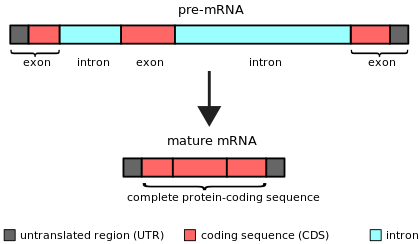
Интрон — это любая нуклеотидная последовательность внутри гена , которая не экспрессируется и не действует в конечном продукте РНК. Слово «интрон» происходит от термина «интрагенный регион » , то есть «участок внутри гена». [1] Термин «интрон» относится как к последовательности ДНК внутри гена, так и к соответствующей последовательности РНК в транскриптах РНК . [2] Неинтронные последовательности, которые соединяются в результате процессинга РНК с образованием зрелой РНК, называются экзонами . [3]
Интроны обнаружены в генах большинства эукариот и многих эукариотических вирусов и могут располагаться как в генах, кодирующих белки, так и в генах, функционирующих как РНК ( некодирующие гены ). Существует четыре основных типа интронов: интроны тРНК, интроны группы I, интроны группы II и сплайсосомные интроны (см. ниже). Интроны редки у бактерий и архей (прокариотов).
и этимология Открытие
Интроны были впервые обнаружены в генах, кодирующих белки аденовируса . [4] [5] и впоследствии были идентифицированы в генах, кодирующих транспортные РНК и гены рибосомальных РНК. Сейчас известно, что интроны встречаются в самых разных генах организмов, бактерий, [6] и вирусы во всех биологических царствах.
Тот факт, что гены расщепляются или прерываются интронами, был независимо открыт в 1977 году Филипом Алленом Шарпом и Ричардом Дж. Робертсом , за что они разделили Нобелевскую премию по физиологии и медицине в 1993 году. [7] Термин «интрон» был введен американским биохимиком Уолтером Гилбертом : [1]
«Представление о цистроне [т.е. гене]... должно быть заменено понятием транскрипционной единицы, содержащей области, которые будут потеряны из зрелого мессенджера – которые я предлагаю называть интронами (для внутригенных областей) – чередующиеся с областями, которые будут выражены – экзоны». (Гилберт, 1978)
Термин «интрон» также относится к интрацистрону , т. е. дополнительной части ДНК, которая возникает внутри цистрона . [8]
Хотя интроны иногда называют промежуточными последовательностями , [9] термин «промежуточная последовательность» может относиться к любому из нескольких семейств внутренних последовательностей нуклеиновых кислот, которые не присутствуют в конечном генном продукте, включая интеины , нетранслируемые области (UTR) и нуклеотиды, удаленные путем редактирования РНК , в дополнение к интронам.
Распространение [ править ]
Наблюдается, что частота интронов в разных геномах широко варьируется в зависимости от спектра биологических организмов. Например, интроны чрезвычайно распространены в ядерном геноме челюстных позвоночных (например, человека, мыши и рыбы-фугу (фугу)), где гены, кодирующие белки, почти всегда содержат несколько интронов, тогда как интроны редко встречаются в ядерных генах некоторых эукариотических микроорганизмов. , [10] например, пекарские/пивные дрожжи ( Saccharomyces cerevisiae ). Напротив, митохондриальные геномы позвоночных полностью лишены интронов, тогда как геномы эукариотических микроорганизмов могут содержать множество интронов. [11]
Особенно крайним случаем является дрозофилы ген dhc7 , содержащий интрон размером ≥3,6 мегабаз (Мб), для транскрипции которого требуется примерно три дня. [12] [13] С другой стороны, исследование 2015 года предполагает, что самая короткая известная длина интрона многоклеточных животных составляет 30 пар оснований (п.н.), принадлежащих человеческому гену MST1L . [14] Самые короткие известные интроны принадлежат гетеротрихным инфузориям, таким как Stentor coeruleus , у которых большинство (>95%) интронов имеют длину 15 или 16 п.н. [15]
Классификация [ править ]
Сплайсинг всех интронсодержащих молекул РНК внешне аналогичен описанному выше. Однако различные типы интронов были идентифицированы посредством изучения структуры интронов с помощью анализа последовательности ДНК, а также генетического и биохимического анализа реакций сплайсинга РНК. Были идентифицированы по крайней мере четыре различных класса интронов:
- Интроны в генах, кодирующих ядерные белки , которые удаляются сплайсосомами (сплайсосомные интроны)
- Интроны в генах ядерных и архейных транспортных РНК , которые удаляются белками (интроны тРНК)
- Самосплайсинговые интроны группы I , удаляемые катализом РНК.
- Самосплайсинговые интроны группы II , удаляемые катализом РНК.
интроны группы III Предполагается, что относятся к пятому семейству, но мало что известно о биохимическом аппарате, который обеспечивает их сплайсинг. По-видимому, они связаны с интронами группы II и, возможно, с интронами сплайсосом. [16]
интроны Сплайсосомные
Интроны ядерной пре-мРНК (сплайсосомные интроны) характеризуются специфическими последовательностями интронов, расположенными на границах между интронами и экзонами. [17] Эти последовательности распознаются молекулами сплайсосомной РНК, когда инициируются реакции сплайсинга. [18] Кроме того, они содержат точку ветвления, определенную нуклеотидную последовательность вблизи 3'-конца интрона, которая ковалентно связывается с 5'-концом интрона во время процесса сплайсинга, образуя разветвленную ( лариатную ) структуру. [ необходимо пояснение (сложный жаргон) ] интрон. Помимо этих трех коротких консервативных элементов, последовательности ядерных интронов пре-мРНК сильно варьируют. Интроны ядерной пре-мРНК часто намного длиннее окружающих их экзонов.
интроны тРНК [ править ]
Интроны транспортной РНК, удаление которых зависит от белков, находятся в определенном месте внутри антикодоновой петли несплайсированных предшественников тРНК и удаляются эндонуклеазой сплайсинга тРНК. Затем экзоны соединяются вместе вторым белком — лигазой сплайсинга тРНК. [19] Обратите внимание, что самосплайсинговые интроны также иногда обнаруживаются в генах тРНК. [20]
группы I и Интроны II группы
Интроны группы I и группы II обнаружены в генах, кодирующих белки ( информационная РНК ), транспортную РНК и рибосомальную РНК у очень широкого круга живых организмов. [21] [22] После транскрипции в РНК интроны группы I и группы II также осуществляют обширные внутренние взаимодействия, которые позволяют им складываться в специфическую сложную трехмерную архитектуру . Эта сложная архитектура позволяет некоторым интронам группы I и группы II осуществлять самосплайсинг , то есть молекула РНК, содержащая интрон, может перестроить свою собственную ковалентную структуру так, чтобы точно удалить интрон и соединить экзоны вместе в правильном порядке. В некоторых случаях в сплайсинге участвуют определенные интрон-связывающие белки, действующие таким образом, что помогают интрону сворачиваться в трехмерную структуру, необходимую для активности самосплайсинга. Интроны группы I и группы II отличаются различным набором внутренних консервативных последовательностей и складчатых структур, а также тем, что при сплайсинге молекул РНК, содержащих интроны группы II, образуются разветвленные интроны (как и у сплайсосомных РНК), тогда как интроны группы I используют не -кодируемый гуанозиновый нуклеотид (обычно GTP) для инициации сплайсинга, добавляя его к 5'-концу вырезанного интрона.
О точности сращивания [ править ]
Сплайсосома представляет собой очень сложную структуру, содержащую до ста белков и пять различных РНК. Субстратом реакции является длинная молекула РНК, а реакции переэтерификации, катализируемые сплайсосомой, требуют объединения сайтов, которые могут находиться на расстоянии тысяч нуклеотидов друг от друга. [23] [24] Все биохимические реакции связаны с известным уровнем ошибок, и чем сложнее реакция, тем выше уровень ошибок. Поэтому неудивительно, что реакция сплайсинга, катализируемая сплайсосомой, имеет значительную частоту ошибок, даже несмотря на то, что существуют дополнительные сплайсосомные факторы, которые подавляют случайное расщепление загадочных сайтов сплайсинга. [25]
В идеальных условиях реакция сплайсинга, вероятно, будет точной на 99,999% (коэффициент ошибки 10 −5 ), и правильные экзоны будут присоединены, а правильный интрон будет удален. [26] Однако эти идеальные условия требуют очень близкого совпадения с лучшими последовательностями сайтов сплайсинга и отсутствия каких-либо конкурирующих последовательностей загадочных сайтов сплайсинга внутри интронов, и эти условия редко встречаются в крупных эукариотических генах, которые могут охватывать более 40 тысяч пар оснований. Недавние исследования показали, что фактическая частота ошибок может значительно превышать 10. −5 и может достигать 2% или 3% ошибок (коэффициент ошибок 2 или 3 x 10 −2 ) по ген. [27] [28] [29] Дополнительные исследования показывают, что частота ошибок составляет не менее 0,1% на интрон. [30] [31] Этот относительно высокий уровень ошибок сплайсинга объясняет, почему большинство вариантов сплайсинга быстро разрушаются в результате бессмысленного распада. [32] [33]
Наличие неаккуратных сайтов связывания внутри генов приводит к ошибкам сплайсинга, и может показаться странным, что эти сайты не были устранены естественным отбором. Аргументы в пользу их устойчивости аналогичны аргументам в пользу мусорной ДНК. [30] [34]
Хотя мутации, которые создают или разрушают сайты связывания, могут быть немного вредными, большое количество возможных таких мутаций делает неизбежным, что некоторые из них достигнут фиксации в популяции. Это особенно актуально для таких видов, как человек, с относительно небольшой эффективной численностью популяции в долгосрочной перспективе. Таким образом, вполне вероятно, что геном человека несет значительную нагрузку субоптимальных последовательностей, которые вызывают генерацию аберрантных изоформ транскриптов. В этом исследовании мы представляем прямые доказательства того, что это действительно так. [30]
Хотя каталитическая реакция может быть достаточно точной для эффективного процесса большую часть времени, общая частота ошибок может быть частично ограничена точностью транскрипции, поскольку ошибки транскрипции приводят к мутациям, которые создают загадочные сайты сплайсинга. Кроме того, частота ошибок транскрипции 10 −5 – 10 −6 настолько высок, что один из каждых 25 000 транскрибируемых экзонов будет иметь ошибку включения в одном из сайтов сплайсинга, приводящую к пропуску интрона или пропуска экзона. Почти все мультиэкзонные гены будут производить неправильно сплайсированные транскрипты, но частота этого фонового шума будет зависеть от размера генов, количества интронов и качества последовательностей сайтов сплайсинга. [28] [31]
В некоторых случаях варианты сплайсинга будут возникать в результате мутаций в гене (ДНК). Это могут быть полиморфизмы SNP, которые создают загадочный сайт сплайсинга или мутируют функциональный сайт. Это также могут быть мутации соматических клеток, влияющие на сплайсинг конкретной ткани или клеточной линии. [35] [36] [37] Когда мутантный аллель находится в гетерозиготном состоянии, это приведет к образованию двух обильных вариантов сплайсинга; один функциональный и один нефункциональный. В гомозиготном состоянии мутантные аллели могут вызывать генетическое заболевание, такое как гемофилия, обнаруженная у потомков королевы Виктории, когда мутация в одном из интронов гена фактора свертывания крови создает загадочный 3'-сайт сплайсинга, что приводит к аберрантному сплайсингу. [38] Значительная часть смертей людей от болезней может быть вызвана мутациями, мешающими нормальному сплайсингу; в основном путем создания загадочных сайтов сплайсинга. [39] [36]
Неправильно сплайсированные транскрипты можно легко обнаружить, а их последовательности ввести в онлайн-базы данных. Их обычно описывают как транскрипты с «альтернативным сплайсингом», что может сбивать с толку, поскольку этот термин не делает различия между реальным, биологически значимым, альтернативным сплайсингом и шумом обработки, возникающим из-за ошибок сплайсинга. Одной из центральных проблем в области альтернативного сплайсинга является определение различий между этими двумя возможностями. Многие ученые утверждают, что нулевая гипотеза должна быть шумом сплайсинга, возлагая бремя доказательства на тех, кто утверждает, что альтернативный сплайсинг биологически значим. По мнению этих ученых, заявление о функции должно сопровождаться убедительными доказательствами того, что несколько функциональных продуктов производятся одним и тем же геном. [40] [41]
и эволюция Биологические функции
Хотя интроны не кодируют белковые продукты, они являются неотъемлемой частью регуляции экспрессии генов. Некоторые интроны сами по себе кодируют функциональные РНК посредством дальнейшего процессинга после сплайсинга с образованием некодирующих молекул РНК. [42] Альтернативный сплайсинг широко используется для создания нескольких белков из одного гена. Более того, некоторые интроны играют важную роль в широком спектре функций регуляции экспрессии генов, таких как нонсенс-опосредованный распад. [43] и экспорт мРНК. [44]
После первоначального открытия интронов в генах, кодирующих белки эукариотического ядра, возникли серьезные споры о том, были ли интроны в современных организмах унаследованы от общего древнего предка (так называемая гипотеза ранних интронов) или они появились в гены сравнительно недавно вступили в эволюционный процесс (так называемая гипотеза позднего появления интронов). Другая теория состоит в том, что сплайсосома и интрон-экзонная структура генов являются пережитком мира РНК (гипотеза «сначала интроны»). [45] До сих пор ведутся серьезные споры о том, какая из этих гипотез наиболее правильна, но на данный момент общепринято мнение, что после образования первой эукариотической клетки интроны группы II бактериального эндосимбионта вторглись в геном хозяина. Вначале эти самосплайсинговые интроны вырезали себя из предшественника мРНК, но со временем некоторые из них утратили эту способность, и их вырезанию в транс-трансформации должны были способствовать другие интроны группы II. Со временем появилось несколько специфических транс-действующих интронов, которые стали предшественниками мяРНК сплайсосомы . Эффективность сплайсинга повышалась за счет ассоциации со стабилизирующими белками с образованием примитивной сплайсосомы. [46] [47] [48] [49]
Ранние исследования последовательностей геномной ДНК широкого круга организмов показывают, что интрон-экзонная структура гомологичных генов у разных организмов может сильно различаться. [50] Более поздние исследования полных эукариот геномов показали, что длина и плотность (интроны/ген) интронов значительно различаются между родственными видами. Например, в то время как геном человека содержит в среднем 8,4 интрона на ген (139 418 в геноме), одноклеточный гриб Encephalitozoon cuniculi содержит только 0,0075 интронов на ген (15 интронов в геноме). [51] Поскольку эукариоты произошли от общего предка ( общее происхождение ), в ходе эволюции должно было произойти значительное увеличение или потеря интронов. [52] [53] Считается, что этот процесс является предметом отбора с тенденцией к увеличению интронов у более крупных видов из-за их меньшего размера популяции и наоборот у более мелких (особенно одноклеточных) видов. [54] Биологические факторы также влияют на то, какие гены в геноме теряют или накапливают интроны. [55] [56] [57]
Альтернативный сплайсинг экзонов внутри гена после удаления интрона приводит к большей вариабельности белковых последовательностей, транслируемых из одного гена, позволяя генерировать множество родственных белков из одного гена и одного транскрипта мРНК-предшественника. Контроль альтернативного сплайсинга РНК осуществляется сложной сетью сигнальных молекул, которые реагируют на широкий спектр внутриклеточных и внеклеточных сигналов.
Интроны содержат несколько коротких последовательностей, которые важны для эффективного сплайсинга, таких как акцепторные и донорные сайты на обоих концах интрона, а также сайт точки ветвления, которые необходимы для правильного сплайсинга сплайсосомой . Известно, что некоторые интроны усиливают экспрессию гена, в котором они содержатся, посредством процесса, известного как интрон-опосредованное усиление (IME).
Активно транскрибируемые участки ДНК часто образуют R-петли , уязвимые для повреждения ДНК . В генах дрожжей с высокой экспрессией интроны ингибируют образование R-петли и возникновение повреждений ДНК. [58] Полногеномный анализ как у дрожжей, так и у людей показал, что интрон-содержащие гены снижают уровни R-петли и уменьшают повреждение ДНК по сравнению с безинтронными генами с аналогичной экспрессией. [58] Вставка интрона в ген, склонный к R-петле, также может подавлять образование и рекомбинацию R-петли . Боннет и др. (2017) [58] предположили, что функция интронов по поддержанию генетической стабильности может объяснить их эволюционное сохранение в определенных местах, особенно в генах с высокой экспрессией.
Адаптация к голоданию [ править ]
Физическое присутствие интронов способствует клеточной устойчивости к голоданию за счет усиленной интронами репрессии генов рибосомальных белков путей восприятия питательных веществ. [59]
Как мобильные генетические элементы [ править ]
Интроны могут теряться или приобретаться в ходе эволюции, как показывают многие сравнительные исследования ортологичных генов. Последующие анализы выявили тысячи примеров событий потери и приобретения интронов, и было высказано предположение, что появление эукариотов или начальные стадии эволюции эукариот включало вторжение интронов. [60] Были идентифицированы и известны два окончательных механизма потери интронов: потеря интронов, опосредованная обратной транскриптазой (RTMIL) и геномные делеции. [61] Однако окончательные механизмы приобретения интронов остаются неуловимыми и спорными. На данный момент известно как минимум семь механизмов усиления интронов: транспозиция интрона, вставка транспозона, тандемная геномная дупликация, перенос интрона, усиление интрона во время репарации двухцепочечного разрыва (DSBR), вставка интрона группы II и интронизация. Теоретически, происхождение недавно полученных интронов должно быть проще всего определить из-за отсутствия мутаций, вызванных хозяином, однако даже недавно полученные интроны не возникли ни в одном из вышеупомянутых механизмов. Эти результаты, таким образом, поднимают вопрос о том, не могут ли предложенные механизмы увеличения интронов описать механистическое происхождение многих новых интронов, потому что они не являются точными механизмами увеличения интронов, или же существуют другие, еще не открытые процессы, генерирующие новые интроны. интроны. [62]
При транспозиции интрона, наиболее часто предполагаемом механизме получения интрона, считается, что сплайсированный интрон осуществляет обратный сплайсинг либо в свою собственную мРНК, либо в другую мРНК в положении, в котором ранее не было интронов. Эта содержащая интрон мРНК затем подвергается обратной транскрипции, и полученная в результате содержащая интрон кДНК может затем вызывать получение интрона посредством полной или частичной рекомбинации с его исходным геномным локусом.
Было показано, что вставки транспозонов генерируют тысячи новых интронов у различных видов эукариот. [63] Вставки транспозонов иногда приводят к дублированию этой последовательности на каждой стороне транспозона. Такая вставка могла бы интронизировать транспозон без нарушения кодирующей последовательности, когда транспозон встраивается в последовательность AGGT или кодирует сайты сплайсинга в последовательности транспозона. Если транспозоны, генерирующие интрон, не создают дублирования сайта-мишени, элементы включают оба сайта сплайсинга GT (5') и AG (3'), таким образом осуществляя точный сплайсинг, не затрагивая последовательность, кодирующую белок. [63] Пока не понятно, почему эти элементы сращиваются: случайно или в результате какого-то предпочтительного действия транспозона.
При тандемной геномной дупликации из-за сходства консенсусных донорных и акцепторных сайтов сплайсинга, которые оба очень напоминают AGGT, тандемная геномная дупликация экзонного сегмента, содержащего последовательность AGGT, генерирует два потенциальных сайта сплайсинга. При распознавании сплайсосомой последовательность между исходным и дублированным AGGT будет сращена, что приведет к созданию интрона без изменения кодирующей последовательности гена. Репарация двухцепочечных разрывов посредством негомологичного соединения концов была недавно идентифицирована как источник прироста интронов, когда исследователи выявили короткие прямые повторы, фланкирующие 43% полученных интронов у дафний. [62] Однако для статистической значимости эти числа необходимо сравнить с количеством консервативных интронов, окруженных повторами в других организмах. Было высказано предположение, что для вставки интрона группы II ретрохоминг интрона группы II в ядерный ген вызывает недавнее увеличение сплайсосомного интрона.
Было высказано предположение, что перенос интрона приводит к увеличению интрона, когда паралог или псевдоген получает интрон, а затем переносит этот интрон посредством рекомбинации в место, где отсутствует интрон, в его сестринском паралоге. Интронизация — это процесс, посредством которого мутации создают новые интроны из ранее экзонной последовательности. Таким образом, в отличие от других предложенных механизмов усиления интронов, этот механизм не требует вставки или генерации ДНК для создания нового интрона. [62]
Единственный гипотетический механизм недавнего прироста интронов, не имеющий каких-либо прямых доказательств, - это механизм вставки интронов группы II, который, продемонстрированный in vivo, отменяет экспрессию генов. [64] Таким образом, интроны группы II, вероятно, являются предполагаемыми предками сплайсосомных интронов, действуют как сайт-специфические ретроэлементы и больше не несут ответственности за прирост интронов. [65] [66] Тандемная геномная дупликация — единственный предложенный механизм, подтверждающий экспериментальные данные in vivo: короткая внутригенная тандемная дупликация может вставлять новый интрон в ген, кодирующий белок, оставляя соответствующую пептидную последовательность неизменной. [67] Этот механизм также имеет обширные косвенные доказательства, подтверждающие идею о том, что тандемная геномная дупликация является распространенным механизмом получения интронов. Возможно тестирование других предложенных механизмов in vivo, в частности получения интронов во время DSBR, переноса интронов и интронизации, хотя эти механизмы должны быть продемонстрированы in vivo, чтобы закрепить их как реальные механизмы получения интронов. Дальнейший геномный анализ, особенно на уровне популяции, может затем количественно оценить относительный вклад каждого механизма, возможно, выявляя видоспецифичные предубеждения, которые могут пролить свет на различные скорости увеличения интронов у разных видов. [62]
См. также [ править ]
Структура:
Сращивание:
Функция
Другие:
- Перетасовка экзонов
- Интеин
- Некодирующая ДНК
- Некодирующая РНК
- Эгоистичная ДНК
- Твинтрон
- Экзон-интронная база данных
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б «Представление о цистроне [т.е. гене]... должно быть заменено понятием транскрипционной единицы, содержащей области, которые будут потеряны из зрелого мессенджера – которые я предлагаю называть интронами (для внутригенных областей) – чередующиеся с областями, которые будут выражены – экзоны». (Гилберт, 1978) Гилберт В. (февраль 1978 г.). «Почему гены разбиты на кусочки?» . Природа . 271 (5645): 501. Бибкод : 1978Natur.271..501G . дои : 10.1038/271501a0 . ПМИД 622185 . S2CID 4216649 .
- ^ Киннибург А.Дж., Мерц Дж.Э., Росс Дж. (июль 1978 г.). «Предшественник информационной РНК бета-глобина мыши содержит две промежуточные последовательности РНК». Клетка . 14 (3): 681–693. дои : 10.1016/0092-8674(78)90251-9 . ПМИД 688388 . S2CID 21897383 .
- ^ Левин Б. (1987). Гены (3-е изд.). Нью-Йорк: Уайли. стр. 159–179, 386. ISBN. 0-471-83278-2 . ОСЛК 14069165 .
- ^ Чоу Л.Т., Гелинас Р.Э., Брокер Т.Р., Робертс Р.Дж. (сентябрь 1977 г.). «Удивительное расположение последовательностей на 5'-концах информационной РНК аденовируса 2». Клетка . 12 (1): 1–8. дои : 10.1016/0092-8674(77)90180-5 . ПМИД 902310 . S2CID 2099968 .
- ^ Бергет С.М., Мур С., Шарп П.А. (август 1977 г.). «Сплайсированные сегменты на 5'-конце поздней мРНК аденовируса 2» . Труды Национальной академии наук Соединенных Штатов Америки . 74 (8): 3171–3175. Бибкод : 1977PNAS...74.3171B . дои : 10.1073/pnas.74.8.3171 . ПМЦ 431482 . ПМИД 269380 .
- ^ Белфорт М. , Педерсен-Лейн Дж., Уэст Д., Эренман К., Мэйли Дж., Чу Ф., Мали Ф. (июнь 1985 г.). «Процессинг интронсодержащего гена тимидилатсинтазы (td) фага Т4 происходит на уровне РНК». Клетка . 41 (2): 375–382. дои : 10.1016/s0092-8674(85)80010-6 . ПМИД 3986907 . S2CID 27127017 .
- ^ «Нобелевская премия по физиологии и медицине 1993 года» .
- ^ Тонегава С., Максам А.М., Тизард Р., Бернард О., Гилберт В. (март 1978 г.). «Последовательность гена зародышевой линии мыши для вариабельной области легкой цепи иммуноглобулина» . Труды Национальной академии наук Соединенных Штатов Америки . 75 (3): 1485–1489. Бибкод : 1978PNAS...75.1485T . дои : 10.1073/pnas.75.3.1485 . ПМЦ 411497 . ПМИД 418414 .
- ^ Тилман С.М., Тимейер Д.С., Зейдман Дж.Г., Петерлин Б.М., Салливан М., Майзель Дж.В., Ледер П. (февраль 1978 г.). «Промежуточная последовательность ДНК, идентифицированная в структурной части гена бета-глобина мыши» . Труды Национальной академии наук Соединенных Штатов Америки . 75 (2): 725–729. Бибкод : 1978PNAS...75..725T . дои : 10.1073/pnas.75.2.725 . ПМЦ 411329 . ПМИД 273235 .
- ^ Стаич Дж.Э., Дитрих Ф.С., Рой С.В. (2007). «Сравнительный геномный анализ геномов грибов выявил богатых интронами предков» . Геномная биология . 8 (10): 223 р. дои : 10.1186/gb-2007-8-10-r223 . ПМК 2246297 . ПМИД 17949488 .
- ^ Таанман Дж. В. (февраль 1999 г.). «Митохондриальный геном: структура, транскрипция, трансляция и репликация». Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1410 (2): 103–123. дои : 10.1016/s0005-2728(98)00161-3 . ПМИД 10076021 . S2CID 19229072 .
- ^ Толлервей Д., Касерес Дж. Ф. (ноябрь 2000 г.). «Процессинг РНК продолжается» . Клетка . 103 (5): 703–709. дои : 10.1016/S0092-8674(00)00174-4 . ПМИД 11114327 .
- ^ Рюгельс А.М., Курек Р., Ламмерманн У., Бюнеманн Х. (февраль 2000 г.). «Мега-интроны в гене динеина DhDhc7(Y) на гетерохроматической Y-хромосоме дают начало петлям гигантских нитей в первичных сперматоцитах Drosophila hydei» . Генетика . 154 (2): 759–769. дои : 10.1093/генетика/154.2.759 . ПМК 1460963 . ПМИД 10655227 .
- ^ Пиовесан А., Каракаузи М., Риччи М., Стрипполи П., Витале Л., Пеллери М.К. (декабрь 2015 г.). «Идентификация минимальных эукариотических интронов с помощью GeneBase, удобного инструмента для анализа банка данных генов NCBI» . Исследование ДНК . 22 (6): 495–503. дои : 10.1093/dnares/dsv028 . ПМЦ 4675715 . ПМИД 26581719 .
- ^ Слабодник М.М., Руби Дж.Г., Рейфф С.Б., Сварт Э.К., Госай С., Прабакаран С. и др. (февраль 2017 г.). «Макроядерный геном Stentor coeruleus обнаруживает крошечные интроны в гигантской клетке» . Современная биология . 27 (4): 569–575. дои : 10.1016/j.cub.2016.12.057 . ПМЦ 5659724 . ПМИД 28190732 .
- ^ Копертино Д.В., Халлик Р.Б. (декабрь 1993 г.). «Интроны группы II и группы III твинтронов: потенциальные связи с интронами ядерной пре-мРНК». Тенденции биохимических наук . 18 (12): 467–471. дои : 10.1016/0968-0004(93)90008-б . ПМИД 8108859 .
- ^ Паджетт Р.А., Грабовски П.Дж., Конарска М.М., Зайлер С., Шарп П.А. (1986). «Сплайсинг предшественников информационной РНК». Ежегодный обзор биохимии . 55 : 1119–1150. дои : 10.1146/annurev.bi.55.070186.005351 . ПМИД 2943217 .
- ^ Гатри С., Паттерсон Б. (1988). «Сплайсосомные мяРНК». Ежегодный обзор генетики . 22 : 387–419. дои : 10.1146/annurev.ge.22.120188.002131 . ПМИД 2977088 .
- ^ Грир К.Л., Пиблс К.Л., Гегенхаймер П., Абельсон Дж. (февраль 1983 г.). «Механизм действия дрожжевой РНК-лигазы при сплайсинге тРНК». Клетка . 32 (2): 537–546. дои : 10.1016/0092-8674(83)90473-7 . ПМИД 6297798 . S2CID 44978152 .
- ^ Рейнхольд-Хурек Б., Шуб Д.А. (май 1992 г.). «Самосплайсинг интронов в генах тРНК широко расходящихся бактерий». Природа . 357 (6374): 173–176. Бибкод : 1992Natur.357..173R . дои : 10.1038/357173a0 . ПМИД 1579169 . S2CID 4370160 .
- ^ Чех ТР (1990). «Самосплайсинг интронов группы I». Ежегодный обзор биохимии . 59 : 543–568. дои : 10.1146/annurev.bi.59.070190.002551 . ПМИД 2197983 .
- ^ Мишель Ф., Ферат Дж.Л. (1995). «Строение и активность интронов группы II». Ежегодный обзор биохимии . 64 : 435–461. дои : 10.1146/annurev.bi.64.070195.002251 . ПМИД 7574489 .
- ^ Ван Р., Бай Р., Чжан Х, Ши Ю (2020). «Как информационная РНК-предшественница сплайсируется сплайсосомой?». Ежегодный обзор биохимии . 89 : 333–358. doi : 10.1146/annurev-biochem-013118-111024 . ПМИД 31815536 . S2CID 209167227 .
- ^ Уилкинсон М.Э., Чарентон С., Нагай К. (2020). «Сплайсинг РНК с помощью сплайсосомы». Ежегодный обзор биохимии . 89 : 359–388. doi : 10.1146/annurev-biochem-091719-064225 . ПМИД 31794245 . S2CID 208626110 .
- ^ Сейлз-Ли Дж., Перри Д.С., Баузер Б.А., Дидрих Дж.К., Рао Б., Беуш I, Йейтс III JR, Рой С.В., Мадхани HD (2021). «Сочетание сложности сплайсосом с разнообразием интронов» . Современная биология . 31 (22): 4898–4910 e4894. дои : 10.1016/j.cub.2021.09.004 . ПМЦ 8967684 . ПМИД 34555349 . S2CID 237603074 .
- ^ Сюй С.Н., Хертель К.Дж. (2009). «Сплайсосомы выходят на первый план: ошибки сплайсинга и их влияние на клеточные функции» . Биология РНК . 6 (5): 526–530. дои : 10.4161/rna.6.5.9860 . ПМЦ 3912188 . ПМИД 19829058 . S2CID 22592978 .
- ^ Меламуд Э., Моулт Дж (2009). «Стохастический шум в сварочных машинах» . Исследования нуклеиновых кислот . гкп471 (14): 4873–4886. дои : 10.1093/nar/gkp471 . ПМЦ 2724286 . ПМИД 19546110 .
- ↑ Перейти обратно: Перейти обратно: а б Фокс-Уолш К.Л., Хертель К.Дж. (2009). «Спаривание мест сращивания — это процесс с высокой точностью воспроизведения» . Труды Национальной академии наук . 106 (6): 1766–1771. Бибкод : 2009PNAS..106.1766F . дои : 10.1073/pnas.0813128106 . ПМК 2644112 . ПМИД 19179398 .
- ^ Степанкив Н., Рагхаван М., Фогарти Э.А., Гримсон А., Плейсс Дж.А. (2015). «Распространённый альтернативный и аберрантный сплайсинг, выявленный с помощью лариатного секвенирования» . Исследования нуклеиновых кислот . 43 (17): 8488–8501. дои : 10.1093/nar/gkv763 . ПМЦ 4787815 . ПМИД 26261211 .
- ↑ Перейти обратно: Перейти обратно: а б с Пикрелл Дж.К., Пай А.А., Гилад Ю., Притчард Дж.К. (2010). «Шумный сплайсинг стимулирует разнообразие изоформ мРНК в клетках человека» . ПЛОС Генет . 6 (12): e1001236. дои : 10.1371/journal.pgen.1001236 . ПМЦ 3000347 . ПМИД 21151575 .
- ↑ Перейти обратно: Перейти обратно: а б Скандалис А (2016). «Оценка минимальной частоты ошибок сплайсинга мРНК у позвоночных» . Мутационные исследования/Фундаментальные и молекулярные механизмы мутагенеза . 784 (1713): 34–38. дои : 10.1098/rstb.2015.0474 . ПМК 5182408 . ПМИД 27994117 .
- ^ Чжан З, Синь Д., Ван П., Чжоу Л., Ху Л., Конг Х., Херст Л.Д. (2009). «Шумный сплайсинг, а не регуляция экспрессии, объясняет, почему некоторые экзоны подвержены нонсенс-опосредованному распаду мРНК» . БМК Биология . 7:23 . дои : 10.1186/1741-7007-7-23 . ПМК 2697156 . ПМИД 19442261 .
- ^ Биттон Д.А., Аткинсон С.Р., Раллис С., Смит Г.К., Эллис Д.А., Чен Ю.Ю., Малецки М., Кодлин С., Лемэй Дж.Ф., Котобал С. (2015). «Широко распространенный пропуск экзонов вызывает деградацию ядерной РНК у делящихся дрожжей» . Геномные исследования . 25 (6): 884–896. дои : 10.1101/гр.185371.114 . ПМЦ 4448684 . ПМИД 25883323 .
- ^ Саудемон Б., Попа А., Пармли Дж.Л., Роше В., Блюжен С., Нексулеа А., Мейер Э., Дюре Л. (2017). «Цена пригодности неправильного сращивания является основным фактором, определяющим альтернативные схемы сращивания» . Геномная биология . 18 (1): 208. дои : 10.1186/s13059-017-1344-6 . ПМК 5663052 . ПМИД 29084568 .
- ^ Скотти М.М., Суонсон М.С. (2016). «Неправильный сплайсинг РНК при заболеваниях» . Обзоры природы Генетика . 17 (1): 19–32. дои : 10.1038/nrg.2015.3 . ПМЦ 5993438 . ПМИД 26593421 .
- ↑ Перейти обратно: Перейти обратно: а б Ширли Б., Мукаки Э., Роган П. (2019). «Панраковое хранилище подтвержденных природных и загадочных мутаций сплайсинга мРНК» . F1000Исследования . 7 : 1908. doi : 10.12688/f1000research.17204.3 . ПМК 6544075 . ПМИД 31275557 . S2CID 202702147 .
- ^ Мукаки Э.Дж., Ширли БК, Роган П.К. (2020). «Изменения экспрессии подтверждают наличие геномных вариантов, которые, по прогнозам, приведут к аллель-специфичному альтернативному сплайсингу мРНК» . Границы генетики . 11 : 109. дои : 10.3389/fgene.2020.00109 . ПМК 7066660 . ПМИД 32211018 .
- ^ Рогаев Е.И., Григоренко А.П., Фасхутдинова Г., Киттлер Э.Л., Моляка Ю.К. (2009). «Анализ генотипа выявил причину «королевской болезни» » . Наука . 326 (5954): 817. Бибкод : 2009Sci...326..817R . дои : 10.1126/science.1180660 . ПМИД 19815722 . S2CID 206522975 .
- ^ Линч М. (2010). «Скорость, молекулярный спектр и последствия человеческой мутации» . Труды Национальной академии наук . 107 (3): 961–968. Бибкод : 2010PNAS..107..961L . дои : 10.1073/pnas.0912629107 . ПМЦ 2824313 . ПМИД 20080596 .
- ^ Мадж Дж. М., Харроу Дж. (2016). «Состояние аннотации генов высших эукариот» . Обзоры природы Генетика . 17 (12): 758–772. дои : 10.1038/nrg.2016.119 . ПМЦ 5876476 . ПМИД 27773922 .
- ^ Бхуян С.А., Ли С., Фан М., Хантингтон Б., Хоган Э., Лю CC, Лю Дж., Павлидис П. (2018). «Систематическая оценка функции изоформы в литературных отчетах об альтернативном сплайсинге» . БМК Геномика . 19 (1): 637. doi : 10.1186/s12864-018-5013-2 . ПМК 6114036 . ПМИД 30153812 .
- ^ Ририк Д., Пракаш А., Максвини А., Шепард С.С., Федорова Л., Федоров А. (март 2011 г.). «Критическая ассоциация нкРНК с интронами» . Исследования нуклеиновых кислот . 39 (6): 2357–2366. дои : 10.1093/nar/gkq1080 . ПМК 3064772 . ПМИД 21071396 .
- ^ Бикнелл А.А., Сеник С., Чуа Х.Н., Рот Ф.П., Мур М.Дж. (декабрь 2012 г.). «Интроны в НТО: почему мы должны перестать их игнорировать» . Биоэссе . 34 (12): 1025–1034. doi : 10.1002/bies.201200073 . ПМИД 23108796 . S2CID 5808466 .
- ^ Ченик С., Чуа Х.Н., Чжан Х., Тарнавски С.П., Акеф А., Дерти А. и др. (апрель 2011 г.). Снайдер М. (ред.). «Анализ генома показывает взаимодействие между интронами 5'UTR и экспортом ядерной мРНК для секреторных и митохондриальных генов» . ПЛОС Генетика . 7 (4): e1001366. дои : 10.1371/journal.pgen.1001366 . ПМК 3077370 . ПМИД 21533221 .
- ^ Пенни Д., член парламента Хоппнера, Пул А.М., Джеффарес, округ Колумбия (ноябрь 2009 г.). «Обзор теории приоритета интронов». Журнал молекулярной эволюции . 69 (5): 527–540. Бибкод : 2009JMolE..69..527P . дои : 10.1007/s00239-009-9279-5 . ПМИД 19777149 . S2CID 22386774 .
- ^ Кавалер-Смит Т. (1991). «Интронная филогения: новая гипотеза». Тенденции в генетике . 7 (5): 145–148. дои : 10.1016/0168-9525(91)90377-3 . ПМИД 2068786 .
- ^ Дулитл В.Ф. (1991). «Происхождение интронов». Современная биология . 1 (3): 145–146. дои : 10.1016/0960-9822(91)90214-h . ПМИД 15336149 . S2CID 35790897 .
- ^ Шарп ПА (1991). « Пять простых штук. (Роль РНК-катализа в клеточных процессах)». Наука . 254 (5032): 663–664. дои : 10.1126/science.1948046 . ПМИД 1948046 . S2CID 508870 .
- ^ Иримия М. и Рой С.В. (2014). «Происхождение сплайсосомных интронов и альтернативный сплайсинг» . Перспективы Колд-Спринг-Харбор в биологии . 6 (6): а016071. doi : 10.1101/cshperspect.a016071 . ПМК 4031966 . ПМИД 24890509 .
- ^ Родригес-Треллес Ф., Таррио Р., Аяла Ф.Дж. (2006). «Происхождение и эволюция сплайсосомных интронов». Ежегодный обзор генетики . 40 : 47–76. дои : 10.1146/annurev.genet.40.110405.090625 . ПМИД 17094737 .
- ^ Мурье Т., Джеффарес, округ Колумбия (май 2003 г.). «Потеря эукариотического интрона». Наука . 300 (5624): 1393. doi : 10.1126/science.1080559 . ПМИД 12775832 . S2CID 7235937 .
- ^ Рой С.В., Гилберт В. (март 2006 г.). «Эволюция сплайсосомных интронов: закономерности, загадки и прогресс». Обзоры природы. Генетика . 7 (3): 211–221. дои : 10.1038/nrg1807 . ПМИД 16485020 . S2CID 33672491 .
- ^ де Соуза SJ (июль 2003 г.). «Появление синтетической теории эволюции интронов». Генетика . 118 (2–3): 117–121. дои : 10.1023/A:1024193323397 . ПМИД 12868602 . S2CID 7539892 .
- ^ Линч М. (апрель 2002 г.). «Эволюция интронов как популяционно-генетический процесс» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (9): 6118–6123. Бибкод : 2002PNAS...99.6118L . дои : 10.1073/pnas.092595699 . ПМЦ 122912 . ПМИД 11983904 .
- ^ Джеффарес, округ Колумбия, Мурье Т., Пенни Д. (январь 2006 г.). «Биология приобретения и потери интронов». Тенденции в генетике . 22 (1): 16–22. дои : 10.1016/j.tig.2005.10.006 . ПМИД 16290250 .
- ^ Джеффарес, округ Колумбия, Пенкетт С.Дж., Бэлер Дж. (август 2008 г.). «Быстрорегулируемые гены бедны интронами». Тенденции в генетике . 24 (8): 375–378. дои : 10.1016/j.tig.2008.05.006 . ПМИД 18586348 .
- ^ Кастильо-Дэвис С.И., Мехедов С.Л., Хартл Д.Л., Кунин Е.В., Кондрашов Ф.А. (август 2002 г.). «Отбор коротких интронов в высокоэкспрессируемых генах» . Природная генетика . 31 (4): 415–418. дои : 10.1038/ng940 . ПМИД 12134150 . S2CID 9057609 .
- ↑ Перейти обратно: Перейти обратно: а б с Боннет А., Гроссо А.Р., Элькаутари А., Колено Е., Пресле А., Шридхара С.К. и др. (август 2017 г.). «Интроны защищают геномы эукариот от генетической нестабильности, связанной с транскрипцией» . Молекулярная клетка . 67 (4): 608–621.e6. doi : 10.1016/j.molcel.2017.07.002 . ПМИД 28757210 .
- ^ Паренто Ж, Менньон Л, Бертумье М, Катала М, Ганьон В, Абу Элела С (январь 2019 г.). «Интроны являются медиаторами клеточного ответа на голодание». Природа . 565 (7741): 612–617. Бибкод : 2019Natur.565..612P . дои : 10.1038/s41586-018-0859-7 . ПМИД 30651641 . S2CID 58014466 .
- ^ Рогозин И.Б., Кармель Л. , Чурос М., Кунин Е.В. (апрель 2012 г.). «Происхождение и эволюция сплайсосомных интронов» . Биология Директ . 7:11 . дои : 10.1186/1745-6150-7-11 . ПМЦ 3488318 . ПМИД 22507701 .
- ^ Дерр Л.К., Стратерн Дж.Н. (январь 1993 г.). «Роль обратных транскриптов в преобразовании генов» . Природа . 361 (6408): 170–173. Бибкод : 1993Natur.361..170D . дои : 10.1038/361170a0 . ПМИД 8380627 . S2CID 4364102 .
- ↑ Перейти обратно: Перейти обратно: а б с д Йенерал П., Чжоу Л. (сентябрь 2012 г.). «Выявление механизмов усиления интронов: прогресс и тенденции» . Биология Директ . 7:29 . дои : 10.1186/1745-6150-7-29 . ПМЦ 3443670 . ПМИД 22963364 .
- ↑ Перейти обратно: Перейти обратно: а б Гозашти Л., Рой С., Торнлоу Б., Крамер А., Арес М., Корбетт-Детиг Р. (ноябрь 2022 г.). «Мобильные элементы способствуют увеличению количества интронов у различных эукариот» . ПНАС . 119 (48): 48. дои : 10.1073/pnas.2209766119 . ПМЦ 9860276 . ПМИД 36417430 .
- ^ Чаламчарла В.Р., Курсио М.Дж., Белфорт М. (апрель 2010 г.). «Ядерная экспрессия интрона группы II соответствует происхождению сплайсосомного интрона» . Гены и развитие . 24 (8): 827–836. дои : 10.1101/gad.1905010 . ПМЦ 2854396 . ПМИД 20351053 .
- ^ Чех ТР (январь 1986 г.). «Общность самосплайсинга РНК: связь со сплайсингом ядерной мРНК». Клетка . 44 (2): 207–210. дои : 10.1016/0092-8674(86)90751-8 . ПМИД 2417724 . S2CID 11652546 .
- ^ Диксон Л., Хуанг Х.Р., Лю Л., Мацуура М., Ламбовиц А.М., Перлман П.С. (ноябрь 2001 г.). «Ретротранспозиция интрона дрожжевой группы II происходит путем обратного сплайсинга непосредственно в эктопические участки ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (23): 13207–13212. Бибкод : 2001PNAS...9813207D . дои : 10.1073/pnas.231494498 . ПМК 60849 . ПМИД 11687644 .
- ^ Хеллстен У., Аспден Дж.Л., Рио, округ Колумбия, Рохсар Д.С. (август 2011 г.). «Сегментарная геномная дупликация генерирует функциональный интрон» . Природные коммуникации . 2 : 454. Бибкод : 2011NatCo...2..454H . дои : 10.1038/ncomms1461 . ПМЦ 3265369 . ПМИД 21878908 .
Внешние ссылки [ править ]
- Поисковая система для последовательностей экзонов и интронов, определенных NCBI.
- Брюс Альбертс, Александр Джонсон, Джулиан Льюис, Мартин Рафф, Кейт Робертс и Питер Уолтер Молекулярная биология клетки , 2007 г., ISBN 978-0-8153-4105-5 . Четвертое издание доступно онлайн на книжной полке NCBI: ссылка
- Джереми М. Берг, Джон Л. Тимочко и Люберт Страйер, Биохимия, 5-е издание, 2002 г., WH Freeman. Доступно онлайн на книжной полке NCBI: ссылка
- Инструмент для поиска интронов в геномных последовательностях растений
- Производитель экзон-интронной графики