Редактирование РНК
В этой статье отсутствует информация о псевдоурациле. ( декабрь 2020 г. ) |
| Часть серии о |
| Генетика |
|---|
 |
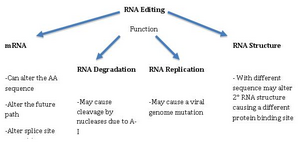
Редактирование РНК (также модификация РНК ) — это молекулярный процесс, посредством которого некоторые клетки могут вносить дискретные изменения в определенные нуклеотидные последовательности внутри молекулы РНК после того, как она была сгенерирована РНК-полимеразой . Он встречается во всех живых организмах и является одним из наиболее эволюционно консервативных свойств РНК . [1] [2] [3] Редактирование РНК может включать вставку, удаление и замену оснований нуклеотидов внутри молекулы РНК. Редактирование РНК встречается относительно редко, при этом распространенные формы процессинга РНК (например , сплайсинг , 5'- кэпирование и 3'- полиаденилирование ) обычно не считаются редактированием. Он может влиять на активность, локализацию и стабильность РНК и связан с заболеваниями человека. [1] [2] [3] [4]
Редактирование РНК наблюдалось в некоторых тРНК , рРНК , мРНК или микроРНК молекулах эукариот и их вирусов , архей и прокариот . [5] Редактирование РНК происходит в ядре клетки, а также внутри митохондрий и пластид . У позвоночных редактирование встречается редко и обычно состоит из небольшого количества изменений последовательности затронутых молекул. У других организмов, например у кальмаров , [6] обширное редактирование ( пан-редактирование может произойти ); в некоторых случаях большинство нуклеотидов в последовательности мРНК может быть результатом редактирования. К настоящему времени описано более 160 типов модификаций РНК. [7]
Процессы редактирования РНК демонстрируют большое молекулярное разнообразие, и некоторые из них кажутся эволюционно недавними приобретениями, возникшими независимо. Разнообразие явлений редактирования РНК включает модификации нуклеиновых оснований , такие как дезаминирование цитидина (C) в уридин (U) и аденозина (A) в инозин (I) дезаминирование , а также нематричные добавления и вставки нуклеотидов. Редактирование РНК в мРНК эффективно изменяет аминокислотную последовательность кодируемого белка так, что она отличается от той, которая предсказывается последовательностью геномной ДНК. [8]
Обнаружение редактирования РНК
[ редактировать ]Секвенирование нового поколения
[ редактировать ]Для идентификации разнообразных посттранскрипционных модификаций молекул РНК и определения полнотранскриптомного ландшафта модификаций РНК посредством секвенирования РНК нового поколения в последнее время во многих исследованиях были разработаны традиционные методы. [9] или специализированные методы секвенирования. [1] [2] [3] Примерами специализированных методов являются MeRIP-seq , [10] м6А-сек, [11] ПА-м 5 C-seq [12] , метилирование-iCLIP, [13] м6А-КЛИП, [14] Псевдо-последовательность, [15] Ψ-сек, [16] CeU-сек, [17] Аза-ИП [18] и РибоМет-сек. [19] ). Многие из этих методов основаны на специфическом захвате видов РНК, содержащих конкретную модификацию, например, посредством связывания антител в сочетании с секвенированием захваченных прочтений. После секвенирования эти прочтения сопоставляются со всем транскриптомом, чтобы увидеть, откуда они происходят. [20] Обычно при таком подходе можно увидеть расположение модификаций вместе с возможной идентификацией некоторых консенсусных последовательностей, которые могут помочь в дальнейшей идентификации и картировании. Одним из примеров специализированных методов является PA-m. 5 C-послед. Этот метод получил дальнейшее развитие от PA-m. 6 Метод A-seq для идентификации м 5 Модификации C мРНК вместо исходного целевого N6-метиладенозина. Легкое переключение между различными модификациями в качестве мишени становится возможным благодаря простой смене формы захватывающего антитела m6A, специфичной для m. 5 C специфический. [12] Применение этих методов позволило выявить различные модификации (например, псевдоуридин, м. 6 A , m5C, 2'-O-Me) внутри кодирующих генов и некодирующих генов (например, тРНК, днРНК, микроРНК) в одном нуклеотиде или с очень высоким разрешением. [4]
Масс-спектрометрия
[ редактировать ]Масс-спектрометрия — это способ количественной оценки модификаций РНК. [21] Чаще всего модификации вызывают увеличение массы данного нуклеозида. Это дает характерные показания для нуклеозида и модифицированного аналога. [21] Более того, масс-спектрометрия позволяет исследовать динамику модификаций путем мечения молекул РНК стабильными (нерадиоактивными) тяжелыми изотопами in vivo . Благодаря определенному увеличению массы нуклеозидов, меченных тяжелыми изотопами, их можно отличить от соответствующих немеченых изотопомеров с помощью масс-спектрометрии. Этот метод, называемый NAIL-MS (масс-спектрометрия с мечением изотопов нуклеиновых кислот), позволяет использовать различные подходы к исследованию динамики модификации РНК. [22] [23] [24]
Типы РНК
[ редактировать ]Модификация мессенджерной РНК
[ редактировать ]Недавно функциональные эксперименты выявили множество новых функциональных ролей модификаций РНК. Большинство модификаций РНК обнаружено в транспортных РНК и рибосомальных РНК, но также было показано, что эукариотическая мРНК модифицируется множеством различных модификаций. Было идентифицировано 17 встречающихся в природе модификаций мРНК, из которых N6-метиладенозин является наиболее распространенным и изученным. [25] Модификации мРНК связаны со многими функциями клетки. Они обеспечивают правильное созревание и функцию мРНК, но в то же время действуют как часть иммунной системы клетки. [26] Определенные модификации, такие как 2'O-метилированные нуклеотиды, связаны со способностью клеток отличать собственную мРНК от чужеродной РНК. [27] Например, м 6 Было предсказано, что А влияет на трансляцию и локализацию белка. [1] [2] [3] стабильность мРНК, [28] alternative polyA choice [14] и плюрипотентность стволовых клеток. [29] Псевдоуридилирование нонсенс-кодонов подавляет терминацию трансляции как in vitro , так и in vivo , что позволяет предположить, что модификация РНК может обеспечить новый способ расширения генетического кода. [30] С другой стороны, 5-метилцитозин связан с транспортом мРНК из ядра в цитоплазму и усилением трансляции. Эти функции m 5 C не полностью известны и доказаны, но одним сильным аргументом в пользу этих функций в клетке является наблюдаемая локализация m 5 C на сайт инициации трансляции. [31] Важно отметить, что при многих типах заболеваний многие модифицирующие ферменты не регулируются и генетически мутируют. [1] Например, генетические мутации псевдоуридинсинтаз вызывают митохондриальную миопатию, сидеробластную анемию (MLASA). [32] и врожденный дискератоз. [33]
По сравнению с модификациями, выявленными в других видах РНК, таких как тРНК и рРНК, количество выявленных модификаций мРНК очень мало. Одной из основных причин, почему модификации мРНК не так хорошо известны, является отсутствие методов исследования. Помимо отсутствия выявленных модификаций, знание ассоциированных белков также отстает от других видов РНК. Модификации являются результатом специфических взаимодействий фермента с молекулой РНК. [25] Что касается модификаций мРНК, большинство известных родственных ферментов являются ферментами-писателями, которые добавляют модификацию мРНК. Дополнительные группы ферментных считывателей и ластиков для большинства модификаций либо плохо известны, либо вообще не известны. [34] По этим причинам в течение последнего десятилетия возник огромный интерес к изучению этих модификаций и их функций. [20]
Модификации транспортной РНК
[ редактировать ]Транспортная РНК или тРНК является наиболее широко модифицированным типом РНК. [35] Модификации тРНК играют решающую роль в поддержании эффективности трансляции посредством поддерживающей структуры, взаимодействий антикодонов-кодонов и взаимодействия с ферментами. [36]
Модификации антикодонов важны для правильного декодирования мРНК. Поскольку генетический код вырожден, для правильного декодирования мРНК необходимы модификации антикодонов. В частности, колебательное положение антикодона определяет, как считываются кодоны. Например, у эукариот аденозин в положении 34 антикодона может превращаться в инозин. Инозин представляет собой модификацию, способную образовывать пары оснований с цитозином, аденином и уридином. [37]
Другое часто модифицируемое основание тРНК — это положение, примыкающее к антикодону. Позиция 37 часто гипермодифицируется с помощью громоздких химических модификаций. Эти модификации предотвращают сдвиг рамки считывания и повышают стабильность связывания антикодонов-кодонов за счет стекинговых взаимодействий. [37]
Модификация рибосомальной РНК
[ редактировать ]Рибосомальная РНК (рРНК) необходима для формирования рибосом и переноса пептидов во время процессов трансляции. [38] Модификации рибосомальной РНК производятся в ходе синтеза рибосом и часто происходят во время и/или после трансляции. Модификации в первую очередь играют роль в структуре рРНК, чтобы защитить эффективность трансляции. [38] Химическая модификация рРНК состоит из метилирования рибозных сахаров , изомеризации уридинов, а также метилирования и ацетилирования отдельных оснований. [39]
Метилирование
[ редактировать ]Метилирование рРНК поддерживает структурную жесткость, блокируя укладку пар оснований и окружая 2'-ОН-группу, блокируя гидролиз. Это происходит в определенных частях эукариотической рРНК. Матрица для метилирования состоит из 10-21 нуклеотида. [38] 2'-О-метилирование сахара рибозы является одной из наиболее распространенных модификаций рРНК. [40] Метилирование в основном осуществляется небольшими ядрышковыми РНК, называемыми мяРНП. Существует два класса мяРНП, которые нацелены на сайты метилирования, и они относятся к боксу C/D и боксу H/ACA. [39] [40] Один тип метилирования, 2'-О-метилирование, способствует спиральной стабилизации. [38]
изомеризация
[ редактировать ]Изомеризация уридина в псевдоуридин является второй наиболее распространенной модификацией рРНК. Эти псевдоуридины также вводятся теми же классами мяРНП, которые участвуют в метилировании. Псевдоуридинсинтазы являются основными ферментами, участвующими в реакции. [41] мяРНП H/ACA-бокса вводят направляющие последовательности длиной около 14-15 нуклеотидов. [39] Псевдоуридилирование запускается сразу во многих местах рРНК, чтобы сохранить термическую стабильность РНК. [39] Псевдоуридин способствует увеличению водородных связей и изменяет трансляцию рРНК и тРНК. [40] [41] Он изменяет трансляцию, увеличивая сродство субъединицы рибосомы к специфическим мРНК. [38]
Базовое редактирование:
Редактирование оснований — третий основной класс модификации рРНК, особенно у эукариот. Существует 8 категорий изменений оснований, которые могут произойти в промежутке между малыми и большими субъединицами рибосом. [38] РНК-метилтрансферазы — это ферменты, осуществляющие метилирование оснований. [38] Ацетилтрансферазы — это ферменты, ответственные за ацетилирование цитозина в рРНК. Метилирование оснований играет роль в трансляции. Все эти базовые модификации работают в сочетании с двумя другими основными классами модификаций, способствуя структурной стабильности РНК. Примером этого является N7-метилирование, которое увеличивает заряд нуклеотида, увеличивая ионные взаимодействия белков, прикрепляющихся к РНК перед трансляцией.
Редактирование путем вставки или удаления
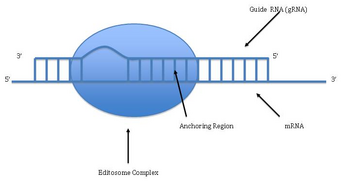
[ редактировать ]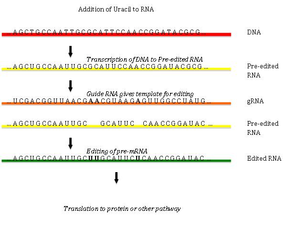
Редактирование РНК посредством добавления и удаления урацила было обнаружено в кинетопластах митохондрий Trypanosoma brucei . [42] Поскольку это может затрагивать большую часть сайтов гена, это иногда называют «пан-редактированием», чтобы отличить его от местного редактирования одного или нескольких сайтов.
Панредактирование начинается с спаривания оснований неотредактированного первичного транскрипта с направляющей РНК (гРНК), которая содержит последовательности, комплементарные областям вокруг точек вставки/делеции. Вновь образованная двухцепочечная область затем окутывается эдитосомой — большим мультибелковым комплексом, который катализирует редактирование. [43] [44] Эдитосома открывает транскрипт на первом несовпадающем нуклеотиде и начинает вставлять уридины. Вставленные уридины образуют пару оснований с направляющей РНК, и вставка будет продолжаться до тех пор, пока A или G присутствует в направляющей РНК, и остановится при обнаружении C или U. [45] [46] Вставленные нуклеотиды вызывают сдвиг рамки считывания , в результате чего транслируемый белок отличается от своего гена.
Механизм Эдосомы включает эндонуклеолитический разрез в точке несоответствия между направляющей РНК и неотредактированным транскриптом. Следующий этап катализируется одним из ферментов комплекса, терминальной U-трансферазой, которая добавляет Us из UTP на 3'-конце мРНК. [47] Открытые концы удерживаются на месте другими белками комплекса. Другой фермент, U-специфическая экзорибонуклеаза, удаляет неспаренный Us. После того, как редактирование сделало мРНК комплементарной гРНК, РНК-лигаза снова присоединяется к концам отредактированного транскрипта мРНК. [48] [49] Как следствие, Эдосома может редактироваться только в направлении от 3’ к 5’ вдоль первичного транскрипта РНК. Комплекс может действовать одновременно только на одну направляющую РНК. Следовательно, транскрипт РНК, требующий обширного редактирования, потребует более одной направляющей РНК и комплекса эдитосом.
Редактирование путем дезаминирования
[ редактировать ]Редактирование C-U
[ редактировать ]
В редактировании участвует цитидиндезаминаза, которая дезаминирует основание цитидина в основание уридина. Примером редактирования C-to-U является ген аполипопротеина B у человека. Апо В100 экспрессируется в печени, а апо В48 — в кишечнике. В кишечнике мРНК имеет последовательность CAA, отредактированную до UAA, стоп-кодона, что приводит к образованию более короткой формы B48.Редактирование C-to-U часто происходит в митохондриальной РНК цветковых растений. Разные растения имеют разную степень редактирования C-U; например, восемь событий редактирования происходят в митохондриях мха Funaria hygrometrica , тогда как более 1700 событий редактирования происходят у ликофитов Isoetes engelmanii . [50] Редактирование C-to-U осуществляется членами семейства белков пентатрикопептидного повтора (PPR). У покрытосеменных есть большие семейства PPR, действующие как трансфакторы для цис -элементов, не имеющих консенсусной последовательности; Arabidopsis Семейство PPR насчитывает около 450 представителей. Был сделан ряд открытий белков PPR как в пластидах, так и в митохондриях. [51]
Монтаж по принципу «А-к-И»
[ редактировать ]Модификации аденозин-инозин (A-to-I) ответственны почти за 90% всех событий редактирования в РНК. Дезаминирование аденозина катализируется двухцепочечной РНК-специфичной аденозиндезаминазой ( ADAR ), которая обычно действует на пре-мРНК. Дезаминирование аденозина в инозин разрушает и дестабилизирует спаривание оснований дцРНК, что делает эту конкретную дцРНК менее способной продуцировать миРНК , что мешает пути РНКи .
Колеблющееся спаривание оснований приводит к тому, что дезаминированная РНК имеет уникальную, но другую структуру, что может быть связано с ингибированием стадии инициации трансляции РНК. Исследования показали, что I-РНК (РНК со многими повторами пары оснований IU) рекрутирует метилазы, которые участвуют в формировании гетерохроматина , и что эта химическая модификация сильно влияет на сайты-мишени микроРНК. [52] Ведутся активные исследования важности модификаций A-to-I и их цели в новой концепции эпитранскриптомики , в которой в РНК вносятся модификации, изменяющие их функцию. [53] [54] Давно установленным следствием A-to-I в мРНК является интерпретация I как G, что приводит, следовательно, к функциональной замене A-на-G, например, при интерпретации генетического кода рибосомами. Однако более новые исследования ослабили эту корреляцию, показав, что инозины также могут декодироваться рибосомой (хотя и в меньшей степени) как аденозины или урацилы. Более того, было показано, что I приводит к остановке рибосом на I-богатой мРНК. [55]
Развитие высокопроизводительного секвенирования в последние годы позволило создать обширные базы данных по различным модификациям и правкам РНК. RADAR (строго аннотированная база данных редактирования РНК A-to-I) была разработана в 2013 году для каталогизации огромного разнообразия сайтов A-to-I и тканеспецифичных уровней, присутствующих у людей, мышей и мух . Добавление новых сайтов и общие изменения в базу данных продолжаются. [56] Уровень редактирования конкретных сайтов редактирования, например, транскрипта филамина А, тканеспецифичен. [57] Эффективность сплайсинга мРНК является основным фактором, контролирующим уровень редактирования РНК A-to-I. [58] [59] Интересно, что ADAR1 и ADAR2 также влияют на альтернативный сплайсинг посредством способности редактирования A-to-I и способности связывания дцРНК. [60] [61]
Альтернативное редактирование мРНК
[ редактировать ]Альтернативное редактирование мРНК U-to-C было впервые описано в транскриптах WT1 (опухоль Вильмса-1), [62] а неклассические изменения мРНК GA впервые наблюдались в транскриптах HNRNPK (гетерогенный ядерный рибонуклеопротеин К) как в злокачественных, так и в нормальных образцах колоректального кишечника. [63] Последние изменения позже наблюдались наряду с неклассическими изменениями U-to-C в транскриптах TPH2 (триптофангидроксилазы 2) клеток головного мозга. [64] Хотя обратное аминирование может быть самым простым объяснением изменений U-to-C, механизмы трансаминирования и трансгликозилирования были предложены для событий редактирования растений U-to-C в митохондриальных транскриптах. [65] Недавнее исследование сообщило о новых изменениях мРНК G-to-A в транскриптах WT1 в двух «горячих точках», предложив APOBEC3A (фермент редактирования мРНК аполипопротеина B, каталитический полипептид 3A) в качестве фермента, участвующего в этом классе альтернативного редактирования мРНК. [66] Также было показано, что альтернативные изменения мРНК связаны с каноническими вариантами сплайсинга WT1 , что указывает на их функциональную значимость.
Редактирование РНК в митохондриях и пластидах растений.
[ редактировать ]В предыдущих исследованиях было показано, что единственными типами редактирования РНК, наблюдаемыми в митохондриях и пластидах растений, являются превращения C-в-U и U-в-C (очень редко). [67] [68] [69] [70] [71] [72] [73] [74] [75] [76] [77] [78] [79] Сайты редактирования РНК обнаруживаются главным образом в кодирующих областях мРНК, интронах и других нетранслируемых областях. [69] Фактически, редактирование РНК может восстановить функциональность молекул тРНК. [71] [72] Сайты редактирования находятся преимущественно выше митохондриальных или пластидных РНК. Хотя конкретные положения событий редактирования C в U РНК достаточно хорошо изучены как в митохондриях, так и в пластидах, [80] идентичность и организация всех белков, входящих в состав эдитосомы, еще предстоит установить. Было показано, что члены обширного семейства белков PPR функционируют как транс -действующие факторы распознавания последовательности РНК. [81] Определенные члены семейства MORF (множественных факторов редактирования органелларных РНК) также необходимы для правильного редактирования на нескольких сайтах. Поскольку было показано, что некоторые из этих белков MORF взаимодействуют с членами семейства PPR, вполне возможно, что белки MORF являются компонентами эдитосомного комплекса. [82] Фермент, ответственный за транс- или дезаминирование транскрипта РНК, остается неуловимым, хотя было высказано предположение, что белки PPR также могут выполнять эту функцию.
Редактирование РНК необходимо для нормального функционирования трансляционной и дыхательной деятельности растения. Редактирование может восстановить основные последовательности спаривания оснований тРНК, восстанавливая функциональность. [83] Это также связано с выработкой белков, отредактированных РНК, которые включаются в полипептидные комплексы дыхательного пути. Поэтому весьма вероятно, что полипептиды, синтезированные из неотредактированных РНК, не будут функционировать должным образом и нарушать активность как митохондрий, так и пластид.
Редактирование РНК C-to-U может создавать старт- и стоп- кодоны , но не может уничтожить существующие старт- и стоп-кодоны. Загадочный стартовый кодон создается, когда кодон ACG редактируется на AUG.
Редактирование РНК у вирусов
[ редактировать ]Было показано, что вирусы (т.е. корь , эпидемический паротит или парагрипп ), особенно вирусы, имеющие РНК-геном, в ходе эволюции научились использовать модификации РНК разными способами при захвате клетки-хозяина. Известно, что вирусы используют модификации РНК на различных этапах своего инфекционного цикла: от уклонения от иммунитета до усиления трансляции белка. [27] Редактирование РНК используется для обеспечения стабильности и создания вариантов белка. [84] [85] Вирусные РНК транскрибируются кодируемой вирусом РНК-зависимой РНК-полимеразой , которая склонна к паузам и «заиканиям» при определенных комбинациях нуклеотидов. Кроме того, полимераза добавляет до нескольких сотен нематрицированных А на 3'-конце образующейся мРНК. [86] Эти As помогают стабилизировать мРНК. Кроме того, пауза и заикание РНК-полимеразы позволяют включить один или два G или As перед трансляционным кодоном. [86] Добавление нематрицированных нуклеотидов смещает рамку считывания, в результате чего генерируется другой белок.
Кроме того, показано, что модификации РНК оказывают как положительное, так и отрицательное влияние на эффективность репликации и трансляции в зависимости от вируса. Например, Кортни и др. [12] показали, что модификация РНК, называемая 5-метилцитозином, добавляется к вирусной мРНК в инфицированных клетках-хозяевах для усиления трансляции белка вируса ВИЧ-1. Торможение м. 5 Модификация C вирусной мРНК приводит к значительному снижению трансляции вирусных белков, но, что интересно, она не влияет на экспрессию вирусных мРНК в клетке. С другой стороны, Личинчи и др. [87] показали, что модификация N6-метиладенозина мРНК ZIKV ингибирует репликацию вируса.
Происхождение и эволюция редактирования РНК
[ редактировать ]Система редактирования РНК, обнаруженная у животного, возможно, произошла от мононуклеотидных деаминаз, что привело к появлению более крупных семейств генов, включающих гены apobec-1 и adar. Эти гены очень схожи с бактериальными деаминазами, участвующими в метаболизме нуклеотидов. Аденозиндезаминаза E. coli не может дезаминировать нуклеозид в РНК; Реакционный карман фермента слишком мал, чтобы с ним могла связаться нить РНК. Однако этот активный сайт расширяется за счет аминокислотных изменений в соответствующих генах-аналогах человека, APOBEC1 и ADAR , что делает возможным дезаминирование. [88] [89] Панредактирование, опосредованное гРНК, в митохондриях трипаносом , включающее матричную вставку остатков U, представляет собой совершенно другую биохимическую реакцию. В других исследованиях было показано, что задействованные ферменты рекрутируются и адаптируются из разных источников. [43] [90] Но специфичность вставки нуклеотидов посредством взаимодействия между гРНК и мРНК аналогична процессам редактирования тРНК у животных и митохондрий акантамебы . [91] Эукариотическая рибозометилирование рРНК молекулами направляющей РНК представляет собой аналогичную форму модификации. [92]
Таким образом, редактирование РНК развивалось неоднократно. Было предложено несколько адаптивных обоснований редактирования. [93] Редактирование часто описывается как механизм исправления или восстановления, позволяющий компенсировать дефекты последовательностей генов. Однако в случае редактирования, опосредованного гРНК, это объяснение не представляется возможным, поскольку, если дефект возникает первым, не существует способа генерировать безошибочную область, кодирующую гРНК, которая предположительно возникает в результате дупликации исходной области гена. Более правдоподобной альтернативой эволюционному происхождению этой системы является конструктивная нейтральная эволюция , где порядок шагов обратный, с необоснованной возможностью редактирования, предшествующей «дефекту». [94]
Терапевтическое редактирование мРНК
[ редактировать ]Направление редактирования для исправления мутировавших последовательностей было впервые предложено и продемонстрировано в 1995 году. [95] В этой первоначальной работе использовались синтетические антисмысловые олигонуклеотиды РНК, комплементарные мутации преждевременного стоп-кодона в последовательности дистрофина, чтобы активировать редактирование стоп-кодона A-to-I для считывания кодона в модельной клеточной системе xenopus. [95] Хотя это также привело к близлежащим непреднамеренным переходам от A к I, переходы от A к I (читаются как G) могут исправить все три стоп-кодона, но не могут создать стоп-кодон. Таким образом, изменения привели к более чем 25% коррекции целевого стоп-кодона с считыванием нижестоящей репортерной последовательности люциферазы. Вслед за работой Розенталя удалось отредактировать мутированную последовательность мРНК в культуре клеток млекопитающих, направив олигонуклеотид, связанный с цитидиндезаминазой, на коррекцию мутантной последовательности муковисцидоза. [96] Совсем недавно CRISPR-Cas13, слитый с деаминазами, был использован для управления редактированием мРНК. [97]
В 2022 году было сообщено о терапевтическом редактировании РНК Cas7-11. [98] [99] Он позволяет осуществлять достаточно целевые разрезы, и его ранняя версия использовалась для редактирования in vitro в 2021 году. [100]
Сравнение с редактированием ДНК
[ редактировать ]В отличие от редактирования ДНК, которое является постоянным, эффекты редактирования РНК, включая потенциальные нецелевые мутации в РНК, являются временными и не наследуются. Поэтому редактирование РНК считается менее рискованным. Более того, для этого может потребоваться только направляющая РНК при использовании белка ADAR, уже обнаруженного в клетках человека и многих других эукариот, вместо необходимости введения чужеродного белка в организм. [101]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и Ли С., Мейсон CE (2013). «Основной регуляторный ландшафт модификаций РНК» . Ежегодный обзор геномики и генетики человека . 15 : 127–150. doi : 10.1146/annurev-genom-090413-025405 . ПМИД 24898039 .
- ^ Перейти обратно: а б с д Сон CX, Йи С, Хе С (ноябрь 2012 г.). «Картирование недавно выявленных вариантов нуклеотидов в геноме и транскриптоме» . Природная биотехнология . 30 (11): 1107–1116. дои : 10.1038/nbt.2398 . ПМЦ 3537840 . ПМИД 23138310 .
- ^ Перейти обратно: а б с д Мейер К.Д., Джеффри С.Р. (май 2014 г.). «Динамический эпитранскриптом: N6-метиладенозин и контроль экспрессии генов» . Обзоры природы. Молекулярно-клеточная биология . 15 (5): 313–326. дои : 10.1038/nrm3785 . ПМЦ 4393108 . ПМИД 24713629 .
- ^ Перейти обратно: а б Сунь В.Дж., Ли Дж.Х., Лю С., Ву Дж., Чжоу Х., Цюй Л.Х., Ян Дж.Х. (январь 2016 г.). «RMBase: ресурс для расшифровки ландшафта модификаций РНК на основе данных высокопроизводительного секвенирования» . Исследования нуклеиновых кислот . 44 (Д1): Д259–Д265. дои : 10.1093/нар/gkv1036 . ПМК 4702777 . ПМИД 26464443 .
- ^ Су А.А., Рандау Л. (август 2011 г.). «Редактирование A-to-I и C-to-U в транспортных РНК». Биохимия. Биохимия . 76 (8): 932–937. дои : 10.1134/S0006297911080098 . ПМИД 22022967 . S2CID 11283810 .
- ^ «У кальмаров обнаружены новые возможности генетического редактирования» . физ.орг . Проверено 5 апреля 2020 г.
- ^ Боккалетто П., Махницка М.А., Пурта Е., Пятковски П., Багинский Б., Вирекки Т.К. и др. (январь 2018 г.). «МОДОМИКС: база данных путей модификации РНК. Обновление 2017 года» . Исследования нуклеиновых кислот . 46 (Д1): Д303–Д307. дои : 10.1093/нар/gkx1030 . ПМЦ 5753262 . ПМИД 29106616 .
- ^ Бреннике А., Марчфельдер А., Биндер С. (июнь 1999 г.). «Редактирование РНК» . Обзоры микробиологии FEMS . 23 (3): 297–316. дои : 10.1111/j.1574-6976.1999.tb00401.x . ПМИД 10371035 .
- ^ Хоффманн А., Фаллманн Дж., Вилардо Э., Мёрл М., Стадлер П.Ф., Амман Ф. (апрель 2018 г.). «Точное картирование чтений тРНК» . Биоинформатика . 34 (7). Оксфорд, Англия: 1116–1124 гг. doi : 10.1093/биоинформатика/btx756 . ПМИД 29228294 .
- ^ Мейер К.Д., Салеторе Ю., Зумбо П., Элементо О, Мейсон С.Э., Джеффри С.Р. (июнь 2012 г.). «Комплексный анализ метилирования мРНК показывает обогащение 3'-UTR и ближайшими стоп-кодонами» . Клетка . 149 (7): 1635–1646. дои : 10.1016/j.cell.2012.05.003 . ПМЦ 3383396 . ПМИД 22608085 .
- ^ Доминисини Д., Мошич-Мошковитц С., Шварц С., Салмон-Дивон М., Унгар Л., Озенберг С. и др. (апрель 2012 г.). «Топология метиломов РНК m6A человека и мыши, выявленная с помощью m6A-seq». Природа . 485 (7397): 201–206. Бибкод : 2012Natur.485..201D . дои : 10.1038/nature11112 . ПМИД 22575960 . S2CID 3517716 .
- ^ Перейти обратно: а б с Кортни Д.Г., Цай К., Богерд Х.П., Кеннеди Э.М., Бакалавр права, Эмери А. и др. (август 2019 г.). «Эпитранскриптомное добавление м. 5 Транскрипты C к ВИЧ-1 регулируют экспрессию вирусных генов» . Cell Host & Microbe . 26 (2): 217–227.e6. : 10.1016 /j.chom.2019.07.005 . PMC 6714563. . PMID 31415754 doi
- ^ Хуссейн С., Саджини А.А., Бланко С., Дитманн С., Ломбард П., Сугимото Ю. и др. (июль 2013 г.). «Метилирование цитозина-5 некодирующей РНК, опосредованное NSun2, определяет ее процессинг в регуляторные малые РНК» . Отчеты по ячейкам . 4 (2): 255–261. дои : 10.1016/j.celrep.2013.06.029 . ПМК 3730056 . ПМИД 23871666 .
- ^ Перейти обратно: а б Ке С., Алему Э.А., Мертенс С., Гантман ЕС, Фак Дж.Дж., Меле А. и др. (октябрь 2015 г.). «Большинство остатков m6A находится в последних экзонах, что обеспечивает возможность регуляции 3'-UTR» . Гены и развитие . 29 (19): 2037–2053. дои : 10.1101/gad.269415.115 . ПМЦ 4604345 . ПМИД 26404942 .
- ^ Карлайл Т.М., Рохас-Дюран М.Ф., Зинштейн Б., Шин Х., Бартоли К.М., Гилберт В.В. (ноябрь 2014 г.). «Профилирование псевдоуридина выявляет регулируемое псевдоуридилирование мРНК в клетках дрожжей и человека» . Природа . 515 (7525): 143–146. Бибкод : 2014Natur.515..143C . дои : 10.1038/nature13802 . ПМЦ 4224642 . ПМИД 25192136 .
- ^ Шварц С., Бернштейн Д.А., Мумбах М.Р., Йованович М., Хербст Р.Х., Леон-Рикардо Б.Х. и др. (сентябрь 2014 г.). «Картирование всего транскриптома обнаруживает широко распространенное динамически регулируемое псевдоуридилирование нкРНК и мРНК» . Клетка . 159 (1): 148–162. дои : 10.1016/j.cell.2014.08.028 . ПМК 4180118 . ПМИД 25219674 .
- ^ Ли Х, Чжу П, Ма С, Сун Дж, Бай Дж, Сунь Ф, И Ц (август 2015 г.). «Химическое исследование выявило динамическое псевдоуридилирование транскриптома млекопитающих». Химическая биология природы . 11 (8): 592–597. дои : 10.1038/nchembio.1836 . ПМИД 26075521 .
- ^ Ходдами В., Кэрнс, БР (май 2013 г.). «Идентификация прямых мишеней и модифицированных оснований РНК-цитозинметилтрансфераз» . Природная биотехнология . 31 (5): 458–464. дои : 10.1038/nbt.2566 . ПМЦ 3791587 . ПМИД 23604283 .
- ^ Биркедал У., Кристенсен-Далсгаард М., Крог Н., Сабаринатан Р., Городкин Дж., Нильсен Х. (январь 2015 г.). «Профилирование метилирования рибозы в РНК путем высокопроизводительного секвенирования». Ангеванде Хеми . 54 (2): 451–455. дои : 10.1002/anie.201408362 . ПМИД 25417815 .
- ^ Перейти обратно: а б Чен LQ, Чжао WS, Луо GZ (2020). «Картирование и редактирование модификаций нуклеиновых кислот» . Журнал вычислительной и структурной биотехнологии . 18 : 661–667. дои : 10.1016/j.csbj.2020.03.010 . ПМЦ 7113611 . ПМИД 32257049 .
- ^ Перейти обратно: а б Ветцель С., Лимбах, Пенсильвания (январь 2016 г.). «Масс-спектрометрия модифицированных РНК: последние разработки» . Аналитик . 141 (1): 16–23. Бибкод : 2016Ана...141...16Вт . дои : 10.1039/C5AN01797A . ПМЦ 4679475 . ПМИД 26501195 .
- ^ Хейсс М., Райхле В.Ф., Келлнер С. (сентябрь 2017 г.). «Наблюдение за судьбой тРНК и ее модификаций с помощью масс-спектрометрии с мечением изотопов нуклеиновых кислот: NAIL-MS» . Биология РНК . 14 (9): 1260–1268. дои : 10.1080/15476286.2017.1325063 . ПМК 5699550 . ПМИД 28488916 .
- ^ Райхле В.Ф., Вебер В., Келлнер С. (декабрь 2018 г.). «NAIL-MS в E. coli определяет источник и судьбу метилирования тРНК» . ХимБиоХим . 19 (24): 2575–2583. дои : 10.1002/cbic.201800525 . ПМК 6582434 . ПМИД 30328661 .
- ^ Райхле В.Ф., Кайзер С., Хейсс М., Хагельскамп Ф., Борланд К., Келлнер С. (март 2019 г.). «Преодоление пределов статического анализа модификаций РНК с помощью динамического NAIL-MS» . Методы . 156 : 91–101. дои : 10.1016/j.ymeth.2018.10.025 . ПМИД 30395967 .
- ^ Перейти обратно: а б МакКаун П.Дж., Рушковска А., Кунклер К.Н., Брегер К., Хулевич Дж.П., Ван М.К. и др. (сентябрь 2020 г.). «Природные модифицированные рибонуклеозиды» . Междисциплинарные обзоры Wiley. РНК . 11 (5): e1595. дои : 10.1002/wrna.1595 . ПМЦ 7694415 . ПМИД 32301288 .
- ^ Онтиверос Р.Дж., Стаут Дж., Лю К.Ф. (апрель 2019 г.). «Химическое разнообразие модификаций РНК» . Биохимический журнал . 476 (8): 1227–1245. дои : 10.1042/BCJ20180445 . ПМЦ 9073955 . ПМИД 31028151 . S2CID 135425191 .
- ^ Перейти обратно: а б Перейра-Монтесинос К, Валиенте-Эчеверриа Ф, Сото-Рифо Р (апрель 2017 г.). «Эпитранскриптомная регуляция репликации вируса». Biochimica et Biophysica Acta (BBA) - Механизмы регуляции генов . 1860 (4): 460–471. дои : 10.1016/j.bbagrm.2017.02.002 . ПМИД 28219769 .
- ^ Ван X, Лу З, Гомес А, Хон Г.К., Юэ Ю, Хан Д. и др. (январь 2014 г.). «N6-метиладенозин-зависимая регуляция стабильности информационной РНК» . Природа . 505 (7481): 117–120. Бибкод : 2014Natur.505..117W . дои : 10.1038/nature12730 . ПМЦ 3877715 . ПМИД 24284625 .
- ^ Геула С., Мошич-Мошковитц С., Доминисини Д., Мансур А.А., Кол Н., Салмон-Дивон М. и др. (февраль 2015 г.). «Стволовые клетки. Метилирование мРНК m6A облегчает разрешение наивной плюрипотентности в сторону дифференцировки» . Наука . 347 (6225): 1002–1006. дои : 10.1126/science.1261417 . ПМИД 25569111 . S2CID 206562941 .
- ^ Карийолич Дж., Ю.Т. (июнь 2011 г.). «Преобразование нонсенс-кодонов в смысловые кодоны путем целенаправленного псевдоуридилирования» . Природа . 474 (7351): 395–398. дои : 10.1038/nature10165 . ПМК 3381908 . ПМИД 21677757 .
- ^ Ян X, Ян Y, Сунь Б.Ф., Чен Ю.С., Сюй Дж.В., Лай В.И. и др. (май 2017 г.). «5-метилцитозин способствует экспорту мРНК — NSUN2 в качестве метилтрансферазы и ALYREF в качестве мРНК. 5 C Reader» . Cell Research . 27 (5): 606–625. doi : 10.1038/ . PMC 5594206. cr.2017.55 PMID 28418038 .
- ^ Быховская Ю., Касас К., Менгеша Э., Инбал А., Фишель-Годсиан Н. (июнь 2004 г.). «Миссенс-мутация псевдоуридинсинтазы 1 (PUS1) вызывает митохондриальную миопатию и сидеробластную анемию (MLASA)» . Американский журнал генетики человека . 74 (6): 1303–1308. дои : 10.1086/421530 . ПМК 1182096 . ПМИД 15108122 .
- ^ Хейсс Н.С., Найт С.В., Вуллиами Т.Дж., Клаук С.М., Виманн С., Мейсон П.Дж. и др. (май 1998 г.). «Врожденный Х-сцепленный дискератоз вызван мутациями высококонсервативного гена с предполагаемыми ядрышковыми функциями». Природная генетика . 19 (1): 32–38. дои : 10.1038/ng0598-32 . ПМИД 9590285 . S2CID 205342127 .
- ^ Гилберт В.В., Белл Т.А., Шенинг С. (июнь 2016 г.). «Модификации информационной РНК: форма, распределение и функции» . Наука . 352 (6292): 1408–1412. Бибкод : 2016Sci...352.1408G . дои : 10.1126/science.aad8711 . ПМК 5094196 . ПМИД 27313037 .
- ^ Киршнер С., Игнатова З. (февраль 2015 г.). «Новая роль тРНК в адаптивной трансляции, динамике передачи сигналов и заболеваниях». Обзоры природы. Генетика . 16 (2): 98–112. дои : 10.1038/nrg3861 . ПМИД 25534324 . S2CID 6727707 .
- ^ Лоренц К., Люнсе К.Э., Мёрль М. (апрель 2017 г.). «Модификации тРНК: влияние на структуру и термическую адаптацию» . Биомолекулы . 7 (2): 35. дои : 10.3390/biom7020035 . ПМЦ 5485724 . ПМИД 28375166 .
- ^ Перейти обратно: а б Агрис П.Ф., Вендейкс Ф.А., Грэм В.Д. (февраль 2007 г.). «Декодирование генома с помощью тРНК: 40 лет модификации». Журнал молекулярной биологии . 366 (1): 1–13. дои : 10.1016/j.jmb.2006.11.046 . ПМИД 17187822 .
- ^ Перейти обратно: а б с д и ж г Слоан К.Э., Варда А.С., Шарма С., Энтиан К.Д., Лафонтен Д.Л., Бонсак М.Т. (сентябрь 2017 г.). «Настройка рибосомы: влияние модификации рРНК на биогенез и функцию эукариотических рибосом» . Биология РНК . 14 (9): 1138–1152. дои : 10.1080/15476286.2016.1259781 . ПМЦ 5699541 . ПМИД 27911188 .
- ^ Перейти обратно: а б с д Шарма, Санни; Энтиан, Карл-Дитер (2022), Энтиан, Карл-Дитер (редактор), «Химические модификации рибосомальной РНК» , Биогенез рибосом: методы и протоколы , Методы молекулярной биологии, том. 2533, Нью-Йорк, штат Нью-Йорк: Springer US, стр. 149–166, doi : 10.1007/978-1-0716-2501-9_9 , ISBN. 978-1-0716-2501-9 , PMC 9761533 , PMID 35796987 , получено 29 февраля 2024 г.
- ^ Перейти обратно: а б с Борхардт, Эрин К.; Мартинес, Николь М.; Гилберт, Венди В. (23 ноября 2020 г.). «Регуляция и функция псевдоуридилирования РНК в клетках человека» . Ежегодный обзор генетики . 54 : 309–336. doi : 10.1146/annurev-genet-112618-043830 . ISSN 0066-4197 . ПМК 8007080 . ПМИД 32870730 .
- ^ Перейти обратно: а б Борхардт, Эрин К.; Мартинес, Николь М.; Гилберт, Венди В. (23 ноября 2020 г.). «Регуляция и функция псевдоуридилирования РНК в клетках человека» . Ежегодный обзор генетики . 54 (1): 309–336. doi : 10.1146/annurev-genet-112618-043830 . ISSN 0066-4197 . ПМК 8007080 . ПМИД 32870730 .
- ^ Бенне Р. (апрель 1994 г.). «Редактирование РНК в трипаносомах» . Европейский журнал биохимии . 221 (1): 9–23. дои : 10.1111/j.1432-1033.1994.tb18710.x . ПМИД 7513284 .
- ^ Перейти обратно: а б Артс Г.Дж., Бенне Р. (июнь 1996 г.). «Механизм и эволюция редактирования РНК в кинетопластидах». Biochimica et Biophysical Acta (BBA) – Структура и экспрессия генов . 1307 (1): 39–54. дои : 10.1016/0167-4781(96)00021-8 . ПМИД 8652667 .
- ^ Альфонсо Дж.Д., Тиманн О., Симпсон Л. (октябрь 1997 г.). «Механизм редактирования U-инсерции/делеции РНК в митохондриях кинетопластид» . Исследования нуклеиновых кислот . 25 (19): 3751–3759. doi : 10.1093/nar/25.19.3751 (неактивен 22 февраля 2024 г.). ПМЦ 146959 . ПМИД 9380494 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на февраль 2024 г. ( ссылка ) - ^ Блюм Б., Бакалара Н., Симпсон Л. (январь 1990 г.). «Модель редактирования РНК в митохондриях кинетопластид: молекулы «направляющей» РНК, транскрибируемые из максикольцевой ДНК, предоставляют отредактированную информацию». Клетка . 60 (2): 189–198. дои : 10.1016/0092-8674(90)90735-W . ПМИД 1688737 . S2CID 19656609 .
- ^ Кейбл М.Л., Хайдман С., Стюарт К.Д. (май 1997 г.). «Редактирование РНК: превращение U в РНК». Тенденции биохимических наук . 22 (5): 162–166. дои : 10.1016/S0968-0004(97)01041-4 . ПМИД 9175474 .
- ^ Симпсон Л., Тиманн Огайо (июнь 1995 г.). «Смысл от ерунды: редактирование РНК в митохондриях кинетопластидных простейших и слизевиков» . Клетка . 81 (6): 837–840. дои : 10.1016/0092-8674(95)90003-9 . ПМИД 7781060 . S2CID 4634304 .
- ^ Стюарт К. (февраль 1991 г.). «Редактирование РНК в митохондриальной мРНК трипаносоматид». Тенденции биохимических наук . 16 (2): 68–72. дои : 10.1016/0968-0004(91)90027-S . ПМИД 1713359 .
- ^ Хайдук С.Л., Сабатини Р.С. (1998). «Редактирование митохондриальной мРНК у кинетопластидных простейших». В Грожан Х., Бенне Р. (ред.). Модификация и редактирование РНК . Вашингтон, округ Колумбия: ASM Press. стр. 377–394.
- ^ Такенака М, Вербицкий Д, Церманн А, Хертель Б, Байер-Чассар Е, Гласс Ф, Бреннике А (ноябрь 2014 г.). «Редактирование РНК в митохондриях растений - соединение целевых последовательностей РНК и действующих белков». Митохондрия . Посадите митохондрии в митохондрии. 19 (Часть Б): 191–197. дои : 10.1016/j.mito.2014.04.005 . ПМИД 24732437 .
- ^ Шиканай Т. (сентябрь 2015 г.). «Редактирование РНК у растений: механизм и гибкость распознавания сайтов» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . SI: Биогенез хлоропластов. 1847 (9): 779–785. дои : 10.1016/j.bbabio.2014.12.010 . ПМИД 25585161 .
- ^ Нисикура К (2010). «Функции и регуляция редактирования РНК деаминазами ADAR» . Ежегодный обзор биохимии . 79 (1): 321–349. doi : 10.1146/annurev-biochem-060208-105251 . ПМЦ 2953425 . ПМИД 20192758 .
- ^ Таджаддод М., Янч М.Ф., Лихт К. (март 2016 г.). «Динамический эпитранскриптом: редактирование от А до I модулирует генетическую информацию» . Хромосома . 125 (1): 51–63. дои : 10.1007/s00412-015-0526-9 . ПМК 4761006 . ПМИД 26148686 .
- ^ Лихт К., Янч М.Ф. (апрель 2016 г.). «Быстрая и динамическая регуляция транскриптома путем редактирования и модификаций РНК» . Журнал клеточной биологии . 213 (1): 15–22. дои : 10.1083/jcb.201511041 . ПМЦ 4828693 . ПМИД 27044895 .
- ^ Лихт К., Хартл М., Амман Ф., Анратер Д., Янисив М.П., Янч М.Ф. (январь 2019 г.). «Инозин вызывает контекстно-зависимое перекодирование и остановку трансляции» . Исследования нуклеиновых кислот . 47 (1): 3–14. дои : 10.1093/nar/gky1163 . ПМК 6326813 . ПМИД 30462291 .
- ^ Рамасвами Дж., Ли Дж.Б. (январь 2014 г.). «РАДАР: строго аннотированная база данных редактирования РНК A-to-I» . Исследования нуклеиновых кислот . 42 (Проблема с базой данных): D109–D113. дои : 10.1093/нар/gkt996 . ПМЦ 3965033 . ПМИД 24163250 .
- ^ Стулич М., Янч М.Ф. (октябрь 2013 г.). «Пространственно-временное профилирование редактирования РНК филамином А выявляет предпочтения ADAR и высокие уровни редактирования за пределами нейрональных тканей» . Биология РНК . 10 (10): 1611–1617. дои : 10.4161/rna.26216 . ПМЦ 3866242 . ПМИД 24025532 .
- ^ Лихт К., Капур У., Майрхофер Э., Янч М.Ф. (июль 2016 г.). «Частота редактирования аденозина в инозин контролируется эффективностью сращивания» . Исследования нуклеиновых кислот . 44 (13): 6398–6408. дои : 10.1093/нар/gkw325 . ПМК 5291252 . ПМИД 27112566 .
- ^ Лихт К., Капур У., Амман Ф., Пикарди Э., Мартин Д., Бахад П., Янч М.Ф. (сентябрь 2019 г.). «Карта редактирования A-to-I с высоким разрешением на мышах идентифицирует события редактирования, контролируемые сплайсингом пре-мРНК» . Геномные исследования . 29 (9): 1453–1463. дои : 10.1101/гр.242636.118 . ПМК 6724681 . ПМИД 31427386 .
- ^ Капур У., Лихт К., Амман Ф., Якоби Т., Мартин Д., Дитрих К., Янч М.Ф. (август 2020 г.). «Дефицит ADAR нарушает глобальную картину сплайсинга в тканях мыши» . Геномные исследования . 30 (8): 1107–1118. дои : 10.1101/гр.256933.119 . ПМЦ 7462079 . ПМИД 32727871 .
- ^ Тан С.Дж., Шен Х., Ан О, Хун Х., Ли Дж., Сонг Ю и др. (февраль 2020 г.). «Цис- и транс-регуляция сплайсинга пре-мРНК ферментами редактирования РНК влияют на развитие рака» . Природные коммуникации . 11 (1): 799. Бибкод : 2020NatCo..11..799T . дои : 10.1038/s41467-020-14621-5 . ПМЦ 7005744 . ПМИД 32034135 .
- ^ Шарма П.М., Боуман М., Мэдден С.Л., Раушер Ф.Дж., Сукумар С. (март 1994 г.). «Редактирование РНК в гене предрасположенности к опухоли Вильмса, WT1» . Гены и развитие . 8 (6): 720–731. дои : 10.1101/gad.8.6.720 . ПМИД 7926762 .
- ^ Климек-Томчак К., Микула М., Дзвонек А., Пазиевска А., Карчмарски Дж., Хенниг Э. и др. (февраль 2006 г.). «Редактирование мРНК белка hnRNP K в колоректальной аденокарциноме и окружающей слизистой оболочке» . Британский журнал рака . 94 (4): 586–592. дои : 10.1038/sj.bjc.6602938 . ПМК 2361188 . ПМИД 16404425 .
- ^ Громанн М., Хаммер П., Вальтер М., Паульманн Н., Бюттнер А., Айзенменгер В. и др. (январь 2010 г.). «Альтернативный сплайсинг и обширное редактирование РНК транскриптов TPH2 человека» . ПЛОС ОДИН . 5 (1): е8956. Бибкод : 2010PLoSO...5.8956G . дои : 10.1371/journal.pone.0008956 . ПМЦ 2813293 . ПМИД 20126463 .
- ^ Кастандет Б., Арайя А (август 2011 г.). «Редактирование РНК в растительных органеллах. Зачем это упрощать?». Биохимия. Биохимия . 76 (8): 924–931. дои : 10.1134/S0006297911080086 . ПМИД 22022966 . S2CID 2174535 .
- ^ Ниаварани А., Карри Э., Рейал Ю., Аньос-Афонсо Ф., Хорсвелл С., Гриссингер Э. и др. (2015). «APOBEC3A участвует в новом классе редактирования мРНК G-to-A в транскриптах WT1» . ПЛОС ОДИН . 10 (3): e0120089. Бибкод : 2015PLoSO..1020089N . дои : 10.1371/journal.pone.0120089 . ПМК 4373805 . ПМИД 25807502 .
- ^ Ковелло П.С., Грей М.В. (октябрь 1989 г.). «Редактирование РНК в митохондриях растений». Природа . 341 (6243): 662–666. Бибкод : 1989Natur.341..662C . дои : 10.1038/341662a0 . ПМИД 2552326 . S2CID 4373041 .
- ^ Гуальберто Х.М., Ламаттина Л., Боннар Г., Вейль Дж.Х., Гриненбергер Дж.М. (октябрь 1989 г.). «Редактирование РНК в митохондриях пшеницы приводит к сохранению белковых последовательностей». Природа . 341 (6243): 660–662. Бибкод : 1989Natur.341..660G . дои : 10.1038/341660a0 . ПМИД 2552325 . S2CID 19402913 .
- ^ Перейти обратно: а б Хизель Р., Виссинджер Б., Шустер В., Бреннике А. (декабрь 1989 г.). «Редактирование РНК в митохондриях растений». Наука . 246 (4937): 1632–1634. Бибкод : 1989Sci...246.1632H . дои : 10.1126/science.2480644 . ПМИД 2480644 .
- ^ Хох Б., Майер Р.М., Аппель К., Иглой Г.Л., Кессель Х. (сентябрь 1991 г.). «Редактирование мРНК хлоропластов путем создания инициирующего кодона». Природа . 353 (6340): 178–180. Бибкод : 1991Natur.353..178H . дои : 10.1038/353178a0 . ПМИД 1653905 . S2CID 4303733 .
- ^ Перейти обратно: а б Принг Д., Бреннике А., Шустер В. (март 1993 г.). «Редактирование РНК придает новый смысл генетической информации в митохондриях и хлоропластах». Молекулярная биология растений . 21 (6): 1163–1170. дои : 10.1007/BF00023611 . ПМИД 8490134 . S2CID 30396182 .
- ^ Перейти обратно: а б Виссинджер Б., Бреннике А., Шустер В. (сентябрь 1992 г.). «Возрождение здравого смысла: редактирование РНК и транс-сплайсинг в митохондриях растений». Тенденции в генетике . 8 (9): 322–328. дои : 10.1016/0168-9525(92)90265-6 . ПМИД 1365399 .
- ^ Гриненбергер Дж. М. (1993). «Редактирование РНК в органеллах растений». Редактирование РНК (Бенн, Р., редактор), Эллис Харвуд, Нью-Йорк .
- ^ Малек О., Ляттиг К., Хизель Р., Бреннике А., Кнооп В. (март 1996 г.). «Редактирование РНК у мохообразных и молекулярная филогения наземных растений» . Журнал ЭМБО . 15 (6): 1403–1411. дои : 10.1002/j.1460-2075.1996.tb00482.x . ПМК 450045 . ПМИД 8635473 .
- ^ Фрейер Р., Кифер-Мейер М.К., Кессель Х. (июнь 1997 г.). «Возникновение редактирования пластидной РНК во всех основных линиях наземных растений» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (12): 6285–6290. Бибкод : 1997PNAS...94.6285F . дои : 10.1073/pnas.94.12.6285 . ПМК 21041 . ПМИД 9177209 .
- ^ Дитрих А., Смолл И., Коссет А., Вейль Дж. Х., Марешаль-Друар Л. (1996). «Редактирование и импорт: стратегии обеспечения митохондрий растений полным набором функциональных транспортных РНК». Биохимия . 78 (6): 518–529. дои : 10.1016/0300-9084(96)84758-4 . ПМИД 8915541 .
- ^ Бок Р., Герман М., Фукс М. (октябрь 1997 г.). «Идентификация критических позиций нуклеотидов для распознавания сайта редактирования пластидной РНК» . РНК . 3 (10): 1194–1200. ПМК 1369561 . ПМИД 9326494 .
- ^ Грей М.В., Ковелло П.С. (январь 1993 г.). «Редактирование РНК в митохондриях и хлоропластах растений» . Журнал ФАСЭБ . 7 (1): 64–71. дои : 10.1096/fasebj.7.1.8422976 . ПМИД 8422976 . S2CID 26005486 .
- ^ Марчфельдер А., Биндер С., Бреннике А., Кнуп В. (1998). "Предисловие". В Грожан Х., Бенне Р. (ред.). Модификация и редактирование РНК . Вашингтон, округ Колумбия: ASM Press. стр. 307–323.
- ^ Такенака М, Церманн А, Вербицкий Д, Хертель Б, Бреннике А (2013). «Редактирование РНК у растений и его эволюция». Ежегодный обзор генетики . 47 : 335–352. doi : 10.1146/annurev-genet-111212-133519 . ПМИД 24274753 .
- ^ Баркан А, Смолл I (2014). «Пентатрикопептидные повторяющиеся белки в растениях» . Ежегодный обзор биологии растений . 65 : 415–442. doi : 10.1146/annurev-arplant-050213-040159 . ПМИД 24471833 .
- ^ Бентолила С., О Дж., Хэнсон М.Р., Буковски Р. (июнь 2013 г.). «Комплексный анализ с высоким разрешением роли семейства генов Arabidopsis в редактировании РНК» . ПЛОС Генетика . 9 (6): e1003584. дои : 10.1371/journal.pgen.1003584 . ПМЦ 3688494 . ПМИД 23818871 .
- ^ Прайс Д.Х., Грей М.В. (1998). «Редактирование тРНК». В Грожан Х., Бенне Р. (ред.). Модификация и редактирование РНК . Вашингтон, округ Колумбия: ASM Press. стр. 289–306.
- ^ Карран Дж., Бек Р., Колакофски Д. (октябрь 1991 г.). «Ген P вируса Сендай экспрессирует как важный белок, так и ингибитор синтеза РНК путем перетасовки модулей посредством редактирования мРНК» . Журнал ЭМБО . 10 (10): 3079–3085. дои : 10.1002/j.1460-2075.1991.tb07860.x . ПМК 453024 . ПМИД 1655410 .
- ^ Чжэн Х., Фу Т.Б., Лазински Д., Тейлор Дж. (август 1992 г.). «Редактирование геномной РНК вируса гепатита дельта человека» . Журнал вирусологии . 66 (8): 4693–4697. doi : 10.1128/jvi.66.8.4693-4697.1992 . ПМК 241294 . ПМИД 1629949 .
- ^ Перейти обратно: а б Колакофски Д., Хаусманн С. (1998). «Глава 23: Котранскрипционное редактирование мРНК парамиксовируса: противоречие в терминах?». В Грожан Х., Бенне Р. (ред.). Модификация и редактирование РНК . Вашингтон, округ Колумбия: ASM Press. стр. 413–420.
- ^ Личинчи Г, Чжао Б.С., Ву Ю, Лу З, Цинь Ю, Хэ С, Рана ТМ (ноябрь 2016 г.). «Динамика метилирования РНК человека и вируса при инфекции вирусом Зика» . Клетка-хозяин и микроб . 20 (5): 666–673. дои : 10.1016/j.chom.2016.10.002 . ПМК 5155635 . ПМИД 27773536 .
- ^ Картер CW (1998). «Нуклеозиддезаминазы для цитидина и аденозина: сравнение с деаминазами, действующими на РНК». В Грожан Х., Бенне Р. (ред.). Модификация и редактирование РНК . Вашингтон, округ Колумбия: ASM Press. стр. 363–376.
- ^ Ковелло П.С., Грей М.В. (август 1993 г.). «Об эволюции редактирования РНК». Тенденции в генетике . 9 (8): 265–268. дои : 10.1016/0168-9525(93)90011-6 . ПМИД 8379005 .
- ^ Лонерган К.М., Грей М.В. (сентябрь 1993 г.). «Прогнозируемое редактирование дополнительных транспортных РНК в митохондриях Acanthamoeba castellanii» . Исследования нуклеиновых кислот . 21 (18): 4402. doi : 10.1093/nar/21.18.4402 . ПМК 310088 . ПМИД 8415006 .
- ^ Bachellerie JP, Cavaille J (1998). «Маленькие ядрышковые РНК управляют метилированием рибозы эукариотических рРНК». В Грожан Х., Бенне Р. (ред.). Модификация и редактирование РНК . Вашингтон, округ Колумбия: ASM Press. стр. 255–272.
- ^ Спейер Д. (май 2011 г.). «Играет ли конструктивная нейтральная эволюция важную роль в возникновении клеточной сложности? Осмысление происхождения и использования биологической сложности». Биоэссе . 33 (5): 344–349. doi : 10.1002/bies.201100010 . ПМИД 21381061 . S2CID 205470421 .
- ^ Штольцфус А (август 1999 г.). «О возможности конструктивной нейтральной эволюции». Журнал молекулярной эволюции . 49 (2): 169–181. Бибкод : 1999JMolE..49..169S . CiteSeerX 10.1.1.466.5042 . дои : 10.1007/PL00006540 . ПМИД 10441669 . S2CID 1743092 .
- ^ Перейти обратно: а б Вульф Т.М., Чейз Дж.М., Стинчкомб Д.Т. (август 1995 г.). «На пути к терапевтическому редактированию мутированных последовательностей РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (18): 8298–8302. Бибкод : 1995PNAS...92.8298W . дои : 10.1073/pnas.92.18.8298 . ПМК 41144 . ПМИД 7545300 .
- ^ Монтьель-Гонсалес МФ, Вальесильо-Вьехо I, Юдовски Г.А., Розенталь Дж.Дж. (ноябрь 2013 г.). «Коррекция мутаций в регуляторе трансмембранной проводимости муковисцидоза путем сайт-направленного редактирования РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (45): 18285–18290. Бибкод : 2013PNAS..11018285M . дои : 10.1073/pnas.1306243110 . ПМЦ 3831439 . ПМИД 24108353 .
- ^ Кокс Д.Б., Гутенберг Дж.С., Абудайе О.О., Франклин Б., Келлнер М.Дж., Йонг Дж., Чжан Ф. (ноябрь 2017 г.). «Редактирование РНК с помощью CRISPR-Cas13» . Наука . 358 (6366): 1019–1027. Бибкод : 2017Sci...358.1019C . дои : 10.1126/science.aaq0180 . ПМЦ 5793859 . ПМИД 29070703 .
- ^ Уильямс С. «Нейробиологи расширяют набор инструментов CRISPR новым компактным ферментом Cas7-11» . Массачусетский технологический институт . Проверено 22 июня 2022 г.
- ^ Като К., Чжоу В., Оказаки С., Исаяма Ю., Нисидзава Т., Гутенберг Дж.С. и др. (июнь 2022 г.). «Строение и разработка эффекторного комплекса CRISPR-Cas7-11 типа III-E» . Клетка . 185 (13): 2324–2337.e16. дои : 10.1016/j.cell.2022.05.003 . ПМИД 35643083 . S2CID 249103058 .
- ^ Озджан А., Краески Р., Иоанниди Е., Ли Б., Гарднер А., Макарова К.С. и др. (сентябрь 2021 г.). «Программируемое нацеливание на РНК с помощью однобелкового эффектора CRISPR Cas7-11». Природа . 597 (7878): 720–725. Бибкод : 2021Natur.597..720O . дои : 10.1038/s41586-021-03886-5 . ПМИД 34489594 . S2CID 237432753 .
- ^ Кросс Р (25 марта 2019 г.). «Осторожно, CRISPR. Гонка редактирования РНК началась» . Новости химии и техники . 97 (12) . Проверено 30 сентября 2020 г.