Направляющая РНК
В этой статье есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|
Гид-РНК (гРНК) или одиночная гидовая РНК (сгРНК) представляет собой короткую последовательность РНК , которая действует как проводник для Cas9 -эндонуклеазы или других Cas-белков. [1] которые разрезают двухцепочечную ДНК и поэтому могут использоваться для редактирования генов. [2] У бактерий и архей гРНК являются частью системы CRISPR -Cas, служащей адаптивной иммунной защитой, защищающей организм от вирусов. Здесь короткие гРНК служат детекторами чужеродной ДНК и направляют Cas-ферменты, разрушающие чужеродную нуклеиновую кислоту. [1] [3]
История
[ редактировать ]Руководство по редактированию РНК РНК была открыта в 1990 году Б. Блюмом, Н. Бакаларой и Л. Симпсоном посредством нозерн-блот-гибридизации в ДНК митохондриального максикольца эукариотического паразита Leishmania tarentolae. Последующие исследования середины 2000-х и в последующие годы изучали структуру и функцию гРНК и системы CRISPR-Cas. Значительный прорыв произошел в 2012 году, когда было обнаружено, что гРНК может направлять эндонуклеазу Cas9 на целевые разрезы в двухцепочечной ДНК. Это открытие привело к присуждению Нобелевской премии 2020 года Дженнифер Дудна и Эммануэль Шарпантье за вклад в разработку технологии редактирования генов CRISPR-Cas9.
Направляющая РНК у протистов
[ редактировать ]Протисты трипаносоматид и другие кинетопластиды имеют процесс посттранскрипционной модификации РНК, известный как «редактирование РНК», который выполняет вставку/удаление уридина внутри митохондрий . [4] [5] Эта митохондриальная ДНК имеет кольцевую форму и разделена на макси- и мини-кольца. Митохондрия содержит около 50 максикольцев , которые имеют как кодирующие, так и некодирующие области, и состоит примерно из 20 тысяч оснований (кб). Кодирующая область высококонсервативна (16-17 т.п.н.), а некодирующая область варьируется в зависимости от вида. Миникольца небольшие (около 1 т.п.н.), но более многочисленны, чем максикольца, митохондрия содержит несколько тысяч миникружков. [6] [7] [8] Максициклы могут кодировать « криптогены » и некоторые гРНК; миникольца могут кодировать большинство гРНК. Некоторые гены гРНК имеют идентичные сайты вставки и делеции, даже если они имеют разные последовательности, тогда как другие последовательности гРНК не комплементарны предварительно отредактированной мРНК. Молекулы макси- и мини-кольца объединены в гигантскую сеть ДНК внутри митохондрии. [9] [8] [10]
Большинство транскриптов maxicircle не могут быть транслированы в белки из-за сдвига рамки считывания в их последовательностях. Эти сдвиги рамки корректируются посттранскрипционно посредством вставки и удаления остатков уридина в определенных участках, которые затем создают открытую рамку считывания . Эта открытая рамка считывания впоследствии транслируется в белок, гомологичный митохондриальным белкам, обнаруженным в других клетках. [11] Процесс вставки и удаления уридина опосредован короткими направляющими РНК (гРНК), которые кодируют информацию редактирования через комплементарные последовательности и позволяют спаривать основания между гуанином и урацилом (ГУ), а также между гуанином и цитозином (GC), облегчая процесс редактирования. [12]
Функция комплекса гРНК-мРНК
[ редактировать ]Направляющие РНК в основном транскрибируются из межгенной области максикольца ДНК и имеют последовательности, комплементарные мРНК. 3'-конец гРНК содержит олиго-U-хвост (длиной 5-24 нуклеотида), который находится в некодируемой области, но взаимодействует и образует стабильный комплекс с богатыми A и G областями предварительно отредактированных мРНК и гРНК, которые термодинамически стабилизирован 5' и 3' якорями. [13] Этот первоначальный гибрид помогает распознавать конкретный участок мРНК, подлежащий редактированию. [14]
Редактирование РНК обычно происходит от 3'-конца мРНК к 5'-концу. Первоначальный процесс редактирования начинается, когда гРНК образует дуплекс РНК с комплементарной последовательностью мРНК, расположенной сразу после сайта редактирования. Это спаривание рекрутирует ряд рибонуклеопротеиновых комплексов, которые направляют расщепление первого несовпадающего основания, прилежащего к якорю гРНК-мРНК. После этого уридилилтрансфераза вставляет букву «U» на 3-конце, а затем РНК-лигаза соединяет два отрезанных конца. Процесс повторяется на следующем вышестоящем сайте редактирования аналогичным образом. Одна гРНК обычно кодирует информацию для нескольких сайтов редактирования («блок редактирования»), редактирование которых создает полный дуплекс гРНК/мРНК. Этот процесс последовательного редактирования известен как модель ферментативного каскада. [14] [12] [15]
В случае «панредактированных» мРНК, [16] дуплекс раскручивается, и другая гРНК образует дуплекс с отредактированной последовательностью мРНК, запуская новый раунд редактирования. Эти перекрывающиеся гРНК образуют «домен редактирования». Некоторые гены содержат несколько доменов редактирования. [17] Степень редактирования любого конкретного гена варьируется среди видов трипаносоматид. Вариант состоит в потере редактирования на 3'-стороне, вероятно, из-за потери классов последовательностей мини-кольца, которые кодируют специфические гРНК. Ретропозиция [18] была предложена модель для объяснения частичной, а в некоторых случаях и полной утраты редактирования в результате эволюции. Хотя потеря редактирования обычно приводит к летальному исходу, такие потери наблюдались у старых лабораторных штаммов. Сохранение редактирования на протяжении долгой истории эволюции этих древних простейших предполагает наличие избирательного преимущества, точная природа которого до сих пор неясна. [16]
Неясно, почему трипаносоматиды используют такой сложный механизм для производства мРНК. Он мог возникнуть в ранних митохондриях предка линии кинтопластидных протистов, поскольку он присутствует в бодонидах, которые являются предками трипаносоматид. [19] и может отсутствовать у эвгленоидов , которые произошли от того же общего предка, что и кинетопластиды.
Направляющие последовательности РНК
[ редактировать ]У простейших Leishmania tarentolae 12 из 18 митохондриальных генов редактируются с помощью этого процесса. Одним из таких генов является Cyb. мРНК фактически редактируется дважды подряд. Для первого редактирования соответствующая последовательность мРНК выглядит следующим образом:
mRNA 5' AAAGAAAAGGCUUUAACUUCAGGUUGU 3'
3'-конец используется для закрепления гРНК (в данном случае гРНК gCyb-I) путем спаривания оснований (используются некоторые пары G/U). 5'-конец не совпадает точно, и одна из трех специфических эндонуклеаз расщепляет мРНК в месте несоответствия.
gRNA 3' AAUAAUAAAUUUUUAAAUAUAAUAGAAAAUUGAAGUUCAGUA 5' mRNA 5' A A AGAAA A G G C UUUAACUUCAGGUUGU 3'
Теперь мРНК «восстанавливается» путем последовательного добавления U в каждом сайте редактирования, что дает следующую последовательность:
gRNA 3' AAUAAUAAAUUUUUAAAUAUAAUAGAAAAUUGAAGUUCAGUA 5' mRNA 5' UUAUUAUUUAGAAAUUUAUGUUGUCUUUUAACUUCAGGUUGU 3'
Этот конкретный ген имеет два перекрывающихся сайта редактирования гРНК. 5'-конец этого участка является 3'-якорем другой гРНК (гРНК gCyb-II). [9]
Направляющая РНК у прокариот
[ редактировать ]CRISPR у прокариот
[ редактировать ]Прокариоты, такие как бактерии и археи, используют CRISPR (кластеризованные короткие палиндромные повторы с регулярными интервалами) и связанные с ним ферменты Cas в качестве своей адаптивной иммунной системы. Когда прокариоты заражаются фагами и им удается отразить атаку, специфические ферменты Cas разрезают ДНК фага (или РНК) и интегрируют фрагменты в промежутки последовательностей CRISPR. Эти сохраненные сегменты затем распознаются во время будущих вирусных атак, что позволяет ферментам Cas использовать копии РНК этих сегментов вместе со связанными с ними последовательностями CRISPR в качестве гРНК для идентификации и нейтрализации чужеродных последовательностей. [20] [21] [22]
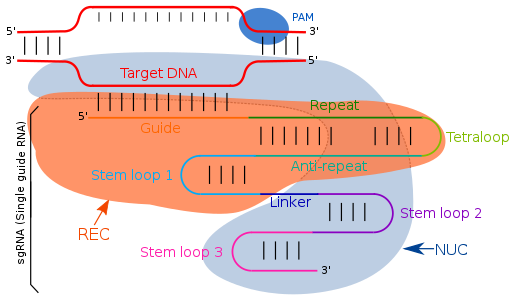
Структура
[ редактировать ]Направляющая РНК нацелена на комплементарные последовательности посредством простого спаривания оснований Уотсона-Крика. [23] В системе CRISPR/cas типа II sgRNA направляет Cas-фермент на определенные области генома для целевого расщепления ДНК. sgRNA представляет собой искусственно созданную комбинацию двух молекул РНК: CRISPR РНК ( crRNA ) и трансактивирующей crRNA ( tracrRNA ). Компонент crRNA отвечает за связывание с целевым участком ДНК, а компонент tracrRNA отвечает за активацию эндонуклеазной активности Cas9. Эти два компонента связаны короткой структурой тетрапетли, что приводит к образованию sgRNA. ТракрРНК состоит из пар оснований, которые образуют структуру «стебель-петля», позволяющую прикрепить ее к ферменту эндонуклеазе . Транскрипция локуса CRISPR генерирует crRNA, которая содержит спейсерные области, фланкированные повторяющимися последовательностями, обычно длиной 18-20 пар оснований (п.н.). Эта crРНК направляет эндонуклеазу Cas9 к комплементарной целевой области ДНК, где она расщепляет ДНК, образуя так называемый эффекторный комплекс. Модификации последовательности crRNA в sgRNA могут изменить место связывания, обеспечивая точное нацеливание на различные участки ДНК, что фактически делает ее программируемой системой редактирования генома. [24] [25] [26]
Приложения
[ редактировать ]Проектирование гРНК
[ редактировать ]Специфичность направленного воздействия CRISPR-Cas9 определяется последовательностью из 20 нуклеотидов (нт) на 5'-конце гРНК. Желаемая целевая последовательность должна предшествовать мотиву, примыкающему к протоспейсеру (PAM), который представляет собой короткую последовательность ДНК, обычно длиной 2–6 пар оснований, которая следует за областью ДНК, предназначенной для расщепления системой CRISPR, такой как CRISPR-Cas9. PAM необходим для разрезания Cas-нуклеазы и обычно расположен на 3-4 нуклеотида ниже сайта разреза. Как только основания гРНК соединяются с мишенью, Cas9 индуцирует двухцепочечный разрыв примерно на 3 нуклеотида выше PAM. [27] [28]
Оптимальное содержание GC в направляющей последовательности должно составлять более 50%. Более высокое содержание GC повышает стабильность дуплекса РНК-ДНК и снижает нецелевую гибридизацию. Длина направляющих последовательностей обычно составляет 20 п.н., но они также могут варьироваться от 17 до 24 п.н. Более длинная последовательность сводит к минимуму нецелевые эффекты. Направляющие последовательности короче 17 п.н. подвергаются риску воздействия на несколько локусов . [29] [30] [24]
CRISPR Cas9
[ редактировать ]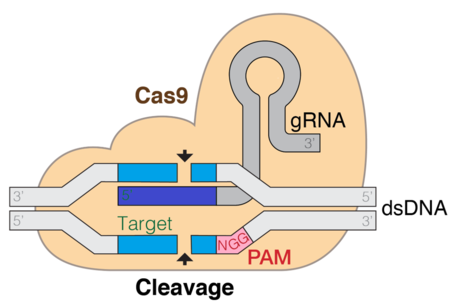
CRISPR (Кластерные короткие палиндромные повторы с регулярными интервалами)/Cas9 — это метод, используемый для редактирования генов и генной терапии. Cas — это фермент эндонуклеаза, который разрезает ДНК в определенном месте под руководством направляющей РНК. Это целевой метод, который может вызывать нокауты или нокауты генов в зависимости от пути восстановления двухцепочечной ДНК. Данные показывают, что как in vitro, так и in vivo tracrRNA необходима для связывания Cas9 с целевой последовательностью ДНК. Система CRISPR-Cas9 состоит из трех основных этапов. Первый этап включает расширение оснований в области локуса CRISPR путем добавления чужеродных спейсеров ДНК в последовательность генома. Белки, такие как cas1 и cas2, помогают находить новые спейсеры. Следующий этап включает транскрипцию CRISPR: пре-crRNA (РНК-предшественник CRISPR) экспрессируются путем транскрипции массива повторов-спейсеров CRISPR. При дальнейшей модификации пре-кРНК превращается в отдельные спейсер-фланкированные области, образующие короткую crРНК. Процесс созревания РНК аналогичен при типах I и III, но различен при типе II. Третий этап включает связывание белка cas9 и направление его на расщепление сегмента ДНК. Белок Cas9 связывается с комбинированной формой crRNA и tracrRNA, образуя эффекторный комплекс. Она служит направляющей РНК для белка cas9, управляя его эндонуклеазной активностью. [31] [2] [3]
Мутагенез РНК
[ редактировать ]Одним из важных методов регуляции генов является мутагенез РНК, который можно осуществить путем редактирования РНК с помощью гРНК. [32] Направляющая РНК заменяет аденозин на инозин в определенных целевых сайтах, модифицируя генетический код. [33] Аденозиндезаминаза действует на РНК, вызывая посттранскрипционную модификацию путем изменения кодонов и различных функций белка. Направляющие РНК представляют собой небольшие ядрышковые РНК, которые наряду с рибопротеинами осуществляют внутриклеточные изменения РНК, такие как рибометилирование рРНК и введение псевдоуридина в прерибосомальную РНК. [34] Направляющие РНК связываются с последовательностью антисмысловой РНК и регулируют модификацию РНК. Было замечено, что малые интерферирующие РНК (миРНК) и микроРНК (миРНК) обычно используются в качестве последовательностей РНК-мишени, а модификации сравнительно легко вводить из-за их небольшого размера. [35]
См. также
[ редактировать ]- Редактирование генов CRISPR
- Инструменты CRISPR/Cas
- миРНК
- Джин нокаут
- Примыкающий к протоспейсеру мотив
Ссылки
[ редактировать ]- ^ Jump up to: а б Мали, Прашант; Ян, Лухан; Эсвелт, Кевин М.; Аах, Джон; Гуэль, Марк; ДиКарло, Джеймс Э.; Норвилл, Джули Э.; Черч, Джордж М. (15 февраля 2013 г.). «Инженерия генома человека под контролем РНК с помощью Cas9» . Наука . 339 (6121): 823–826. Бибкод : 2013Sci...339..823M . дои : 10.1126/science.1232033 . ISSN 1095-9203 . ПМЦ 3712628 . ПМИД 23287722 .
- ^ Jump up to: а б Дудна, Дженнифер А.; Шарпантье, Эммануэль (28 ноября 2014 г.). «Новый рубеж геномной инженерии с CRISPR-Cas9» . Наука . 346 (6213). дои : 10.1126/science.1258096 . ISSN 0036-8075 . ПМИД 25430774 .
- ^ Jump up to: а б Джинек, Мартин; Чилинский, Кшиштоф; Фонфара, Инес; Хауэр, Майкл; Дудна, Дженнифер А.; Шарпантье, Эммануэль (17 августа 2012 г.). «Программируемая ДНК-эндонуклеаза, управляемая двойной РНК, в адаптивном бактериальном иммунитете» . Наука . 337 (6096): 816–821. Бибкод : 2012Sci...337..816J . дои : 10.1126/science.1225829 . ISSN 1095-9203 . ПМК 6286148 . ПМИД 22745249 .
- ^ Симпсон, Ларри; Сбичего, Сандро; Афазижев, Руслан (01 марта 2003 г.). «Редактирование РНК с вставкой/удалением уридина в митохондриях трипаносом: сложный бизнес» . РНК . 9 (3): 265–276. дои : 10.1261/rna.2178403 . ISSN 1355-8382 . ПМК 1370392 . ПМИД 12591999 .
- ^ Ли, Фэн; Ге, Пэн; Хуэй, Вонг Х.; Атанасов, Иво; Роджерс, Кестрел; Го, Цян; Осато, Дарен; Фалик, Арнольд М.; Чжоу, З. Хун; Симпсон, Ларри (28 июля 2009 г.). «Структура основного комплекса редактирования (L-комплекса), участвующего в редактировании РНК вставки / удаления уридина в митохондриях трипаносоматид» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (30): 12306–12310. Бибкод : 2009PNAS..10612306L . дои : 10.1073/pnas.0901754106 . ISSN 1091-6490 . ПМК 2708173 . ПМИД 19590014 .
- ^ Эстевес, Антонио М.; Симпсон, Ларри (ноябрь 1999 г.). «Редактирование РНК с помощью вставки/делеции уридина в митохондриях трипаносом — обзор» . Джин . 240 (2): 247–260. дои : 10.1016/S0378-1119(99)00437-0 . ПМИД 10580144 .
- ^ Оксенрайтер, Торстен; Сиприано, Майкл; Хайдук, Стивен Л. (1 января 2007 г.). «KISS: инструмент поиска последовательности редактирования кинетопластидной РНК» . РНК . 13 (1): 1–4. дои : 10.1261/rna.232907 . ISSN 1355-8382 . ПМК 1705751 . ПМИД 17123956 .
- ^ Jump up to: а б Купер, Синклер; Уодсворт, Элизабет С; Оксенрайтер, Торстен; Ивенс, Аласдер; Сэвилл, Николас Дж; Шнауфер, Ахим (30 октября 2019 г.). «Сборка и аннотация митохондриального миникольцевого генома компетентного к дифференцировке штамма Trypanosoma brucei» . Исследования нуклеиновых кислот . 47 (21): 11304–11325. дои : 10.1093/nar/gkz928 . ISSN 0305-1048 . ПМЦ 6868439 . PMID 31665448 .
- ^ Jump up to: а б Блюм, Б.; Бакалара, Н.; Симпсон, Л. (26 января 1990 г.). «Модель редактирования РНК в митохондриях кинетопластид: молекулы «направляющей» РНК, транскрибируемые из ДНК максикольца, предоставляют отредактированную информацию» . Клетка . 60 (2): 189–198. дои : 10.1016/0092-8674(90)90735-w . ISSN 0092-8674 . ПМИД 1688737 . S2CID 19656609 .
- ^ Блом, Даниэль; Хаан, Аннетт Де; Бург, Дженни Ван Ден; Берг, Марлен Ван Ден; Слуф, Пол; Йирку, Милан; Люкс, Юлиус; Бенне, Роб (январь 2000 г.). «Митохондриальные миникольца у свободноживущих бодонид Bodo saltans содержат две кассеты генов гРНК и не встречаются в крупных сетях» . РНК . 6 (1): 121–135. дои : 10.1017/S1355838200992021 . ISSN 1355-8382 . ПМК 1369900 . ПМИД 10668805 .
- ^ Прочтите, ЛК; Майлер, ПиДжей; Стюарт, К. (январь 1992 г.). «Обширное редактирование как обработанных, так и предварительно обработанных транскриптов CR6 maxicircle у Trypanosoma brucei» . Журнал биологической химии . 267 (2): 1123–1128. дои : 10.1016/s0021-9258(18)48405-0 . ISSN 0021-9258 . ПМИД 1730639 .
- ^ Jump up to: а б Афазижев, Руслан; Афазижева, Инна (сентябрь 2011 г.). «Редактирование вставки / удаления уридина в трипаносомах: площадка для передачи информации под управлением РНК» . ПРОВОДА РНК . 2 (5): 669–685. дои : 10.1002/wrna.82 . ISSN 1757-7004 . ПМК 3154072 . ПМИД 21823228 .
- ^ Блюм, Бит; Симпсон, Ларри (июль 1990 г.). «Направляющие РНК в митохондриях кинетопластид имеют некодируемый 3'-олиго(U)-хвост, участвующий в распознавании предварительно отредактированной области» . Клетка . 62 (2): 391–397. дои : 10.1016/0092-8674(90)90375-о . ISSN 0092-8674 . ПМИД 1695552 . S2CID 2181338 .
- ^ Jump up to: а б Коннелл, Грегори Дж.; Бирн, Элейн М.; Симпсон, Ларри (14 февраля 1997 г.). «Направляющая РНК-независимая и направляющая РНК-зависимая вставка уридина в мРНК цитохрома b в митохондриальном лизате Leishmania tarentolae РОЛЬ ВТОРИЧНОЙ СТРУКТУРЫ РНК» . Журнал биологической химии . 272 (7): 4212–4218. дои : 10.1074/jbc.272.7.4212 . ISSN 0021-9258 . ПМИД 9020135 .
- ^ Бирн, EM; Коннелл, Дж.Дж.; Симпсон, Л. (декабрь 1996 г.). «Руководство по редактированию РНК с вставкой уридина in vitro» . Журнал ЭМБО . 15 (23): 6758–6765. дои : 10.1002/j.1460-2075.1996.tb01065.x . ISSN 0261-4189 . ПМЦ 452499 . ПМИД 8978701 .
- ^ Jump up to: а б Маслов, Дмитрий А. (октябрь 2010 г.). «Полный набор митохондриальных панредактированных мРНК Leishmania mexicana amazonensis LV78» . Молекулярная и биохимическая паразитология . 173 (2): 107–114. дои : 10.1016/j.molbiopara.2010.05.013 . ISSN 0166-6851 . ПМЦ 2913609 . ПМИД 20546801 .
- ^ Маслов Дмитрий А.; Симпсон, Ларри (август 1992 г.). «Полярность редактирования внутри множественного домена, опосредованного гРНК, обусловлена образованием якорей для вышестоящих гРНК путем нижестоящего редактирования» . Клетка . 70 (3): 459–467. дои : 10.1016/0092-8674(92)90170-H . ПМИД 1379519 .
- ^ Брозиус, Юрген (2003), «Вклад РНК и ретропозиции в эволюционные новинки» , «Происхождение и эволюция новых функций генов », «Современные проблемы генетики и эволюции», том. 10, Дордрехт: Springer Нидерланды, стр. 99–116, doi : 10.1007/978-94-010-0229-5_1 , ISBN. 978-94-010-3982-6 , получено 24 февраля 2024 г.
- ^ Дешам, П.; Лара, Э.; Маранде, В.; Лопес-Гарсия, П.; Экелунд, Ф.; Морейра, Д. (28 октября 2010 г.). «Филогеномный анализ кинетопластид подтверждает, что трипаносоматиды возникли из бодонид» . Молекулярная биология и эволюция . 28 (1): 53–58. дои : 10.1093/molbev/msq289 . ISSN 0737-4038 . ПМИД 21030427 .
- ^ Виденхефт, Блейк; Штернберг, Сэмюэл Х.; Дудна, Дженнифер А. (февраль 2012 г.). «Системы генетического молчания, управляемые РНК, у бактерий и архей» . Природа . 482 (7385): 331–338. Бибкод : 2012Natur.482..331W . дои : 10.1038/nature10886 . ISSN 1476-4687 . ПМИД 22337052 . S2CID 205227944 .
- ^ Бхайя, Деваки; Дэвисон, Мишель; Баррангу, Родольф (2011). «Системы CRISPR-Cas у бактерий и архей: универсальные малые РНК для адаптивной защиты и регуляции» . Ежегодный обзор генетики . 45 : 273–297. doi : 10.1146/annurev-genet-110410-132430 . ISSN 1545-2948 . ПМИД 22060043 .
- ^ Тернс, Майкл П.; Тернс, Ребекка М. (июнь 2011 г.). «Адаптивные иммунные системы на основе CRISPR» . Современное мнение в микробиологии . 14 (3): 321–327. дои : 10.1016/j.mib.2011.03.005 . ISSN 1879-0364 . ПМК 3119747 . ПМИД 21531607 .
- ^ Стюарт, Кеннет Д.; Шнауфер, Ахим; Эрнст, Нэнси Льюис; Паниграхи, Ашвини К. (февраль 2005 г.). «Комплексное управление: редактирование РНК в трипаносомах» . Тенденции биохимических наук . 30 (2): 97–105. дои : 10.1016/j.tibs.2004.12.006 . ISSN 0968-0004 . ПМИД 15691655 .
- ^ Jump up to: а б Цзян, Фуго; Дудна, Дженнифер А. (22 мая 2017 г.). «Структуры и механизмы CRISPR–Cas9» . Ежегодный обзор биофизики . 46 (1): 505–529. doi : 10.1146/annurev-biophys-062215-010822 . ISSN 1936-122Х . ПМИД 28375731 .
- ^ Чилинский, Кшиштоф; Макарова Кира С.; Шарпантье, Эммануэль; Кунин, Евгений В. (11 апреля 2014 г.). «Классификация и эволюция систем CRISPR-Cas типа II» . Исследования нуклеиновых кислот . 42 (10): 6091–6105. дои : 10.1093/nar/gku241 . ISSN 1362-4962 . ПМК 4041416 . ПМИД 24728998 .
- ^ Чилинский, Кшиштоф; Ле Рун, Анаис; Шарпантье, Эммануэль (май 2013 г.). «Семейства tracrRNA и Cas9 систем иммунитета CRISPR-Cas типа II» . Биология РНК . 10 (5): 726–737. дои : 10.4161/rna.24321 . ISSN 1547-6286 . ПМЦ 3737331 . ПМИД 23563642 .
- ^ Сюй, Патрик Д.; Скотт, Дэвид А.; Вайнштейн, Джошуа А.; Ран, Ф. Энн; Конерманн, Сильвана; Агарвала, Винита; Ли, Иньцин; Хорошо, Эли Дж.; У, Сюэбин; Шалем, Офир; Крэдик, Томас Дж.; Марраффини, Лучано А.; Бао, Банда; Чжан, Фэн (сентябрь 2013 г.). «Специфичность воздействия на ДНК РНК-ориентированных нуклеаз Cas9» . Природная биотехнология . 31 (9): 827–832. дои : 10.1038/nbt.2647 . ISSN 1546-1696 . ПМЦ 3969858 . ПМИД 23873081 .
- ^ Дёнч, Джон Г.; Хартениан, Элла; Грэм, Дэниел Б.; Тотова, Зузана; Хегде, Мудра; Смит, Ян; Саллендер, Миган; Эберт, Бенджамин Л.; Ксавье, Рамник Дж.; Рут, Дэвид Э. (декабрь 2014 г.). «Рациональный дизайн высокоактивных sgRNA для инактивации генов, опосредованной CRISPR-Cas9» . Природная биотехнология . 32 (12): 1262–1267. дои : 10.1038/nbt.3026 . ISSN 1546-1696 . ПМЦ 4262738 . ПМИД 25184501 .
- ^ Лин, Янни; Крэдик, Томас Дж.; Браун, Мэтью Т.; Дешмукх, Харшавардхан; Ранджан, Пиюш; Сароде, Неха; Уайл, Брайан М.; Вертино, Паула М.; Стюарт, Фрэнк Дж.; Бао, Банда (июнь 2014 г.). «Системы CRISPR/Cas9 обладают нецелевой активностью с вставками или делециями между последовательностями целевой ДНК и направляющей РНК» . Исследования нуклеиновых кислот . 42 (11): 7473–7485. дои : 10.1093/nar/gku402 . ISSN 1362-4962 . ПМК 4066799 . ПМИД 24838573 .
- ^ Вонг, Натан; Лю, Вэйцзюнь; Ван, Сяовэй (18 сентября 2015 г.). «WU-CRISPR: характеристики функциональных направляющих РНК для системы CRISPR/Cas9» . Геномная биология . 16 :218. bioRxiv 10.1101/026971 . дои : 10.1186/s13059-015-0784-0 . ПМЦ 4629399 . ПМИД 26521937 .
- ^ Карвелис, Таутвидас; Гасюнас, Гедрюс; Миксы, Альгирдас; Баррангу, Родольф; Хорват, Филипп; Сикснис, Виргиниюс (01.05.2013). «crRNA и tracrRNA направляют Cas9-опосредованную интерференцию ДНК у Streptococcus thermophilus» . Биология РНК . 10 (5): 841–851. дои : 10.4161/rna.24203 . ISSN 1547-6286 . ПМЦ 3737341 . ПМИД 23535272 .
- ^ Басс, Бренда Л. (2002). «Редактирование РНК аденозиндезаминазами, действующими на РНК» . Ежегодный обзор биохимии . 71 : 817–846. doi : 10.1146/annurev.biochem.71.110601.135501 . ISSN 0066-4154 . ПМК 1823043 . ПМИД 12045112 .
- ^ Фукуда, Масатора; Умено, Хиромицу; Нос, Всегда; Нишитарумидзу, Азуса; Ногучи, Рёма; Накагава, Хироюки (2 февраля 2017 г.). «Создание направляющей РНК для сайт-направленного мутагенеза РНК с использованием внутриклеточного редактирования РНК A-to-I» . Научные отчеты 7 : 41478. Бибкод : 2017NatSR... 741478F дои : 10.1038/srep41478 . ISSN 2045-2322 . ПМЦ 5288656 . ПМИД 28148949 .
- ^ Маден, Бельгия (1990). «Многочисленные модифицированные нуклеотиды в эукариотической рибосомальной РНК» . Прогресс в исследованиях нуклеиновых кислот и молекулярной биологии . 39 : 241–303. дои : 10.1016/s0079-6603(08)60629-7 . ISBN 978-0-12-540039-8 . ISSN 0079-6603 . ПМИД 2247610 .
- ^ Ха, Минджу; Ким, В. Нарри (август 2014 г.). «Регуляция биогенеза микроРНК» . Обзоры природы. Молекулярно-клеточная биология . 15 (8): 509–524. дои : 10.1038/nrm3838 . ISSN 1471-0080 . ПМИД 25027649 .
Дальнейшее чтение
[ редактировать ]- Руководство по редактированию РНК с помощью РНК-инсерции уридина in vitro http://www.jbc.org/content/272/7/4212.full
- Блюм, Бит; Симпсон, Ларри (1990). «Направляющие РНК в митохондриях кинетопластид имеют некодируемый 3'-олиго(U) хвост, участвующий в распознавании предварительно отредактированной области». Клетка . 62 (2): 391–397. дои : 10.1016/0092-8674(90)90375-О . ПМИД 1695552 . S2CID 2181338 .
- Курата, Морито; Вольф, Натали К.; Лар, Уокер С.; Вег, Мэдисон Т.; Клюснер, Митчелл Г.; Ли, Саманта; Хуэй, Кай; Сираива, Масано; Уэббер, Бо Р.; Мориарити, Бранден С. (2018). «Высокомультиплексная геномная инженерия с использованием массивов гРНК CRISPR/Cas9» . ПЛОС ОДИН . 13 (9): e0198714. Бибкод : 2018PLoSO..1398714K . дои : 10.1371/journal.pone.0198714 . ПМК 6141065 . ПМИД 30222773 .
- Хан, Фехад Дж.; Юэнь, Гармен; Ло, Цзи (2019). «Мультиплексный нокаут гена CRISPR/Cas9 с простой котрансфекцией crRNA:tracrRNA» . Клетка и биологические науки . 9:41 . дои : 10.1186/s13578-019-0304-0 . ПМК 6528186 . ПМИД 31139343 .
- Нишимасу, Хироши; Нуреки, Осаму (2017). «Структуры и механизмы эффекторных нуклеаз, управляемых CRISPR РНК» . Современное мнение в области структурной биологии . 43 : 68–78. дои : 10.1016/j.sbi.2016.11.013 . ПМИД 27912110 .
- Чуай, Гохуэй; Янь, Чэнь, Мин; Сюэ, Дунъюй; Чэнь, Кэ; Гу, Фэн; Дешуан, Цзя; Лю, Ци (2018). «DeepCRISPR: Оптимизированный дизайн РНК с помощью глубокого обучения» . Геномная биология . 19 (1): 80. : 10.1186 / . doi s13059-018-1459-4 . ПМИД 29945655