Геномика
| Часть серии о |
| Генетика |
|---|
 |
Геномика — это междисциплинарная область молекулярной биологии, фокусирующаяся на структуре, функциях, эволюции, картировании и редактировании геномов . организма Геном — это полный набор ДНК , включая все его гены, а также его иерархическую трехмерную структурную конфигурацию. [1] [2] [3] [4] В отличие от генетики , которая занимается изучением отдельных генов и их роли в наследовании, геномика направлена на коллективную характеристику и количественную оценку всех генов организма, их взаимосвязей и влияния на организм. [5] Гены могут управлять выработкой белков с помощью ферментов и молекул-мессенджеров. В свою очередь, белки составляют структуры тела, такие как органы и ткани, а также контролируют химические реакции и переносят сигналы между клетками. Геномика также включает в себя секвенирование и анализ геномов с использованием высокопроизводительного секвенирования ДНК и биоинформатики для сборки и анализа функций и структуры целых геномов. [6] [7] Достижения в области геномики вызвали революцию в исследованиях, основанных на открытиях, и системной биологии, которые облегчили понимание даже самых сложных биологических систем, таких как мозг. [8]
Эта область также включает исследования внутригеномных (внутри генома) явлений, таких как эпистаз (влияние одного гена на другой), плейотропия (один ген влияет на более чем один признак), гетерозис (гибридная сила) и другие взаимодействия между локусами и аллелями внутри генома. геном. [9]
История [ править ]
Этимология [ править ]
От греческого ΓΕΝ [10] gen , «ген» (гамма, эпсилон, ню, эпсилон), означающий «становиться, создавать, творение, рождение», и последующие варианты: генеалогия, генезис, генетика, генный, геномер, генотип, род и т. д. В то время как слово геном (от геном немецкий ) , приписываемый Гансу Винклеру использовался в английском языке еще в 1926 году, [11] Термин «геномика» был придуман Томом Родериком, генетиком из лаборатории Джексона ( Бар-Харбор, штат Мэн ), за пивом с Джимом Вомаком, Томом Шоусом и Стивеном О'Брайеном на встрече, состоявшейся в Мэриленде по картированию генома человека в 1986 году. . [12] Сначала как название нового журнала , а затем как целой новой научной дисциплины. [13]
усилия секвенированию по Ранние
После подтверждения Розалиндой Франклин спиральной структуры ДНК, публикации Джеймсом Д. Уотсоном и Фрэнсисом Криком структуры ДНК в 1953 году и Фредом Сэнгером публикации аминокислотной последовательности инсулина в 1955 году секвенирование нуклеиновых кислот стало основная цель первых молекулярных биологов . [14] В 1964 году Роберт Холли и его коллеги опубликовали первую когда-либо определенную последовательность нуклеиновой кислоты - рибонуклеотидную последовательность аланина РНК-переносчика . [15] [16] Продолжая эту работу, Маршалл Ниренберг и Филип Ледер выявили триплетную природу генетического кода и в своих экспериментах смогли определить последовательности 54 из 64 кодонов . [17] В 1972 году Уолтер Фирс и его команда из Лаборатории молекулярной биологии Гентского университета ( Гент , Бельгия ) первыми определили последовательность гена: гена белка оболочки бактериофага MS2 . [18] Группа Фирса расширила свою работу по белку оболочки MS2, определив полную нуклеотидную последовательность РНК бактериофага MS2 (чей геном кодирует всего четыре гена в 3569 парах оснований [bp]) и обезьяньего вируса 40 в 1976 и 1978 годах соответственно. [19] [20]
ДНК Разработана секвенирования технология
Помимо своей плодотворной работы над аминокислотной последовательностью инсулина, Фредерик Сэнгер и его коллеги сыграли ключевую роль в разработке методов секвенирования ДНК, которые позволили создать комплексные проекты по секвенированию генома. [9] В 1975 году он и Алан Коулсон опубликовали процедуру секвенирования с использованием ДНК-полимеразы с радиоактивно меченными нуклеотидами, которую он назвал методом «Плюс и Минус» . [21] [22] Это включало два близкородственных метода, которые позволили получить короткие олигонуклеотиды с определенными 3'-концами. Их можно фракционировать электрофорезом в полиакриламидном геле (так называемый электрофорез в полиакриламидном геле) и визуализировать с помощью авторадиографии. Эта процедура позволяла секвенировать до 80 нуклеотидов за один раз и была большим улучшением, но все равно оставалась очень трудоемкой. Тем не менее, в 1977 году его группа смогла секвенировать большую часть из 5386 нуклеотидов одноцепочечного бактериофага φX174 , завершив первый полностью секвенированный геном на основе ДНК. [23] Усовершенствование метода Плюс и Минус привело к появлению метода обрыва цепи, или метода Сэнгера (см. ниже ), который лег в основу методов секвенирования ДНК, картирования генома, хранения данных и биоинформационного анализа, наиболее широко используемых в следующем квартале. - столетие исследований. [24] [25] В том же году Уолтер Гилберт и Аллан Максам из Гарвардского университета независимо разработали метод Максама-Гилберта (также известный как химический метод ) секвенирования ДНК, включающий преимущественное расщепление ДНК по известным основаниям, что является менее эффективным методом. [26] [27] За новаторскую работу в области секвенирования нуклеиновых кислот Гилберт и Сэнгер разделили половину Нобелевской премии по химии 1980 года с Полом Бергом ( рекомбинантная ДНК ).
Полные геномы [ править ]
Появление этих технологий привело к быстрому увеличению масштабов и скорости завершения проектов по секвенированию генома . Первая полная последовательность генома эукариотической органеллы человека , митохондрии (16 568 пар оснований, около 16,6 т.п.н. [килобаз]), была опубликована в 1981 году. [28] а первые геномы хлоропластов последовали в 1986 году. [29] [30] В 1992 году была секвенирована первая эукариотическая хромосома , хромосома III пивных дрожжей Saccharomyces cerevisiae (315 т.п.н.). [31] Первым свободноживущим организмом, секвенированным в 1995 году, был Haemophilus influenzae (1,8 МБ [мегабаза]). [32] В следующем году консорциум исследователей из лабораторий Северной Америки , Европы и Японии объявил о завершении первой полной последовательности генома эукариота S. cerevisiae (12,1 МБ), и с тех пор геномы секвенируются с экспоненциально растущей скоростью. шаг. [33] По состоянию на октябрь 2011 г. [update]полные последовательности доступны для: 2719 вирусов , 1115 архей и бактерий и 36 эукариот , из которых около половины — грибы . [34] [35]

Большинство микроорганизмов, чьи геномы были полностью секвенированы, являются проблемными патогенами , такими как Haemophilus influenzae , что привело к выраженному отклонению в их филогенетическом распределении по сравнению с широтой микробного разнообразия. [36] [37] Из других секвенированных видов большинство было выбрано потому, что они представляли собой хорошо изученные модельные организмы или обещали стать хорошими моделями. Дрожжи ( Saccharomyces cerevisiae ) долгое время были важным модельным организмом для эукариотической клетки , а плодовая мушка Drosophila melanogaster была очень важным инструментом (особенно в ранней домолекулярной генетике ). Червь Caenorhabditis elegans — часто используемая простая модель многоклеточных организмов . Рыбка данио Brachydanio rerio используется во многих исследованиях развития на молекулярном уровне, а растение Arabidopsis thaliana является модельным организмом для цветковых растений. Японская рыба-фугу ( Takifugu Rubripes ) и пятнистая зеленая рыба-фугу ( Tetraodon nigroviridis ) интересны своими маленькими и компактными геномами, которые содержат очень мало некодирующей ДНК по сравнению с большинством видов. [38] [39] Собака-млекопитающее ( Canis familiaris ), [40] бурая крыса ( Rattus norvegicus ), мышь ( Mus musculus ) и шимпанзе ( Pan troglodytes ) являются важными модельными животными в медицинских исследованиях. [27]
Черновой вариант генома человека был завершен в рамках проекта «Геном человека» в начале 2001 года, что вызвало много шума. [41] В этом проекте, завершенном в 2003 году, секвенировали весь геном одного конкретного человека, и к 2007 году эта последовательность была объявлена «завершенной» (менее одной ошибки на 20 000 оснований и всех собранных хромосом). [41] За прошедшие годы геномы многих других людей были секвенированы, частично под эгидой проекта «1000 геномов» , который объявил о секвенировании 1092 геномов в октябре 2012 года. [42] Завершение этого проекта стало возможным благодаря разработке значительно более эффективных технологий секвенирования и потребовало привлечения значительных ресурсов биоинформатики в результате широкого международного сотрудничества. [43] Продолжающийся анализ геномных данных человека имеет глубокие политические и социальные последствия для человеческого общества. [44]
Революция » омикса «
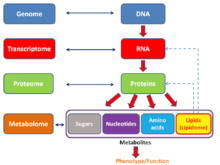
Англоязычный неологизм omics неофициально относится к области исследований в биологии, оканчивающейся на -omics , такой как геномика, протеомика или метаболомика . Родственный суффикс -оме используется для обращения к объектам изучения таких областей, как геном , протеом или метаболом ( липидом ) соответственно. Суффикс -оме , используемый в молекулярной биологии, относится к совокупности некоторой ; Точно так же омика стала в целом относиться к изучению больших и полных наборов биологических данных. Хотя рост использования этого термина привел к тому, что некоторые ученые ( Джонатан Эйзен и другие) [45] ) утверждать, что он был перепродан, [46] оно отражает изменение ориентации на количественный анализ полного или почти полного ассортимента всех составляющих системы. [47] Например, при изучении симбиозов исследователи, которые когда-то ограничивались изучением одного генного продукта, теперь могут одновременно сравнивать общий набор нескольких типов биологических молекул. [48] [49]
Геномный анализ [ править ]
После того, как организм выбран, геномные проекты включают три компонента: секвенирование ДНК, сборку этой последовательности для создания представления исходной хромосомы, а также аннотацию и анализ этого представления. [9]
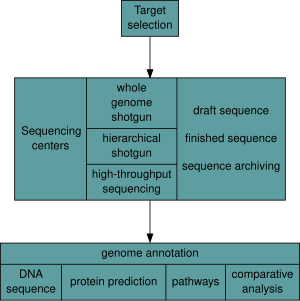
Секвенирование [ править ]
Исторически секвенирование проводилось в центрах секвенирования , централизованных учреждениях (начиная от крупных независимых учреждений, таких как Объединенный институт генома , который секвенирует десятки терабаз в год, до местных основных центров молекулярной биологии), которые содержат исследовательские лаборатории с дорогостоящим оборудованием и необходимой технической поддержкой. Однако по мере того, как технология секвенирования продолжает совершенствоваться, новое поколение эффективных быстродействующих настольных секвенаторов стало доступно средней академической лаборатории. [50] [51] В целом подходы к секвенированию генома делятся на две широкие категории: дробовое секвенирование и высокопроизводительное секвенирование (или секвенирование следующего поколения ). [9]
Последовательность дробовика [ править ]

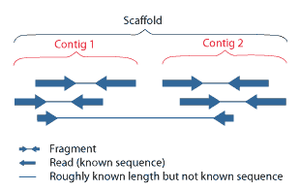
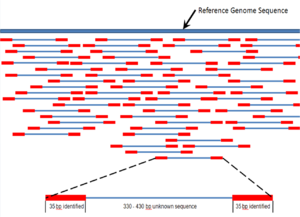
Секвенирование дробовиком — это метод секвенирования, предназначенный для анализа последовательностей ДНК длиной более 1000 пар оснований, включая целые хромосомы. [52] Он назван по аналогии с быстро расширяющейся квазислучайной схемой стрельбы из дробовика . Поскольку секвенирование гель-электрофорезом можно использовать только для довольно коротких последовательностей (от 100 до 1000 пар оснований), более длинные последовательности ДНК необходимо разбить на случайные небольшие сегменты, которые затем секвенируются для получения считываний . Множественные перекрывающиеся прочтения целевой ДНК получают путем выполнения нескольких раундов фрагментации и секвенирования. Компьютерные программы затем используют перекрывающиеся концы разных чтений, чтобы собрать их в непрерывную последовательность. [52] [53] Секвенирование дробовика — это процесс случайной выборки, требующий избыточной выборки, чтобы гарантировать, что данный нуклеотид представлен в реконструированной последовательности; Среднее количество чтений, при которых геном подвергается избыточной выборке, называется покрытием . [54]
На протяжении большей части своей истории технология, лежащая в основе дробового секвенирования, представляла собой классический метод обрыва цепи или « метод Сэнгера », который основан на селективном включении дидезоксинуклеотидов, обрывающих цепь, с помощью ДНК-полимеразы во время in vitro репликации ДНК . [23] [55] В последнее время метод секвенирования был вытеснен высокопроизводительными методами секвенирования, особенно для крупномасштабного автоматического анализа генома . Тем не менее, метод Сэнгера по-прежнему широко используется, в первую очередь для небольших проектов и для получения особенно длинных последовательных считываний последовательностей ДНК (> 500 нуклеотидов). [56] Методы обрыва цепи требуют одноцепочечной ДНК-матрицы, ДНК- праймера , ДНК-полимеразы , нормальных дезоксинуклеозидтрифосфатов (dNTP) и модифицированных нуклеотидов (дидезоксиNTP), которые завершают удлинение цепи ДНК. В этих нуклеотидах, оканчивающих цепь, отсутствует 3'- ОН- группа, необходимая для образования фосфодиэфирной связи между двумя нуклеотидами, в результате чего ДНК-полимераза прекращает удлинение ДНК при включении ddNTP. ddNTP могут быть радиоактивно или флуоресцентно помечены для обнаружения в секвенаторах ДНК . [9] Обычно эти машины могут секвенировать до 96 образцов ДНК за одну партию (прогон) за 48 прогонов в день. [57]
Высокопроизводительное секвенирование
Высокий спрос на недорогое секвенирование привел к развитию технологий высокопроизводительного секвенирования, которые распараллеливают процесс секвенирования, производя тысячи или миллионы последовательностей одновременно. [58] [59] Высокопроизводительное секвенирование призвано снизить стоимость секвенирования ДНК по сравнению с тем, что возможно при использовании стандартных методов красителя-терминатора. При сверхвысокопроизводительном секвенировании можно параллельно выполнять до 500 000 операций секвенирования путем синтеза. [60] [61]

Метод секвенирования красителя Illumina основан на обратимых терминаторах красителя и был разработан в 1996 году в Женевском институте биомедицинских исследований Паскалем Майером и Лораном Фаринелли. [62] В этом методе молекулы ДНК и праймеры сначала прикрепляются к предметному стеклу и амплифицируются с помощью полимеразы, так что образуются локальные клональные колонии, первоначально называемые «колониями ДНК». Для определения последовательности добавляются четыре типа обратимых терминаторных оснований (RT-оснований) и отмываются невключенные нуклеотиды. В отличие от пиросеквенирования, цепи ДНК удлиняются по одному нуклеотиду за раз, и получение изображений может выполняться с задержкой, что позволяет захватывать очень большие массивы колоний ДНК с помощью последовательных изображений, полученных с одной камеры. Разделение ферментативной реакции и захвата изображения обеспечивает оптимальную производительность и теоретически неограниченную мощность секвенирования; при оптимальной конфигурации конечная производительность прибора зависит только от скорости аналого-цифрового преобразования камеры. Камера делает изображения флуоресцентно меченных нуклеотидов, затем краситель вместе с блокатором концевого 3'-конца химически удаляется из ДНК, позволяя перейти к следующему циклу. [63]
Альтернативный подход — ионно-полупроводниковое секвенирование — основан на стандартной химии репликации ДНК. Эта технология измеряет высвобождение ионов водорода каждый раз при добавлении основания. Микролунка, содержащая ДНК-матрицу, заполнена одним нуклеотидом . Если нуклеотид комплементарен цепи матрицы, он будет включен и высвободится ион водорода. Этот выпуск запускает ионный датчик ISFET . Если в матричной последовательности присутствует гомополимер , несколько нуклеотидов будут включены в один цикл заполнения, и обнаруженный электрический сигнал будет пропорционально выше. [64]
Сборка [ править ]
Сборка последовательности относится к выравниванию и слиянию фрагментов гораздо более длинной последовательности ДНК с целью восстановления исходной последовательности. [9] Это необходимо, поскольку современная технология секвенирования ДНК не может считывать целые геномы как непрерывную последовательность, а скорее считывает небольшие фрагменты длиной от 20 до 1000 оснований, в зависимости от используемой технологии. Технологии секвенирования третьего поколения, такие как PacBio или Oxford Nanopore, обычно генерируют считывания секвенирования длиной более 10 КБ; однако у них высокий уровень ошибок — примерно 15 процентов. [65] [66] Обычно короткие фрагменты, называемые чтениями, возникают в результате секвенирования геномной ДНК или транскриптов генов ( EST ). [9]
Подходы к сборке [ править ]
Сборку можно в общих чертах разделить на два подхода: сборка de novo для геномов, которые не похожи ни на один секвенированный в прошлом, и сравнительная сборка, которая использует существующую последовательность близкородственного организма в качестве эталона во время сборки. [54] По сравнению со сравнительной сборкой, сборка de novo сложна в вычислительном отношении ( NP-hard ), что делает ее менее благоприятной для технологий NGS короткого чтения. В рамках парадигмы сборки de novo существуют две основные стратегии сборки: стратегии Эйлера и стратегии перекрытия-компоновки-консенсуса (OLC). Стратегии OLC в конечном итоге пытаются создать гамильтонов путь через граф перекрытия, что является NP-сложной проблемой. Стратегии эйлерова пути более удобны в вычислительном отношении, поскольку они пытаются найти эйлеров путь через граф де Брёйна. [54]
Завершение [ править ]
Готовые геномы определяются как имеющие одну непрерывную последовательность без двусмысленностей, представляющую каждый репликон . [67]
Аннотация [ править ]
Сама по себе сборка последовательности ДНК не имеет большого значения без дополнительного анализа. [9] Аннотация генома — это процесс прикрепления биологической информации к последовательностям , который состоит из трех основных этапов: [68]
- выявление частей генома, которые не кодируют белки
- идентификация элементов в геноме , процесс, называемый предсказанием генов , и
- прикрепление биологической информации к этим элементам.
Инструменты автоматического аннотирования пытаются выполнить эти шаги in silico , в отличие от ручного аннотирования (так называемого курирования), которое предполагает человеческий опыт и потенциальную экспериментальную проверку. [69] В идеале эти подходы сосуществуют и дополняют друг друга в одном конвейере аннотаций (см. также ниже ).
Традиционно базовым уровнем аннотации является использование BLAST для поиска сходства, а затем аннотирование геномов на основе гомологов. [9] Совсем недавно на платформу аннотаций была добавлена дополнительная информация. Дополнительная информация позволяет аннотаторам вручную устранять расхождения между генами, которым присвоена одна и та же аннотация. Некоторые базы данных используют информацию о контексте генома, оценки сходства, экспериментальные данные и интеграцию других ресурсов для предоставления аннотаций генома с помощью своего подхода подсистем. Другие базы данных (например, Ensembl ) полагаются как на курируемые источники данных, так и на ряд программных инструментов в своем автоматизированном конвейере аннотаций генома. [70] Структурная аннотация состоит из идентификации геномных элементов, в первую очередь ORF , и их локализации или структуры гена. Функциональная аннотация заключается в прикреплении биологической информации к геномным элементам.
Конвейеры секвенирования и данных базы
Необходимость воспроизводимости и эффективного управления большими объемами данных, связанных с геномными проектами, означает, что вычислительные конвейеры имеют важные приложения в геномике. [71]
Области исследований [ править ]
Функциональная геномика [ править ]
Функциональная геномика — это область молекулярной биологии , которая пытается использовать огромное количество данных, полученных в результате геномных проектов (таких как проекты секвенирования генома ), для описания функций и взаимодействий генов (и белков ). Функциональная геномика фокусируется на динамических аспектах, таких как транскрипция генов , трансляция и белок-белковые взаимодействия , в отличие от статических аспектов геномной информации, таких как последовательность или структуры ДНК. Функциональная геномика пытается ответить на вопросы о функции ДНК на уровне генов, транскриптов РНК и белковых продуктов. Ключевой характеристикой исследований функциональной геномики является их общегеномный подход к этим вопросам, обычно включающий высокопроизводительные методы, а не более традиционный подход «ген за геном».
Основная отрасль геномики по-прежнему занимается секвенированием геномов различных организмов, но знание полных геномов создало возможность для области функциональной геномики , которая в основном занимается изучением закономерностей экспрессии генов в различных условиях. Важнейшими инструментами здесь являются микрочипы и биоинформатика .
Структурная геномика [ править ]
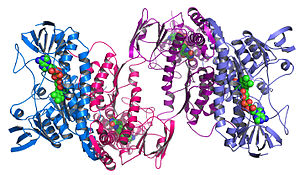
Структурная геномика стремится описать трехмерную структуру каждого белка, кодируемого данным геномом . [72] [73] Этот основанный на геноме подход позволяет использовать высокопроизводительный метод определения структуры за счет сочетания экспериментальных и модельных подходов . Принципиальное различие между структурной геномикой и традиционным структурным предсказанием заключается в том, что структурная геномика пытается определить структуру каждого белка, кодируемого геномом, а не сосредотачивается на одном конкретном белке. При наличии полногеномных последовательностей предсказание структуры может осуществляться быстрее за счет сочетания экспериментальных и модельных подходов, особенно потому, что наличие большого количества секвенированных геномов и ранее решенных белковых структур позволяет ученым моделировать структуру белка на основе ранее решенных структур. гомологи. Структурная геномика включает в себя использование большого количества подходов к определению структуры, включая экспериментальные методы с использованием геномных последовательностей или подходы, основанные на моделировании, основанные на последовательностях или структурной гомологии с белком известной структуры или основанные на химических и физических принципах для белка, не имеющего гомологии с белком известной структуры. любая известная структура. В отличие от традиционных В структурной биологии определение структуры белка с помощью структурной геномики часто (но не всегда) происходит до того, как становится известно что-либо о функции белка. Это поднимает новые задачи в структурной биоинформатике , т.е. определение функции белка по его трехмерной структуре. [74]
Эпигеномика [ править ]
Эпигеномика — это изучение полного набора эпигенетических модификаций генетического материала клетки, известного как эпигеном . [75] Эпигенетические модификации — это обратимые модификации ДНК или гистонов клетки, которые влияют на экспрессию генов без изменения последовательности ДНК (Russell 2010, стр. 475). Двумя наиболее характерными эпигенетическими модификациями являются метилирование ДНК и модификация гистонов . [76] Эпигенетические модификации играют важную роль в экспрессии и регуляции генов, а также участвуют во многих клеточных процессах, таких как дифференцировка/развитие. [77] и онкогенез . [75] Изучение эпигенетики на глобальном уровне стало возможным лишь недавно благодаря адаптации высокопроизводительных геномных анализов. [78]
Метагеномика [ править ]
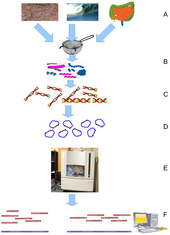
Метагеномика — это изучение метагеномов , генетического материала, полученного непосредственно из образцов окружающей среды . Эту широкую область можно также назвать геномикой окружающей среды, экогеномикой или геномикой сообщества. В то время как традиционная микробиология и секвенирование микробного генома полагаются на культивируемые клональные культуры , раннее секвенирование генов окружающей среды клонировало специфические гены (часто ген 16S рРНК ) для получения профиля разнообразия в природном образце. Такая работа показала, что подавляющее большинство микробного биоразнообразия было упущено из-за методов культивирования . [79] В недавних исследованиях используется «дробовическое» секвенирование по Сэнгеру или массовое параллельное пиросеквенирование, чтобы получить в значительной степени объективные образцы всех генов от всех членов отобранных сообществ. [80] Благодаря своей способности раскрыть ранее скрытое разнообразие микроскопической жизни, метагеномика предлагает мощную линзу для рассмотрения микробного мира, которая потенциально может революционизировать понимание всего живого мира. [81] [82]
Модельные системы [ править ]
Вирусы и бактериофаги [ править ]
Бактериофаги играли и продолжают играть ключевую роль в генетике бактерий и молекулярной биологии . Исторически они использовались для определения структуры генов и регуляции генов. Кроме того, первым геномом , который был секвенирован, был бактериофаг . Однако исследования бактериофагов не привели к революции в геномике, в которой явно доминирует бактериальная геномика. Лишь совсем недавно изучение геномов бактериофагов стало заметным, что позволило исследователям понять механизмы, лежащие в основе эволюции фагов . Последовательности генома бактериофагов могут быть получены путем прямого секвенирования изолированных бактериофагов, но также могут быть получены как часть микробных геномов. Анализ бактериальных геномов показал, что значительное количество микробной ДНК состоит из профаговых последовательностей и профагоподобных элементов. [83] Подробный анализ этих последовательностей в базе данных дает представление о роли профагов в формировании бактериального генома: в целом этот метод подтвердил многие известные группы бактериофагов, что делает его полезным инструментом для прогнозирования взаимоотношений профагов из бактериальных геномов. [84] [85]
Цианобактерии [ править ]
В настоящее время существует 24 цианобактерии , для которых доступна полная последовательность генома. 15 из этих цианобактерий происходят из морской среды. Это шесть штаммов Prochromococcus , семь морских штаммов Synechococcus , Trichodesmium erythraeum IMS101 и Crocosphaera watsonii WH8501 . Несколько исследований продемонстрировали, как эти последовательности можно очень успешно использовать для определения важных экологических и физиологических характеристик морских цианобактерий. Однако в настоящее время ведется еще много геномных проектов, среди которых есть другие изоляты Prochromococcus и морских Synechococcus , Acaryochromis и Prochromon , N 2 -фиксирующие нитчатые цианобактерии Nodularia spumigena , Lyngbya aestuarii и Lyngbya majuscula , а также бактериофаги , заражающие морские цианобактерии. . Таким образом, растущий объем геномной информации можно использовать и в более общем плане для решения глобальных проблем, применяя сравнительный подход. Некоторыми новыми и захватывающими примерами прогресса в этой области являются идентификация генов регуляторных РНК, понимание эволюционного происхождения фотосинтез или оценка вклада горизонтального переноса генов в анализируемые геномы. [86]
Приложения [ править ]

Геномика нашла применение во многих областях, включая медицину , биотехнологию , антропологию и другие социальные науки . [44]
Геномная медицина [ править ]
Геномные технологии следующего поколения позволяют клиницистам и биомедицинским исследователям резко увеличить объем геномных данных, собираемых на больших исследуемых популяциях. [87] В сочетании с новыми информационными подходами, которые объединяют многие виды данных с геномными данными в исследованиях заболеваний, это позволяет исследователям лучше понять генетические основы реакции на лекарства и болезней. [88] [89] Ранние попытки применить геном в медицине включали усилия Стэнфордской команды под руководством Юана Эшли , которая разработала первые инструменты для медицинской интерпретации человеческого генома. [90] [91] [92] Исследовательская программа Genomes2People в Бригамской и женской больнице , Институте Броуда и Гарвардской медицинской школе была создана в 2012 году для проведения эмпирических исследований по использованию геномики в здравоохранении. В августе 2019 года Brigham and Women's Hospital открыла клинику профилактической геномики, а Массачусетскую больницу общего профиля . через месяц — [93] [94] Исследовательская программа All of Us направлена на сбор данных о последовательностях генома от 1 миллиона участников, чтобы стать важнейшим компонентом исследовательской платформы точной медицины. [95]
Синтетическая биология и биоинженерия [ править ]
Рост геномных знаний позволил реализовать все более сложные применения синтетической биологии . [96] В 2010 году исследователи из Института Дж. Крейга Вентера создании частично синтетического вида бактерий Mycoplasma Laboratorium , полученного из генома Mycoplasmagentitalium объявили о . [97]
и геномика природоохранная Популяционная
Популяционная геномика развилась как популярная область исследований, где методы геномного секвенирования используются для проведения крупномасштабных сравнений последовательностей ДНК среди популяций - за пределами генетических маркеров, таких как продукты ПЦР ближнего действия или микросателлиты, традиционно используемые в популяционной генетике . Популяционная геномика изучает общегеномные эффекты, чтобы улучшить наше понимание микроэволюции , чтобы мы могли изучить филогенетическую историю и демографию популяции. [98] Методы популяционной геномики используются во многих различных областях, включая эволюционную биологию , экологию , биогеографию , природоохранную биологию и управление рыболовством . Точно так же ландшафтная геномика развилась из ландшафтной генетики и стала использовать геномные методы для выявления взаимосвязей между закономерностями окружающей среды и генетическими вариациями.
Специалисты по охране природы могут использовать информацию, собранную с помощью геномного секвенирования, чтобы лучше оценить генетические факторы, имеющие ключевое значение для сохранения видов, такие как генетическое разнообразие популяции или является ли человек гетерозиготным по рецессивному наследственному генетическому заболеванию. [99] Используя геномные данные для оценки последствий эволюционных процессов и выявления закономерностей вариаций в данной популяции, защитники природы могут сформулировать планы помощи данному виду, не оставляя при этом так много переменных, которые остаются неизвестными, как те, которые не учитываются стандартными генетическими подходами . [100]
См. также [ править ]
- Когнитивная геномика
- Вычислительная геномика
- Эпигеномика
- Функциональная геномика
- GeneCalling — технология профилирования мРНК.
- Геномика одомашнивания
- Генетика в художественной литературе
- гликомика
- Иммуномика
- Метагеномика
- Патогеномика
- Персональная геномика
- Протеомика
- Транскриптомика
- Веномикс
- Психогеномика
- Полногеномное секвенирование
- Томас Родерик
Ссылки [ править ]
- ^ Франклин Р.Э., Гослинг Р.Г. (апрель 1953 г.). «Молекулярная конфигурация тимонуклеата натрия». Природа . 171 (4356): 740–1. Бибкод : 1953Natur.171..740F . дои : 10.1038/171740a0 . ПМИД 13054694 . S2CID 4268222 .
- ^ Сатцингер Х (март 2008 г.). «Теодор и Марселла Бовери: хромосомы и цитоплазма в наследственности и развитии». Обзоры природы. Генетика . 9 (3): 231–238. дои : 10.1038/nrg2311 . ПМИД 18268510 . S2CID 15829893 .
- ^ Кремер Т., Кремер С. (2006). «Взлет, падение и возрождение хромосомных территорий: историческая перспектива. Часть I. Возвышение хромосомных территорий» . Европейский журнал гистохимии . 50 (3): 161–176. ПМИД 16920639 .
- ^ Росси, MJ; Кунтала, ПК; Лай, WKM; Ямада, Н.; Баджатия, Н; Миттал, К; Кузу, Г; Боклунд, К; Фаррелл, Северная Каролина; Бланда, ТР; Майроз, доктор юридических наук; Бастинг, А.В.; Мистретта, Канзас; Рокко, диджей; Перкинсон, ES; Келлог, Джорджия; Махони, С; Пью, БФ (март 2021 г.). «Белковая архитектура генома почкующихся дрожжей в высоком разрешении» . Природа . 592 (7853): 309–314. Бибкод : 2021Natur.592..309R . дои : 10.1038/s41586-021-03314-8 . ПМК 8035251 . ПМИД 33692541 .
- ^ «Определения ВОЗ генетики и геномики» . Всемирная организация здравоохранения. Архивировано из оригинала 30 июня 2004 года.
- ^ Концепции генетики (10-е изд.). Сан-Франциско: Pearson Education. 2012. ISBN 978-0-321-72412-0 .
- ^ Калвер К.В., Лабоу Массачусетс (8 ноября 2002 г.). «Геномика» . В Робинсоне Р. (ред.). Генетика . Научная библиотека Макмиллана. Справочник Macmillan США. ISBN 978-0-02-865606-9 .
- ^ Кадаккужа Б.М., Путханветтил С.В. (июль 2013 г.). «Геномика и протеомика в решении проблем сложности мозга» . Молекулярные биосистемы . 9 (7): 1807–1821. дои : 10.1039/C3MB25391K . ПМК 6425491 . ПМИД 23615871 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я Певснер Дж (2009). Биоинформатика и функциональная геномика (2-е изд.). Хобокен, Нью-Джерси: Уайли-Блэквелл. ISBN 978-0-470-08585-1 .
- ^ Лидделл Х.Г., Скотт Р. (2013). Средний греко-английский лексикон . Книги Мартино Файн. ISBN 978-1-61427-397-4 .
- ^ «Геном, н» . Оксфордский словарь английского языка (Третье изд.). Издательство Оксфордского университета. 2008 год . Проверено 1 декабря 2012 г. (требуется подписка)
- ^ Ядав С.П. (декабрь 2007 г.). «Целостность в суффиксе -омикс, -омес и в слове ом» . Журнал биомолекулярных методов . 18 (5):277. ПМК 2392988 . ПМИД 18166670 .
- ^ О'Брайен SJ (июнь 2022 г.). «Десятилетие GigaScience: взгляд на сохранение генетики» . ГигаСайенс . 11 . doi : 10.1093/gigascience/giac055 . ПМЦ 9197679 . ПМИД 35701371 .
- ^ Анкени Р.А. (июнь 2003 г.). «Секвенирование генома от нематоды до человека: изменение методов, изменение науки». Стараться . 27 (2): 87–92. дои : 10.1016/S0160-9327(03)00061-9 . ПМИД 12798815 .
- ^ Холли Р.В., Эверетт Дж.А., Мэдисон Дж.Т., Замир А. (май 1965 г.). «Нуклеотидные последовательности дрожжевого аланина переносят рибонуклеиновую кислоту» . Журнал биологической химии . 240 (5): 2122–2128. дои : 10.1016/S0021-9258(18)97435-1 . ПМИД 14299636 .
- ^ Холли Р.В., Апгар Дж., Эверетт Г.А., Мэдисон Дж.Т., Маркизи М., Меррилл С.Х. и др. (март 1965 г.). «Структура рибонуклеиновой кислоты». Наука . 147 (3664): 1462–1465. Бибкод : 1965Sci...147.1462H . дои : 10.1126/science.147.3664.1462 . ПМИД 14263761 . S2CID 40989800 .
- ^ Ниренберг М., Ледер П., Бернфилд М., Бримакомб Р., Трупин Дж., Роттман Ф., О'Нил С. (май 1965 г.). «Кодовые слова РНК и синтез белка, VII. Об общей природе кода РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 53 (5): 1161–1168. Бибкод : 1965PNAS...53.1161N . дои : 10.1073/pnas.53.5.1161 . ПМК 301388 . ПМИД 5330357 .
- ^ Мин Джоу В., Хагеман Г., Изеберт М., Фирс В. (май 1972 г.). «Нуклеотидная последовательность гена, кодирующего белок оболочки бактериофага MS2». Природа . 237 (5350): 82–88. Бибкод : 1972Natur.237...82J . дои : 10.1038/237082a0 . ПМИД 4555447 . S2CID 4153893 .
- ^ Фирс В., Контрерас Р., Дуринк Ф., Хегеман Г., Изерентант Д., Меррегарт Дж. и др. (апрель 1976 г.). «Полная нуклеотидная последовательность РНК бактериофага MS2: первичная и вторичная структура гена репликазы». Природа . 260 (5551): 500–507. Бибкод : 1976Natur.260..500F . дои : 10.1038/260500a0 . ПМИД 1264203 . S2CID 4289674 .
- ^ Фирс В., Контрерас Р., Хагеманн Г., Рогирс Р., Ван де Вурде А., Ван Хеверсвин Х. и др. (май 1978 г.). «Полная нуклеотидная последовательность ДНК SV40». Природа . 273 (5658): 113–120. Стартовый код : 1978Natur.273..113F . дои : 10.1038/273113a0 . ПМИД 205802 . S2CID 1634424 .
- ^ Тамарин Р.Х. (2004). Основы генетики (7-е изд.). Лондон: МакГроу Хилл. ISBN 978-0-07-124320-9 .
- ^ Сэнгер Ф (1980). «Нобелевская лекция: Определение нуклеотидных последовательностей в ДНК» (PDF) . Нобелевская премия.org . Проверено 18 октября 2010 г.
- ↑ Перейти обратно: Перейти обратно: а б Сэнгер Ф., Air GM, Баррелл Б.Г., Браун Н.Л., Коулсон А.Р., Фиддес Калифорния и др. (февраль 1977 г.). «Нуклеотидная последовательность ДНК бактериофага phi X174». Природа . 265 (5596): 687–695. Бибкод : 1977Natur.265..687S . дои : 10.1038/265687a0 . ПМИД 870828 . S2CID 4206886 .
- ^ Кайзер О., Бартельс Д., Бекель Т., Гёсманн А., Кесполь С., Пюлер А., Мейер Ф. (декабрь 2003 г.). «Полногеномное секвенирование под руководством биоинформатических конвейеров - оптимизированный подход для устоявшейся техники». Журнал биотехнологии . 106 (2–3): 121–133. doi : 10.1016/j.jbiotec.2003.08.008 . ПМИД 14651855 .
- ^ Сэнгер Ф., Никлен С., Коулсон А.Р. (декабрь 1977 г.). «Секвенирование ДНК с ингибиторами обрыва цепи» . Труды Национальной академии наук Соединенных Штатов Америки . 74 (12): 5463–5467. Бибкод : 1977PNAS...74.5463S . дои : 10.1073/pnas.74.12.5463 . ПМК 431765 . ПМИД 271968 .
- ^ Максам А.М., Гилберт В. (февраль 1977 г.). «Новый метод секвенирования ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 74 (2): 560–564. Бибкод : 1977ПНАС...74..560М . дои : 10.1073/pnas.74.2.560 . ПМК 392330 . ПМИД 265521 .
- ↑ Перейти обратно: Перейти обратно: а б Дарден Л., Табери Дж. (2010). «Молекулярная биология» . В Залте EN (ред.). Стэнфордская энциклопедия философии (изд. осени 2010 г.).
- ^ Андерсон С., Банкир А.Т., Баррелл Б.Г., де Брёйн М.Х., Коулсон А.Р., Друэн Дж. и др. (апрель 1981 г.). «Последовательность и организация митохондриального генома человека». Природа . 290 (5806): 457–465. Бибкод : 1981Natur.290..457A . дои : 10.1038/290457a0 . ПМИД 7219534 . S2CID 4355527 . (требуется подписка)
- ^ Шинозаки К., Оме М., Танака М., Вакасуги Т., Хаяшида Н., Мацубаяши Т. и др. (сентябрь 1986 г.). «Полная нуклеотидная последовательность генома хлоропластов табака: организация и экспрессия его генов» . Журнал ЭМБО . 5 (9): 2043–2049. дои : 10.1002/j.1460-2075.1986.tb04464.x . ПМК 1167080 . ПМИД 16453699 .
- ^ Охяма К., Фукудзава Х., Кочи Т., Шираи Х., Сано Т., Сано С. и др. (1986). «Организация гена хлоропластов выведена из полной последовательности ДНК хлоропластов печеночника Marchantia polymorpha». Природа . 322 (6079): 572–574. Бибкод : 1986Natur.322..572O . дои : 10.1038/322572a0 . S2CID 4311952 .
- ^ Оливер С.Г. , ван дер Аарт QJ, Агостони-Карбоне М.Л., Эгль М., Альбергина Л., Александраки Д. и др. (май 1992 г.). «Полная последовательность ДНК дрожжевой хромосомы III». Природа . 357 (6373): 38–46. Бибкод : 1992Natur.357...38O . дои : 10.1038/357038a0 . ПМИД 1574125 . S2CID 4271784 .
- ^ Флейшманн Р.Д., Адамс М.Д., Уайт О., Клейтон Р.А., Киркнесс Э.Ф., Керлаваж А.Р. и др. (июль 1995 г.). «Полногеномное случайное секвенирование и сборка Haemophilus influenzae Rd». Наука . 269 (5223): 496–512. Бибкод : 1995Sci...269..496F . дои : 10.1126/science.7542800 . ПМИД 7542800 . S2CID 10423613 .
- ^ Гоффо А., Баррелл Б.Г., Басси Х., Дэвис Р.В., Дюжон Б., Фельдманн Х. и др. (октябрь 1996 г.). «Жизнь с 6000 генами». Наука . 274 (5287): 546, 563–546, 567. Бибкод : 1996Sci...274..546G . дои : 10.1126/science.274.5287.546 . ПМИД 8849441 . S2CID 211123134 . (требуется подписка)
- ^ «Полные геномы: вирусы» . НКБИ . 17 ноября 2011 года . Проверено 18 ноября 2011 г.
- ^ «Статистика геномного проекта» . Проект Энтрез Геном . 7 октября 2011 года . Проверено 18 ноября 2011 г.
- ^ Циммер С. (29 декабря 2009 г.). «Ученые создают геномный каталог многочисленных микробов на Земле» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 21 декабря 2012 г.
- ^ Ву Д., Хугенхольц П., Мавроматис К., Пукалл Р., Далин Э., Иванова Н.Н. и др. (декабрь 2009 г.). «Геномная энциклопедия бактерий и архей, основанная на филогении» . Природа . 462 (7276): 1056–1060. Бибкод : 2009Natur.462.1056W . дои : 10.1038/nature08656 . ПМК 3073058 . ПМИД 20033048 .
- ^ «Число человеческих генов сократилось» . Би-би-си . 20 октября 2004 года . Проверено 21 декабря 2012 г.
- ^ Юэ Г.Х., Ло Л.К., Чжу ЗЫ, Линь Г., Фэн Ф. (апрель 2006 г.). «Полная нуклеотидная последовательность митохондриального генома Tetraodon nigroviridis». Последовательность ДНК . 17 (2): 115–121. дои : 10.1080/10425170600700378 . ПМИД 17076253 . S2CID 21797344 .
- ^ Национальный институт исследования генома человека (14 июля 2004 г.). «Геном собаки в сборе: геном собаки теперь доступен исследовательскому сообществу во всем мире» . Genome.gov . Проверено 20 января 2012 г.
- ↑ Перейти обратно: Перейти обратно: а б МакЭлхени V (2010). Рисуем карту жизни: внутри проекта «Геном человека» . Нью-Йорк, штат Нью-Йорк: Основные книги. ISBN 978-0-465-04333-0 .
- ^ Абекасис Г.Р., Аутон А., Брукс Л.Д., ДеПристо М.А., Дурбин Р.М., Handsaker RE и др. (ноябрь 2012 г.). «Интегрированная карта генетических вариаций 1092 геномов человека» . Природа . 491 (7422): 56–65. Бибкод : 2012Natur.491...56T . дои : 10.1038/nature11632 . ПМК 3498066 . ПМИД 23128226 .
- ^ Нильсен Р. (октябрь 2010 г.). «Геномика: В поисках редких вариантов человека» . Природа . 467 (7319): 1050–1051. Бибкод : 2010Natur.467.1050N . дои : 10.1038/4671050a . ПМИД 20981085 .
- ↑ Перейти обратно: Перейти обратно: а б Барнс Б., Дюпре Дж. (2008). Геномы и что из них делать . Чикаго: Издательство Чикагского университета. ISBN 978-0-226-17295-8 .
- ^ Эйзен Дж. А. (июль 2012 г.). «Слова бадомики, сила и опасность оме-мема» . ГигаСайенс . 1 (1): 6. дои : 10.1186/2047-217X-1-6 . ПМЦ 3617454 . ПМИД 23587201 .
- ^ Хотц Р.Л. (13 августа 2012 г.). «Вот омическая история: ученые обнаруживают распространяющийся суффикс» . Wall Street Journal . ISSN 0099-9660 . Проверено 4 января 2013 г.
- ^ Скуделлари М (1 октября 2011 г.). «Поток данных» . Ученый . Проверено 4 января 2013 г.
- ^ Частон Дж., Дуглас А.Э. (август 2012 г.). «Использование «омики» по максимуму для исследования симбиоза» . Биологический вестник . 223 (1): 21–29. дои : 10.1086/BBLv223n1p21 . ПМЦ 3491573 . ПМИД 22983030 .
- ^ Маккатчеон Дж. П., фон Долен CD (август 2011 г.). «Взаимозависимое метаболическое одеяло во гнездовом симбиозе мучнистых червецов» . Современная биология . 21 (16): 1366–1372. дои : 10.1016/j.cub.2011.06.051 . ПМК 3169327 . ПМИД 21835622 .
- ↑ Перейти обратно: Перейти обратно: а б Бейкер М. (14 сентября 2012 г.). «Настольные секвенсоры отправляются в продажу» (Блог) . Блог новостей природы . Проверено 22 декабря 2012 г.
- ^ Куэйл М.А., Смит М., Коупленд П., Отто Т.Д., Харрис С.Р., Коннор Т.Р. и др. (июль 2012 г.). «Рассказ о трех платформах секвенирования следующего поколения: сравнение секвенаторов Ion Torrent, Pacific Biosciences и Illumina MiSeq» . БМК Геномика . 13 :341. дои : 10.1186/1471-2164-13-341 . ПМЦ 3431227 . ПМИД 22827831 .
- ↑ Перейти обратно: Перейти обратно: а б Стаден Р. (июнь 1979 г.). «Стратегия секвенирования ДНК с использованием компьютерных программ» . Исследования нуклеиновых кислот . 6 (7): 2601–2610. дои : 10.1093/нар/6.7.2601 . ПМК 327874 . ПМИД 461197 .
- ^ Андерсон С. (июль 1981 г.). «Секвенирование ДНК методом дробовика с использованием клонированных фрагментов ДНКазы I» . Исследования нуклеиновых кислот . 9 (13): 3015–3027. дои : 10.1093/нар/9.13.3015 . ПМК 327328 . ПМИД 6269069 .
- ↑ Перейти обратно: Перейти обратно: а б с Поп М (июль 2009 г.). «Возрождение сборки генома: недавние вычислительные проблемы» . Брифинги по биоинформатике . 10 (4): 354–366. дои : 10.1093/нагрудник/bbp026 . ПМК 2691937 . ПМИД 19482960 .
- ^ Сэнгер Ф., Коулсон А.Р. (май 1975 г.). «Быстрый метод определения последовательностей ДНК путем синтеза с помощью ДНК-полимеразы». Журнал молекулярной биологии . 94 (3): 441–448. дои : 10.1016/0022-2836(75)90213-2 . ПМИД 1100841 .
- ^ Мавроматис К., Лэнд М.Л., Бреттин Т.С., Квест DJ, Коупленд А., Клам А. и др. (2012). Лю Цзы (ред.). «Быстро меняющаяся среда технологий секвенирования и их влияние на сборки и аннотации микробного генома» . ПЛОС ОДИН . 7 (12): е48837. Бибкод : 2012PLoSO...748837M . дои : 10.1371/journal.pone.0048837 . ПМК 3520994 . ПМИД 23251337 .
- ^ Illumina, Inc. (28 февраля 2012 г.). Введение в технологию секвенирования следующего поколения (PDF) . Сан-Диего, Калифорния, США: Illumina, Inc., с. 12. Архивировано из оригинала (PDF) 11 апреля 2013 г. Проверено 28 декабря 2012 г.
- ^ Зал N (май 2007 г.). «Передовые технологии секвенирования и их более широкое влияние в микробиологии» . Журнал экспериментальной биологии . 210 (Часть 9): 1518–1525. дои : 10.1242/jeb.001370 . ПМИД 17449817 .
- ^ Черч ГМ (январь 2006 г.). «Геномы для всех». Научный американец . 294 (1): 46–54. Бибкод : 2006SciAm.294a..46C . doi : 10.1038/scientificamerican0106-46 . ПМИД 16468433 . S2CID 28769137 .
- ^ Тен Бош-младший, Гроди В.В. (ноябрь 2008 г.). «Идти в ногу со следующим поколением: массовое параллельное секвенирование в клинической диагностике» . Журнал молекулярной диагностики . 10 (6): 484–492. дои : 10.2353/jmoldx.2008.080027 . ПМК 2570630 . ПМИД 18832462 .
- ^ Такер Т., Марра М., Фридман Дж. М. (август 2009 г.). «Массовое параллельное секвенирование: следующий большой шаг в генетической медицине» . Американский журнал генетики человека . 85 (2): 142–154. дои : 10.1016/j.ajhg.2009.06.022 . ПМЦ 2725244 . ПМИД 19679224 .
- ^ США 20050100900 , Кавасима Э.Х., Фаринелли Л., Майер П., «Метод амплификации нуклеиновых кислот», опубликовано 12 мая 2005 г., выдано 26 июля 2011 г., передано компании Solexa Ltd, Великобритания.
- ^ Мардис ЭР (2008). «Методы секвенирования ДНК нового поколения» (PDF) . Ежегодный обзор геномики и генетики человека . 9 : 387–402. дои : 10.1146/annurev.genom.9.081307.164359 . ПМИД 18576944 . Архивировано из оригинала (PDF) 18 мая 2013 г. Проверено 4 января 2013 г.
- ^ Дэвис К. (2011). «Энергия профилактической медицины» . Мир Био-ИТ (сентябрь–октябрь). Архивировано из оригинала 6 июня 2016 г. Проверено 17 декабря 2014 г.
- ^ "Дом" . ПакБио .
- ^ "дом" . Оксфордские нанопоровые технологии .
- ^ Чейн П.С., Графэм Д.В., Фултон Р.С., Фицджеральд М.Г., Хостетлер Дж., Музный Д. и др. (октябрь 2009 г.). «Геномика. Стандарты геномного проекта в новую эпоху секвенирования» . Наука . 326 (5950): 236–237. Бибкод : 2009Sci...326..236C . дои : 10.1126/science.1180614 . ПМЦ 3854948 . ПМИД 19815760 .
- ^ Штейн Л. (июль 2001 г.). «Аннотация генома: от последовательности к биологии». Обзоры природы. Генетика . 2 (7): 493–503. дои : 10.1038/35080529 . ПМИД 11433356 . S2CID 12044602 .
- ^ Брент М.Р. (январь 2008 г.). «Устойчивый прогресс и недавние прорывы в точности автоматизированной аннотации генома» (PDF) . Обзоры природы. Генетика . 9 (1): 62–73. дои : 10.1038/nrg2220 . ПМИД 18087260 . S2CID 20412451 . Архивировано из оригинала (PDF) 29 мая 2013 г. Проверено 4 января 2013 г.
- ^ Фличек П., Ахмед И., Амод М.Р., Баррелл Д., Бил К., Брент С. и др. (январь 2013 г.). «Ансамбль 2013» . Исследования нуклеиновых кислот . 41 (Проблема с базой данных): D48–D55. дои : 10.1093/nar/gks1236 . ПМЦ 3531136 . ПМИД 23203987 .
- ^ Кейт Дж. М. (2008). Кейт Дж.М. (ред.). Биоинформатика . Методы молекулярной биологии. Том. 453. стр. v – vi. дои : 10.1007/978-1-60327-429-6 . ISBN 978-1-60327-428-9 . ПМИД 18720577 .
- ^ Марсден Р.Л., Льюис Т.А., Оренго, Калифорния (март 2007 г.). «На пути к всестороннему структурному охвату завершенных геномов: точка зрения структурной геномики» . БМК Биоинформатика . 8:86 . дои : 10.1186/1471-2105-8-86 . ПМК 1829165 . ПМИД 17349043 .
- ^ Бреннер С.Е., Левитт М. (январь 2000 г.). «Ожидания от структурной геномики» . Белковая наука . 9 (1): 197–200. дои : 10.1110/пс.9.1.197 . ПМК 2144435 . ПМИД 10739263 .
- ^ Бреннер С.Е. (октябрь 2001 г.). «Экскурсия по структурной геномике». Обзоры природы. Генетика . 2 (10): 801–809. дои : 10.1038/35093574 . ПМИД 11584296 . S2CID 5656447 .
- ↑ Перейти обратно: Перейти обратно: а б Фрэнсис RC (2011). Эпигенетика: величайшая тайна наследственности . Нью-Йорк: WW Нортон. ISBN 978-0-393-07005-7 .
- ^ Гальего, Л.Д.; Шнайдер, М; Миттал, К; Романушка, Анете; Гудино Каррильо, РМ; Шуберт, Т; Пью, БФ; Колер, А. (март 2020 г.). «Разделение фаз управляет убиквитинированием нуклеосом генного тела» . Природа . 579 (7800): 592–597. Бибкод : 2020Natur.579..592G . дои : 10.1038/s41586-020-2097-z . ПМЦ 7481934 . ПМИД 32214243 .
- ^ Самс, КЛ; Мукаи, К; Маркс, бакалавр; Миттал, К; Деметра, Е.А.; Нелиссен, С; Гренье, Дж. К.; Тейт, А.Е.; Ахмед, Ф; Кунрод, ЮАР (октябрь 2022 г.). «Задержка полового созревания, аномалии гонадотропинов и субфертильность у самцов мышей с двойным нокаутом Padi2/Padi4» . Репрод Биол Эндокринол . 20 (1): 150. дои : 10.1186/s12958-022-01018-w . ПМЦ 9555066 . ПМИД 36224627 .
- ^ Лэрд П.В. (март 2010 г.). «Принципы и проблемы полногеномного анализа метилирования ДНК». Обзоры природы. Генетика . 11 (3): 191–203. дои : 10.1038/nrg2732 . ПМИД 20125086 . S2CID 6780101 .
- ^ Хугенхольц П., Гебель Б.М., Пейс Н.Р. (сентябрь 1998 г.). «Влияние культурно-независимых исследований на формирующийся филогенетический взгляд на бактериальное разнообразие» . Журнал бактериологии . 180 (18): 4765–4774. дои : 10.1128/JB.180.18.4765-4774.1998 . ПМЦ 107498 . ПМИД 9733676 .
- ^ Эйзен Дж. А. (март 2007 г.). «Экологическое секвенирование дробовика: его потенциал и проблемы для изучения скрытого мира микробов» . ПЛОС Биология . 5 (3): е82. doi : 10.1371/journal.pbio.0050082 . ПМК 1821061 . ПМИД 17355177 .
- ^ Марко Д., изд. (2010). Метагеномика: теория, методы и приложения . Кайстер Академик Пресс. ISBN 978-1-904455-54-7 .
- ^ Марко Д., изд. (2011). Метагеномика: текущие инновации и будущие тенденции . Кайстер Академик Пресс . ISBN 978-1-904455-87-5 .
- ^ Канчая С., Пру С., Фурнус Г., Бруттен А., Брюссов Х. (июнь 2003 г.). «Профаговая геномика» . Обзоры микробиологии и молекулярной биологии . 67 (2): 238–76, оглавление. дои : 10.1128/MMBR.67.2.238-276.2003 . ПМК 156470 . ПМИД 12794192 .
- ^ МакГрат С., ван Синдерен Д., ред. (2007). Бактериофаг: генетика и молекулярная биология (1-е изд.). Кайстер Академик Пресс. ISBN 978-1-904455-14-1 .
- ^ Футс Д.Е. (ноябрь 2006 г.). «Phage_Finder: автоматическая идентификация и классификация профаговых областей в полных последовательностях бактериального генома» . Исследования нуклеиновых кислот . 34 (20): 5839–5851. дои : 10.1093/нар/gkl732 . ПМЦ 1635311 . ПМИД 17062630 .
- ^ Эрреро А., Флорес Э., ред. (2008). Цианобактерии: молекулярная биология, геномика и эволюция (1-е изд.). Кайстер Академик Пресс. ISBN 978-1-904455-15-8 .
- ^ Хадсон, КЛ (сентябрь 2011 г.). «Геномика, здравоохранение и общество» . Медицинский журнал Новой Англии . 365 (11): 1033–1041. дои : 10.1056/NEJMra1010517 . ПМИД 21916641 .
- ^ О'Доннелл СиДжей, Набель Э.Г. (декабрь 2011 г.). «Геномика сердечно-сосудистых заболеваний» . Медицинский журнал Новой Англии . 365 (22): 2098–2109. дои : 10.1056/NEJMra1105239 . ПМИД 22129254 .
- ^ Лу Ю.Ф., Гольдштейн Д.Б., Ангрист М., Каваллери Г. (июль 2014 г.). «Персонализированная медицина и генетическое разнообразие человека» . Перспективы Колд-Спринг-Харбора в медицине . 4 (9): а008581. doi : 10.1101/cshperspect.a008581 . ПМК 4143101 . ПМИД 25059740 .
- ^ Эшли Э.А., Бьютт А.Дж., Уилер М.Т., Чен Р., Кляйн Т.Е., Дьюи Ф.Е. и др. (май 2010 г.). «Клиническая оценка с учетом личного генома» . Ланцет . 375 (9725): 1525–1535. дои : 10.1016/S0140-6736(10)60452-7 . ПМЦ 2937184 . ПМИД 20435227 .
- ^ Дьюи Ф.Е., Чен Р., Кордеро С.П., Ормонд К.Е., Калешу С., Карчевски К.Дж. и др. (сентябрь 2011 г.). «Поэтапный полногеномный генетический риск в семейном квартете с использованием эталонной последовательности основного аллеля» . ПЛОС Генетика . 7 (9): e1002280. дои : 10.1371/journal.pgen.1002280 . ПМК 3174201 . ПМИД 21935354 .
- ^ Дьюи Ф.Е., Гроув М.Э., Пан С., Гольдштейн Б.А., Бернштейн Дж.А., Чайб Х. и др. (март 2014 г.). «Клиническая интерпретация и последствия полногеномного секвенирования» . ДЖАМА . 311 (10): 1035–1045. дои : 10.1001/jama.2014.1717 . ПМК 4119063 . ПМИД 24618965 .
- ^ Роббинс Р. (16 августа 2019 г.). «Ведущие медицинские центры США открывают клиники по секвенированию ДНК для здоровых (и зачастую богатых) клиентов» . Новости СТАТ .
- ^ «Две системы здравоохранения Бостона выходят на растущий рынок секвенирования генов, ориентированного непосредственно на потребителя, открыв клиники профилактической геномики, но могут ли пациенты позволить себе эту услугу?» . Темный ежедневник . Группа Темного Разума. 3 января 2020 г.
- ^ «Геномные центры, финансируемые НИЗ, для ускорения открытий в области точной медицины» . Национальные институты здравоохранения: Исследовательская программа «Все мы» . Национальные институты здравоохранения. 25 сентября 2018 г.
- ^ Генеральный директор церкви Реджис Э (2012). Регенезис: как синтетическая биология заново изобретет природу и нас самих . Нью-Йорк: Основные книги. ISBN 978-0-465-02175-8 .
- ^ Бейкер М. (май 2011 г.). «Синтетические геномы: следующий шаг для синтетического генома» . Природа . 473 (7347): 403, 405–403, 408. Бибкод : 2011Natur.473..403B . дои : 10.1038/473403а . ПМИД 21593873 . S2CID 205064528 .
- ^ Луикарт Г., Англия, PR, Таллмон Д., Джордан С., Таберлет П. (декабрь 2003 г.). «Сила и перспективы популяционной геномики: от генотипирования к типированию генома». Обзоры природы. Генетика . 4 (12): 981–94. дои : 10.1038/nrg1226 . ПМИД 14631358 . S2CID 8516357 .
- ^ Фрэнкхэм Р. (1 сентября 2010 г.). «Проблемы и возможности генетических подходов к биологическому сохранению». Биологическая консервация . 143 (9): 1922–1923. дои : 10.1016/j.biocon.2010.05.011 .
- ^ Аллендорф Ф.В., Гогенлоэ П.А., Луикарт Г. (октябрь 2010 г.). «Геномика и будущее консервативной генетики». Обзоры природы. Генетика . 11 (10): 697–709. дои : 10.1038/nrg2844 . ПМИД 20847747 . S2CID 10811958 .
Дальнейшее чтение [ править ]
- Леск А.М. (2017). Введение в геномику (3-е изд.). Нью-Йорк: Издательство Оксфордского университета. п. 544. ИСБН 978-0-19-107085-3 . АСИН 0198754833 .
- Стунненберг Х.Г., Хюбнер, Северная Каролина (июнь 2014 г.). «Геномика встречается с протеомикой: выявление виновников болезней» . Генетика человека . 133 (6): 689–700. дои : 10.1007/s00439-013-1376-2 . ПМК 4021166 . ПМИД 24135908 .
- Шибата Т. (октябрь 2012 г.). «Геномика и патология рака: теперь все вместе» . Международная патология . 62 (10): 647–659. дои : 10.1111/j.1440-1827.2012.02855.x . ПМИД 23005591 . S2CID 27886018 .
- Ройчоудхури С., Чиннаян А.М. (2016). «Трансляция раковых геномов и транскриптомов для точной онкологии» . КА . 66 (1): 75–88. дои : 10.3322/caac.21329 . ПМЦ 4713245 . ПМИД 26528881 .
- Гладышев В.Н., Чжан Ю (2013). «Глава 16. Сравнительный геномный анализ металломов». В Banci L (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том. 12. Спрингер. doi : 10.1007/978-94-007-5561-10_16 (неактивен 31 января 2024 г.). ISBN 978-94-007-5560-4 .
{{cite book}}: CS1 maint: DOI inactive as of January 2024 (link) electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 электронный- ISSN 1868-0402
Внешние ссылки [ править ]
- Ежегодный обзор геномики и генетики человека. Архивировано 18 января 2009 г. в Wayback Machine.
- BMC Genomics : журнал BMC по геномике
- Журнал геномики
- Genomics.org : открытый бесплатный портал по геномике.
- NHGRI : Институт генома правительства США.
- Комплексный микробный ресурс JCVI
- KoreaGenome.org : первый опубликованный корейский геном, последовательность которого доступна бесплатно.
- GenomicsNetwork : рассматривает развитие и использование науки и технологий геномики.
- Институт геномных наук : Геномные исследования.
- MIT OpenCourseWare HST.512 Геномная медицина Бесплатный курс самообучения по геномной медицине. Ресурсы включают аудиолекции и избранные конспекты лекций.
- Обозреватель потоков ENCODE. Подходы машинного обучения к геномике. Природа (журнал)
- Глобальная карта лабораторий геномики
- Геномика: образование, доступное по своей природе