Протеомика

Протеомика — это крупномасштабное исследование белков . [1] [2] Белки — это жизненно важные макромолекулы всех живых организмов, выполняющие множество функций, таких как образование структурных волокон мышечной ткани , ферментативное переваривание пищи или синтез и репликация ДНК . Кроме того, к другим видам белков относятся антитела , защищающие организм от инфекции, и гормоны , посылающие важные сигналы по всему организму.
Протеом — это весь набор белков, вырабатываемых или модифицированных организмом или системой. Протеомика позволяет идентифицировать постоянно растущее число белков. Это зависит от времени и различных требований или стрессов, которым подвергается клетка или организм. [3]
Протеомика — это междисциплинарная область, которая получила большую пользу от генетической информации различных геномных проектов, включая проект «Геном человека» . [4] Он охватывает исследование протеомов на общем уровне белкового состава, структуры и активности и является важным компонентом функциональной геномики .
Протеомика обычно означает крупномасштабный экспериментальный анализ белков и протеомов, но часто относится конкретно к очистке белков и масс-спектрометрии . Действительно, масс-спектрометрия является самым мощным методом анализа протеомов, как в больших образцах, состоящих из миллионов клеток, так и в больших образцах, состоящих из миллионов клеток. [5] и в одиночных клетках. [6] [7]
История и этимология [ править ]
Первые исследования белков, которые можно было бы рассматривать как протеомики, начались в 1975 году, после введения двумерного геля и картирования белков бактерии Escherichia coli . [ нужна ссылка ]
Протеом – это смесь слов «белок» и «геном». Он был придуман в 1994 году аспирантом Марком Уилкинсом из Университета Маккуори . [8] которая основала первую специализированную лабораторию протеомики в 1995 году. [9] [10]
Сложность проблемы [ править ]
После геномики и транскриптомики протеомика является следующим шагом в изучении биологических систем. Она сложнее геномики, поскольку геном организма более или менее постоянен, а протеомы различаются от клетки к клетке и время от времени. разные гены В разных типах клеток экспрессируются , а это означает, что необходимо идентифицировать даже основной набор белков, вырабатываемых в клетке. [ нужна ссылка ]
Раньше это явление оценивалось с помощью анализа РНК, который не имел корреляции с содержанием белка. [11] [12] Сейчас известно, что мРНК не всегда транслируется в белок. [13] а количество белка, продуцируемого для данного количества мРНК, зависит от гена, с которого она транскрибируется, и от физиологического состояния клетки. Протеомика подтверждает наличие белка и обеспечивает прямую оценку его количества. [ нужна ссылка ]
Посттрансляционные модификации [ править ]
Мало того, что трансляция с мРНК вызывает различия, многие белки также подвергаются множеству химических модификаций после трансляции. Наиболее распространенные и широко изученные посттрансляционные модификации включают фосфорилирование и гликозилирование. Многие из этих посттрансляционных модификаций имеют решающее значение для функции белка. [ нужна ссылка ]
Фосфорилирование [ править ]
Одной из таких модификаций является фосфорилирование , которое происходит со многими ферментами и структурными белками в процессе передачи клеточных сигналов . Добавление фосфата к определенным аминокислотам, чаще всего к серину и треонину. [14] опосредованный серин-треониновыми киназами или, реже, тирозин, опосредованный тирозинкиназами, — заставляет белок становиться мишенью для связывания или взаимодействия с отдельным набором других белков, которые распознают фосфорилированный домен. [ нужна ссылка ]
Поскольку фосфорилирование белков является одной из наиболее изученных модификаций белков, многие «протеомные» усилия направлены на определение набора фосфорилированных белков в конкретной клетке или типе ткани при определенных обстоятельствах. Это предупреждает ученого о сигнальных путях, которые могут быть активны в этом случае.
Убиквитинирование [ править ]
Убиквитин представляет собой небольшой белок, который может быть прикреплен к определенным белковым субстратам с помощью ферментов, называемых убиквитинлигазами Е3 . Определение того, какие белки являются полиубиквитинированными, помогает понять, как регулируются белковые пути. Таким образом, это дополнительное законное «протеомное» исследование. Аналогичным образом, как только исследователь определяет, какие субстраты убиквитинируются каждой лигазой, полезно определить набор лигаз, экспрессируемых в определенном типе клеток. [ нужна ссылка ]
Дополнительные модификации [ править ]
Помимо фосфорилирования и убиквитинирования , белки могут подвергаться (среди прочего) метилированию , ацетилированию , гликозилированию , окислению и нитрозилированию . Некоторые белки претерпевают все эти модификации, часто в комбинациях, зависящих от времени. Это иллюстрирует потенциальную сложность изучения структуры и функции белка.
белки производятся в условиях разных Различные
Клетка может вырабатывать разные наборы белков в разное время или в разных условиях, например, во время развития , клеточной дифференцировки , клеточного цикла или канцерогенеза . Как уже упоминалось, при дальнейшем усложнении протеома большинство белков способны подвергаться широкому спектру посттрансляционных модификаций.
Поэтому «протеомное» исследование может очень быстро усложниться, даже если тема исследования ограничена. В более амбициозных условиях, например, когда ведется поиск биомаркера для определенного подтипа рака, ученый-протеомик может решить изучить несколько образцов сыворотки крови от нескольких больных раком, чтобы минимизировать мешающие факторы и учесть экспериментальный шум. [15] Таким образом, иногда необходимы сложные экспериментальные планы, чтобы объяснить динамическую сложность протеома.
области геномики и Ограничения исследований в протеомики
Протеомика дает другой уровень понимания, чем геномика, по многим причинам:
- уровень транскрипции гена дает лишь приблизительную оценку уровня его трансляции в белок. [16] МРНК , вырабатываемая в большом количестве, может быстро разрушаться или транслироваться неэффективно, что приводит к образованию небольшого количества белка.
- как упоминалось выше, многие белки претерпевают посттрансляционные модификации , которые глубоко влияют на их активность; например, некоторые белки не активны, пока не фосфорилируются. такие методы, как фосфопротеомика и гликопротеомика . Для изучения посттрансляционных модификаций используются
- многие транскрипты дают начало более чем одному белку посредством альтернативного сплайсинга или альтернативных посттрансляционных модификаций.
- многие белки образуют комплексы с другими белками или молекулами РНК и функционируют только в присутствии этих других молекул.
- Скорость деградации белка играет важную роль в содержании белка. [17]
Воспроизводимость . Одним из основных факторов, влияющих на воспроизводимость протеомных экспериментов, является одновременное элюирование гораздо большего количества пептидов, чем могут измерить масс-спектрометры. Это вызывает стохастические различия между экспериментами из -за зависимого от данных приобретения триптических пептидов. Хотя ранние крупномасштабные протеомные анализы показали значительную вариабельность между лабораториями, [18] [19] предположительно, отчасти из-за технических и экспериментальных различий между лабораториями, воспроизводимость была улучшена в более поздних масс-спектрометрических анализах, особенно на уровне белка. [20] Примечательно, что целевая протеомика демонстрирует повышенную воспроизводимость и повторяемость по сравнению с методами «дробовика», хотя и за счет плотности данных и эффективности. [21]
Качество данных . Протеомный анализ хорошо поддается автоматизации, создаются большие наборы данных, которые обрабатываются программными алгоритмами. Параметры фильтра используются для уменьшения количества ложных попаданий, но полностью исключить их невозможно. Ученые выразили необходимость осознания того, что эксперименты по протеомике должны соответствовать критериям аналитической химии (достаточное качество данных, проверка работоспособности, валидация). [22] [23] [24] [25]
Методы изучения белков [ править ]
В протеомике существует множество методов изучения белков. Как правило, белки можно обнаружить с помощью антител (иммуноанализы), электрофоретического разделения или масс-спектрометрии . Если анализируется сложный биологический образец, необходимо использовать либо очень специфическое антитело в количественном дот-блот-анализе (QDB), либо перед этапом обнаружения необходимо использовать биохимическое разделение, поскольку в образце слишком много аналитов для проведения анализа. точное обнаружение и количественная оценка.
Обнаружение белка с помощью антител иммуноанализы ( )
Антитела к определенным белкам или их модифицированным формам использовались в биохимии и клеточной биологии исследованиях . Это одни из наиболее распространенных инструментов, используемых сегодня молекулярными биологами. Существует несколько конкретных методов и протоколов, в которых для обнаружения белков используются антитела. Иммуноферментный анализ (ИФА) десятилетиями использовался для обнаружения и количественного измерения белков в образцах. Вестерн -блоттинг можно использовать для обнаружения и количественного определения отдельных белков, при этом на начальном этапе сложная смесь белков разделяется с помощью SDS-PAGE , а затем интересующий белок идентифицируется с помощью антитела. [ нужна ссылка ]
Модифицированные белки можно изучать путем разработки антитела, специфичного к этой модификации. Например, некоторые антитела распознают определенные белки только тогда, когда они фосфорилированы по тирозину ; они известны как фосфоспецифические антитела. Также существуют антитела, специфичные к другим модификациям. Их можно использовать для определения набора белков, подвергшихся интересующей модификации. [ нужна ссылка ]
Иммуноанализы также можно проводить с использованием производных иммуноглобулина, полученных рекомбинантным путем, или синтетически созданных белковых каркасов, отобранных по высокой антигенной специфичности. Такие связующие включают фрагменты однодоменных антител (нанотела), [26] разработал белки с анкириновыми повторами (DARPins) [27] и аптамеры. [28]
Обнаружение заболеваний на молекулярном уровне является движущей силой новой революции в области ранней диагностики и лечения. Проблема, стоящая перед этой областью, заключается в том, что белковые биомаркеры для ранней диагностики могут присутствовать в очень небольшом количестве. Нижним пределом обнаружения при использовании традиционной технологии иммуноанализа является верхний фемтомолярный диапазон (10 −13 М). Технология цифрового иммуноанализа улучшила чувствительность обнаружения на три логарифма до аттомолярного диапазона (10 −16 М). Эта возможность потенциально может открыть новые достижения в диагностике и терапии, но такие технологии были отнесены к ручным процедурам, которые не очень подходят для эффективного повседневного использования. [29]
белка антител без Обнаружение
Хотя обнаружение белков с помощью антител по-прежнему очень распространено в молекулярной биологии, были разработаны и другие методы, не основанные на антителах. Эти методы имеют различные преимущества: например, они часто позволяют определить последовательность белка или пептида, они могут иметь более высокую производительность, чем методы, основанные на антителах, а иногда они могут идентифицировать и количественно определять белки, для которых не существует антител.
Методы обнаружения [ править ]
Одним из самых ранних методов анализа белков была деградация по Эдману (введенная в 1967 году), когда один пептид подвергается множеству стадий химической деградации для определения его последовательности. Эти ранние методы в основном были вытеснены технологиями, обеспечивающими более высокую производительность. [ нужна ссылка ]
В недавно реализованных методах используются методы, основанные на масс-спектрометрии , развитие, которое стало возможным благодаря открытию методов «мягкой ионизации», разработанных в 1980-х годах, таких как матричная лазерная десорбция / ионизация (MALDI) и ионизация электрораспылением (ESI) . Эти методы привели к появлению протеомных рабочих процессов «сверху вниз» и « снизу вверх», при которых перед анализом часто проводится дополнительное разделение (см. Ниже).
Методы разделения [ править ]
Для анализа сложных биологических образцов требуется уменьшение сложности образцов. Это может быть выполнено в автономном режиме посредством одномерного или двумерного разделения. Совсем недавно были разработаны онлайн-методы, в которых отдельные пептиды (в подходах протеомики «снизу вверх») разделяются с помощью обращенно-фазовой хроматографии , а затем напрямую ионизируются с использованием ESI ; Прямое сочетание разделения и анализа объясняет термин «онлайновый» анализ.
Гибридные технологии [ править ]
Некоторые гибридные технологии используют очистку отдельных аналитов с помощью антител, а затем выполняют масс-спектрометрический анализ для идентификации и количественного определения. Примерами таких методов являются MSIA (масс-спектрометрический иммуноанализ) , разработанный Рэндаллом Нельсоном в 1995 году, [30] и метод SISCAPA (захват стандартного изотопа с помощью антипептидных антител), предложенный Ли Андерсон в 2004 году. [31]
исследования Текущие методологии
Флуоресцентный двумерный дифференциальный гель-электрофорез (2-D DIGE) [32] может использоваться для количественной оценки изменений в процессе 2-D DIGE и установления статистически достоверных пороговых значений для определения количественных изменений между образцами. [32]
Сравнительный протеомный анализ может выявить роль белков в сложных биологических системах, в том числе в репродукции. Например, обработка инсектицидом триазофосом вызывает увеличение содержания белков добавочных желез самцов (Acps) коричневой цикадки ( Nilaparvata lugens (Stål)) которые могут передаваться самкам при спаривании, вызывая увеличение плодовитости (т.е. рождаемости). женщин. [33] Чтобы выявить изменения в типах белков добавочных желез (Acps) и репродуктивных белков, которые спаривающиеся самки цикадки получают от самцов цикадки, исследователи провели сравнительный протеомный анализ спаривающихся самок N. lugens . [34] Результаты показали, что эти белки участвуют в репродуктивном процессе взрослых самок и самцов N. lugens . [34]
Протеомный анализ пероксисом арабидопсиса [35] был признан основным объективным подходом для идентификации новых пероксисомальных белков в больших масштабах. [35]
Существует множество подходов к характеристике протеома человека, который, по оценкам, содержит от 20 000 до 25 000 неизбыточных белков. Число уникальных видов белков, вероятно, увеличится на 50 000–500 000 из-за событий сплайсинга РНК и протеолиза, а если учесть также посттрансляционную модификацию, общее количество уникальных человеческих белков оценивается в несколько миллионов. [36] [37]
Кроме того, недавно появились первые многообещающие попытки расшифровки протеома опухолей животных. [38] Этот метод был использован в качестве функционального метода при профилировании белков Macrobrachium rosenbergii . [39]
Высокопроизводительные протеомные технологии [ править ]
За последнее десятилетие протеомика неуклонно набирала обороты благодаря развитию нескольких подходов. Некоторые из них являются новыми, а другие основаны на традиционных методах. Методы масс-спектрометрии, аффинная протеомика и микроматрицы являются наиболее распространенными технологиями крупномасштабного изучения белков.
и профилирование Масс- спектрометрия белков

В настоящее время для определения профиля белка используются два метода, основанных на масс-спектрометрии. Более устоявшийся и широко распространенный метод использует двумерный электрофорез высокого разрешения для параллельного разделения белков из разных образцов с последующим отбором и окрашиванием дифференциально экспрессируемых белков для идентификации с помощью масс-спектрометрии. Несмотря на достижения в области 2-DE и ее зрелость, она также имеет свои пределы.Главной проблемой является невозможность различить все белки в образце, учитывая их резкий диапазон уровней экспрессии и различных свойств. Сочетание размера пор, заряда, размера и формы белка может во многом определять скорость миграции, что приводит к другим осложнениям. [40]
Второй количественный подход использует метки стабильных изотопов для дифференциальной маркировки белков из двух разных сложных смесей. [41] [42] Здесь белки в сложной смеси сначала метятся изотопно, а затем расщепляются с получением меченых пептидов. Меченые смеси затем объединяют, пептиды разделяют с помощью многомерной жидкостной хроматографии и анализируют с помощью тандемной масс-спектрометрии. Реагенты для аффинных меток с изотопным кодированием (ICAT) являются широко используемыми изотопными метками. В этом методе цистеиновые остатки белков ковалентно присоединяются к реагенту ICAT, тем самым уменьшая сложность смесей, исключающих нецистеиновые остатки.
Количественная протеомика с использованием мечения стабильными изотопами становится все более полезным инструментом в современном развитии. Во-первых, химические реакции использовались для введения меток в определенные сайты или белки с целью исследования функциональности конкретных белков. Выделение фосфорилированных пептидов было достигнуто с использованием изотопной маркировки и селективной химии для улавливания фракции белка в сложной смеси. Во-вторых, технология ICAT использовалась для дифференциации частично очищенных или очищенных макромолекулярных комплексов, таких как комплекс преинициации большой РНК-полимеразы II, и белков, образующих комплекс с дрожжевым фактором транскрипции. В-третьих, мечение ICAT недавно было объединено с выделением хроматина для идентификации и количественного определения белков, связанных с хроматином. Наконец, реагенты ICAT полезны для протеомного профилирования клеточных органелл и конкретных клеточных фракций. [40]
Другой количественный подход - это метод меток точной массы и времени (AMT), разработанный Ричардом Д. Смитом и его коллегами из Тихоокеанской северо-западной национальной лаборатории . В этом подходе повышение производительности и чувствительности достигается за счет исключения необходимости в тандемной масс-спектрометрии и использования точно определенной информации о времени разделения и высокоточного определения массы для идентификации пептидов и белков.
Аффинная протеомика [ править ]
Аффинная протеомика использует антитела или другие аффинные реагенты (такие как аптамеры на основе олигонуклеотидов) в качестве зондов для специфичного обнаружения белка. [43] В настоящее время этот метод позволяет исследовать несколько тысяч белков, обычно из биожидкостей, таких как плазма, сыворотка или спинномозговая жидкость (СМЖ). Ключевым отличием этой технологии является возможность анализировать сотни или тысячи образцов в разумные сроки (несколько дней или недель); Методы, основанные на масс-спектрометрии, не масштабируются до такого уровня пропускной способности образцов для протеомного анализа.
Протеиновые чипсы [ править ]
Балансированием использования масс-спектрометров в протеомике и медицине является использование белковых микрочипов. Цель белковых микроматриц — напечатать тысячи функций обнаружения белков для исследования биологических образцов. Массивы антител являются примером, в котором множество различных антител расположены для обнаружения соответствующих антигенов в образце человеческой крови. Другой подход заключается в объединении нескольких типов белков для изучения таких свойств, как взаимодействия белок-ДНК, белок-белок и белок-лиганд. В идеале функциональные протеомные массивы должны содержать весь набор белков данного организма. Первая версия таких массивов состояла из 5000 очищенных белков дрожжей, нанесенных на предметные стекла. Несмотря на успех первого чипа, внедрение белковых массивов оказалось более сложной задачей. С белками по своей природе гораздо сложнее работать, чем с ДНК. Они имеют широкий динамический диапазон, менее стабильны, чем ДНК, и их структуру трудно сохранить на предметных стеклах, хотя они необходимы для большинства анализов. Глобальная технология ICAT имеет поразительные преимущества перед технологиями белковых чипов. [40]
белковые - фазовые микрочипы Обращенно
Это многообещающее и новое применение микрочипов для диагностики, изучения и лечения сложных заболеваний, таких как рак. Эта технология объединяет микродиссекцию лазерного захвата (LCM) с технологией микрочипов для производства белковых микрочипов с обращенной фазой. В микрочипах этого типа иммобилизуется вся совокупность белков с целью фиксации различных стадий заболевания у отдельного пациента. При использовании с LCM матрицы обращенной фазы могут отслеживать колебания состояния протеома среди различных популяций клеток на небольшой площади человеческой ткани. Это полезно для определения профиля состояния клеточных сигнальных молекул в поперечном срезе ткани, который включает как нормальные, так и раковые клетки. Этот подход полезен для мониторинга состояния ключевых факторов в нормальном эпителии простаты и тканях инвазивного рака простаты. Затем LCM препарирует эти ткани, и белковые лизаты помещают на нитроцеллюлозные предметные стекла, которые исследуют специфическими антителами. Этот метод позволяет отслеживать все виды молекулярных событий и сравнивать больные и здоровые ткани одного и того же пациента, что позволяет разрабатывать стратегии лечения и диагностики. Возможность получать протеомные снимки соседних клеточных популяций с использованием обращенно-фазовых микрочипов в сочетании с LCM имеет ряд применений, выходящих за рамки изучения опухолей. Этот подход может дать представление о нормальной физиологии и патологии всех тканей и имеет неоценимое значение для характеристики процессов развития и аномалий. [40]
белков с помощью биоортогональной химии Обнаружение
Недавние достижения в области биоортогональной химии открыли возможности ее применения в анализе белков. Расширение использования органических молекул для наблюдения за их реакцией с белками открывает широкие возможности для их маркировки. Неприродные аминокислоты и различные функциональные группы представляют собой новые технологии выращивания в протеомике.
Специфические биомолекулы, способные метаболизироваться в клетках или тканях, встраиваются в белки или гликаны. Молекула будет иметь аффинную метку, модифицирующую белок, позволяющую его обнаружить. Азидогомоаланин (AHA) использует эту аффинную метку посредством включения с синтетазой Met-t-RNA для включения в белки. Это позволило AHA помочь определить идентичность вновь синтезированных белков, созданных в ответ на возмущения , и идентифицировать белки, секретируемые клетками. [44]
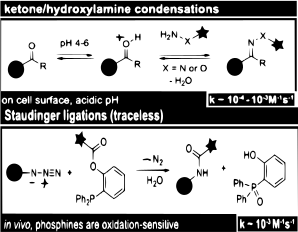
Недавние исследования [45] Использование конденсаций кетонов и альдегидов показывает, что они лучше всего подходят для мечения in vitro или поверхности клеток . Однако использование кетонов и альдегидов в качестве биоортогональных репортеров выявило медленную кинетику, что указывает на то, что, хотя они и эффективны для мечения, концентрация должна быть высокой.
Определенные белки можно обнаружить по их реакционной способности к азидным группам . Непротеиногенные аминокислоты могут нести азидные группы, которые реагируют с фосфинами в лигированиях Штаудингера . Эта реакция уже использовалась для мечения других биомолекул в живых клетках и животных. [46]
Область биоортогональности расширяется и стимулирует дальнейшие применения в протеомике. Стоит отметить ограничения и преимущества. Быстрые реакции могут создавать биоконъюнкции и создавать высокие концентрации с небольшим количеством реагентов. Напротив, медленные кинетические реакции, такие как конденсация альдегидов и кетонов, хотя и эффективны, требуют высокой концентрации, что делает их экономически неэффективными.
Практическое применение [ править ]
Открытие нового лекарства [ править ]
Одним из важнейших достижений в изучении человеческих генов и белков стало определение потенциальных новых лекарств для лечения болезней. Это опирается на информацию о геноме и протеоме для идентификации белков, связанных с заболеванием, которые компьютерное программное обеспечение затем может использовать в качестве мишеней для новых лекарств. Например, если определенный белок вовлечен в заболевание, его трехмерная структура предоставляет информацию для разработки лекарств, которые будут вмешиваться в действие белка. Молекула, которая соответствует активному центру фермента, но не может быть высвобождена ферментом, инактивирует фермент. Это основа новых инструментов поиска лекарств, целью которых является поиск новых лекарств для инактивации белков, участвующих в заболеваниях. Поскольку обнаруживаются генетические различия между людьми, исследователи рассчитывают использовать эти методы для разработки персонализированных лекарств, более эффективных для человека. [47]
Протеомика также используется для выявления сложных взаимодействий растений и насекомых, которые помогают идентифицировать гены-кандидаты, участвующие в защитной реакции растений на травоядных. [48] [49] [50]
Раздел протеомики, называемый хемопротеомикой, предоставляет многочисленные инструменты и методы для обнаружения белковых мишеней лекарств. [51]
сети Протеомика взаимодействия и белковые
Протеомика взаимодействия — это анализ белковых взаимодействий от масштабов бинарных взаимодействий до масштабов протеома или всей сети. Большинство белков функционируют посредством белок-белковых взаимодействий , и одной из целей протеомики взаимодействий является идентификация бинарных белковых взаимодействий , белковых комплексов и интерактомов .
Существует несколько методов исследования белок-белковых взаимодействий . В то время как наиболее традиционным методом является двухгибридный анализ дрожжей , мощным новым методом является аффинная очистка с последующей масс-спектрометрией белка с использованием меченых белковых приманок . Другие методы включают поверхностный плазмонный резонанс (ППР), [52] [53] белковые микрочипы , интерферометрия с двойной поляризацией , микромасштабный термофорез , кинетический анализ исключения и экспериментальные методы, такие как фаговый дисплей и in silico вычислительные методы .
Знание белок-белковых взаимодействий особенно полезно в отношении биологических сетей и системной биологии , например, в клеточных сигнальных каскадах и генных регуляторных сетях (GRN, где знание взаимодействий белок-ДНК также информативно). Общепротеомный анализ белковых взаимодействий и интеграция этих моделей взаимодействия в более крупные биологические сети имеют решающее значение для понимания биологии системного уровня . [54] [55]
Экспрессионная протеомика [ править ]
Протеомика экспрессии включает анализ экспрессии белка в более крупном масштабе. Это помогает идентифицировать основные белки в конкретном образце, а также те белки, которые дифференциально экспрессируются в родственных образцах, например, в больных и здоровых тканях. Если белок обнаружен только в образце больного человека, он может быть полезной мишенью для лекарств или диагностическим маркером. Белки с одинаковыми или подобными профилями экспрессии также могут быть функционально родственными. Существуют такие технологии, как 2D-PAGE и масс-спектрометрия , которые используются в экспрессионной протеомике. [56]
Биомаркеры [ править ]
Национальный институт здравоохранения определил биомаркер как «характеристику, которая объективно измеряется и оценивается как индикатор нормальных биологических процессов, патогенных процессов или фармакологического ответа на терапевтическое вмешательство». [57] [58]
Понимание протеома, структуры и функции каждого белка, а также сложности белок-белковых взаимодействий имеет решающее значение для разработки наиболее эффективных методов диагностики и лечения заболеваний в будущем. Например, протеомика очень полезна для идентификации биомаркеров-кандидатов (белков в жидкостях организма, имеющих значение для диагностики), идентификации бактериальных антигенов, на которые направлен иммунный ответ, а также идентификации возможных иммуногистохимических маркеров инфекционных или неопластических заболеваний. . [59]
Интересным применением протеомики является использование специфических белковых биомаркеров для диагностики заболеваний. Ряд методов позволяет проверить белки, вырабатываемые при конкретном заболевании, что помогает быстро диагностировать заболевание. Методы включают вестерн-блоттинг , иммуногистохимическое окрашивание , иммуноферментный анализ (ELISA) или масс-спектрометрию . [38] [60] Секретомика , раздел протеомики, изучающий секретируемые белки и пути секреции с использованием протеомных подходов, недавно стала важным инструментом для открытия биомаркеров заболеваний. [61]
Протеогеномика [ править ]
В протеогеномике протеомные технологии, такие как масс-спектрометрия, используются для улучшения аннотаций генов . Параллельный анализ генома и протеома облегчает обнаружение посттрансляционных модификаций и протеолитических событий. [62] особенно при сравнении нескольких видов (сравнительная протеогеномика). [63]
Структурная протеомика [ править ]
Структурная протеомика включает в себя крупномасштабный анализ белковых структур. Он сравнивает структуры белков и помогает определить функции недавно открытых генов. Структурный анализ также помогает понять, где лекарства связываются с белками, а также показывает, где белки взаимодействуют друг с другом. Это понимание достигается с помощью различных технологий, таких как рентгеновская кристаллография и ЯМР-спектроскопия. [56]
для протеомики (протеомная Биоинформатика информатика )
Большая часть протеомных данных собирается с помощью высокопроизводительных технологий, таких как масс-спектрометрия и микрочипы. Часто на анализ данных и сравнение вручную уходили недели или месяцы. По этой причине биологи и химики сотрудничают с учеными-компьютерщиками и математиками для создания программ и конвейеров для вычислительного анализа данных о белках. Используя методы биоинформатики , исследователи способны быстрее анализировать и хранить данные. Хорошее место для поиска списков текущих программ и баз данных — на портале биоинформатических ресурсов ExPASy . Приложения протеомики, основанной на биоинформатике, включают медицину, диагностику заболеваний, идентификацию биомаркеров и многое другое.
Идентификация белка [ править ]
Масс-спектрометрия и микрочип дают информацию о фрагментации пептидов, но не позволяют идентифицировать конкретные белки, присутствующие в исходном образце. Из-за отсутствия идентификации конкретных белков предыдущие исследователи были вынуждены расшифровывать сами пептидные фрагменты. Однако в настоящее время существуют программы для идентификации белков. Эти программы берут пептидные последовательности, полученные с помощью масс-спектрометрии и микрочипов, и возвращают информацию о совпадающих или похожих белках. Это делается с помощью алгоритмов, реализованных в программе, которые выполняют выравнивание с белками из известных баз данных, таких как UniProt. [64] and PROSITE [65] чтобы с определенной степенью уверенности предсказать, какие белки находятся в образце.
Структура белка [ править ]
Биомолекулярная структура образует трехмерную конфигурацию белка. Понимание структуры белка помогает определить его взаимодействия и функции. Раньше считалось, что трехмерную структуру белков можно было определить только с помощью рентгеновской кристаллографии и ЯМР-спектроскопии . По состоянию на 2017 год криоэлектронная микроскопия является ведущим методом, решающим трудности с кристаллизацией (в рентгеновской кристаллографии) и конформационной неоднозначностью (в ЯМР); разрешение по состоянию на 2015 год составляло 2,2 Å. Теперь, благодаря биоинформатике, существуют компьютерные программы, которые в некоторых случаях могут предсказывать и моделировать структуру белков. Эти программы используют химические свойства аминокислот и структурные свойства известных белков для прогнозирования трехмерной модели образцов белков. Это также позволяет ученым моделировать взаимодействия белков в более широком масштабе. Кроме того, биомедицинские инженеры разрабатывают методы, учитывающие гибкость белковых структур для проведения сравнений и прогнозов. [66]
Посттрансляционные модификации [ править ]
Большинство программ, доступных для анализа белков, не написаны для белков, подвергшихся посттрансляционным модификациям . [67] Некоторые программы принимают посттрансляционные модификации для облегчения идентификации белка, но затем игнорируют модификацию во время дальнейшего анализа белка. Важно учитывать эти модификации, поскольку они могут повлиять на структуру белка. В свою очередь, внимание научного сообщества привлек компьютерный анализ посттрансляционных модификаций. Текущие программы посттрансляционной модификации носят только прогнозирующий характер. [68] Химики, биологи и ученые-компьютерщики работают вместе над созданием и внедрением новых конвейеров, которые позволят анализировать посттрансляционные модификации, влияние которых на структуру и функцию белка было обнаружено экспериментально.
изучении белковых Вычислительные методы в биомаркеров
Одним из примеров использования биоинформатики и использования вычислительных методов является исследование белковых биомаркеров. Вычислительные прогнозные модели [69] показали, что обширный и разнообразный транспорт фето-материнских белков происходит во время беременности и может быть легко обнаружен неинвазивным путем в цельной крови матери. Этот вычислительный подход обошел главное ограничение — обилие материнских белков, мешающее обнаружению фетальных белков , при протеомном анализе материнской крови плода. Вычислительные модели могут использовать транскрипты генов плода, ранее идентифицированные в цельной крови матери , для создания комплексной протеомной сети термина «новорожденный» . Такая работа показывает, что фетальные белки, обнаруженные в крови беременной женщины, происходят из разнообразных групп тканей и органов развивающегося плода. Протеомные сети содержат множество биомаркеров , которые являются индикаторами развития и иллюстрируют потенциальное клиническое применение этой технологии как способа мониторинга нормального и аномального развития плода.
Также была введена теоретико-информационная основа для открытия биомаркеров , объединяющая информацию о биожидкостях и тканях. [70] Этот новый подход использует преимущества функциональной синергии между определенными биожидкостями и тканями, что дает возможность получить клинически значимые результаты, которые были бы невозможны, если бы ткани и биожидкости рассматривались индивидуально. Концептуализируя ткань-биожидкость как информационные каналы, можно идентифицировать важные прокси-биожидкости, а затем использовать их для направленной разработки клинической диагностики. Затем биомаркеры-кандидаты прогнозируются на основе критериев передачи информации по каналам ткань-биожидкость. Значимые взаимоотношения биожидкость-ткань можно использовать для определения приоритетности клинической проверки биомаркеров. [70]
тенденции Новые
Ряд новых концепций потенциально могут улучшить текущие особенности протеомики. Получение абсолютного количественного определения белков и мониторинг посттрансляционных модификаций — две задачи, которые влияют на понимание функции белков в здоровых и больных клетках. Для многих клеточных событий концентрации белка не меняются; скорее, их функция модулируется посттрансляционными модификациями (ПТМ). Методы мониторинга ПТМ — слаборазработанное направление протеомики. Выбор определенного подмножества белков для анализа существенно снижает сложность белка, что делает его полезным для диагностических целей, когда исходным материалом является кровь. Еще один важный аспект протеомики, но еще не рассмотренный, заключается в том, что методы протеомики должны быть сосредоточены на изучении белков в контексте окружающей среды. Растущее использование химических сшивающих агентов, вводимых в живые клетки для фиксации белок-белковых, белок-ДНК и других взаимодействий, может частично решить эту проблему. Задача состоит в том, чтобы определить подходящие методы сохранения соответствующих взаимодействий. Другая цель изучения белков — разработка более сложных методов визуализации белков и других молекул в живых клетках в режиме реального времени. [40]
Системная биология
Достижения в количественной протеомике, очевидно, позволят провести более глубокий анализ клеточных систем. [54] [55] Еще одним направлением исследований является анализ одиночных клеток. [71] [72] и ковариация белков в отдельных клетках [73] который отражает биологические процессы, такие как образование белковых комплексов, иммунные функции, [74] а также клеточный цикл и подготовка раковых клеток к устойчивости к лекарствам [75] Биологические системы подвержены разнообразным возмущениям ( клеточный цикл , клеточная дифференцировка , канцерогенез , окружающая среда (биофизические) и т. д.). Транскрипционные и трансляционные ответы на эти возмущения приводят к функциональным изменениям протеома, возникающим в ответ на стимул. Следовательно, описание и количественная оценка общепротеомных изменений содержания белка имеет решающее значение для более целостного понимания биологического явления на уровне всей системы. Таким образом, протеомика может рассматриваться как дополнение к геномике , транскриптомике , эпигеномике , метаболомике и другим подходам -омики в интегративном анализе, пытающемся более полно определить биологические фенотипы . Например, «Атлас протеома рака» предоставляет количественные данные по экспрессии белков для ~ 200 белков в более чем 4000 образцах опухолей с соответствующими транскриптомными и геномными данными из «Атласа генома рака» . [76] Подобные наборы данных о других типах клеток, типах тканей и видах, особенно с использованием глубокой масс-спектрометрии, станут чрезвычайно важным ресурсом для исследований в таких областях, как биология рака , развития и стволовых клеток биология , медицина и эволюционная биология .
плазмы человека Протеом
Характеристика протеома плазмы человека стала основной целью в области протеомики, но это также и наиболее сложные протеомы всех тканей человека. [77] Он содержит иммуноглобулин, цитокины, белковые гормоны и секретируемые белки, указывающие на инфекцию, помимо резидентных гемостатических белков. Он также содержит белки тканевой утечки из-за кровообращения в различных тканях организма. Таким образом, кровь содержит информацию о физиологическом состоянии всех тканей и в сочетании с ее доступностью делает протеом крови неоценимым для медицинских целей. Считается, что характеристика протеома плазмы крови является сложной задачей.
Глубина протеома плазмы охватывает динамический диапазон более 10 10 Между самым распространенным белком (альбумином) и самым низким (некоторые цитокины) и считается одной из основных проблем протеомики. [78] Временная и пространственная динамика еще больше усложняет изучение протеома плазмы человека. Обмен некоторых белков происходит гораздо быстрее, чем других, и содержание белка в артерии может существенно отличаться от содержания белка в вене. Из-за всех этих различий даже самая простая протеомная задача каталогизации протеома кажется недостижимой. Для решения этой проблемы необходимо расставить приоритеты. Одним из таких приоритетов является захват наиболее значимого подмножества белков во всем протеоме для создания диагностического инструмента. Во-вторых, поскольку рак связан с повышенным гликозилированием белков, также будут полезны методы, ориентированные на эту часть белков. Опять же: многопараметрический анализ лучше всего выявляет патологическое состояние. По мере совершенствования этих технологий профили заболеваний должны постоянно быть связаны с изменениями экспрессии соответствующих генов. [40] Из-за вышеупомянутых проблем протеомика плазмы оставалась сложной задачей. Однако технологические достижения и постоянные разработки, похоже, приводят к возрождению протеомики плазмы, как это недавно было показано с помощью технологии, называемой профилированием протеома плазмы. [79] Благодаря таким технологиям исследователи смогли изучить процессы воспаления у мышей, наследственность протеомов плазмы, а также показать влияние такого распространенного изменения образа жизни, как потеря веса, на протеом плазмы. [80] [81] [82]
Журналы [ править ]
Многочисленные журналы посвящены области протеомики и смежным областям. Обратите внимание, что журналы, посвященные белкам, обычно больше фокусируются на структуре и функциях, тогда как журналы по протеомике больше ориентированы на крупномасштабный анализ целых протеомов или, по крайней мере, больших наборов белков. Некоторые из наиболее важных [ по мнению кого? ] перечислены ниже (с их издателями).
- Молекулярная и клеточная протеомика ( ASBMB )
- Журнал исследований протеома ( ACS )
- Журнал протеомики ( Elsevier )
- Протеомика ( Уайли )
См. также [ править ]
- Протеомика, основанная на активности
- Протеомика снизу вверх
- Цитомика
- Функциональная геномика
- Термостабилизация
- Проект протеома человека
- Иммунопротеомика
- Список биологических баз данных
- Список тем омики по биологии
- ПЭГилирование
- Фосфопротеомика
- Производство белка
- Протеогеномика
- Протеомная химия
- Секретомика
- Протеомика дробовика
- Нисходящая протеомика
- Системная биология
- Дрожжевая двугибридная система
- TCP-последовательность
- гликомика
Базы данных белков [ править ]
- Атлас человеческого белка
- Справочная база данных по белкам человека
- Национальный центр биотехнологической информации (NCBI)
- Пептидный Атлас
- Банк данных белков (PDB)
- Информационный ресурс о белках (PIR)
- База данных протеомной идентификации (PRIDE)
- Proteopedia — Совместная трехмерная энциклопедия белков и других молекул.
- Свисс-Прот
- ЮниПрот
Исследовательские центры [ править ]
Ссылки [ править ]
- ^ Андерсон Н.Л., Андерсон Н.Г. (август 1998 г.). «Протеом и протеомика: новые технологии, новые концепции и новые слова». Электрофорез . 19 (11): 1853–1861. дои : 10.1002/elps.1150191103 . ПМИД 9740045 . S2CID 28933890 .
- ^ Блэксток WP, член парламента Weir (март 1999 г.). «Протеомика: количественное и физическое картирование клеточных белков». Тенденции в биотехнологии . 17 (3): 121–127. дои : 10.1016/S0167-7799(98)01245-1 . ПМИД 10189717 .
- ^ Андерсон Дж.Д., Йоханссон Х.Дж., Грэм К.С., Вестерлунд М., Фам М.Т., Брамлетт К.С. и др. (март 2016 г.). «Комплексный протеомный анализ экзосом мезенхимальных стволовых клеток выявляет модуляцию ангиогенеза посредством передачи сигналов ядерного фактора-KappaB» . Стволовые клетки . 34 (3): 601–613. дои : 10.1002/stem.2298 . ПМЦ 5785927 . ПМИД 26782178 .
- ^ Худ Л., Роуэн Л. (13 сентября 2013 г.). «Проект «Геном человека»: большая наука меняет биологию и медицину» . Геномная медицина . 5 (9): 79. дои : 10,1186/gm483 . ПМК 4066586 . ПМИД 24040834 .
- ^ Чжан Ю, Фонслоу Б.Р., Шан Б., Пэк М.К., Йейтс-младший (апрель 2013 г.). «Анализ белков методом дробовика/протеомики снизу вверх» . Химические обзоры . 113 (4): 2343–2394. дои : 10.1021/cr3003533 . ПМЦ 3751594 . ПМИД 23438204 .
- ^ Гатто Л., Эберсолд Р., Кокс Дж., Демичев В., Деркс Дж., Эммотт Э. и др. (март 2023 г.). «Первоначальные рекомендации по проведению, сравнительному анализу и составлению отчетов об экспериментах по протеомике отдельных клеток» . Природные методы . 20 (3): 375–386. дои : 10.1038/s41592-023-01785-3 . ПМЦ 10130941 . ПМИД 36864200 . S2CID 251018292 .
- ^ Славов Н. (февраль 2021 г.). «Анализ одноклеточных белков методом масс-спектрометрии» . Современное мнение в области химической биологии . Омики. 60 : 1–9. дои : 10.1016/j.cbpa.2020.04.018 . ПМЦ 7767890 . ПМИД 32599342 .
- ^ Васингер В.К., Кордвелл С.Дж., Серпа-Поляк А., Ян Дж.Х., Гули А.А., Уилкинс М.Р. и др. (июль 1995 г.). «Прогресс в картировании генных продуктов Mollicutes: Mycoplasmaogenicium». Электрофорез . 16 (7): 1090–1094. дои : 10.1002/elps.11501601185 . ПМИД 7498152 . S2CID 9269742 .
- ^ Суинбэнкс Д. (декабрь 1995 г.). «Правительство поддерживает предложение протеома» . Природа . 378 (6558): 653. Бибкод : 1995Natur.378..653S . дои : 10.1038/378653a0 . ПМИД 7501000 .
- ^ «APAF - Австралийский центр анализа протеома» . www.proteome.org.au . Новый Южный Уэльс, Австралия: Университет Маккуори . Проверено 06 февраля 2017 г.
- ^ Роджерс С., Джиролами М., Колх В., Уотерс К.М., Лю Т., Тралл Б., Уайли Х.С. (декабрь 2008 г.). «Исследование соответствия между транскриптомными и протеомными профилями экспрессии с использованием связанных кластерных моделей» . Биоинформатика . 24 (24): 2894–2900. doi : 10.1093/биоинформатика/btn553 . ПМЦ 4141638 . ПМИД 18974169 .
- ^ Дхингра В., Гупта М., Андахт Т., Фу З.Ф. (август 2005 г.). «Новые рубежи в исследованиях протеомики: перспективы». Международный фармацевтический журнал . 299 (1–2): 1–18. doi : 10.1016/j.ijpharm.2005.04.010 . ПМИД 15979831 .
- ^ Букингем С. (май 2003 г.). «Большой мир микроРНК» . Проверено 14 января 2009 г.
- ^ Олсен Дж.В., Благоев Б., Гнад Ф., Мачек Б., Кумар С., Мортенсен П., Манн М. (ноябрь 2006 г.). «Глобальная, in vivo и сайт-специфическая динамика фосфорилирования в сигнальных сетях» . Клетка . 127 (3): 635–648. дои : 10.1016/j.cell.2006.09.026 . ПМИД 17081983 . S2CID 7827573 .
- ^ Шринивас П.Р., Верма М., Чжао Ю., Шривастава С. (август 2002 г.). «Протеомика для открытия биомаркеров рака». Клиническая химия . 48 (8): 1160–1169. ПМИД 12142368 .
- ^ Гиги С.П., Рошон Ю., Франца Б.Р., Эберсольд Р. (март 1999 г.). «Корреляция между содержанием белка и мРНК у дрожжей» . Молекулярная и клеточная биология . 19 (3): 1720–1730. дои : 10.1128/MCB.19.3.1720 . ПМК 83965 . ПМИД 10022859 .
- ^ Белль А., Танай А., Битинка Л., Шамир Р., О'Ши Э.К. (август 2006 г.). «Количественная оценка периода полураспада белка в протеоме почкующихся дрожжей» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (35): 13004–13009. Бибкод : 2006PNAS..10313004B . дои : 10.1073/pnas.0605420103 . ПМК 1550773 . ПМИД 16916930 .
- ^ Пэн Дж., Элиас Дж.Э., Торин CC, Ликлайдер Л.Дж., Гиги С.П. (2003). «Оценка многомерной хроматографии в сочетании с тандемной масс-спектрометрией (ЖХ/ЖХ-МС/МС) для крупномасштабного анализа белков: протеом дрожжей». Журнал исследований протеома . 2 (1): 43–50. CiteSeerX 10.1.1.460.237 . дои : 10.1021/pr025556v . ПМИД 12643542 .
- ^ Член парламента Уошберна, Уолтерс Д., Йейтс-младший (март 2001 г.). «Крупномасштабный анализ протеома дрожжей с помощью технологии многомерной идентификации белков». Природная биотехнология . 19 (3): 242–247. дои : 10.1038/85686 . ПМИД 11231557 . S2CID 16796135 .
- ^ Табб Д.Л., Вега-Монтото Л., Рудник П.А., Вариат А.М., Хэм А.Дж., Банк Д.М. и др. (февраль 2010 г.). «Повторяемость и воспроизводимость протеомной идентификации методом жидкостной хроматографии и тандемной масс-спектрометрии» . Журнал исследований протеома . 9 (2): 761–776. дои : 10.1021/pr9006365 . ПМЦ 2818771 . ПМИД 19921851 .
- ^ Домон Б., Эберсольд Р. (июль 2010 г.). «Варианты и соображения при выборе стратегии количественной протеомики». Природная биотехнология . 28 (7): 710–721. дои : 10.1038/nbt.1661 . ПМИД 20622845 . S2CID 12367142 .
- ^ Дюпри Э.Дж., Джаятирта М., Йорки Х., Михасан М., Петре Б.А., Дари CC (июль 2020 г.). «Критический обзор восходящей протеомики: хорошее, плохое и будущее этой области» . Протеомы . 8 (3): 14. doi : 10.3390/proteomes8030014 . ПМК 7564415 . ПМИД 32640657 .
- ^ Курссен-младший, Ергей А.Л. (декабрь 2015 г.). «Протеомика - это аналитическая химия: соответствие цели при применении анализа сверху вниз и снизу вверх» . Протеомы . 3 (4): 440–453. doi : 10.3390/proteomes3040440 . ПМЦ 5217385 . ПМИД 28248279 .
- ^ Кениг С. (февраль 2021 г.). «Спектральное качество превосходит оценку программного обеспечения. Краткое руководство по анализу данных фрагментации пептидов для непрофессионалов по масс-спектрометрии» . Журнал масс-спектрометрии . 56 (2): e4616. дои : 10.1002/jms.4616 . ПМИД 32955142 . S2CID 221827335 .
- ^ Дункан М.В. (июнь 2012 г.). «Хорошая масс-спектрометрия и ее место в хорошей науке». Журнал масс-спектрометрии . 47 (6): 795–809. Бибкод : 2012JMSp...47..795D . дои : 10.1002/jms.3038 . ПМИД 22707172 .
- ^ Арбаби Гаруди М., Демитер А., Винс Л., Хамерс Р., Мюлдерманс С. (сентябрь 1997 г.). «Отбор и идентификация фрагментов однодоменных антител из верблюжьих антител с тяжелой цепью» . Письма ФЭБС . 414 (3): 521–526. дои : 10.1016/S0014-5793(97)01062-4 . ПМИД 9323027 . S2CID 5988844 .
- ^ Стампп М.Т., Бинц Х.К., Амштуц П. (август 2008 г.). «DARPins: новое поколение белковой терапии». Открытие наркотиков сегодня . 13 (15–16): 695–701. дои : 10.1016/j.drudis.2008.04.013 . ПМИД 18621567 .
- ^ Джаясена С.Д. (сентябрь 1999 г.). «Аптамеры: новый класс молекул, конкурирующих с антителами в диагностике» . Клиническая химия . 45 (9): 1628–1650. дои : 10.1093/клинчем/45.9.1628 . ПМИД 10471678 .
- ^ Уилсон Д.Х., Риссин Д.М., Кан К.В., Фурнье Д.Р., Пих Т., Кэмпбелл Т.Г. и др. (август 2016 г.). «Анализатор Simoa HD-1: новый полностью автоматизированный цифровой иммуноанализатор с чувствительностью к одиночным молекулам и мультиплексированием» . Журнал автоматизации лабораторий . 21 (4): 533–547. дои : 10.1177/2211068215589580 . ПМИД 26077162 .
- ^ Нельсон Р.В., Кроун-младший, Бибер А.Л., Уильямс П. (апрель 1995 г.). «Масс-спектрометрический иммуноанализ». Аналитическая химия . 67 (7): 1153–1158. дои : 10.1021/ac00103a003 . ОСТИ 1175578 . ПМИД 15134097 .
- ^ «SISCAPA, захват стандартного изотопа антипептидными антителами» . Институт Броуда Массачусетского технологического института и Гарварда . 2015. Архивировано из оригинала 15 июля 2015 г. Проверено 15 июля 2015 г.
- ^ Jump up to: Перейти обратно: а б Тонг Р., Шоу Дж., Миддлтон Б., Роулинсон Р., Рейнер С., Янг Дж. и др. (март 2001 г.). «Валидация и разработка технологии протеомики флуоресцентного двумерного дифференциального гель-электрофореза». Протеомика . 1 (3): 377–396. doi : 10.1002/1615-9861(200103)1:3<377::AID-PROT377>3.0.CO;2-6 . ПМИД 11680884 . S2CID 22432028 .
- ^ Ван Л.П., Шен Дж., Ге Л.К., Ву Дж.К., Ян Г.К., Ян Г.К. (ноябрь 2010 г.). «Вызванное инсектицидами увеличение содержания белка в добавочных железах самцов и его влияние на плодовитость самок коричневой цикадки Nilaparvata lugens Stål (Hemiptera: Delphacidae)». Защита урожая . 29 (11): 1280–5. дои : 10.1016/j.cropro.2010.07.009 .
- ^ Jump up to: Перейти обратно: а б Ge LQ, Ченг Ю, Ву Дж.К., Ян Г.К. (октябрь 2011 г.). «Протеомный анализ инсектицидных триазофос-индуцированных белков, реагирующих на спаривание Nilaparvata lugens Stål (Hemiptera: Delphacidae)». Журнал исследований протеома . 10 (10): 4597–4612. дои : 10.1021/pr200414g . ПМИД 21800909 .
- ^ Jump up to: Перейти обратно: а б Ройман С. (май 2011 г.). «К определению полного протеома пероксисом растений: где экспериментальная протеомика должна быть дополнена биоинформатикой». Протеомика . 11 (9): 1764–1779. дои : 10.1002/pmic.201000681 . ПМИД 21472859 . S2CID 20337179 .
- ^ Улен М., Понтен Ф. (апрель 2005 г.). «Протеомика на основе антител для профилирования тканей человека» . Молекулярная и клеточная протеомика . 4 (4): 384–393. дои : 10.1074/mcp.R500009-MCP200 . ПМИД 15695805 .
- ^ Дженсен О.Н. (февраль 2004 г.). «Протеомика, специфичная для модификаций: характеристика посттрансляционных модификаций с помощью масс-спектрометрии». Современное мнение в области химической биологии . 8 (1): 33–41. дои : 10.1016/j.cbpa.2003.12.009 . ПМИД 15036154 .
- ^ Jump up to: Перейти обратно: а б Клопфляйш Р., Клозе П., Вайзе С., Бондзио А., Мультхауп Г., Эйнспаньер Р., Грубер А.Д. (декабрь 2010 г.). «Протеом метастатического рака молочной железы собак: сходства и различия с раком молочной железы человека». Журнал исследований протеома . 9 (12): 6380–6391. дои : 10.1021/pr100671c . ПМИД 20932060 .
- ^ Алинежад Т., Бин К.К., Веджаян Дж., Отман Р.Ю., Бхасу С. (сентябрь 2015 г.). «Протеомный анализ дифференциально экспрессируемого белка в гемоцитах дикой гигантской пресноводной креветки Macrobrachium rosenbergii, инфицированной вирусом инфекционного гиподермального и гематопоэтического некроза (IHHNV)» . Мета Джин . 5 : 55–67. дои : 10.1016/j.mgene.2015.05.004 . ПМЦ 4473098 . ПМИД 26106581 .
- ^ Jump up to: Перейти обратно: а б с д и ж Уэстон А.Д., Худ Л. (2004). «Системная биология, протеомика и будущее здравоохранения: к прогностической, профилактической и персонализированной медицине». Журнал исследований протеома . 3 (2): 179–196. CiteSeerX 10.1.1.603.4384 . дои : 10.1021/pr0499693 . ПМИД 15113093 .
- ^ Розанова Светлана; Барковиц, Каталин; Николов, Мирослав; Шмидт, Карла; Урлауб, Хеннинг; Маркус, Катрин (2021), Маркус, Катрин; Эйзенахер, Мартин; Ситек, Барбара (ред.), «Количественная протеомика на основе масс-спектрометрии: обзор», Количественные методы в протеомике , Методы молекулярной биологии, том. 2228, Нью-Йорк, штат Нью-Йорк: Springer US, стр. 85–116, doi : 10.1007/978-1-0716-1024-4_8 , ISBN. 978-1-0716-1023-7 , PMID 33950486 , S2CID 233740602
- ^ Николов, Мирослав; Шмидт, Карла; Урлауб, Хеннинг (2012), Маркус, Катрин (редактор), «Количественная протеомика на основе масс-спектрометрии: обзор» , Количественные методы в протеомике , Методы молекулярной биологии, том. 893, Тотова, Нью-Джерси: Humana Press, стр. 85–100, doi : 10.1007/978-1-61779-885-6_7 , hdl : 11858/00-001M-0000-000F-C327-D , ISBN 978-1-61779-884-9 , PMID 22665296 , S2CID 33009117 , получено 14 апреля 2023 г.
- ^ Стовесандт О., Тауссиг М.Дж. (август 2012 г.). «Аффинная протеомика: роль специфически связывающих реагентов в анализе протеома человека». Экспертное обозрение по протеомике . 9 (4): 401–414. дои : 10.1586/12.34 апреля . ПМИД 22967077 . S2CID 19727645 .
- ^ Эйхельбаум К., Винтер М., Берриэль Диас М., Херциг С., Кригсвельд Дж. (октябрь 2012 г.). «Селективное обогащение вновь синтезированных белков для количественного анализа секретома». Природная биотехнология . 30 (10): 984–990. дои : 10.1038/nbt.2356 . ПМИД 23000932 . S2CID 2651429 .
- ^ Ланг К., Чин Дж.В. (январь 2014 г.). «Биоортогональные реакции мечения белков». АКС Химическая биология . 9 (1): 16–20. дои : 10.1021/cb4009292 . ПМИД 24432752 .
- ^ Деварадж Н.К. (август 2018 г.). «Будущее биоортогональной химии» . Центральная научная служба ACS . 4 (8): 952–959. дои : 10.1021/accentsci.8b00251 . ПМК 6107859 . ПМИД 30159392 .
- ^ Вайдьянатан Дж. (март 2012 г.). «Переосмысление клинических исследований: эпоха персонализированной медицины» . Клетка . 148 (6): 1079–1080. дои : 10.1016/j.cell.2012.02.041 . ПМИД 22424218 .
- ^ Раквал Р., Комацу С. (июль 2000 г.). «Роль жасмоната в механизме самозащиты риса (Oryza sativa L.) с использованием анализа протеома». Электрофорез . 21 (12): 2492–2500. doi : 10.1002/1522-2683(20000701)21:12<2492::AID-ELPS2492>3.0.CO;2-2 . ПМИД 10939463 . S2CID 24979515 .
- ^ Ву Дж, Болдуин И.Т. (2010). «Новое понимание реакции растений на нападение травоядных насекомых». Ежегодный обзор генетики . 44 : 1–24. doi : 10.1146/annurev-genet-102209-163500 . ПМИД 20649414 .
- ^ Сангха Дж.С., Чен Ю.Х., Каур Дж., Хан В., Абдулджалил З., Аланази М.С. и др. (февраль 2013 г.). «Анализ протеома мутантов риса (Oryza sativa L.) выявил дифференциально индуцированные белки во время заражения бурой цикадкой (Nilaparvata lugens)» . Международный журнал молекулярных наук . 14 (2): 3921–3945. дои : 10.3390/ijms14023921 . ПМК 3588078 . ПМИД 23434671 .
- ^ Мёллеринг Р.Э., Краватт Б.Ф. (январь 2012 г.). «Как хемопротеомика может способствовать открытию и разработке лекарств» . Химия и биология . 19 (1): 11–22. doi : 10.1016/j.chembiol.2012.01.001 . ПМК 3312051 . ПМИД 22284350 .
- ^ де Мол, Нью-Джерси (2012). «Поверхностный плазмонный резонанс для протеомики». Химическая геномика и протеомика . Методы молекулярной биологии. Том. 800. стр. 33–53. дои : 10.1007/978-1-61779-349-3_4 . ISBN 978-1-61779-348-6 . ПМИД 21964781 .
- ^ Виссер Н.Ф., Хек А.Дж. (июнь 2008 г.). «Масс-спектрометрия поверхностного плазмонного резонанса в протеомике». Экспертное обозрение по протеомике . 5 (3): 425–433. дои : 10.1586/14789450.5.3.425 . ПМИД 18532910 . S2CID 11772983 .
- ^ Jump up to: Перейти обратно: а б Бенсимон А., Хек А.Дж., Эберсольд Р. (7 июля 2012 г.). «Протеомика и сетевая биология на основе масс-спектрометрии». Ежегодный обзор биохимии . 81 (1): 379–405. doi : 10.1146/annurev-biochem-072909-100424 . ПМИД 22439968 .
- ^ Jump up to: Перейти обратно: а б Сабидо Э., Селевсек Н., Эберсольд Р. (август 2012 г.). «Протеомика на основе масс-спектрометрии для системной биологии». Современное мнение в области биотехнологии . 23 (4): 591–597. дои : 10.1016/j.copbio.2011.11.014 . ПМИД 22169889 .
- ^ Jump up to: Перейти обратно: а б «Что такое протеомика?» . ПротеоКонсалт. [ ненадежный медицинский источник? ]
- ^ Стримбу К., Тавель Дж.А. (ноябрь 2010 г.). «Что такое биомаркеры?» . Современное мнение о ВИЧ и СПИДе . 5 (6): 463–466. дои : 10.1097/COH.0b013e32833ed177 . ПМЦ 3078627 . ПМИД 20978388 .
- ^ Рабочая группа по определениям биомаркеров (март 2001 г.). «Биомаркеры и суррогатные конечные точки: предпочтительные определения и концептуальная основа». Клиническая фармакология и терапия . 69 (3): 89–95. дои : 10.1067/mcp.2001.113989 . ПМИД 11240971 . S2CID 288484 .
- ^ Сесилиани Ф., Экерсолл Д., Берчмор Р., Лекки К. (март 2014 г.). «Протеомика в ветеринарной медицине: применение и тенденции в патогенезе и диагностике заболеваний». Ветеринарная патология . 51 (2): 351–362. дои : 10.1177/0300985813502819 . hdl : 2434/226049 . ПМИД 24045891 . S2CID 25693263 .
- ^ Клопфляйш Р., Грубер А.Д. (май 2009 г.). «Повышенная экспрессия BRCA2 и RAD51 в метастазах лимфатических узлов аденокарциномы молочной железы собак» . Ветеринарная патология . 46 (3): 416–422. doi : 10.1354/vp.08-VP-0212-K-FL . ПМИД 19176491 . S2CID 11583190 .
- ^ Хатхут Ю. (апрель 2007 г.). «Подходы к изучению клеточного секретома». Экспертное обозрение по протеомике . 4 (2): 239–248. дои : 10.1586/14789450.4.2.239 . ПМИД 17425459 . S2CID 26169223 .
- ^ Гупта Н., Таннер С., Джейтли Н., Адкинс Дж.Н., Липтон М., Эдвардс Р. и др. (сентябрь 2007 г.). «Целопротеомный анализ посттрансляционных модификаций: применение масс-спектрометрии для протеогеномной аннотации» . Геномные исследования . 17 (9): 1362–1377. дои : 10.1101/гр.6427907 . ПМК 1950905 . ПМИД 17690205 .
- ^ Гупта Н., Бенхамида Дж., Бхаргава В., Гудман Д., Кейн Э., Керман И. и др. (июль 2008 г.). «Сравнительная протеогеномика: сочетание масс-спектрометрии и сравнительной геномики для анализа множественных геномов» . Геномные исследования . 18 (7): 1133–1142. дои : 10.1101/гр.074344.107 . ПМК 2493402 . ПМИД 18426904 .
- ^ «ЮниПрот» . www.uniprot.org .
- ^ "ExPASy - PROSITE" . prosite.expasy.org .
- ^ Ван Х.В., Чу Ч., Ван В.К., Пай Т.В. (апрель 2014 г.). «Дескриптор локального среднего расстояния для гибкого сравнения структуры белков» . БМК Биоинформатика . 15 (95): 95. дои : 10.1186/1471-2105-15-95 . ПМЦ 3992163 . ПМИД 24694083 .
- ^ Петров Д., Маргрейтер С., Грандиц М., Остенбринк С., Загрович Б. (июль 2013 г.). «Систематическая основа молекулярно-динамического моделирования посттрансляционных модификаций белков» . PLOS Вычислительная биология . 9 (7): e1003154. Бибкод : 2013PLSCB...9E3154P . дои : 10.1371/journal.pcbi.1003154 . ПМЦ 3715417 . ПМИД 23874192 .
- ^ Маргрейтер С., Петров Д., Загрович Б. (июль 2013 г.). «Веб-сервер Vienna-PTM: набор инструментов для МД-моделирования посттрансляционных модификаций белков» . Исследования нуклеиновых кислот . 41 (проблема с веб-сервером): W422–W426. дои : 10.1093/нар/gkt416 . ПМК 3692090 . ПМИД 23703210 .
- ^ Марон Дж.Л., Альтеровиц Г., Рамони М., Джонсон К.Л., Бьянки Д.В. (декабрь 2009 г.). «Высокопроизводительное обнаружение и характеристика торговли фетальными белками в крови беременных женщин» . Протеомика. Клинические применения . 3 (12): 1389–1396. дои : 10.1002/prca.200900109 . ПМЦ 2825712 . ПМИД 20186258 .
- ^ Jump up to: Перейти обратно: а б Альтеровиц Г., Сян М., Лю Дж., Чанг А., Рамони М.Ф. (2008). «Общесистемное обнаружение периферических биомаркеров с использованием теории информации» . Биокомпьютинг 2008 . стр. 231–42. дои : 10.1142/9789812776136_0024 . ISBN 9789812776082 . ПМИД 18229689 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Славов Н. (январь 2022 г.). «Расширение масштабов протеомики отдельных клеток» . Молекулярная и клеточная протеомика . 21 (1): 100179. doi : 10.1016/j.mcpro.2021.100179 . ПМЦ 8683604 . ПМИД 34808355 .
- ^ Деркс Дж., Ледюк А., Валлманн Г., Хаффман Р.Г., Уиллеттс М., Хан С. и др. (июль 2022 г.). «Увеличение производительности чувствительной протеомики с помощью plexDIA» . Природная биотехнология . 41 (1): 50–59. дои : 10.1038/s41587-022-01389-w . ПМЦ 9839897 . ПМИД 35835881 .
- ^ Славов Н. (январь 2022 г.). «Изучение естественных вариаций протеомов отдельных клеток» . ПЛОС Биология . 20 (1): e3001512. дои : 10.1371/journal.pbio.3001512 . ПМЦ 8765665 . ПМИД 34986167 .
- ^ Хаффман Р.Г., Ледюк А., Вихманн С., ди Джоя М., Борриелло Ф., Шпехт Х. и др. (18 марта 2022 г.). «Приоритетная протеомика одиночных клеток выявляет молекулярную и функциональную поляризацию первичных макрофагов». bioRxiv : 2022.03.16.484655. дои : 10.1101/2022.03.16.484655 . S2CID 247599981 .
- ^ Ледюк А., Хаффман Р.Г., Кантлон Дж., Хан С., Славов Н. (декабрь 2022 г.). «Изучение функциональной ковариации белков в отдельных клетках с использованием nPOP» . Геномная биология . 23 (1): 261. doi : 10.1186/s13059-022-02817-5 . ПМЦ 9756690 . ПМИД 36527135 .
- ^ Ли Дж., Лу Ю., Акбани Р., Джу З., Робак П.Л., Лю В. и др. (ноябрь 2013 г.). «TCPA: ресурс данных функциональной протеомики рака» . Природные методы . 10 (11): 1046–1047. дои : 10.1038/nmeth.2650 . ПМЦ 4076789 . ПМИД 24037243 .
- ^ Андерсон Н.Л. (февраль 2010 г.). «Клинический протеом плазмы: обзор клинических анализов белков в плазме и сыворотке» . Клиническая химия . 56 (2): 177–185. дои : 10.1373/clinchem.2009.126706 . ПМИД 19884488 .
- ^ Андерсон Л. (июль 2014 г.). «Шесть десятилетий в поисках смысла в протеоме». Журнал протеомики . 107 : 24–30. дои : 10.1016/j.jprot.2014.03.005 . ПМИД 24642211 .
- ^ Гейер П.Е., Кулак Н.А., Пихлер Г., Холдт Л.М., Тойпсер Д., Манн М. (март 2016 г.). «Профилирование протеома плазмы для оценки здоровья и заболеваний человека» . Клеточные системы . 2 (3): 185–195. дои : 10.1016/j.cels.2016.02.015 . hdl : 11858/00-001M-0000-002B-A17E-4 . ПМИД 27135364 .
- ^ Мальмстрем Э., Килсгорд О., Хаури С., Смедс Э., Хервальд Х., Мальмстрём Л., Мальмстрём Дж. (январь 2016 г.). «Крупномасштабный вывод о происхождении белковой ткани в плазме грамположительного сепсиса с использованием количественной целевой протеомики» . Природные коммуникации . 7 : 10261. Бибкод : 2016NatCo...710261M . дои : 10.1038/ncomms10261 . ПМЦ 4729823 . ПМИД 26732734 .
- ^ Гейер П.Е., Вевер Альбрехцен Н.Дж., Тьянова С., Грассл Н., Ипсен Э.В., Лундгрен Дж. и др. (декабрь 2016 г.). «Протеомика раскрывает влияние устойчивой потери веса на протеом плазмы человека» . Молекулярная системная биология . 12 (12): 901. дои : 10.15252/msb.20167357 . ПМК 5199119 . ПМИД 28007936 .
- ^ Лю Ю., Буил А., Коллинз Б.С., Жилле Л.С., Блюм Л.С., Ченг Л.И. и др. (февраль 2015 г.). «Количественная изменчивость 342 белков плазмы в популяции близнецов человека» . Молекулярная системная биология . 11 (1): 786. doi : 10.15252/msb.20145728 . ПМЦ 4358658 . ПМИД 25652787 .
Библиография [ править ]
- Арора П.С., Ямагива Х., Шривастава А., Боландер М.Е., Саркар Г. (2005). «Сравнительная оценка двух программных приложений для анализа изображений двумерного гель-электрофореза с использованием синовиальной жидкости пациентов с заболеваниями суставов». Журнал ортопедической науки . 10 (2): 160–166. дои : 10.1007/s00776-004-0878-0 . ПМИД 15815863 . S2CID 45193214 .
- Белхаджджам К., Эмбери С.М., Фан Х., Гобл К.А., Хермякоб Х., Хаббард С.Дж. и др. (сентябрь 2005 г.). Интеграция протеомных данных: характеристики и проблемы (PDF) . Материалы собрания всех участников британской электронной науки. Ноттингем, Великобритания. ISBN 978-1-904425-53-3 . Архивировано из оригинала (PDF) 28 июня 2006 года.
- Сесилиани Ф., Экерсолл Д., Берчмор Р., Лекки К. (март 2014 г.). «Протеомика в ветеринарии: применение и тенденции в патогенезе и диагностике заболеваний». Ветеринарная патология . 51 (2): 351–62. дои : 10.1177/0300985813502819 . hdl : 2434/226049 . ПМИД 24045891 . S2CID 25693263 .
- Либлер, округ Колумбия (2002). Введение в протеомику: инструменты новой биологии . Тотова, Нью-Джерси: Humana Press. ISBN 978-0-89603-992-6 . ISBN 0-585-41879-9 (электронный, в Netlibrary?), ISBN 0-89603-991-9 хбк
- Маколей И.С., Карр П., Гуснанто А., Оувеханд В.Х., Фицджеральд Д., Уоткинс Н.А. (декабрь 2005 г.). «Геномика и протеомика тромбоцитов в здоровье и заболеваниях человека» . Журнал клинических исследований . 115 (12): 3370–3377. дои : 10.1172/JCI26885 . ПМЦ 1297260 . ПМИД 16322782 .
- Навен Т., Вестермайер Р. (2002). Протеомика на практике: Лабораторное руководство по анализу протеома . Вайнхайм: Wiley-VCH. ISBN 978-3-527-30354-0 . (ориентирован на 2D-гели, хорош в детализации)
- Твайман Р.М. (2004). Принципы протеомики (серия расширенных текстов) . Оксфорд, Великобритания: Научные издательства BIOS. ISBN 978-1-85996-273-2 . (охватывает практически все разделы протеомики)
- Хаген Дж. (2008). Подготовка проб для протеомики . Вайнхайм: Wiley-VCH. ISBN 978-3-527-31796-7 .
- Уилкинс М.Р., Уильямс К.Л., Аппель Р.Д., Хохштрассер Д.Ф. (1997). Исследования протеома: новые рубежи функциональной геномики (принципы и практика) . Берлин: Шпрингер. ISBN 978-3-540-62753-1 .
- Васан РС (май 2006 г.). «Биомаркеры сердечно-сосудистых заболеваний: молекулярная основа и практические соображения» . Тираж . 113 (19): 2335–2362. doi : 10.1161/CIRCULATIONAHA.104.482570 . ПМИД 16702488 .