Иммуногистохимия
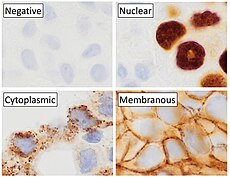
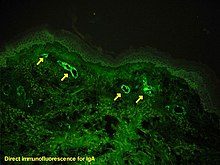

Иммуногистохимия — это форма иммуноокрашивания . Он включает в себя процесс выборочной идентификации антигенов (белков) в клетках и тканях, используя принцип антител, специфически связывающихся с антигенами в биологических тканях . Альберт Хьюитт Кунс , Эрнест Берлинер , Норман Джонс и Хью Дж. Крич были первыми, кто разработал иммунофлуоресценцию в 1941 году. Это привело к более позднему развитию иммуногистохимии. [2] [3]
Иммуногистохимическое окрашивание широко используется для диагностики аномальных клеток, например, обнаруженных в раковых опухолях. В некоторых раковых клетках экспрессируются определенные опухолевые антигены, которые позволяют их обнаружить. Иммуногистохимия также широко используется в фундаментальных исследованиях, чтобы понять распределение и локализацию биомаркеров и дифференциально экспрессируемых белков в различных частях биологической ткани. [4]
Подготовка проб
[ редактировать ]Иммуногистохимию можно проводить на тканях, зафиксированных и залитых парафином , а также на криоконсервированных (замороженных) тканях. В зависимости от способа сохранения ткани существуют различные этапы подготовки ткани к иммуногистохимии, но общий метод включает правильную фиксацию, инкубацию извлечения антигена с первичным антителом, а затем инкубацию со вторичным антителом. [5] [6]
Подготовка и фиксация тканей
[ редактировать ]Фиксация ткани важна для сохранения ткани и поддержания клеточной морфологии. Формула фиксации, соотношение фиксатора к ткани и время пребывания фиксатора будут влиять на результат. Фиксирующим раствором (фиксативом) часто является 10% нейтральный буферный формалин . Нормальное время фиксации составляет 24 часа при комнатной температуре. Соотношение фиксатора к ткани колеблется от 1:1 до 1:20. После фиксации ткани ее можно залить парафином. [5] [6]
Для замороженных срезов фиксация обычно выполняется после срезов, если не планируется тестировать новые антитела. Тогда можно использовать ацетон или формалин. [6]
Секционирование
[ редактировать ]Разделение образца ткани производится с помощью микротома. Для тканей, залитых парафином, нормальной толщиной является 4 мкм, а для замороженных срезов — 4–6 мкм. [6] Толщина срезов имеет значение и является важным фактором в иммуногистохимии. Если вы сравните срез ткани мозга толщиной 4 мкм с срезом толщиной 7 мкм, то часть того, что вы видите на срезе толщиной 7 мкм, может отсутствовать в срезе толщиной 4 мкм. Это показывает важность детальных методов, связанных с этой методологией. [7] Ткани, залитые парафином, следует депарафинизировать, чтобы удалить весь парафин на образце ткани и вокруг него в ксилоле или его хорошем заменителе, а затем в спирте. [8]
Получение антигена
[ редактировать ]Извлечение антигена необходимо для того, чтобы сделать эпитопы доступными для иммуногистохимического окрашивания для большинства срезов тканей, фиксированных формалином. Эпитопы представляют собой сайты связывания антител, используемые для визуализации целевого антигена, который может быть замаскирован из-за фиксации. Фиксация ткани может вызвать образование метиленовых мостиков или сшивание аминогрупп, в результате чего эпитопы перестанут быть доступными. Извлечение антигена может восстановить замаскированную антигенность, возможно, за счет разрушения поперечных связей, вызванных фиксацией. [9] Самый распространенный способ извлечения антигена — использование высокотемпературного нагрева при замачивании предметных стекол в буферном растворе. [10] Это можно сделать разными способами, например, используя микроволновую печь, автоклавы, нагревательные плиты или водяные бани. Для замороженных срезов извлечение антигена обычно не требуется, но для замороженных срезов, зафиксированных в ацетоне или формалине, извлечение антигена может улучшить иммуногистохимический сигнал. [6]
Блокировка
[ редактировать ]Неспецифическое связывание антител может вызвать фоновое окрашивание. Хотя антитела связываются со специфическими эпитопами, они также могут частично или слабо связываться с сайтами неспецифических белков, сходными с сайтом связывания на белке-мишени. Инкубируя ткань с нормальной сывороткой, выделенной у видов, у которых были продуцированы вторичные антитела, можно уменьшить фоновое окрашивание. Также возможно использовать имеющиеся в продаже универсальные блокирующие буферы. Другие распространенные блокирующие буферы включают нормальную сыворотку, обезжиренное сухое молоко, БСА или желатин. [5] [6] Активность эндогенных ферментов также может вызывать фоновое окрашивание, но ее можно уменьшить, если обработать ткань перекисью водорода. [5]
Образец маркировки
[ редактировать ]После подготовки образца мишень можно визуализировать с помощью антител, меченных флуоресцентными соединениями, металлами или ферментами. Существуют прямые и косвенные методы маркировки пробы. [6] [11]
Типы антител
[ редактировать ]Антитела, используемые для обнаружения, могут быть поликлональными или моноклональными. Поликлональные антитела производятся с использованием животных, таких как морская свинка, кролик, мышь, крыса или коза. Животному вводят интересующий антиген и вызывают иммунный ответ. Антитела можно выделить из цельной сыворотки животного. Производство поликлональных антител приведет к образованию смеси различных антител и распознаванию нескольких эпитопов. Моноклональные антитела получают путем инъекции животному интересующего антигена и последующего выделения В-клетки, продуцирующей антитела, обычно из селезенки. Затем клетку, продуцирующую антитела, сливают с линией раковых клеток. Это заставляет антитела проявлять специфичность к одному эпитопу. [12]
Для стратегий иммуногистохимического обнаружения антитела классифицируются как первичные или вторичные реагенты. Первичные антитела вырабатываются против интересующего антигена и обычно являются неконъюгированными (немечеными). Вторичные антитела вырабатываются против иммуноглобулинов первичных видов антител. Вторичное антитело обычно конъюгируется с линкерной молекулой, такой как биотин, которая затем рекрутирует репортерные молекулы, или само вторичное антитело напрямую связывается с репортерной молекулой. [11]
Методы обнаружения
[ редактировать ]Прямой метод представляет собой одноэтапный метод окрашивания и включает в себя реакцию меченого антитела непосредственно с антигеном в срезах ткани. Хотя в этом методе используется только одно антитело и поэтому он прост и быстр, чувствительность ниже из-за незначительного усиления сигнала, в отличие от непрямых подходов. [11]
Непрямой метод предполагает использование немеченого первичного антитела, которое связывается с целевым антигеном в ткани. Затем в качестве второго слоя добавляют вторичное антитело, которое связывается с первичным антителом. Как уже упоминалось, вторичное антитело должно быть выработано против антитела IgG того вида животных, у которого было выработано первичное антитело. Этот метод более чувствителен, чем стратегии прямого обнаружения, из-за усиления сигнала за счет связывания нескольких вторичных антител с каждым первичным антителом. [11]
Непрямой метод, помимо его большей чувствительности, также имеет то преимущество, что необходимо получить лишь относительно небольшое количество стандартных конъюгированных (меченых) вторичных антител. Например, меченое вторичное антитело, полученное против IgG кролика, можно использовать с любым первичным антителом, полученным у кролика. Это особенно полезно, когда исследователь мечет более одного первичного антитела, будь то в результате поликлональной селекции, производящей массив первичных антител к одному антигену, или когда существует интерес к множеству антигенов. При использовании прямого метода необходимо будет маркировать каждое первичное антитело для каждого интересующего антигена. [11]

Репортерные молекулы
[ редактировать ]Репортерные молекулы различаются в зависимости от характера метода обнаружения, наиболее распространенными из которых являются хромогенное и флуоресцентное обнаружение. В хромогенной иммуногистохимии антитело конъюгируется с ферментом, таким как щелочной фосфат и пероксидаза хрена, который может катализировать реакцию образования цвета в присутствии хромогенного субстрата, такого как диаминобензидин. [5] Окрашенный продукт можно анализировать с помощью обычного светового микроскопа. [13] При иммунофлуоресценции антитело метится к флуорофору , такому как изотиоцианат флуоресцеина , изотиоцианат тетраметилродамина, ацетат аминометилкумарина или цианин5. Также широко используются синтетические флуорохромы от Alexa Fluors. [13] [14] Флуорохромы можно визуализировать с помощью флуоресцентного или конфокального микроскопа. [13]
Для хромогенных и флуоресцентных методов обнаружения денситометрический анализ сигнала может предоставить полу- и полностью количественные данные, соответственно, для корреляции уровня репортерного сигнала с уровнем экспрессии или локализации белка. [6]
Контракрасители
[ редактировать ]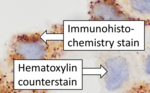
После иммуногистохимического окрашивания целевого антигена часто применяют другое окрашивание. Контрастное окрашивание обеспечивает контраст, который помогает выделить первичное пятно и облегчает изучение морфологии ткани. Это также помогает ориентироваться и визуализировать срез ткани. Обычно используют гематоксилин. [6] [15]
Поиск неисправностей
[ редактировать ]В иммуногистохимических методах перед окончательным окрашиванием ткани необходимо пройти несколько этапов, которые могут вызвать различные проблемы. Это может быть сильное фоновое окрашивание, слабое окрашивание целевым антигеном и наличие артефактов. Важно оптимизировать качество антител и методы иммуногистохимии. [16] Эндогенный биотин, репортерные ферменты или перекрестная реактивность первичных и вторичных антител являются частыми причинами сильного фонового окрашивания. [11] [13] Слабое или полное отсутствие окрашивания может быть вызвано неточной фиксацией ткани или низким уровнем антигена. Эти аспекты иммуногистохимической подготовки тканей и окрашивания антител необходимо систематически решать, чтобы выявить и преодолеть проблемы с окрашиванием. [5] [6]

Методы устранения фонового окрашивания включают разбавление первичных или вторичных антител, изменение времени или температуры инкубации, а также использование другой системы обнаружения или другого первичного антитела. Контроль качества должен, как минимум, включать ткань, о которой известно, что она экспрессирует антиген, в качестве положительного контроля и отрицательный контроль ткани, о которой известно, что она не экспрессирует антиген, а также тестируемую ткань, зондированную таким же способом с исключением первичного антитела (или лучше). , абсорбция первичного антитела). [5]
Диагностические иммуногистохимические маркеры
[ редактировать ]
Иммуногистохимия является отличным методом обнаружения и имеет огромное преимущество, поскольку позволяет точно показать, где именно находится данный белок в исследуемой ткани. Это также эффективный способ исследования тканей. Это сделало этот метод широко используемым в нейробиологии , позволяя исследователям изучать экспрессию белков в определенных структурах мозга. Его основным недостатком является то, что, в отличие от методов иммуноблоттинга , при которых окрашивание проверяется по шкале молекулярной массы , с помощью иммуногистохимии невозможно показать, что окрашивание соответствует интересующему белку. По этой причине первичные антитела должны быть тщательно проверены с помощью вестерн-блоттинга или аналогичной процедуры. Этот метод еще более широко используется в диагностике хирургической патологии при иммунофенотипировании опухолей (например, иммуноокрашивание на е-кадгерин для дифференциации протоковой карциномы in situ (положительное окрашивание) и лобулярной карциномы in situ (не дает положительного окрашивания). [18] ). Совсем недавно иммуногистохимические методы стали полезны для дифференциальной диагностики множественных форм рака слюнных желез, головы и шеи. [19]
Разнообразие иммуногистохимических маркеров, используемых в диагностике хирургической патологии, весьма велико. Многие клинические лаборатории в больницах третичного уровня будут иметь меню из более чем 200 антител, используемых в качестве диагностических, прогностических и прогностических биомаркеров. Примеры некоторых часто используемых маркеров включают в себя:
- BrdU : используется для идентификации реплицирующихся клеток. Используется для выявления опухолей, а также в нейробиологических исследованиях. [20]
- Цитокератины : используются для идентификации карцином, но могут также экспрессироваться в некоторых саркомах. [21]
- CD15 и CD30: используются при болезни Ходжкина .
- Альфа-фетопротеин : при опухолях желточного мешка и гепатоцеллюлярной карциноме .
- CD117 (KIT): при желудочно-кишечных стромальных опухолях (ГИСО) и тучных клетках.
- CD10 (CALLA): при почечно-клеточном раке и остром лимфобластном лейкозе .
- Простатический специфический антиген (ПСА): при раке простаты .
- Окрашивание эстрогенов и рецепторов прогестерона (ER и PR) используется как в диагностических целях (опухоли молочной железы и гинекологии), так и в прогностических целях при раке молочной железы и для прогнозирования ответа на терапию (рецептор эстрогена).
- Идентификация В-клеточных лимфом с использованием CD20 .
- Идентификация Т-клеточных лимфом с использованием CD3 .
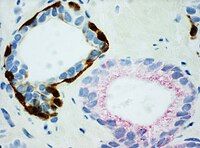
- Коктейль PIN-4, нацеленный на p63 , CK-5 , CK-14 и AMACR (последний также известен как P504S), используется для отличия аденокарциномы простаты от доброкачественных желез.
Направление терапии
[ редактировать ]При раке изменяются различные молекулярные пути, и на некоторые изменения можно воздействовать при терапии рака. Иммуногистохимия может использоваться для оценки того, какие опухоли могут реагировать на терапию, путем обнаружения присутствия или повышенных уровней молекулярной мишени. [ нужна ссылка ]
Химические ингибиторы
[ редактировать ]Биология опухолей допускает наличие ряда потенциальных внутриклеточных мишеней. Многие опухоли гормонозависимы. Наличие рецепторов гормонов можно использовать для определения потенциальной реакции опухоли на антигормональную терапию. Одним из первых методов лечения был антиэстроген тамоксифен , используемый для лечения рака молочной железы. Такие гормональные рецепторы можно обнаружить с помощью иммуногистохимии. [22] Иматиниб , внутриклеточный ингибитор тирозинкиназы , был разработан для лечения хронического миелогенного лейкоза , заболевания, характеризующегося образованием специфической аномальной тирозинкиназы. Имитаниб доказал свою эффективность при опухолях, которые экспрессируют другие тирозинкиназы, особенно KIT. Большинство желудочно-кишечных стромальных опухолей экспрессируют KIT, что можно обнаружить с помощью иммуногистохимии. [23]
Моноклональные антитела
[ редактировать ]Многие белки, активность которых в патологических состояниях сильно активируется с помощью иммуногистохимии, являются потенциальными мишенями для терапии с использованием моноклональных антител . Моноклональные антитела из-за своего размера используются против мишеней на клеточной поверхности. Среди сверхэкспрессируемых мишеней являются члены семейства EGFR , трансмембранные белки с внеклеточным рецепторным доменом, регулирующим внутриклеточную тирозинкиназу. [24] Из них HER2/neu (также известный как Erb-B2) был разработан первым. Молекула высоко экспрессируется в различных типах раковых клеток, особенно в раке молочной железы. Таким образом, антитела против HER2/neu были одобрены FDA для клинического лечения рака под названием Герцептин . Имеются коммерчески доступные иммуногистохимические тесты Dako HercepTest, Leica Biosystems Oracle. [25] и Вентана . Тропа [26]
Аналогичным образом, рецептор эпидермального фактора роста (HER-1) сверхэкспрессируется при различных видах рака, включая рак головы, шеи и толстой кишки. Иммуногистохимия используется для определения пациентов, которым могут помочь терапевтические антитела, такие как эрбитукс (цетуксимаб). [27] Коммерческие системы для обнаружения рецептора эпидермального фактора роста с помощью иммуногистохимии включают Dako pharmDx.
Картирование экспрессии белка
[ редактировать ]Иммуногистохимию также можно использовать для более общего профиля белков при условии наличия антител, проверенных для иммуногистохимии. Атлас белков человека отображает карту экспрессии белков в нормальных органах и тканях человека. Комбинация иммуногистохимии и тканевых микрочипов позволяет выявить закономерности экспрессии белков в большом количестве различных типов тканей. Иммуногистохимия также используется для определения профиля белка при наиболее распространенных формах рака человека. [28] [29]
См. также
[ редактировать ]- Кожные заболевания с данными иммунофлуоресценции
- Хромогенная гибридизация in situ
- Тканевая цитометрия — метод, который привносит концепцию проточной цитометрии в срез ткани in situ и помогает выполнять сканирование всего предметного стекла и количественную оценку маркеров, сохраняя пространственный контекст с использованием машинного обучения и искусственного интеллекта.
Ссылки
[ редактировать ]- ^ Изображение Микаэля Хэггстрема, доктора медицинских наук. Ссылка на терминологию: Анжелика Ходжсон, доктор медицинских наук, Карлос Парра-Эрран, доктор медицинских наук «p16» . Очертания патологии .
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка ) Последнее обновление персонала: 25 января 2024 г. - ^ Ортис Идальго С. (2022), Дель Валле Л. (редактор), «Иммуногистохимия в исторической перспективе: знание прошлого, чтобы понять настоящее» , Иммуногистохимия и иммуноцитохимия , Методы молекулярной биологии, том. 2422, Нью-Йорк, штат Нью-Йорк: Springer US, стр. 17–31, doi : 10.1007/978-1-0716-1948-3_2 , ISBN. 978-1-0716-1947-6 , PMID 34859396 , S2CID 244861186 , получено 22 февраля 2024 г.
- ^ «Иммуногистохимия: истоки, советы и взгляд в будущее» . Журнал «Ученый»® . Проверено 22 февраля 2024 г.
- ^ Дурайян Дж., Говиндараджан Р., Калияппан К., Паланисами М. (2012). «Применение иммуногистохимии» . Журнал фармации и биологических наук . 4 (6): С307-9. дои : 10.4103/0975-7406.100281 . ISSN 0975-7406 . ПМЦ 3467869 . ПМИД 23066277 .
- ^ Перейти обратно: а б с д и ж г Магаки С., Ходжат С.А., Вэй Б., Со А, Йонг WH (2019), Йонг WH (ред.), «Введение в эффективность иммуногистохимии», Biobanking , vol. 1897, Нью-Йорк, штат Нью-Йорк: Springer New York, стр. 289–298, doi : 10.1007/978-1-4939-8935-5_25 , ISBN. 978-1-4939-8933-1 , PMC 6749998 , PMID 30539453
- ^ Перейти обратно: а б с д и ж г час я дж Ким С.В., Ро Дж., Пак CS (15 ноября 2016 г.). «Иммуногистохимия для патологов: протоколы, подводные камни и советы» . Журнал патологии и трансляционной медицины . 50 (6): 411–418. дои : 10.4132/jptm.2016.08.08 . ISSN 2383-7837 . ПМК 5122731 . ПМИД 27809448 .
- ^ Либард С., Сержан Д., Алафузофф И. (январь 2019 г.). «Характеристики среза ткани, влияющие на результат окрашивания в иммуногистохимии» . Гистохимия и клеточная биология . 151 (1): 91–96. дои : 10.1007/s00418-018-1742-1 . ISSN 0948-6143 . ПМК 6328518 . ПМИД 30357509 .
- ^ Бинч А., Снаггс Дж., Ле Мэтр CL (15 мая 2020 г.). «Иммуногистохимический анализ экспрессии белка в фиксированных формалином и залитых в парафин тканях межпозвоночных дисков человека» . Джор Спайн . 3 (3): e1098. дои : 10.1002/jsp2.1098 . ISSN 2572-1143 . ПМЦ 7524243 . ПМИД 33015573 .
- ^ Ши С.Р., Кот Р.Дж., Тейлор С.Р. (март 1997 г.). «Иммуногистохимия поиска антигенов: прошлое, настоящее и будущее» . Журнал гистохимии и цитохимии . 45 (3): 327–343. дои : 10.1177/002215549704500301 . ISSN 0022-1554 . ПМИД 9071315 .
- ^ Ши С.Р., Ки МЭ, Калра К.Л. (июнь 1991 г.). «Извлечение антигена в тканях, фиксированных формалином и залитых парафином: метод улучшения иммуногистохимического окрашивания, основанный на нагревании срезов тканей в микроволновой печи» . Журнал гистохимии и цитохимии . 39 (6): 741–748. дои : 10.1177/39.6.1709656 . ISSN 0022-1554 .
- ^ Перейти обратно: а б с д и ж Рамос-Вара Х.А. (4 июля 2005 г.). «Технические аспекты иммуногистохимии» . Ветеринарная патология . 42 (4): 405–426. дои : 10.1354/vp.42-4-405 . ISSN 0300-9858 . ПМИД 16006601 . S2CID 6229029 .
- ^ Пелтомаа Р., Бардерас Р., Бенито-Пенья Э., Морено-Бонди МС (21 августа 2021 г.). «Рекомбинантные антитела и их использование для иммуноанализа пищевых продуктов» . Аналитическая и биоаналитическая химия . 414 (1): 193–217. дои : 10.1007/s00216-021-03619-7 . ISSN 1618-2642 . ПМК 8380008 . ПМИД 34417836 .
- ^ Перейти обратно: а б с д Кренакс Т., Кренакс Л., Раффельд М. (2010), Оливер С., Джамур М.К. (ред.), «Процедуры иммуноокрашивания множественных антигенов», Иммуноцитохимические методы и протоколы , том. 588, Тотова, Нью-Джерси: Humana Press, стр. 281–300, doi : 10.1007/978-1-59745-324-0_28 , ISBN. 978-1-58829-463-0 , ПМЦ 7670878 , ПМИД 20012839
- ^ Им К., Маренинов С., Диас М.Ф., Йонг WH (2019), Йонг WH (ред.), «Введение в выполнение иммунофлуоресцентного окрашивания», Biobanking , vol. 1897, Нью-Йорк, штат Нью-Йорк: Springer New York, стр. 299–311, doi : 10.1007/978-1-4939-8935-5_26 , ISBN. 978-1-4939-8933-1 , PMC 6918834 , PMID 30539454
- ^ Зентнер С.П., Чакраварти М.М., Болован Р.Дж., Чан С., Беделл Б.Дж. (3 июня 2008 г.). «Методы синергического контрастного окрашивания тканей и сегментации изображений для точной количественной иммуногистохимии» . Журнал гистохимии и цитохимии . 56 (10): 873–880. дои : 10.1369/jhc.2008.950345 . ISSN 0022-1554 . ПМК 2544616 . ПМИД 18574255 .
- ^ Уорд Дж. М., Рег Дж. Э. (27 сентября 2013 г.). «Иммуногистохимия грызунов: подводные камни и устранение неполадок» . Ветеринарная патология . 51 (1): 88–101. дои : 10.1177/0300985813503571 . ISSN 0300-9858 . ПМИД 24078006 . S2CID 20084645 .
- ^ Изображение Микаэля Хэггстрема, доктора медицинских наук. Ссылка: Торлакович Э.Э., Фрэнсис Г., Гаррат Дж., Гилкс Б., Хайек Э., Ибрагим М. и др. (2014). «Стандартизация отрицательных контролей в диагностической иммуногистохимии: рекомендации международной специальной группы экспертов» . Аппл Иммуногистохим Мол Морфол . 22 (4): 241–52. дои : 10.1097/PAI.0000000000000069 . ПМК 4206554 . ПМИД 24714041 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ О'Мэлли Ф., Пиндер С. (2006). Патология молочной железы (Первое изд.). Эдинбург: Черчилль Ливингстон/Эльзевир. ISBN 978-0-443-06680-1 .
- ^ Чжу С., Шуерх С., Хант Дж. (январь 2015 г.). «Обзор и обновления иммуногистохимии при избранных опухолях слюнных желез, а также головы и шеи» . Архивы патологии и лабораторной медицины . 139 (1): 55–66. дои : 10.5858/arpa.2014-0167-RA . ПМИД 25549144 .
- ^ Топин П. (январь 2007 г.). «Имногистохимия BrdU для изучения нейрогенеза взрослых: парадигмы, подводные камни, ограничения и проверка». Обзоры исследований мозга . 53 (1): 198–214. doi : 10.1016/j.brainresrev.2006.08.002 . ПМИД 17020783 . S2CID 23557588 .
- ^ Лидер М., Патель Дж., Макин С., Генри К. (декабрь 1986 г.). «Анализ чувствительности и специфичности цитокератинового маркера САМ 5.2 для эпителиальных опухолей. Результаты исследования 203 сарком, 50 карцином и 28 злокачественных меланом». Гистопатология . 10 (12): 1315–1324. дои : 10.1111/j.1365-2559.1986.tb02574.x . ПМИД 2434403 . S2CID 28142859 .
- ^ Йоргенсен Дж.Т., Нильсен К.В., Эйлерцен Б. (апрель 2007 г.). «Фармакодиагностика и таргетная терапия – рациональный подход к индивидуализации медикаментозной противораковой терапии при раке молочной железы» . Онколог . 12 (4): 397–405. doi : 10.1634/теонколог.12-4-397 . ПМИД 17470682 . S2CID 19065186 .
- ^ Gold JS, Dematteo RP (август 2006 г.). «Комбинированная хирургическая и молекулярная терапия: модель стромальной опухоли желудочно-кишечного тракта» . Анналы хирургии . 244 (2): 176–184. doi : 10.1097/01.sla.0000218080.94145.cf . ПМК 1602162 . ПМИД 16858179 .
- ^ Харари, премьер-министр (декабрь 2004 г.). «Стратегии ингибирования рецепторов эпидермального фактора роста в онкологии» . Эндокринный рак . 11 (4): 689–708. дои : 10.1677/erc.1.00600 . ПМИД 15613446 .
- ^ «leicabiosystems.com» . leicabiosystems.com . Проверено 16 июня 2013 г.
- ^ Пресс М.Ф., Заутер Г., Бернштейн Л., Виллалобос И.Е., Мирлахер М., Чжоу Дж.Ю. и др. (сентябрь 2005 г.). «Диагностическая оценка HER-2 как молекулярной мишени: оценка точности и воспроизводимости лабораторных исследований в крупных проспективных рандомизированных клинических исследованиях» . Клинические исследования рака . 11 (18): 6598–6607. дои : 10.1158/1078-0432.CCR-05-0636 . ПМИД 16166438 .
- ^ Бибо Ф., Буасьер-Мишо Ф., Сабурен Ж.К., Гургу-Бургад С., Радаль М., Пено-Льорка Ф. и др. (сентябрь 2006 г.). «Оценка экспрессии рецептора эпидермального фактора роста (EGFR) при первичных колоректальных карциномах и связанных с ними метастазах на срезах тканей и тканевых микроматрицах» . Архив Вирхова . 449 (3): 281–287. дои : 10.1007/s00428-006-0247-9 . ПМЦ 1888717 . ПМИД 16865406 .
- ^ «Атлас белков человека» . www.proteinatlas.org . Проверено 2 октября 2017 г.
- ^ Улен М., Фагерберг Л., Халльстрем Б.М., Линдског С., Оксволд П., Мардиноглу А. и др. (январь 2015 г.). «Протеомика. Тканевая карта протеома человека». Наука . 347 (6220): 1260419. doi : 10.1126/science.1260419 . ПМИД 25613900 . S2CID 802377 .
Дальнейшее чтение
[ редактировать ]- Бернетт Р., Гишар Ю., Барале Э. (апрель 1997 г.). «Иммуногистохимия для световой микроскопии при оценке безопасности терапевтических средств: обзор». Токсикология . 119 (1): 83–93. дои : 10.1016/S0300-483X(96)03600-1 . ПМИД 9129199 .
- Джойнер А., Уолл Н. (январь 2008 г.). «Иммуногистохимия цельных эмбрионов мыши» . Протоколы Колд-Спринг-Харбора . 2008 (2): pdb.prot4820. дои : 10.1101/pdb.prot4820 . ПМИД 21356665 .
- Рамос-Вара Дж.А., Миллер М.А. (январь 2014 г.). «Когда тканевые антигены и антитела уживаются вместе: новый взгляд на технические аспекты иммуногистохимии — красный, коричневый и синий методы» . Ветеринарная патология . 51 (1): 42–87. дои : 10.1177/0300985813505879 . ПМИД 24129895 .
Внешние ссылки
[ редактировать ]- Иммуногистохимия в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Атлас человеческого белка
- Обзор иммуногистохимии - описывает все аспекты иммуногистохимии, включая подготовку образцов, окрашивание и устранение неполадок.
- Иммунофлуоресцентное окрашивание тканей, залитых парафином (IF-P)
- Совет IHC 1: Извлечение антигена: следует ли мне делать PIER или HIER?
- Гистохимические методы окрашивания - Рочестерского университета Кафедра патологии
- Протокол иммуногистохимического окрашивания, заархивированный 15 октября 2007 г. в Wayback Machine.