ИФА
| ИФА | |
|---|---|
 Разрабатывается метод ELISA с субстратом TMB для пероксидазой хрена . вторичного антитела, связанного с | |
| МеШ | D004797 |
Иммуноферментный анализ ( ELISA ) ( / ɪ ˈ l aɪ z ə / , / ˌ iː ˈ l aɪ z ə / ) — широко используемый аналитический биохимический анализ , впервые описанный Евой Энгвалл и Питером Перлманном в 1971 году. [1] Анализ представляет собой твердофазный иммуноферментный анализ (ИФА) для обнаружения присутствия лиганда ( обычно белка) в жидком образце с использованием антител, направленных против измеряемого лиганда. ИФА используется в качестве диагностического инструмента в медицине, патологии растений и биотехнологии , а также для проверки качества в различных отраслях промышленности.
В самой простой форме ELISA антигены из тестируемого образца прикрепляются к поверхности. Затем подходящее антитело на поверхность наносится , чтобы оно могло связаться с антигеном. Это антитело связывается с ферментом, а затем любые несвязанные антитела удаляются. фермента вещество, содержащее субстрат На последнем этапе добавляется . Если связывание произошло, последующая реакция дает обнаруживаемый сигнал, чаще всего изменение цвета.
При проведении ELISA используется по меньшей мере одно антитело, специфичное к определенному антигену. Образец с неизвестным количеством антигена иммобилизуют на твердой подложке (обычно полистироловой титрационной пластинке ) либо неспецифически (посредством адсорбции на поверхности), либо специфично (посредством захвата другим антителом, специфичным к тому же антигену, в виде «сэндвича»). «ИФА»). После иммобилизации антигена добавляют детектирующее антитело, образующее комплекс с антигеном. Детектирующее антитело может быть ковалентно связано с ферментом или само может быть обнаружено вторичным антителом , которое связано с ферментом посредством биоконъюгации . Между каждым этапом планшет обычно промывают раствором мягкого моющего средства для удаления неспецифически связанных белков или антител. После заключительного этапа промывки планшет проявляют путем добавления ферментативного субстрата для получения видимого сигнала , указывающего количество антигена в образце.
Следует отметить, что ELISA может выполнять другие формы анализов связывания лигандов вместо строго «иммуно» анализов, хотя первоначальное название носило «иммуно» из-за общего использования и истории развития этого метода. Для этого метода по существу требуется любой лигирующий реагент, который можно иммобилизовать на твердой фазе, а также реагент для обнаружения, который будет специфически связываться и использовать фермент для генерации сигнала, который можно правильно определить количественно. В промежутках между промывками только лиганд и его специфически связывающиеся аналоги остаются специфически связанными или «иммуносорбированными» в результате взаимодействия антиген-антитело с твердой фазой, в то время как неспецифические или несвязанные компоненты смываются. В отличие от других форматов спектрофотометрических влажных лабораторных анализов, в которых одну и ту же реакционную лунку (например, кювету) можно использовать повторно после промывки, в планшетах для ИФА продукты реакции иммуносорбируются на твердой фазе, которая является частью планшета, и поэтому их нелегко использовать повторно. .
Принцип
[ редактировать ]Являясь аналитическим биохимическим анализом и методом «влажной лаборатории», ИФА включает в себя обнаружение аналита ( т. е. конкретного вещества, присутствие которого анализируется количественно или качественно) в жидком образце с помощью метода, который продолжает использовать жидкие реагенты во время анализа. (т.е. контролируемая последовательность биохимических реакций, которая генерирует сигнал, который можно легко определить количественно и интерпретировать как меру количества аналита в образце), который остается жидким и остается внутри реакционной камеры или в колодце, необходимом для удержания реагентов. [2] [3] В этом отличие от методов «сухой лаборатории», в которых используются сухие полоски. Даже если образец является жидким (например, небольшая измеренная капля), заключительный этап обнаружения в «сухом» анализе включает в себя считывание высушенной полоски такими методами, как рефлектометрия , и не требует камеры для сдерживания реакции для предотвращения перелива или смешивания между образцами. . [4]
В качестве гетерогенного анализа ELISA отделяет некоторые компоненты аналитической реакционной смеси путем адсорбции определенных компонентов на твердой фазе, которая физически иммобилизована. В ИФА жидкий образец добавляется к неподвижной твердой фазе со специальными связывающими свойствами, после чего последовательно добавляются несколько жидких реагентов, инкубируются и промываются с последующим некоторым оптическим изменением (например, появлением цвета под действием продукта ферментативного анализа). реакция) в конечной жидкости в лунке, из которой измеряется количество аналита. Количественное «чтение» обычно основано на определении интенсивности проходящего света с помощью спектрофотометрии , которая включает количественный анализ прохождения определенной длины волны света через жидкость (а также прозрачное дно лунки в формате многолуночного планшета). . [2] [3] Чувствительность обнаружения зависит от усиления сигнала в ходе аналитических реакций. Поскольку ферментативные реакции представляют собой хорошо известные процессы амплификации, сигнал генерируется ферментами, которые связаны с реагентами для обнаружения в фиксированных пропорциях, чтобы обеспечить точную количественную оценку, отсюда и название «связанный с ферментом». [5]
Аналит также называют лигандом, потому что он специфически связывается или связывается с реагентом для обнаружения, таким образом, ELISA подпадает под более широкую категорию анализов связывания лиганда . [2] Специфически связывающий лиганд реагент «иммобилизован», т.е. обычно наносится и высушивается на прозрачное дно, а иногда и на боковую стенку лунки. [6] (неподвижная «твердая фаза»/«твердый субстрат» здесь в отличие от твердых микрочастиц/шариков, которые можно смыть), который обычно изготавливается в виде многолуночного планшета, известного как «планшет для ИФА». Обычно, как и в других формах иммуноанализа , используется специфичность реакции типа антиген - антитело , поскольку в качестве реагента легко получить антитело, специфичное против антигена. Альтернативно, если анализируемое вещество само по себе представляет собой антитело, его целевой антиген можно использовать в качестве связывающего реагента. [7]
История
[ редактировать ]До разработки ELISA единственным вариантом проведения иммуноанализа был радиоиммуноанализ — метод с использованием радиоактивно меченных антигенов или антител. При радиоиммунном анализе радиоактивность дает сигнал, указывающий, присутствует ли в образце специфический антиген или антитело. Радиоиммуноанализ был впервые описан в научной статье Розалин Сассман Ялоу и Соломона Берсона , опубликованной в 1960 году. [8]
Поскольку радиоактивность представляет потенциальную угрозу для здоровья, была найдена более безопасная альтернатива. Подходящей альтернативой радиоиммунному анализу может быть замена радиоактивного сигнала нерадиоактивным сигналом. Когда ферменты (например, пероксидаза хрена ) реагируют с соответствующими субстратами (например, ABTS или TMB ), происходит изменение цвета, которое используется в качестве сигнала. Однако сигнал должен быть связан с присутствием антитела или антигена, поэтому фермент должен быть связан с соответствующим антителом. Этот процесс связывания был независимо разработан Стратисом Аврамеасом и Дж.Б. Пирсом. [9] Поскольку необходимо удалить любое несвязавшееся антитело или антиген путем промывания, антитело или антиген необходимо зафиксировать на поверхности контейнера; т.е. иммуносорбент должен быть приготовлен. Методика достижения этой цели была опубликована Уайдом и Джеркером Поратом в 1966 году. [10]
В 1971 году Питер Перлманн и Ева Энгвалл из Стокгольмского университета в Швеции, а также Антон Шурс и Бауке ван Вемен в Нидерландах независимо друг от друга опубликовали статьи, в которых эти знания были синтезированы в методы проведения ИФА/ИФА. [11] [12]
Традиционный ИФА обычно включает хромогенные репортеры и субстраты, которые вызывают заметное изменение цвета, указывающее на присутствие антигена или аналита. В более новых методах, подобных ИФА, используются флуорогенные , электрохемилюминесцентные и количественные репортеры ПЦР для создания поддающихся количественной оценке сигналов. Эти новые репортеры могут иметь различные преимущества, включая более высокую чувствительность и мультиплексирование . [13] [14] С технической точки зрения, новые анализы этого типа не являются строго ELISA, поскольку они не «связаны с ферментами», а вместо этого связаны с некоторым неферментативным репортером. Однако, учитывая, что общие принципы этих анализов во многом схожи, их часто группируют в ту же категорию, что и ELISA.
В 2012 году сверхчувствительный тест ELISA на основе ферментов с использованием наночастиц в качестве хромогенного репортера смог дать цветовой сигнал невооруженным глазом благодаря обнаружению простых аттограмм аналита. Синий цвет отображается для положительных результатов, а красный — для отрицательных. Обратите внимание, что это обнаружение может подтвердить только наличие или отсутствие аналита, но не фактическую концентрацию. [15]
Типы
[ редактировать ]Существует множество тестов ELISA для конкретных молекул, в которых используются соответствующие антитела. Тесты ELISA разбиты на несколько типов тестов в зависимости от того, как аналиты и антитела связываются и используются. [16] [17] Здесь описаны основные типы. [18]
Прямой
[ редактировать ]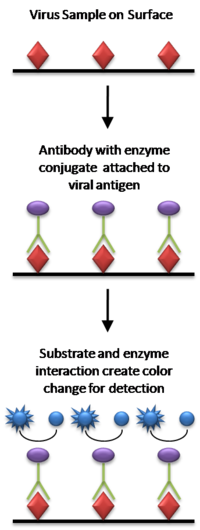
Этапы прямого ИФА [19] следует следующему механизму:
- Буферный раствор тестируемого антигена добавляется в каждую лунку (обычно 96-луночный планшет) микротитровального планшета , где ему дается время прилипнуть к пластику за счет взаимодействия зарядов.
- В каждую лунку добавляется раствор нереагирующего белка, такого как бычий сывороточный альбумин или казеин , чтобы покрыть любую пластиковую поверхность в лунке, которая остается непокрытой антигеном.
- лунку . Добавляется первичное антитело с присоединенным (конъюгированным) ферментом, который специфически связывается с тестируемым антигеном, покрывающим
- Затем добавляется субстрат для этого фермента. Часто этот субстрат меняет цвет при реакции с ферментом.
- Чем выше концентрация первичного антитела, присутствующего в сыворотке, тем сильнее изменение цвета. Часто для получения количественных значений интенсивности цвета используется спектрометр.
Фермент действует как усилитель; даже если только несколько антител, связанных с ферментами, остаются связанными, молекулы фермента будут продуцировать множество сигнальных молекул. В пределах здравого смысла фермент может продолжать производить цвет бесконечно, но чем больше антител связано, тем быстрее будет развиваться цвет. Основным недостатком прямого ИФА является то, что метод иммобилизации антигена неспецифичен; когда в качестве источника тест-антигена используется сыворотка, все белки в образце могут хорошо прилипать к микротитровальному планшету, поэтому небольшие концентрации аналита в сыворотке должны конкурировать с другими белками сыворотки при связывании с поверхностью лунки. Сэндвич- или непрямой ИФА обеспечивает решение этой проблемы за счет использования «захватывающего» антитела, специфичного для тестируемого антигена, для извлечения его из молекулярной смеси сыворотки. [ нужна ссылка ]
ELISA может проводиться в качественном или количественном формате. Качественные результаты дают простой положительный или отрицательный результат (да или нет) для образца. Граница между положительным и отрицательным определяется аналитиком и может быть статистической. Чтобы отличить положительные образцы от отрицательных, часто используется двух- или трехкратное стандартное отклонение (ошибка, присущая тесту). При количественном ИФА оптическая плотность (ОП) образца сравнивается со стандартной кривой, которая обычно представляет собой серийное разведение раствора целевой молекулы с известной концентрацией. Например, если тестируемый образец дает ОП 1,0, точка на стандартной кривой, дающая ОП = 1,0, должна иметь ту же концентрацию аналита, что и образец. [ нужна ссылка ]
Использование и значение названий «непрямой ИФА» и «прямой ИФА» различаются в литературе и на веб-сайтах в зависимости от контекста эксперимента. Когда анализируется наличие антигена, название «прямой ИФА» относится к ИФА, в котором используется только меченое первичное антитело, а термин «непрямой ИФА» относится к ИФА, в котором антиген связывается с первичным антителом. который затем обнаруживается меченым вторичным антителом. В последнем случае сэндвич-ИФА явно отличается от непрямого ИФА. Когда «первичное» антитело представляет интерес, например, в случае анализа иммунизации, это антитело непосредственно выявляется вторичным антителом, и термин «непрямой ИФА» применяется к ситуации с двумя антителами. [ нужна ссылка ]
Сэндвич
[ редактировать ]
Для обнаружения антигена в образце используется «сэндвич»-ELISA. [20] Шаги:
- Поверхность подготавливают с использованием известного количества захватывающего антитела.
- Любые сайты неспецифического связывания на поверхности блокируются.
- Содержащий антиген образец наносится на планшет и захватывается антителом.
- Планшет промывают для удаления несвязавшегося антигена.
- Добавляется специфическое антитело, которое связывается с антигеном (отсюда и «сэндвич»: антиген застревает между двумя антителами). Это первичное антитело может находиться в сыворотке донора для проверки на реактивность по отношению к антигену.
- Вторичные антитела, связанные с ферментом, применяются в качестве антител для обнаружения, которые специфически связываются с Fc-областью антитела (неспецифически).
- Планшет промывают для удаления несвязавшихся конъюгатов антитело-фермент.
- Добавляется химическое вещество, которое фермент преобразует в цветной, флуоресцентный или электрохимический сигнал.
- Поглощение, флуоресценцию или электрохимический сигнал (например, ток) лунок планшета измеряют для определения присутствия и количества антигена.
Изображение справа включает использование вторичного антитела, конъюгированного с ферментом, хотя с технической точки зрения в этом нет необходимости, если первичное антитело конъюгировано с ферментом (это будет прямой ИФА). Однако использование конъюгата вторичного антитела позволяет избежать дорогостоящего процесса создания ферментосвязанных антител для каждого антигена, который можно обнаружить. Используя связанное с ферментом антитело, которое связывает область Fc других антител, это же самое связанное с ферментом антитело можно использовать в различных ситуациях. Без первого слоя «захватывающих» антител любые белки в образце (включая белки сыворотки) могут конкурентно адсорбироваться на поверхности планшета, снижая количество иммобилизованного антигена. Использование очищенного специфического антитела для прикрепления антигена к пластику устраняет необходимость очистки антигена от сложных смесей перед измерением, упрощая анализ и повышая специфичность и чувствительность анализа. Поэтому сэндвич-ИФА, используемый в исследованиях, часто требует проверки, чтобы снизить риск ложноположительных результатов. [21]
Конкурентоспособный
[ редактировать ]Третий вариант использования ELISA – конкурентное связывание. Шаги для этого ИФА несколько отличаются от первых двух примеров:
Немеченое антитело инкубируют в присутствии его антигена (образца).
- Эти связанные комплексы антитело/антиген затем добавляют в лунку, покрытую антигеном.
- Планшет промывают, чтобы удалить несвязавшиеся антитела. (Чем больше антигена в образце, тем больше образуется комплексов Ag-Ab и, следовательно, остается меньше несвязанных антител, доступных для связывания с антигеном в лунке, отсюда и «конкуренция».)
- антителу . Добавляется вторичное антитело, специфичное к первичному Это второе антитело связано с ферментом.
- Добавляется субстрат, а оставшиеся ферменты вызывают хромогенный или флуоресцентный сигнал.
- Реакцию останавливают, чтобы предотвратить возможное насыщение сигнала.
Некоторые конкурентные наборы ELISA содержат связанный с ферментом антиген, а не антитело, связанное с ферментом. Меченый антиген конкурирует за сайты связывания первичных антител с образцом антигена (немеченым). Чем меньше антигена в образце, тем больше меченого антигена сохраняется в лунке и тем сильнее сигнал.
Обычно антиген не помещается в лунку первым.
Для обнаружения антител к ВИЧ лунки титровального микропланшета покрывают антигеном ВИЧ. Используются два специфических антитела: одно конъюгировано с ферментом, а другое присутствует в сыворотке (если сыворотка положительна на антитела). Между двумя антителами за один и тот же антиген возникает кумулятивная конкуренция, в результате чего виден более сильный сигнал. В эти лунки добавляют тестируемую сыворотку и инкубируют при 37°С, а затем промывают. Если антитела присутствуют, происходит реакция антиген-антитело. Для меченных ферментом специфических антител к ВИЧ не остается антигена. Эти антитела остаются свободными при добавлении и смываются во время промывания. Субстрат добавляется, но на него не действует фермент, поэтому положительный результат не показывает изменения цвета.
Косвенный
[ редактировать ]Четвертый тест ELISA не использует традиционные лунки, а оставляет антигены во взвешенном состоянии в тестируемой жидкости. [22] [23]
- Немеченое антитело инкубируют в присутствии его антигена (образца).
- Обеспечивается достаточный инкубационный период, чтобы антитела могли связаться с антигенами.
- Затем образец пропускают через контейнер Scavenger. Это может быть пробирка или специально сконструированный проточный канал. На поверхности контейнера или канала Scavenger связаны «антигены Scavenger». Они могут быть идентичными или достаточно похожими на первичные антигены, с которыми будут связываться свободные антитела.
- Контейнер-поглотитель должен иметь достаточную площадь поверхности и достаточно времени, чтобы позволить антигенам-поглотителям связаться со всеми избыточными антителами, введенными в образец.
- Образец, который теперь содержит меченые и связанные антитела, пропускается через детектор. Это устройство может представлять собой проточный цитометр или другое устройство, которое освещает метки и регистрирует ответ. [24]
Этот тест позволяет одновременно помечать и подсчитывать несколько антигенов. Это позволяет идентифицировать определенные штаммы бактерий по двум (или более) меткам разного цвета. Если обе метки присутствуют на клетке, то клетка относится к конкретному штамму. Если присутствует только один, то это не так.
Этот тест обычно проводится по одному тесту за раз и не может быть выполнен с помощью микротитровального планшета. Необходимое оборудование обычно менее сложное и может использоваться в полевых условиях.
Часто используемые ферментативные маркеры
[ редактировать ]В следующей таблице перечислены ферментативные маркеры, обычно используемые в анализах ELISA, которые позволяют измерить результаты анализа после завершения.
- OPD ( дигидрохлорид о -фенилендиамина) меняет цвет на желтый для обнаружения HRP ( пероксидазы хрена ), который часто используется в качестве конъюгированного белка . [25]
- ТМБ (3,3',5,5'-тетраметилбензидин) становится синим при обнаружении HRP и желтеет после добавления серной или фосфорной кислоты. [25]
- ABTS (2,2'-азинобис[3-этилбензотиазолин-6-сульфоновая кислота]диаммониевая соль) становится зеленым при обнаружении HRP. [25]
- PNPP ( п -нитрофенилфосфат, динатриевая соль) желтеет при обнаружении щелочной фосфатазы . [25]
Приложения
[ редактировать ]
Поскольку ELISA можно использовать для оценки наличия антигена или антител в образце, он является полезным инструментом для определения концентрации антител в сыворотке крови (например, при тесте на ВИЧ). [26] или вирус Западного Нила ). Он также нашел применение в пищевой промышленности для обнаружения потенциальных пищевых аллергенов , таких как молоко , арахис , грецкие орехи , миндаль и яйца. [27] и как серологический анализ крови на целиакию . [28] [29] ИФА также может использоваться в токсикологии в качестве быстрого предварительного скрининга определенных классов лекарств.

ИФА был первым скрининговым тестом, широко используемым на ВИЧ из-за его высокой чувствительности. При проведении ELISA сыворотку человека разбавляют в 400 раз и наносят на чашку, к которой прикреплены антигены ВИЧ. Если антитела к ВИЧ присутствуют в сыворотке, они могут связываться с этими антигенами ВИЧ. Затем планшет промывают для удаления всех остальных компонентов сыворотки. Затем на планшет наносят специально подготовленное «вторичное антитело» — антитело, которое связывается с другими антителами, после чего следует еще одно промывание. Это вторичное антитело заранее химически связано с ферментом.
Таким образом, планшет будет содержать фермент пропорционально количеству вторичных антител, связанных с планшетом. Наносится субстрат для фермента, и катализ фермента приводит к изменению цвета или флуоресценции. Результаты ELISA сообщаются в виде чисел; наиболее спорным аспектом этого теста является определение «точки отсечения» между положительным и отрицательным результатом.
Точка отсечки может быть определена путем сравнения ее с известным стандартом. Если тест ELISA используется для проверки на наркотики на рабочем месте, устанавливается пороговая концентрация, например, 50 нг/мл, и готовится образец, содержащий стандартную концентрацию аналита. Неизвестные, которые генерируют более сильный сигнал, чем известный образец, считаются «положительными». Те, которые генерируют более слабый сигнал, являются «отрицательными».
Существуют тесты ELISA для выявления различных заболеваний, таких как лихорадка денге , малярия , болезнь Шагаса , [30] болезнь Ионе и другие. [31] ИФА-тесты также широко используются для in vitro диагностики в медицинских лабораториях . Другие варианты использования ELISA включают:
- обнаружение антител к SARS-CoV-2 в образцах крови [32]

С 2023 года ИФА является основным методом обнаружения патогенов растений во всем мире. [33]
Массив одиночных молекул, связанных с ферментами (eSimoa)
[ редактировать ]eSimoa (матрица одиночных молекул, связанных с ферментами) представляет собой значительную эволюцию традиционного метода ELISA (иммуноферментный анализ), который широко используется в клинической диагностике и исследованиях. Значительно повышая чувствительность и разрешение биомолекулярного обнаружения, eSimoa расширяет возможности ИФА, позволяя обнаруживать биомолекулы в концентрациях, ранее недостижимых с помощью стандартных анализов. [34]
Технология
[ редактировать ]Основываясь на основополагающих принципах ELISA, eSimoa использует парамагнитные шарики для выделения биомолекул или ферментов способом, аналогичным детектированию на планшетах ELISA. Однако eSimoa развивает эту концепцию, позволяя измерять ферментативные реакции на уровне отдельных молекул, что значительно улучшает пределы обнаружения различных ферментов и биомолекул. Этот метод позволяет точно определить количество белков с низким содержанием и активность важнейших ферментов, таких как протеинкиназы и теломеры, которые часто находятся ниже порога обнаружения обычного ИФА.
Приложения
[ редактировать ]Повышенная чувствительность eSimoa имеет решающее значение для раннего и точного обнаружения биомаркеров в клинической диагностике, способствуя лучшему мониторингу и лечению заболеваний. При открытии лекарств способность отслеживать тонкие изменения ферментативной активности помогает в разработке более эффективных фармацевтических препаратов, предоставляя подробное представление о механизмах ингибирования ферментов.
Истоки и противоречия
[ редактировать ]Чи-Ань Ченг из Национального Тайваньского университета (NTU) заявила, что ее команда разработала эту инновационную технологию. [35] [36] Однако это утверждение оспаривается существованием предыдущих публикаций команды Дэвида Р. Уолта из Гарвардского университета, которые опубликовали свою работу на eSimoa в 2020 году. [37] [38] Эта более ранняя документация, подготовленная командой Уолта, предполагает предшествующий вклад в развитие технологии.
См. также
[ редактировать ]- Агглютинация-ПЦР
- Иммуноскрининг
- Испытание бокового потока
- Магнитный иммуноанализ
- Микротитровальный планшет
- Нефелометрия
- Тест нейтрализации уменьшения налета
- Устройство считывания пластин
- Анализ секреции
Примечания и ссылки
[ редактировать ]- ^ Энгвалл, Э. (22 ноября 1972 г.). «Имуноферментный анализ, Элиза» . Журнал иммунологии . 109 (1): 129–135. дои : 10.4049/jimmunol.109.1.129 . ISSN 0022-1767 . ПМИД 4113792 .
- ^ Jump up to: а б с Мсагати, Т.А. (2017). Пищевая судебная экспертиза и токсикология . Джон Уайли и сыновья. п. ПТ229. ISBN 9781119101383 .
- ^ Jump up to: а б Кроутер, младший (1995). «Глава 2: Основные принципы ИФА» . ИФА: Теория и практика . Методы молекулярной биологии. Том. 42. Хумана Пресс. стр. 35–62. дои : 10.1385/0-89603-279-5:1 . ISBN 0896032795 . ПМИД 7655571 .
- ^ Зоннтаг, О. (1993). «Глава 1: Введение в сухую химию» . Ин ван дер Влит, ПК (ред.). Сухая химия: анализ с использованием реагентов, связанных с носителем . Лабораторные методы в биохимии и молекулярной биологии. Том. 25. С. 1–6. ISBN 9780080887364 .
- ^ Се, Ю.-Х.П.; Рао, К. (2017). Нильсен, СС (ред.). Анализ еды . Спрингер. стр. 491–98. ISBN 9783319457765 .
- ^ Шасфорт, RBM (2017). Справочник по поверхностному плазмонному резонансу (2-е изд.). Королевское химическое общество. п. 296. ИСБН 9781782627302 .
- ^ Элгерт, К.Д. (2009). Иммунология: понимание иммунной системы . Джон Уайли и сыновья. стр. 149–50. ISBN 9780470081570 .
- ^ Ялоу, Розалин С.; Берсон, Соломон А. (1960). «Иммуноанализ эндогенного инсулина плазмы у человека» . Журнал клинических исследований . 39 (7): 1157–75. дои : 10.1172/JCI104130 . ПМК 441860 . ПМИД 13846364 .
- ^ Лекин, РМ (2005). «Иммуноферментный анализ (ИФА)/иммуноферментный анализ (ИФА)» . Клиническая химия . 51 (12): 2415–8. дои : 10.1373/clinchem.2005.051532 . ПМИД 16179424 .
- ^ Широкий, Лейф; Порат, Джеркер (1966). «Радиоиммуноанализ белков с использованием антител, связанных с сефадексом». Biochimica et Biophysical Acta (BBA) – Общие предметы . 130 (1): 257–60. дои : 10.1016/0304-4165(66)90032-8 .
- ^ Энгвалл, Ева; Перлманн, Питер (1971). «Количественный анализ иммуноглобулина G с помощью иммуноферментного анализа (ИФА)». Иммунохимия . 8 (9): 871–4. дои : 10.1016/0019-2791(71)90454-X . ПМИД 5135623 .
- ^ Ван Вимен, Британская Колумбия; Шурс, AHWM (1971). «Иммуноанализ с использованием конъюгатов антиген-фермент» . Письма ФЭБС . 15 (3): 232–236. дои : 10.1016/0014-5793(71)80319-8 . ПМИД 11945853 . S2CID 37147723 .
- ^ Ленг, SX; МакЭлхани, Дж. Э.; Уолстон, доктор медицинских наук; Се, Д.; Федарко, Н.С.; Кучел, Джорджия (2008). «ИФА и мультиплексные технологии для измерения цитокинов в исследованиях воспаления и старения» . Журналы геронтологии, серия A: Биологические и медицинские науки . 63 (8): 879–84. дои : 10.1093/герона/63.8.879 . ПМЦ 2562869 . ПМИД 18772478 .
- ^ Адлер, Майкл; Шульц, Свен; Шпенглер, Марк (2009). «Количественное определение цитокинов при разработке лекарств: сравнение чувствительных платформ иммуноанализа» . Химера Биотех. Архивировано из оригинала 22 декабря 2015 г. Проверено 20 августа 2015 г.
- ^ де ла Рика, Роберто; Стивенс, Молли М. (2012). «Плазмонный ИФА для сверхчувствительного обнаружения биомаркеров заболеваний невооруженным глазом». Природные нанотехнологии . 7 (12): 821–4. Бибкод : 2012НатНа...7..821Д . дои : 10.1038/nnano.2012.186 . hdl : 10044/1/21938 . ПМИД 23103935 .
- ^ Р., Кроутер, Дж. (1995). «Основная иммунология». ИФА: теория и практика . Методы молекулярной биологии. Том. 42. Тотова, Нью-Джерси: Humana Press. стр. 1–218. дои : 10.1385/0-89603-279-5:1 . ISBN 978-0896032798 . ОСЛК 32130600 . ПМИД 7655571 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ РОБЕРТ., ХНАСКО (2016). ИФА (перепечатка ред. В МЯГКОЙ ОБЛОЖКЕ). [Место публикации не указано]: HUMANA. ISBN 978-1493953851 . OCLC 960834982 .
- ^ «Что такое ИФА?» . Системы исследований и разработок . Проверено 31 января 2020 г.
- ^ Спенс, Закари (18 октября 2018 г.). «Биохимия, 8-е изд. - Джереми М. Берг» : 83.
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) [ постоянная мертвая ссылка ] - ^ Шмидт, С.Д.; Маццелла, MJ; Никсон, РА; Мэтьюз, премьер-министр (2012). «Измерение Aβ с помощью иммуноферментного анализа». Амилоидные белки . Методы молекулярной биологии. Том. 849. стр. 507–27. дои : 10.1007/978-1-61779-551-0_34 . ISBN 978-1-61779-550-3 . ПМИД 22528112 .
- ^ Крагструп, Вт; Воруп-Йенсен, Томас; Делеран, Бент; Хвид, Мален (2013). «Простой набор шагов проверки идентифицирует и устраняет ложные результаты сэндвич-ферментного иммуноферментного анализа, вызванные наличием антител IgG к животным в плазме пациентов с артритом» . СпрингерПлюс . 2 (1): 263. дои : 10.1186/2193-1801-2-263 . ПМЦ 3695686 . ПМИД 23875127 .
- ^ US 7767404 , Charbonnet, Derrick, «Аппарат и способ одностадийного иммуносорбентного анализа одного и нескольких аналитов», выдан 3 августа 2010 г.
- ^ US 8735142 , Charbonnet, Derrick & Evans, Norman Scott, «Системы и методы иммуносорбентного анализа одного и нескольких аналитов», выдан 27 мая 2014 г.
- ^ Махмуди Гомари, Мохаммед; Сарайгорд-Афшари, Неда; Фарсимадан, Марзие; Ростами, Неда; Агамири, Шахин; Фарахоллахи, Мохаммад М. (декабрь 2020 г.). «Возможности и проблемы методов очистки белков с помощью меток: применение в фармацевтической промышленности» . Достижения биотехнологии . 45 : 107653. doi : 10.1016/j.biotechadv.2020.107653 . ISSN 0734-9750 . ПМИД 33157154 . S2CID 226276355 .
- ^ Jump up to: а б с д «Ферментные субстраты для ИФА» . Thermo Fisher Scientific – США . Проверено 6 июня 2018 г.
- ^ Энциклопедия MedlinePlus : ИФА/Вестерн-блот-тесты на ВИЧ.
- ^ «Партнерство пищевых аллергенов» (Пресс-релиз). FDA. Январь 2001 года . Проверено 20 августа 2015 г.
- ^ Сблаттеро, Д.; Берти, И.; Тревизиол, К.; Марзари, Р.; Томмазини, А.; Брэдбери, А.; Фазано, А.; Вентура, А.; Нет, Т. (2000). «ИФА на рекомбинантную тканевую трансглутаминазу человека: инновационный метод диагностики целиакии». Американский журнал гастроэнтерологии . 95 (5): 1253–7. дои : 10.1111/j.1572-0241.2000.02018.x . ПМИД 10811336 . S2CID 11018740 .
- ^ Порчелли, Брунетта; Ферретти, Фабио; Виндини, Карла; Терцуоли, Люсия (2014). «Оценка теста для скрининга и диагностики целиакии» . Журнал клинического лабораторного анализа . 30 (1): 65–70. дои : 10.1002/jcla.21816 . ПМК 6807240 . ПМИД 25385391 .
- ^ Дель-Рей, Родриго Пеппер; Леони, Леонардо; Селедон, Паола Александра Фиорани; Занчин, Нельсон Иво Тонин; Рейс, Митермайер Болтинг два; Гомес, Яра де Миранда; Шейман, Александр Габриэль; Лонги, Сильвия Андреа; Святые, Фред Лучано Невес (18 апреля 2019 г.). «Обнаружение антител против Trypanosoma cruzi с помощью химерных антигенов у лиц с хронической болезнью Шагаса из эндемичных стран Южной Америки» . ПЛОС ОДИН 14 (4): e0215623. Бибкод : 2019PLoSO..1415623D дои : 10.1371/journal.pone.0215623 . ISSN 1932-6203 . ПМК 6472793 . ПМИД 30998741 .
- ^ Гриффин, JFT; Спиттл, Э.; Роджерс, ЧР; Лиггетт, С.; Купер, М.; Баккер, Д.; Баннантин, JP (2005). «Иммуноглобулин G1-ферментный иммуносорбентный анализ для диагностики болезни Джонса у благородного оленя (Cervus elaphus)» . Клиническая и вакциноиммунология . 12 (12): 1401–9. дои : 10.1128/CDLI.12.12.1401-1409.2005 . ПМК 1317074 . ПМИД 16339063 .
- ^ Дхамад, А.Е.; Абдал Рида, Массачусетс (2020). «COVID-19: молекулярные и серологические методы обнаружения» . ПерДж . 8 : е10180. дои : 10.7717/peerj.10180 . ПМЦ 7547594 . ПМИД 33083156 .
- ^ Текущие и новые тенденции в методах обнаружения патогенов растений. Границы в науке о растениях.
- ^ Ван, Сюй; Огата, Алана Ф.; Уолт, Дэвид Р. (2 сентября 2020 г.). «Сверхчувствительное обнаружение ферментативной активности с использованием массивов одиночных молекул» . Журнал Американского химического общества . 142 (35): 15098–15106. дои : 10.1021/jacs.0c06599 . ПМЦ 7472518 . ПМИД 32797755 .
- ^ Ченг, Калифорния (28 ноября 2023 г.). «eSimoa - сверхчувствительная белковая основа пространственного декодирования опухолевых внеклеточных везикул с высоким разрешением | Экзосомная РНК» . Экзосомная РНК .
- ^ Ченг, Чиань (13 июня 2024 г.). «Голоса в молекулярной фармацевтике: познакомьтесь с профессором Чи-Ань Ченгом, который разрабатывает инновационные диагностические инструменты, открывает биомаркеры, разрабатывает новые методы анализа и создает новые материалы» . Молекулярная фармацевтика . doi : 10.1021/acs.molpharmaceut.4c00623 . ПМИД 38869420 .
- ^ Ван, Сюй; Огата, Алана Ф.; Уолт, Дэвид Р. (2 сентября 2020 г.). «Сверхчувствительное обнаружение ферментативной активности с использованием массивов одиночных молекул» . Журнал Американского химического общества . 142 (35): 15098–15106. дои : 10.1021/jacs.0c06599 . ПМЦ 7472518 . ПМИД 32797755 .
- ^ «Обнаружение других биомолекул – Лаборатория Уолта» .
Внешние ссылки
[ редактировать ]- ИФА в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- «Введение в ИФА» — пошаговое руководство по ИФА, используемому для выявления ВИЧ, включая анимацию в Университете Аризоны.
- «Принцип анализа ИФА» — обзор принципа ИФА и инструментов для обнаружения аналитов в Assay Genie.