Болезнь Шагаса
| Болезнь Шагаса | |
|---|---|
| Другие имена | Американский трипаносомоз |
 | |
| Микрофотография Гимзе, окрашенных по трипомастигот Trypanosoma cruzi, в крови человека. | |
| Произношение |
|
| Специальность | Инфекционное заболевание |
| Симптомы | Лихорадка, увеличение лимфатических узлов, головная боль. [1] |
| Осложнения | Сердечная недостаточность , увеличение пищевода , увеличение толстой кишки. [1] |
| Причины | Trypanosoma cruzi распространяется через поцелуев клопов [1] |
| Метод диагностики | Обнаружение паразита, его ДНК или антител в крови [2] |
| Профилактика | Устранение поцелуев и предотвращение их укусов [1] |
| Медикамент | Бензнидазол , нифуртимокс [1] |
| Частота | 6,5 миллионов (2019) [3] |
| Летальные исходы | 9,490 (2019) [3] |
Болезнь Шагаса , также известная как американский трипаносомоз , представляет собой тропическое паразитарное заболевание, вызываемое Trypanosoma cruzi . Он распространяется в основном насекомыми подсемейства Triatominae , известных как «целующиеся клопы». Симптомы меняются в течение инфекции. На ранней стадии симптомы обычно либо отсутствуют, либо слабо выражены и могут включать лихорадку, увеличение лимфатических узлов , головные боли или отек в месте укуса . [1] Через четыре-восемь недель нелеченые люди переходят в хроническую фазу заболевания, которая в большинстве случаев не приводит к появлению дальнейших симптомов. [2] [4] До 45% людей с хроническими инфекциями развиваются заболевания сердца через 10–30 лет после первоначального заболевания, что может привести к сердечной недостаточности . Осложнения пищеварения, включая увеличение пищевода или толстой кишки , также могут возникать у 21% людей, и до 10% людей могут испытывать повреждение нервов. [2]
T. cruzi обычно передается людям и другим млекопитающим через укусы клопов-целующихся и зараженные фекалии клопов. [5] Заболевание также может передаваться при переливании крови , трансплантации органов , употреблении пищи или напитков, зараженных паразитами, а также при вертикальной передаче (от матери к ребенку). [1] Диагностика раннего заболевания осуществляется путем обнаружения паразита в крови с помощью микроскопа или обнаружения его ДНК с помощью полимеразной цепной реакции . [4] Хроническое заболевание диагностируется при обнаружении антител к T. cruzi . в крови [6]
Профилактика направлена на устранение целующихся клопов и предотвращение их укусов. [1] Это может включать использование инсектицидов или надкроватных сеток . [7] Другие профилактические меры включают проверку крови, используемой для переливания. Ранние инфекции поддаются лечению препаратами бензнидазола или нифуртимокса , которые обычно излечивают заболевание, если принимать их вскоре после заражения, но становятся менее эффективными, чем дольше человек страдает болезнью Шагаса. При использовании при хронических заболеваниях лекарства могут задержать или предотвратить развитие симптомов терминальной стадии. Бензнидазол и нифуртимокс часто вызывают побочные эффекты , включая кожные заболевания, раздражение пищеварительной системы и неврологические симптомы, которые могут привести к прекращению лечения. [2] [8] В настоящее время разрабатываются новые лекарства от болезни Шагаса. [9] и хотя экспериментальные вакцины изучались на животных моделях, [10] [11] для человека вакцина не разработана.
По оценкам, 6,5 миллионов человек, в основном в Мексике , Центральной Америке и Южной Америке , страдают болезнью Шагаса. по состоянию на 2019 год [1] [3] что приводит к примерно 9 490 смертям в год. [3] Большинство людей с этим заболеванием бедны , [12] и большинство из них не осознают, что они инфицированы. [13] Масштабная миграция населения привела к переносу болезни Шагаса в новые регионы, в том числе в США и многие европейские страны. [1] Болезнь поражает более 150 видов животных. [14]
Заболевание было впервые описано в 1909 году бразильским врачом Карлосом Шагасом , в честь которого оно и названо. [1] Болезнь Шагаса классифицируется как забытая тропическая болезнь . [15]
Признаки и симптомы [ править ]

Болезнь Шагаса протекает в две стадии: острую , развивающуюся через одну-две недели после укуса насекомого, и хроническую , развивающуюся на протяжении многих лет. [2] [4] [16] Острая стадия часто протекает бессимптомно. [2] Если они присутствуют, симптомы обычно незначительны и неспецифичны для какого-либо конкретного заболевания. [4] Признаки и симптомы включают лихорадку, недомогание , головную боль и увеличение печени , селезенки и лимфатических узлов . [1] [2] [4] Иногда на месте инфекции у людей появляется опухший узел, который называется «признаком Романья», если он находится на веке, или «чагомой», если он находится в другом месте на коже. [4] [17] В редких случаях (менее 1–5%) у инфицированных людей развивается тяжелое острое заболевание, которое может включать воспаление сердечной мышцы , скопление жидкости вокруг сердца , воспаление головного мозга и окружающих тканей и может быть опасным для жизни. Острая фаза обычно длится от четырех до восьми недель и проходит без лечения. [2]
Если не лечить противопаразитарными препаратами , люди остаются инфицированными T. cruzi после выздоровления от острой фазы. Большинство хронических инфекций протекают бессимптомно, что называется неопределённой хронической болезнью Шагаса. Однако в течение десятилетий заболевания примерно у 30–40% людей развивается органная дисфункция ( детерминированная хроническая болезнь Шагаса), которая чаще всего поражает сердце или пищеварительную систему . [2] [4]
Наиболее частым долгосрочным проявлением является болезнь сердца , которая встречается у 14–45% людей с хронической болезнью Шагаса. [2] Люди с болезнью сердца Шагаса часто испытывают учащенное сердцебиение , а иногда и обмороки из-за нерегулярной работы сердца. По электрокардиограмме у людей с болезнью Шагаса чаще всего наблюдаются аритмии . сердца По мере прогрессирования заболевания желудочки увеличиваются ( дилатационная кардиомиопатия ), что снижает его способность перекачивать кровь. Во многих случаях первым признаком болезни сердца Шагаса является сердечная недостаточность , тромбоэмболия или боль в груди, связанная с аномалиями микроциркуляторного русла . [18]
Также при хронической болезни Шагаса часто встречается поражение пищеварительной системы, которым страдают 10–21% людей. [2] Увеличение пищевода или толстой кишки являются наиболее распространенными проблемами пищеварения. [16] Люди с увеличенным пищеводом часто испытывают боль ( одинофагия ) или проблемы с глотанием ( дисфагия ), кислотный рефлюкс , кашель и потерю веса. Люди с увеличенной толстой кишкой часто страдают запорами и могут развить тяжелую закупорку кишечника или его кровоснабжение . У 10% хронически инфицированных людей развивается повреждение нервов , которое может привести к онемению и изменению рефлексов или движений. [2] Хотя хроническое заболевание обычно развивается в течение десятилетий, у некоторых людей с болезнью Шагаса (менее 10%) сразу после острого заболевания развивается поражение сердца. [18]
Признаки и симптомы различаются у людей, инфицированных T. cruzi менее распространенными путями. У людей, инфицированных в результате проглатывания паразитов, в течение трех недель после употребления в пищу, как правило, развивается тяжелое заболевание, симптомы которого включают лихорадку, рвоту , одышку , кашель и боли в груди, животе и мышцах . [2] У людей, инфицированных врожденно, симптомы обычно незначительны или вообще отсутствуют, но могут иметь легкие неспецифические симптомы или тяжелые симптомы, такие как желтуха , респираторный дистресс и проблемы с сердцем. [2] Люди, инфицированные в результате трансплантации органов или переливания крови, как правило, имеют симптомы, аналогичные симптомам трансмиссивных заболеваний, но симптомы могут не проявляться в течение от недели до пяти месяцев. [2] У хронически инфицированных людей, у которых наблюдается иммуносупрессия из-за ВИЧ- инфекции, может наблюдаться особенно тяжелое и отчетливое заболевание, которое чаще всего характеризуется воспалением головного мозга и окружающих тканей или абсцессами головного мозга . [4] Симптомы широко варьируются в зависимости от размера и расположения абсцессов головного мозга, но обычно включают лихорадку, головные боли, судороги, потерю чувствительности или другие неврологические проблемы , которые указывают на определенные участки поражения нервной системы. [19] Иногда у этих людей также наблюдаются острые воспаления сердца, поражения кожи и заболевания желудка, кишечника или брюшины . [4]
Причина [ править ]
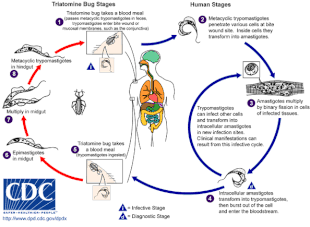
Болезнь Шагаса вызывается заражением простейшим паразитом T. cruzi , который обычно попадает в организм человека через укус триатомовых клопов, также называемых «целующимися клопами». [4] Когда насекомое испражняется в месте укуса, подвижные формы T. cruzi, называемые трипомастиготами, попадают в кровоток и проникают в различные клетки-хозяева. [5] Внутри клетки-хозяина паразит трансформируется в репликативную форму, называемую амастиготой, которая проходит несколько раундов репликации. [5] Реплицированные амастиготы снова превращаются в трипомастиготы, которые разрывают клетку-хозяина и выбрасываются в кровоток. [2] Затем трипомастиготы распространяются по всему организму в различные ткани, где они проникают в клетки и размножаются. [2] В течение многих лет циклы репликации паразитов и иммунный ответ могут серьезно повредить эти ткани, особенно сердце и пищеварительный тракт. [2]
Трансмиссия [ править ]

T. cruzi может передаваться различными триатомовыми клопами родов Triatoma , Panstrongylus и Rhodnius . [2] Основными переносчиками заражения человека являются виды триатомовых клопов, населяющие жилища человека, а именно Triatoma infestans , Rhodnius prolixus , Triatoma dimidiata и Panstrongylus megistus . [20] Эти насекомые известны под несколькими местными названиями, в том числе винчука в Аргентине, Боливии, Чили и Парагвае, барбейро ( парикмахер ) в Бразилии, пито в Колумбии, чинче в Центральной Америке и чипо в Венесуэле. [21] Насекомые, как правило, питаются ночью , предпочитая влажные поверхности возле глаз или рта. [16] [20] Триатомовый клоп может заразиться T. cruzi , когда питается зараженным хозяином. [16] T. cruzi размножается в кишечном тракте насекомого и выделяется с фекалиями клопа. [16] Когда инфицированный триатомин питается, он прокалывает кожу и поглощает кровь , одновременно испражняясь, чтобы освободить место для новой еды. [16] Укус обычно безболезненный, но вызывает зуд. [16] При расчесывании места укуса фекалии, содержащие T. cruzi, попадают в рану от укуса, вызывая инфекцию. [16]
Помимо классического переносчика, болезнь Шагаса может передаваться при употреблении в пищу продуктов питания и напитков, зараженных триатомовыми насекомыми или их фекалиями. [22] Поскольку нагревание или сушка убивают паразитов, напитки и особенно фруктовые соки являются наиболее частым источником заражения. [22] Этот оральный путь передачи был задействован в нескольких вспышках, где он привел к необычно тяжелым симптомам, вероятно, из-за заражения более высокой паразитарной нагрузкой, чем при укусе триатомового клопа. [6] [22] один измельченный триатомин в еде или напитке, содержащем T cruzi , может содержать около 600 000 метациклических трипомастигот, тогда как фекалии триатомина содержат 3 000–4 000 на мкл. [23]
T. cruzi может передаваться независимо от триатомового клопа во время переливания крови, после трансплантации органов или через плаценту во время беременности. [2] При переливании крови инфицированного донора реципиент заражается в 10–25% случаев. [2] Чтобы предотвратить это, доноры крови проверяются на T. cruzi во многих странах с эндемической болезнью Шагаса, а также в США. [6] Аналогичным образом, трансплантация солидных органов от инфицированного донора может привести к передаче T. cruzi реципиенту. [2] Это особенно справедливо для трансплантации сердца , которая передает T. cruzi в 75–100% случаев, и в меньшей степени для трансплантации печени ( 0–29%) или почки (0–19%). [2] Инфицированная мать может передать T. cruzi своему ребенку через плаценту; это происходит примерно в 15% случаев родов у инфицированных матерей. [24] По состоянию на 2019 год 22,5% новых случаев заражения произошли врожденным путем. [25]
Патофизиология [ править ]

В острой фазе заболевания признаки и симптомы обусловлены непосредственно репликацией T. cruzi и иммунной системы на нее. реакцией [2] На этом этапе T. cruzi можно обнаружить в различных тканях организма и циркулировать в крови. [2] В течение первых недель инфекции репликация паразита находится под контролем за счет выработки антител хозяина и активации воспалительной реакции , особенно клеток, нацеленных на внутриклеточные патогены, такие как NK-клетки и макрофаги , управляемые сигнальными молекулами воспаления, такими как TNF-α и IFN. -γ . [2]
При хронической болезни Шагаса в течение многих лет развивается долговременное повреждение органов из-за продолжающейся репликации паразита и повреждения иммунной системы. На ранних стадиях заболевания T. cruzi часто обнаруживается в поперечно-полосатых мышечных волокнах сердца. [26] По мере прогрессирования заболевания сердце обычно увеличивается, при этом значительные участки волокон сердечной мышцы заменяются рубцовой тканью и жиром . [26] Области активного воспаления разбросаны по всему сердцу, в каждой из которых находятся воспалительные иммунные клетки, обычно макрофаги и Т-клетки . [26] На поздних стадиях заболевания паразиты в сердце обнаруживаются редко и могут присутствовать лишь в очень небольших количествах. [26]
В сердце, толстой кишке и пищеводе хронические заболевания приводят к массивной потере нервных окончаний . [18] В сердце это может способствовать аритмиям и другим сердечным дисфункциям. [18] В толстой кишке и пищеводе потеря контроля со стороны нервной системы является основной причиной дисфункции органов. [18] Поражение нервов ухудшает движение пищи по пищеварительному тракту, что может привести к закупорке пищевода или толстой кишки и ограничению их кровоснабжения. [18]
Диагностика [ править ]

Наличие T. cruzi в крови является диагностическим признаком болезни Шагаса. Во время острой фазы инфекции его можно обнаружить путем микроскопического исследования свежей антикоагулянтной крови или ее лейкоцитной пленки на наличие подвижных паразитов; или путем приготовления тонких и толстых мазков крови , окрашенных по Гимзе , для прямой визуализации паразитов. [4] [6] При исследовании мазка крови паразитов обнаруживают в 34–85% случаев. Чувствительность такие методы , как центрифугирование на микрогематокрите . увеличивается, если для концентрирования крови используются [2] При микроскопическом исследовании окрашенных мазков крови трипомастиготы T. cruzi выглядят как S- или U-образные организмы со жгутиком, соединенным с телом волнистой мембраной. ядро кинетопластом и меньшая структура, называемая ; Внутри тела паразита видны кинетопласт T. cruzi относительно крупный, что помогает отличить его от других видов трипаносом, заражающих человека. [27]
Альтернативно, ДНК T. cruzi можно обнаружить с помощью полимеразной цепной реакции (ПЦР). При острой и врожденной болезни Шагаса ПЦР более чувствительна, чем микроскопия. [25] и он более надежен, чем тесты на основе антител для диагностики врожденных заболеваний, поскольку на него не влияет передача антител против T. cruzi от матери к ребенку ( пассивный иммунитет ). [28] ПЦР также используется для мониторинга уровня T. cruzi у реципиентов трансплантатов органов и людей с ослабленным иммунитетом, что позволяет обнаружить инфекцию или реактивацию на ранней стадии. [2] [4] [25]
При хронической болезни Шагаса концентрация паразитов в крови слишком мала, чтобы ее можно было достоверно обнаружить с помощью микроскопии или ПЦР. [2] поэтому диагноз обычно ставится с помощью серологических тестов, которые обнаруживают антитела иммуноглобулина G против T. cruzi . в крови [6] Для подтверждения диагноза необходимы два положительных результата серологического исследования с использованием различных методов тестирования. [4] Если результаты теста неубедительны, дополнительные методы тестирования, такие как вестерн-блоттинг . можно использовать [2]
различные экспресс-тесты для диагностики Доступны болезни Шагаса. Эти тесты легко транспортируются и могут выполняться людьми без специальной подготовки. [29] Они полезны для скрининга большого количества людей и тестирования людей, которые не могут получить доступ к медицинским учреждениям, но их чувствительность относительно низка. [2] и рекомендуется использовать второй метод для подтверждения положительного результата. [29] [30]
Паразитов T. cruzi можно вырастить из образцов крови путем посева крови , ксенодиагностики или путем прививки животным крови человека. человека В методе культуры крови эритроциты отделяются от плазмы и добавляются в специализированную питательную среду, чтобы стимулировать размножение паразита. Для получения результата может потребоваться до шести месяцев. Ксенодиагностика включает в себя скармливание крови трехатомным насекомым с последующим исследованием их фекалий на наличие паразита через 30–60 дней. [29] Эти методы обычно не используются, поскольку они медленны и имеют низкую чувствительность. [31] [29]
Профилактика [ править ]

Усилия по предотвращению болезни Шагаса в основном сосредоточены на борьбе с переносчиками , чтобы ограничить воздействие триатомовых клопов. Программы распыления инсектицидов были основой борьбы с переносчиками инфекции и заключались в опрыскивании домов и прилегающих территорий остаточными инсектицидами. [32] Первоначально это делалось с использованием хлорорганических , фосфорорганических и карбаматных инсектицидов, которые в 1980-х годах были заменены пиретроидами . [32] Эти программы резко сократили передачу вируса в Бразилии и Чили . [16] и уничтожили основных переносчиков из определенных регионов: Triatoma infestans из Бразилии, Чили, Уругвая и некоторых частей Перу и Парагвая , а также Rhodnius prolixus из Центральной Америки . [18] Борьба с переносчиками инфекции в некоторых регионах затруднена из-за развития у триатомовых клопов устойчивости к инсектицидам . [32] В ответ на это программы борьбы с переносчиками инфекции внедрили альтернативные инсектициды (например, фенитротион и бендиокарб в Аргентине и Боливии ), обработку домашних животных (которые также питаются триатомовыми клопами) пестицидами, краски, пропитанные пестицидами, и другие экспериментальные подходы. [32] В районах, где обитают триатомовые клопы, передачу T. cruzi можно предотвратить, если спать под надкроватными сетками и улучшить жилищные условия, которые предотвращают колонизацию домов триатомовыми клопами. [16]
Ранее переливание крови было вторым по распространенности путем передачи болезни Шагаса. [33] T. cruzi может выживать в охлажденной крови, а также замораживать и оттаивать, что позволяет ему сохраняться в цельной крови, эритроцитах , гранулоцитах , криопреципитате и тромбоцитах . [33] Разработка и внедрение скрининговых тестов банков крови резко снизили риск заражения во время переливания крови. [33] Почти все донорские крови в странах Латинской Америки проходят проверку Шагаса. [33] Широко распространенный скрининг также распространен в неэндемичных странах со значительным количеством иммигрантов из эндемичных районов, включая Великобританию (реализован в 1999 г.), Испанию (2005 г.), США (2007 г.), Францию и Швецию (2009 г.), Швейцарию ( 2012 г.) и Бельгия (2013 г.). [34] Серологические тесты, обычно ELISA , используются для обнаружения антител против белков T. cruzi в донорской крови. [33]
На другие пути передачи направлены программы профилактики болезни Шагаса. Лечение матерей, инфицированных T. cruzi, во время беременности снижает риск врожденной передачи инфекции. [24] С этой целью многие страны Латинской Америки ввели регулярный скрининг беременных женщин и младенцев на инфекцию T. cruzi , а Всемирная организация здравоохранения рекомендует проверять всех детей, рожденных от инфицированных матерей, чтобы предотвратить перерастание врожденной инфекции в хроническое заболевание. [1] [35] Подобно переливанию крови, во многих странах с эндемической болезнью Шагаса органы проверяются на предмет трансплантации с помощью серологических тестов. [2]
Вакцины против болезни Шагаса не существует. [8] Несколько экспериментальных вакцин были протестированы на животных, инфицированных T. cruzi , и смогли снизить количество паразитов в крови и сердце. [36] но по состоянию на 2016 год ни одна вакцина-кандидат не прошла клинические испытания на людях. [37]
Управление [ править ]
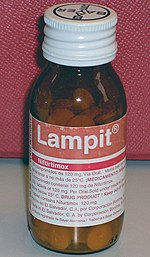
Болезнь Шагаса лечат с помощью противопаразитарных препаратов для устранения T. cruzi из организма и симптоматического лечения для устранения последствий инфекции. [6] По состоянию на 2018 год бензнидазол и нифуртимокс . противопаразитарными препаратами выбора для лечения болезни Шагаса были [2] хотя бензнидазол — единственный препарат, доступный в большинстве стран Латинской Америки. [38] Лечение любого препарата обычно состоит из двух-трех пероральных доз в день в течение 60-90 дней. [2] Противопаразитарное лечение наиболее эффективно на ранних стадиях инфекции: оно уничтожает T. cruzi у 50–80% людей в острой фазе (ВОЗ: «почти 100%» [39] ), но только у 20–60% тех, кто находится в хронической фазе. [6] Лечение хронических заболеваний более эффективно у детей, чем у взрослых, а показатель излечения врожденных заболеваний приближается к 100%, если лечить их в первый год жизни. [2] Противопаразитарное лечение также может замедлить прогрессирование заболевания и снизить вероятность врожденной передачи. [1] Устранение T. cruzi не излечивает поражения сердца и желудочно-кишечного тракта, вызванные хронической болезнью Шагаса, поэтому эти состояния необходимо лечить отдельно. [6] Противопаразитарное лечение не рекомендуется людям, у которых уже развилась дилатационная кардиомиопатия. [18]
Бензнидазол обычно считается препаратом первой линии, поскольку он имеет более легкие побочные эффекты , чем нифуртимокс, и его эффективность лучше изучена. [2] [25] И бензнидазол, и нифуртимокс имеют общие побочные эффекты , которые могут привести к прекращению лечения. Наиболее распространенными побочными эффектами бензнидазола являются кожная сыпь, проблемы с пищеварением, снижение аппетита , слабость, головная боль и проблемы со сном . Эти побочные эффекты иногда можно лечить антигистаминными препаратами или кортикостероидами , и обычно они проходят после прекращения лечения. [2] Однако прием бензнидазола прекращают в 29% случаев. [2] Нифуртимокс имеет более частые побочные эффекты, от которых страдают до 97,5% людей, принимающих препарат. [2] Наиболее распространенными побочными эффектами являются потеря аппетита, потеря веса, тошнота и рвота, а также различные неврологические расстройства , включая изменения настроения, бессонницу , парестезии и периферическую невропатию . [2] Лечение прекращают в 75% случаев. [2] [25] Оба препарата противопоказаны к применению беременным женщинам и людям с печеночной или почечной недостаточностью . [1] По состоянию на 2019 год сообщалось об устойчивости к этим препаратам. [38]
Осложнения [ править ]
В хронической стадии лечение включает купирование клинических проявлений заболевания. Лечение кардиомиопатии Шагаса аналогично лечению других форм заболеваний сердца. [2] Могут быть назначены бета-блокаторы и ингибиторы АПФ , но некоторые люди с болезнью Шагаса могут быть не в состоянии принимать стандартную дозу этих препаратов из-за низкого артериального давления или низкой частоты сердечных сокращений . [2] [18] Чтобы контролировать нерегулярное сердцебиение, людям могут прописать антиаритмические препараты, такие как амиодарон , или имплантировать кардиостимулятор . [4] препараты, разжижающие кровь можно использовать Для предотвращения тромбоэмболии и инсульта . [18] Хроническая болезнь сердца, вызванная Шагасом, является частой причиной операции по трансплантации сердца . [16] Поскольку реципиенты трансплантатов принимают иммунодепрессанты для предотвращения отторжения органов , за ними наблюдают с помощью ПЦР для выявления реактивации заболевания. Люди с болезнью Шагаса, перенесшие трансплантацию сердца, имеют более высокие показатели выживаемости, чем средний реципиент трансплантата сердца. [18]
Легкие желудочно-кишечные заболевания можно лечить симптоматически, например, используя слабительные средства от запора или принимая прокинетические препараты, такие как метоклопрамид, перед едой для облегчения симптомов пищевода. [4] [40] операция по рассечению мышц нижнего пищеводного сфинктера ( кардиомиотомия ). В более тяжелых случаях заболевания пищевода может быть выполнена [40] при развитом мегаколоне и мегаэзофаге может потребоваться хирургическое удаление пораженной части органа. [4] [31]
Эпидемиология [ править ]


По оценкам, в 2019 году около 6,5 миллионов человек во всем мире болели болезнью Шагаса, при этом ежегодно регистрировалось около 173 000 новых случаев заражения и 9 490 случаев смерти. [3] Заболевание привело к глобальному годовому экономическому бремени, которое в 2013 году оценивалось в 7,2 миллиарда долларов США, 86% которого несут эндемичные страны. [34] [43] Болезнь Шагаса приводит к потере более 800 000 лет жизни с поправкой на инвалидность каждый год. [2]
Эндемичный ареал болезни Шагаса простирается от юга США до севера Чили и Аргентины, при этом наибольшая распространенность заболевания наблюдается в Боливии (6,1%), Аргентине (3,6%) и Парагвае (2,1%). [2] В пределах континентальной Латинской Америки болезнь Шагаса эндемична для 21 страны: Аргентины, Белиза, Боливии, Бразилии, Чили, Колумбии, Коста-Рики, Эквадора, Сальвадора, Французской Гвианы, Гватемалы, Гайаны, Гондураса, Мексики, Никарагуа, Панамы, Парагвая, Перу, Суринам, Уругвай и Венесуэла. [1] [2] В эндемичных районах, в основном благодаря усилиям по борьбе с переносчиками инфекции и проверке донорской крови, ежегодные инфекции и смертность снизились на 67% и более чем 73% соответственно по сравнению с пиковыми значениями, приходившимися в 1980-е годы по 2010 год. [2] [44] Передача инфекции через насекомое-переносчик и при переливании крови полностью прекращена в Уругвае (1997 г.), Чили (1999 г.) и Бразилии (2006 г.). [44] а в Аргентине по состоянию на 2001 г. векторная передача была прервана в 13 из 19 эндемичных провинций. [45] в Венесуэле Во время гуманитарного кризиса векторная передача началась в районах, где она ранее была прервана, а уровень серологической распространенности болезни Шагаса увеличился. [46] Скорость передачи также возросла в регионе Гран-Чако из-за устойчивости к инсектицидам и в бассейне Амазонки из-за оральной передачи. [2]
В то время как уровень заболеваемости болезнью Шагаса, передающейся переносчиками, снизился на большей части территории Латинской Америки, уровень заболеваний, передающихся оральным путем, возрос, возможно, из-за растущей урбанизации и вырубки лесов , что привело к более тесному контакту людей с триатоминами и изменению распределения видов триатоминов. [22] [47] [48] Болезнь Шагаса, передающаяся перорально, вызывает особую озабоченность в Венесуэле, где в период с 2007 по 2018 год было зарегистрировано 16 вспышек. [46]
Чагас существует в двух разных экологических зонах. В регионе Южного Конуса основной переносчик живет в жилых домах и вокруг них. В Центральной Америке и Мексике основные виды переносчиков обитают как внутри жилищ, так и на необитаемых территориях. В обеих зонах чагас встречается почти исключительно в сельской местности, где T. cruzi также циркулирует среди диких и домашних животных. [49] T. cruzi обычно заражает более 100 видов млекопитающих в Латинской Америке, включая опоссумов ( Didelphis spp.), [50] броненосцы , игрунки , летучие мыши , различные грызуны [51] и собаки [50] все они могут быть заражены переносчиками или перорально при употреблении в пищу триатомовых клопов и других инфицированных животных. [51] [50] Для животных -энтомофагов это обычный режим. [50] Дидельфис виды. уникальны тем, что им не требуется триатомин для передачи, завершая жизненный цикл через собственную мочу и фекалии. [50] Ветеринарная передача также происходит при вертикальной передаче через плаценту, при переливании крови и трансплантации органов . [50]
Неэндемичные страны
Хотя Шагаса традиционно считают болезнью сельских жителей Латинской Америки, международная миграция привела к тому, что люди с этим заболеванием были рассеяны по многочисленным неэндемичным странам, в первую очередь в Северной Америке и Европе. [1] [34] По состоянию на 2020 год в США проживает около 300 000 инфицированных. [52] По оценкам, в 2018 году от 30 000 до 40 000 человек в Соединенных Штатах страдали кардиомиопатией Шагаса. [18] Подавляющее большинство случаев в США приходится на иммигрантов из Латинской Америки , [18] [25] но возможна местная передача. Одиннадцать видов триатоминов являются аборигенными для Соединенных Штатов, а в некоторых южных штатах существуют устойчивые циклы передачи болезней между насекомыми-переносчиками и животными-резервуарами. [2] [25] в том числе лесные крысы, опоссумы, еноты , броненосцы и скунсы . [53] Однако местное заражение встречается очень редко: с 1955 по 2015 год было зарегистрировано всего 28 случаев. [2] [52] По состоянию на 2013 год стоимость лечения в Соединенных Штатах оценивалась в 900 миллионов долларов США в год (общая стоимость лечения в 7 миллиардов долларов США), включая госпитализацию и использование медицинских устройств, таких как кардиостимуляторы. [43]
По состоянию на 2019 год болезнь Шагаса затронула примерно от 68 000 до 123 000 человек в Европе. [54] В Испании, где высокий уровень иммиграции из Латинской Америки, наблюдается самый высокий уровень распространенности заболевания. По оценкам, от 50 000 до 70 000 человек в Испании живут с болезнью Шагаса, что составляет большинство случаев заболевания в Европе. [55] Распространенность широко варьируется в европейских странах из-за различий в структуре иммиграции. [54] Италия занимает второе место по распространенности, за ней следуют Нидерланды, Великобритания и Германия. [55]
История [ править ]

T. cruzi , вероятно, циркулировал среди млекопитающих Южной Америки задолго до прибытия на континент людей. [56] T. cruzi был обнаружен в древних человеческих останках по всей Южной Америке: от 9000-летней мумии Чинчорро в пустыне Атакама до останков разного возраста в Минас-Жерайс и 1100-летней мумии на севере, вплоть до Пустыня Чиуауа недалеко от Рио-Гранде . [56] Во многих ранних письменных отчетах описываются симптомы, соответствующие болезни Шагаса, при этом ранние описания болезни иногда приписывают Мигелю Диасу Пименте (1707 г.), Луису Гомешу Феррейре (1735 г.) и Теодоро Дж. Х. Ланггаарду (1842 г.). [56]
Формальное описание болезни Шагаса было сделано Карлосом Шагасом в 1909 году после обследования двухлетней девочки с лихорадкой, увеличением лимфатических узлов, увеличением селезенки и печени. [56] При исследовании ее крови Чагас увидел трипаносомы, идентичные тем, которые он недавно идентифицировал в задней кишке триатомовых клопов, и назвал Trypanosoma cruzi в честь своего наставника, бразильского врача Освальдо Круза . [56] Он отправил зараженных триатомовых клопов Крузу в Рио-де-Жанейро что укус зараженного триатомина может передать T. cruzi мартышкам . , который показал , также [56] Всего за два года, в 1908 и 1909 годах, Шагас опубликовал описания болезни, организма, ее вызвавшего, и насекомых-переносчиков, необходимых для заражения. [57] [58] [59] Почти сразу после этого, по предложению Мигеля Коуто , тогдашнего профессора Медицинского факультета Рио-де-Жанейро , болезнь получила широкое название «болезнь Шагаса». [57] Открытие Шагаса принесло ему национальную и международную . известность Нобелевская премия 1921 года. [57] [60]
В 1930-х годах Сальвадор Мацца возобновил исследования болезни Шагаса, описав более тысячи случаев в аргентинской провинции Чако . [56] В Аргентине болезнь известна как Mal de Chagas-Mazza в его честь. [61] Серологические тесты на болезнь Шагаса были внедрены в 1940-х годах, продемонстрировав, что инфекция T. cruzi широко распространена по всей Латинской Америке. [56] Это, в сочетании с успехами в ликвидации переносчиков малярии посредством использования инсектицидов, стимулировало создание кампаний общественного здравоохранения, направленных на обработку домов инсектицидами для искоренения триатомовых клопов. [32] [56] В 1950-х годах было обнаружено, что обработка крови кристаллическим фиолетовым может уничтожить паразита, что привело к его широкому использованию в программах скрининга переливания крови в Латинской Америке. [56] Крупномасштабные программы борьбы начали формироваться в 1960-х годах, сначала в Сан-Паулу , затем в различных местах Аргентины, а затем программы национального уровня по всей Латинской Америке. [62] Эти программы получили значительный импульс в 1980-х годах с появлением пиретроидных инсектицидов, которые не оставляли пятен или запаха после применения, были более долговечными и экономически эффективными. [56] [62] Региональные органы, занимающиеся борьбой с болезнью Шагаса, возникли при поддержке Панамериканской организации здравоохранения : в 1991 г. была запущена Инициатива Южного Конуса по ликвидации болезни Шагаса, за которой последовали Инициатива Андских стран (1997 г.), Инициатива Центрального Конуса. Американские страны (1997 г.) и Инициатива стран Амазонии (2004 г.). [32]
Исследования [ править ]
Лечение [ править ]
Фексинидазол , противопаразитарный препарат, одобренный для лечения африканского трипаносомоза, продемонстрировал активность против болезни Шагаса на животных моделях. По состоянию на 2019 год он проходит II фазу клинических испытаний при хронической болезни Шагаса в Испании. [38] [63] Другие кандидаты на лекарства включают GNF6702 , ингибитор протеасом , который эффективен против болезни Шагаса у мышей и проходит предварительные исследования токсичности, и AN4169 , который дал многообещающие результаты на животных моделях. [11] [64]
Ряд экспериментальных вакцин был протестирован на животных. В дополнение к субъединичным вакцинам некоторые подходы включают вакцинацию аттенуированными паразитами T. cruzi или организмами, которые экспрессируют некоторые из тех же антигенов, что и T. cruzi , но не вызывают заболевания человека, например Trypanosomarangeli или Phytomonas serpens . ДНК-вакцинация Также изучалась . По состоянию на 2019 год исследования вакцин в основном ограничивались моделями на мелких животных. [10]
Диагностические тесты [ править ]
По состоянию на 2018 год стандартные диагностические тесты на болезнь Шагаса были ограничены в своей способности измерять эффективность противопаразитарного лечения, поскольку серологические тесты могут оставаться положительными в течение многих лет после выведения T. cruzi из организма, а ПЦР может давать ложноотрицательные результаты при концентрация паразита в крови низкая. несколько потенциальных биомаркеров В настоящее время исследуются ответа на лечение, такие как иммуноанализы на специфические антигены T. cruzi , проточная цитометрия для обнаружения антител против различных стадий жизни T. cruzi , а также маркеры физиологических изменений, вызванных паразитом, таких как изменения в коагуляции. и липидный обмен . [18]
Еще одним направлением исследований является использование биомаркеров для прогнозирования прогрессирования хронических заболеваний. Уровни сывороточного фактора некроза опухоли альфа , мозга и натрийуретического пептида предсердий и ангиотензинпревращающего фермента 2 были изучены как индикаторы прогноза кардиомиопатии Шагаса. [65]
T. cruzi выделяет антиген острой фазы (SAPA), который можно обнаружить в крови с помощью ИФА или вестерн-блоттинга. [24] использовался в качестве индикатора ранней острой и врожденной инфекции. [65] анализ на антигены T. cruzi в моче. Для диагностики врожденных заболеваний был разработан [24]
См. также [ править ]
- Инициатива «Лекарства от забытых болезней»
- Кампания «Шагас: время лечить»
- Ассоциация содействия независимому контролю заболеваний в развивающихся странах
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д «Болезнь Шагаса (американский трипаносомоз)» . Всемирная организация здравоохранения . 17 апреля 2019 года. Архивировано из оригинала 20 января 2020 года . Проверено 9 марта 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а к ап ак с как в В из хорошо топор Перес-Молина Х.А., Молина I (2018). «Болезнь Шагаса». Ланцет . 391 (10115): 82–94. дои : 10.1016/S0140-6736(17)31612-4 . ISSN 0140-6736 . ПМИД 28673423 . S2CID 4514617 .
- ↑ Перейти обратно: Перейти обратно: а б с д и «Глобальные показатели здравоохранения: болезнь Шагаса — причина 3-го уровня» (PDF) . Ланцет . 2020. Архивировано (PDF) из оригинала 18 марта 2022 года.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п Берн С (июль 2015 г.). «Болезнь Шагаса». Н. англ. Дж. Мед. (Обзор). 373 (5): 456–66. дои : 10.1056/NEJMra1410150 . ПМИД 26222561 .
- ↑ Перейти обратно: Перейти обратно: а б с «DPDx – Американский трипаносомоз. Информационный бюллетень» . Центры по контролю заболеваний (CDC). 30 апреля 2019 года. Архивировано из оригинала 5 сентября 2019 года . Проверено 10 марта 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Гарнер Дж. (май 2019 г.). «Болезнь Шагаса как пример вновь появляющегося паразита» . Семинары по диагностической патологии . 36 (3): 164–9. дои : 10.1053/j.semdp.2019.04.008 . ПМИД 31006555 .
- ^ «Профилактика болезни Шагаса» . Всемирная организация здравоохранения . Архивировано из оригинала 11 февраля 2018 года . Проверено 24 февраля 2018 г.
- ↑ Перейти обратно: Перейти обратно: а б Санти А.М., Мурта С.М. (2022). «Система антиоксидантной защиты как рациональная мишень для химиотерапии болезни Шагаса и лейшманиоза» . Мемориалы Института Освальдо Круса . 117 : e210401. дои : 10.1590/0074-02760210401 . ПМЦ 8896756 . ПМИД 35239945 .
- ^ Порта, Эксекиэль О.Дж.; Калеш, Карунакаран; Стил, Патрик Г. (2023). «Навигация по перепрофилированию лекарств для лечения болезни Шагаса: достижения, проблемы и возможности» . Границы в фармакологии . 14 . дои : 10.3389/fphar.2023.1233253 . ISSN 1663-9812 . ПМЦ 10416112 . PMID 37576826 .
- ↑ Перейти обратно: Перейти обратно: а б Риос Л.Е., Васкес-Чагоян Х.К., Пачеко А.О., член парламента Заго, Гарг, Нью-Джерси (2019). «Усилия по разработке иммунитета и вакцины против Trypanosoma cruzi» . Акта Тропика . 200 : 105168. doi : 10.1016/j.actatropica.2019.105168 . ISSN 0001-706X . ПМЦ 7409534 . ПМИД 31513763 .
- ↑ Перейти обратно: Перейти обратно: а б Вермельо AB, Родригес GC, Супуран CT (2019). «Почему не было достигнуто большего прогресса в открытии новых лекарств от болезни Шагаса?». Мнение экспертов об открытии лекарств . 15 (2): 145–158. дои : 10.1080/17460441.2020.1681394 . ISSN 1746-0441 . ПМИД 31670987 . S2CID 207815975 .
- ^ Расси-младший А, Расси А, Маркондес де Резенде Дж (июнь 2012 г.). «Американский трипаносомоз (болезнь Шагаса)». Клиники инфекционных заболеваний Северной Америки . 26 (2): 275–91. дои : 10.1016/j.idc.2012.03.002 . ПМИД 22632639 . S2CID 34941921 .
- ^ Капинера Дж.Л., изд. (2008). Энциклопедия энтомологии (2-е изд.). Дордрехт: Спрингер. п. 824 . ISBN 9781402062421 .
- ^ Расси А., Расси А., Марин-Нето Дж.А. (апрель 2010 г.). «Болезнь Шагаса». Ланцет . 375 (9723): 1388–402. дои : 10.1016/S0140-6736(10)60061-X . ПМИД 20399979 . S2CID 5068417 .
- ^ «Забытые тропические болезни» . cdc.gov . 6 июня 2011 года. Архивировано из оригинала 4 декабря 2014 года . Проверено 28 ноября 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л Деспомье Д.Д., Гриффин Д.О., Гвадз Р.В., Хотез П.Дж., Книрш К.А. (2019). «Американский трипаносомоз». Паразитарные болезни (7-е изд.). Нью-Йорк: Паразиты без границ. стр. 71–84 . Проверено 26 марта 2020 г. .
- ^ «Болезнь Шагаса – подробный информационный бюллетень» . www.cdc.gov . CDC-Центры по контролю и профилактике заболеваний. Архивировано из оригинала 16 августа 2019 года . Проверено 15 апреля 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н Нуньес М.К., Битон А., Аквателла Х. и др. (сентябрь 2018 г.). «Кардиомиопатия Шагаса: обновление современных клинических знаний и методов лечения: научное заявление Американской кардиологической ассоциации» . Тираж (обзор). 138 (12): e169–e209. doi : 10.1161/CIR.0000000000000599 . ПМИД 30354432 .
- ^ Эчеверрия LE, Морилло, Калифорния (февраль 2019 г.). «Американский трипаносомоз (болезнь Шагаса)». Клиники инфекционных заболеваний Северной Америки . 33 (1): 119–134. дои : 10.1016/j.idc.2018.10.015 . ПМИД 30712757 . S2CID 73446292 .
- ↑ Перейти обратно: Перейти обратно: а б с Альба Сото CD, Гонсалес Каппа SM (9 сентября 2019 г.). «Путешествие Trypanosoma cruzi от насекомого-переносчика к клетке-хозяину». Марсело Альчех Дж., Фрейли Х. (ред.). Болезнь Шагаса . Биркхойзер: достижения в области инфекционных заболеваний. Швейцария: Природа Спрингера. стр. 25–59. дои : 10.1007/978-3-030-00054-7_2 . ISBN 978-3-030-00054-7 . ISSN 2504-3811 . S2CID 203357705 .
- ^ Модлин И., Холмс П.Х., Майлз М.А., ред. (2004). Трипаносомозы . Уоллингфорд: CAB International. п. 184 . ISBN 9780851990347 .
- ↑ Перейти обратно: Перейти обратно: а б с д Робертсон Л.Дж., Девешауэр Б., де Нойя Б.А., Госалес О.Н., Тогерсон П.Р. (июнь 2016 г.). «Trypanosoma cruzi: время международного признания как паразита пищевого происхождения» . PLOS Забытые тропические болезни . 10 (6): e0004656. дои : 10.1371/journal.pntd.0004656 . ПМЦ 4890754 . ПМИД 27253136 .
- ^ «Оральная передача болезни Шагаса имеет серьезные последствия (с разделом «Семь вещей, которые следует знать о болезни Шагаса, передающейся орально»)» . Медскейп . 1 марта 2024 г.
- ↑ Перейти обратно: Перейти обратно: а б с д Мессенджер Лос-Анджелес, Берн С. (2018). «Врожденная болезнь Шагаса: текущая диагностика, ограничения и перспективы на будущее» (PDF) . Современное мнение об инфекционных заболеваниях . 31 (5): 415–21. doi : 10.1097/QCO.0000000000000478 . ПМИД 30095485 . S2CID 51955023 . Архивировано (PDF) из оригинала 5 марта 2020 года.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Берн С., Мессенджер Л.А., Уитмен Дж.Д., Магуайр Дж.Х. (2019). «Болезнь Шагаса в Соединенных Штатах: подход общественного здравоохранения» . Обзоры клинической микробиологии (обзор). 33 (1). дои : 10.1128/CMR.00023-19 . ISSN 0893-8512 . ПМК 6927308 . ПМИД 31776135 .
- ↑ Перейти обратно: Перейти обратно: а б с д Бонни К.М., Лютрингер DJ, Ким С.А., Гарг Нью-Джерси, Энгман Д.М. (январь 2019 г.). «Патология и патогенез болезни сердца Шагаса» . Анну Рев Патол (обзор). 14 : 421–47. doi : 10.1146/annurev-pathol-020117-043711 . ПМЦ 7373119 . ПМИД 30355152 .
- ^ Бэйн Б.Дж. (20 января 2015 г.). Клетки крови: Практическое руководство . Джон Уайли и сыновья. стр. 165–7. ISBN 978-1-118-81733-9 .
- ^ Шейман АГ (август 2018 г.). «Молекулярная диагностика Trypanosoma cruzi». Акта Тропика . 184 : 59–66. doi : 10.1016/j.actatropica.2018.02.019 . hdl : 11336/79861 . ПМИД 29476727 . S2CID 3513900 .
- ↑ Перейти обратно: Перейти обратно: а б с д Лукетти А.О., Шейман АГ (9 сентября 2019 г.). «Диагностика болезни Шагаса». Марсело Альчех Дж., Фрейли Х. (ред.). Болезнь Шагаса . Биркхойзер: достижения в области инфекционных заболеваний. Швейцария: Природа Спрингера. стр. 141–58. дои : 10.1007/978-3-030-00054-7_7 . ISBN 978-3-030-00054-7 . ISSN 2504-3811 . S2CID 203376369 .
- ^ Ангебен А., Буонфрате Д., Круциани М. и др. (май 2019 г.). «Быстрые иммунохроматографические тесты для диагностики хронической болезни Шагаса в группах риска: систематический обзор и метаанализ» . PLOS Забытые тропические болезни . 13 (5): e0007271. дои : 10.1371/journal.pntd.0007271 . ПМК 6561601 . ПМИД 31150377 .
- ↑ Перейти обратно: Перейти обратно: а б Кирхгоф О.В. (26 апреля 2019 г.). «Болезнь Шагаса (Американский трипаносомоз)» . Электронная медицина . Архивировано из оригинала 12 марта 2020 года . Проверено 8 апреля 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Мугабуре-Куэто Дж., Пиколло М.И. (сентябрь 2015 г.). «Устойчивость к инсектицидам у переносчиков болезни Шагаса: эволюция, механизмы и управление». Акта Тропика . 149 : 70–85. doi : 10.1016/j.actatropica.2015.05.014 . hdl : 11336/61521 . ПМИД 26003952 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Ангебен А., Бойкс Л., Буонфрат Д. и др. (октябрь 2015 г.). «Болезнь Шагаса и трансфузионная медицина: взгляд из неэндемичных стран» . Переливание крови . 13 (4): 540–50. дои : 10.2450/2015.0040-15 . ПМЦ 4624528 . ПМИД 26513769 .
- ↑ Перейти обратно: Перейти обратно: а б с Лидани К.Ф., Андраде Ф.А., Бавиа Л. и др. (июль 2019 г.). «Болезнь Шагаса: от открытия до мировой проблемы здравоохранения» . Границы общественного здравоохранения . 7 : 166. дои : 10.3389/fpubh.2019.00166 . ПМК 6614205 . ПМИД 31312626 .
- ^ Бонни К.М. (март 2014 г.). «Болезнь Шагаса в XXI веке: успех общественного здравоохранения или новая угроза» . Паразит . 21 (11): 11. doi : 10.1051/parasite/2014012 . ПМЦ 3952655 . ПМИД 24626257 .
- ^ Дюмонтейл Э., Эррера К., Бюкенс П. (январь 2019 г.). «Терапевтическая вакцина против болезни Шагаса до зачатия: новое показание, которое может снизить врожденную передачу инфекции и ускорить разработку вакцины» . PLOS Забытые тропические болезни . 13 (1): e0006985. дои : 10.1371/journal.pntd.0006985 . ПМК 6354953 . ПМИД 30703092 .
- ^ Beaumier CM, Gillespie PM, Strych U и др. (июнь 2016 г.). «Состояние исследований и разработок вакцин против болезни Шагаса» . Вакцина . 34 (26): 2996–3000. doi : 10.1016/j.vaccine.2016.03.074 . ПМИД 27026146 .
- ↑ Перейти обратно: Перейти обратно: а б с Рибейро В., Диас Н., Пайва Т. и др. (декабрь 2019 г.). «Современные тенденции в фармакологическом лечении болезни Шагаса» . Int J Устойчивость к лекарствам от паразитов (обзор). 12 :7–17. дои : 10.1016/j.ijpddr.2019.11.004 . ПМК 6928327 . ПМИД 31862616 .
- ^ ВОЗ. (13 апреля 2022 г.). «Болезнь Шагаса (также известная как американский трипаносомоз» . Информационные бюллетени ).
- ↑ Перейти обратно: Перейти обратно: а б де Оливейра EC, да Силвейра ABM, Лукетти AO (9 сентября 2019 г.). «Желудочно-кишечная болезнь Шагаса». Марсело Альчех Дж., Фрейли Х. (ред.). Болезнь Шагаса . Биркхойзер: достижения в области инфекционных заболеваний. Швейцария: Природа Спрингера. стр. 243–62. дои : 10.1007/978-3-030-00054-7_12 . ISBN 978-3-030-00054-7 . ISSN 2504-3811 . S2CID 203457516 .
- ^ Лю Ц, Чжоу С.Н. (декабрь 2015 г.). «Предотвращение передачи американского трипаносомоза и его распространения в неэндемичные страны» . Инфекционные болезни бедности . 4:60 . дои : 10.1186/s40249-015-0092-7 . ПМЦ 4693433 . ПМИД 26715535 .
- ^ Всемирная организация здравоохранения. «Оценки бремени болезней и смертности» . Архивировано из оригинала 10 февраля 2020 года . Проверено 27 апреля 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б Ли БАЙ, Бэкон К.М., Боттацци М.Э., Хотез П.Дж. (апрель 2013 г.). «Глобальное экономическое бремя болезни Шагаса: компьютерная модель» . Ланцет инфекционных заболеваний . 13 (4): 342–8. дои : 10.1016/S1473-3099(13)70002-1 . ПМЦ 3763184 . ПМИД 23395248 .
- ↑ Перейти обратно: Перейти обратно: а б Монкайо А, Сильверия АК (2017). «Текущие эпидемиологические тенденции болезни Шагаса в Латинской Америке и будущие проблемы: эпидемиология, надзор и политика здравоохранения». Американский трипаносомоз - болезнь Шагаса (2-е изд.). Эльзевир. стр. 59–88. дои : 10.1016/B978-0-12-801029-7.00004-6 .
- ^ «Инициатива Южного Конуса: обновленная информация» . Специальная программа исследований и подготовки кадров в области тропических болезней (TDR) (пресс-релиз). ВОЗ. 2004. Архивировано из оригинала 22 сентября 2009 года . Проверено 29 августа 2008 г.
- ↑ Перейти обратно: Перейти обратно: а б Гриль М.Э., Эрнандес-Виллена СП, Ллевеллин М.С. и др. (май 2019 г.). «Гуманитарный кризис в Венесуэле, возрождение трансмиссивных болезней и последствия для распространения в регионе» (PDF) . Lancet Infect Dis (обзор). 19 (5): e149–e161. дои : 10.1016/S1473-3099(18)30757-6 . ПМИД 30799251 . S2CID 73475841 .
- ^ Аларкон де Нойя Б, Нойя Гонсалес О (9 сентября 2019 г.). «Болезнь Шагаса, передающаяся перорально: биология, эпидемиология и клинические аспекты инфекции пищевого происхождения». Марсело Альчех Дж., Фрейли Х. (ред.). Болезнь Шагаса . Биркхойзер: достижения в области инфекционных заболеваний. Швейцария: Природа Спрингера. стр. 225–241 . дои : 10.1007/978-3-030-00054-7_11 . ISBN 978-3-030-00054-7 . ISSN 2504-3811 . S2CID 239445211 .
- ^ Хотез П.Дж., Басанес М.Г., Акоста-Серрано А., Гриле М.Э. (2017). «Венесуэла и рост заболеваемости трансмиссивными, забытыми болезнями» . PLOS Забытые тропические болезни . 11 (6): e0005423. дои : 10.1371/journal.pntd.0005423 . ISSN 1935-2735 . ПМК 5490936 . ПМИД 28662038 .
- ^ Морель CM, Лаздиньш Дж (октябрь 2003 г.). «Болезнь Шагаса» . Nat Rev Микробиол . 1 (1): 14–5. дои : 10.1038/nrmicro735 . ПМИД 15040175 . S2CID 29869370 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Вилковский С.Е. (9 марта 2022 г.). «Трипаносомоз у животных – Система кровообращения» . Ветеринарное руководство Merck . Архивировано из оригинала 28 марта 2022 года . Проверено 28 марта 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Янсен А.М., Роке Алр (2010). «11 - Водоемы домашних и диких млекопитающих». В Теллерии Дж., Тибайренц М. (ред.). Американский трипаносомоз . Эльзевир. стр. 249–276. дои : 10.1016/B978-0-12-384876-5.00011-3 . ISBN 978-0-123-84876-5 .
- ↑ Перейти обратно: Перейти обратно: а б Турабелидзе Г., Васудеван А., Рохас-Морено С. и др. (2020). «Автохтонная болезнь Шагаса — Миссури, 2018» . ММВР. Еженедельный отчет о заболеваемости и смертности . 69 (7): 193–195. дои : 10.15585/mmwr.mm6907a4 . ISSN 0149-2195 . ПМК 7043387 . ПМИД 32078594 .
- ^ Монтгомери С.П., Старр МК, Канти П.Т., Эдвардс М.С., Мейманди С.К. (2014). «Забытые паразитарные инфекции в США: болезнь Шагаса» . Am J Trop Med Hyg . 90 (5): 814–818. дои : 10.4269/ajtmh.13-0726 . ПМК 4015570 . ПМИД 24808250 .
- ↑ Перейти обратно: Перейти обратно: а б Алонсо-Падилья Х, Пинасо М.Ю., Гаскон Х. (9 сентября 2019 г.). «Болезнь Шагаса в Европе». Марсело Альчех Дж., Фрейли Х. (ред.). Болезнь Шагаса . Биркхойзер: достижения в области инфекционных заболеваний. Швейцария: Природа Спрингера. стр. 111–123. дои : 10.1007/978-3-030-00054-7_5 . ISBN 978-3-030-00054-7 . ISSN 2504-3811 . S2CID 203406723 .
- ↑ Перейти обратно: Перейти обратно: а б Веласко М., Гимено-Фелиу Л.А., Молина И. и др. (февраль 2020 г.). «Скрининг инфекции Trypanosoma cruzi у иммигрантов и беженцев: систематический обзор и рекомендации Испанского общества инфекционных заболеваний и клинической микробиологии» . Евронаблюдение. (Обзор). 25 (8). дои : 10.2807/1560-7917.ES.2020.25.8.1900393 . ПМК 7055039 . ПМИД 32127121 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к Стевердинг Д. (июль 2014 г.). «История болезни Шагаса» . Паразиты и переносчики . 7 : 317. дои : 10.1186/1756-3305-7-317 . ПМК 4105117 . ПМИД 25011546 .
- ↑ Перейти обратно: Перейти обратно: а б с Кропф С.П., Са М.Р. (июль 2009 г.). «Открытие Trypanosoma cruzi и болезни Шагаса (1908–1909): тропическая медицина в Бразилии» . Hist Cienc Saude Manguinhos . 16 (Приложение 1): 13–34. дои : 10.1590/s0104-59702009000500002 . ПМИД 20027916 . S2CID 36106351 .
- ^ Чагас С (1909). «Новые трипаносомы». Предварительное сообщение Архикорабель Тропенхиг . 13 :120–2.
- ^ Чагас С (1909). «Новый человеческий трипаносомоз: исследования морфологии и эволюционного цикла Schizotrypanum cruzi n. gen., n. sp., этиологического воздействия нового болезненного организма у человека [Новый человеческий трипаносомоз. Исследования морфологии и жизненного цикла Schizotripanum cruzi» . , этиологический агент новой болезненной сущности человека]" . Мем Инст Освальдо Круз . 1 (2): 159–218. дои : 10.1590/S0074-02761909000200008 . ISSN 0074-0276 . (на португальском языке с полным переводом на немецкий язык как «Ueber eine neue Trypanosomiasis des Menschen».)
- ^ Бестетти Р.Б., Мартинс К.А., Кардиналли-Нето А. (май 2009 г.). «Справедливость там, где справедливость: посмертная Нобелевская премия Карлосу Шагасу (1879–1934), первооткрывателю американского трипаносомоза (болезни Шагаса)». Международный журнал кардиологии . 134 (1): 9–16. дои : 10.1016/j.ijcard.2008.12.197 . ПМИД 19185367 .
- ^ «Болезнь Чагаса – Маццы» (на испанском языке). Ассоциация по борьбе с болезнью Шагаса. Архивировано из оригинала 16 сентября 2011 года . Проверено 15 сентября 2011 г.
- ↑ Перейти обратно: Перейти обратно: а б Диас JCP (сентябрь 2015 г.). «Эволюция программ скрининга и борьбы с болезнью Шагаса». Глобальное Сердце . 10 (3): 193–202. дои : 10.1016/j.gheart.2015.06.003 . ПМИД 26407516 .
- ^ Дикс ЭД (2019). «Фексинидазол: первое глобальное одобрение». Наркотики (обзор). 79 (2): 215–220. дои : 10.1007/s40265-019-1051-6 . ISSN 0012-6667 . ПМИД 30635838 . S2CID 57772417 .
- ^ Крац Дж. М. (2019). «Открытие лекарства от болезни Шагаса: точка зрения» . Акта Тропика (Обзор). 198 : 105107. doi : 10.1016/j.actatropica.2019.105107 . ISSN 0001-706X . ПМИД 31351074 .
- ↑ Перейти обратно: Перейти обратно: а б Балуз В., Агуэро Ф., Бускалья, Калифорния (2017). «Применение диагностики болезни Шагаса: современные знания и будущие шаги» . Адв. Паразитол. (Обзор). 97 : 1–45. дои : 10.1016/bs.apar.2016.10.001 . ПМЦ 5363286 . ПМИД 28325368 .
Внешние ссылки [ править ]
- Болезнь Шагаса у Керли
- Информация о Шагасе США в Центрах по контролю заболеваний
- Информация Шагаса от инициативы «Лекарства от забытых болезней»
- Информация о болезни Шагаса для путешественников от Международной ассоциации медицинской помощи путешественникам