Белок-предшественник бета-амилоида
| ПРИЛОЖЕНИЕ | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | APP , AAA, ABETA, ABPP, AD1, APPI, CTFgamma, CVAP, PN-II, PN2, белок-предшественник бета-амилоида, preA4, альфа-sAPP | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 104760 ; МГИ : 88059 ; Гомологен : 56379 ; GeneCards : приложение ; ОМА : APP – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||

Белок-предшественник бета-амилоида ( АРР ) представляет собой интегральный мембранный белок, во многих тканях и концентрирующийся в синапсах нейронов экспрессирующийся . Он действует как рецептор клеточной поверхности. [5] и участвует в качестве регулятора образования синапсов , [6] нейронная пластичность , [7] противомикробное действие, [8] и экспорт железа . [9] Он кодируется геном APP и регулируется презентацией субстрата . [10] APP наиболее известен как молекула-предшественник, протеолиз которой генерирует бета-амилоид (Aβ), полипептид, содержащий от 37 до 49 аминокислотных остатков, амилоидная фибриллярная форма которого является основным компонентом амилоидных бляшек, обнаруженных в мозге пациентов с болезнью Альцгеймера .
Генетика
[ редактировать ]Белок-предшественник бета-амилоида — древний и высококонсервативный белок . [11] У человека ген , APP расположен на 21 хромосоме и содержит 18 экзонов охватывающих 290 тысяч оснований . [12] [13] несколько альтернативных сплайсинговых У людей наблюдалось изоформ APP, длина которых варьируется от 639 до 770 аминокислот, причем некоторые изоформы преимущественно экспрессируются в нейронах; изменения в соотношении нейронов этих изоформ были связаны с болезнью Альцгеймера. [14] Гомологичные белки были идентифицированы у других организмов, таких как Drosophila (дрозофилы), C. elegans (круглые черви), [15] и все млекопитающие . [16] Бета-амилоидная область белка, расположенная в трансмембранном домене, недостаточно консервативна у разных видов и не имеет очевидной связи с биологическими функциями АРР в нативном состоянии . [16]
Мутации в критических областях белка-предшественника амилоида, включая область, которая генерирует бета-амилоид (Aβ), вызывают семейную предрасположенность к болезни Альцгеймера. [17] [18] [19] [20] Например, было обнаружено, что несколько мутаций за пределами региона Aβ, связанных с семейной болезнью Альцгеймера, резко увеличивают выработку Aβ. [21]
Мутация (A673T) в гене APP защищает от болезни Альцгеймера. Эта замена прилегает к участку расщепления бета-секретазой и приводит к 40% снижению образования бета-амилоида in vitro. [22]
Структура
[ редактировать ]

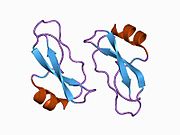
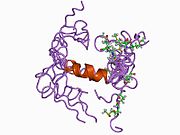
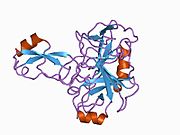
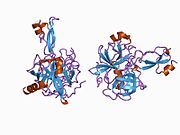
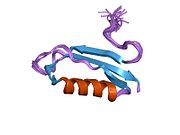
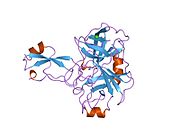
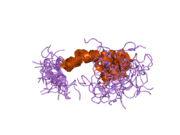
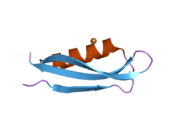
В последовательности APP был обнаружен ряд различных структурных доменов , которые складываются преимущественно самостоятельно. Внеклеточная область, намного превышающая внутриклеточную, разделена на домены E1 и E2, связанные кислым доменом (AcD); E1 содержит два субдомена, включая домен, подобный фактору роста (GFLD) и медь -связывающий домен (CuBD), тесно взаимодействующие друг с другом. [24] Домен ингибитора сериновой протеазы, отсутствующий в изоформе, дифференциально экспрессируемой в головном мозге, обнаруживается между кислой областью и доменом E2. [25] Полная кристаллическая структура АРР еще не выяснена; однако отдельные домены были успешно кристаллизованы: домен, подобный фактору роста, [26] медь-связывающий домен, [27] полный домен E1 [24] и домен E2. [23]
Разнообразие изоформ
[ редактировать ]Белок-предшественник бета-амилоида очень универсален: несколько изоформ образуются путем альтернативного сплайсинга его мРНК. Первичные изоформы включают APP695, APP751 и APP770, отличающиеся включением определенных экзонов, в основном экзонов 7 и 8. APP695 преимущественно экспрессируется в нейрональных клетках и имеет решающее значение для нормальной функции нейронов. APP751 и APP770 более широко экспрессируются в ненейрональных тканях, но демонстрируют различные паттерны экспрессии во время дифференцировки нейронов. [28] Дифференциальная экспрессия этих изоформ играет важную роль в клеточных процессах, таких как развитие нервной системы, синаптическая пластичность и патогенез болезни Альцгеймера. Понимание разнообразия изоформ АРР необходимо для расшифровки его различных физиологических и патологических ролей.

Посттрансляционная обработка
[ редактировать ]АРР подвергается обширной посттрансляционной модификации, включая гликозилирование , фосфорилирование , сиалилирование и сульфатирование тирозина , а также многим типам протеолитического процессинга с образованием пептидных фрагментов. [29] Обычно он расщепляется протеазами семейства секретаз ; Альфа-секретаза и бета-секретаза удаляют почти весь внеклеточный домен, высвобождая прикрепленные к мембране карбокси-концевые фрагменты, которые могут быть связаны с апоптозом . [16] Расщепление гамма-секретазой в трансмембранном домене после расщепления бета-секретазой приводит к образованию фрагмента бета-амилоида; гамма-секретаза представляет собой большой мультисубъединичный комплекс, компоненты которого еще не полностью охарактеризованы, но он включает пресенилин , ген которого был идентифицирован как основной генетический фактор риска болезни Альцгеймера. [30]
Амилоидогенный процессинг АРР связан с его присутствием в липидных рафтах . Когда молекулы АРР занимают область липидного рафта мембраны, они более доступны и дифференциально расщепляются бета-секретазой, тогда как молекулы АРР вне рафта дифференциально расщепляются неамилоидогенной альфа-секретазой. [31] Активность гамма-секретазы также связана с липидными рафтами. [32] Роль холестерина в поддержании липидного рафта была названа вероятным объяснением наблюдений о том, что высокий уровень холестерина и аполипопротеина Е генотип являются основными факторами риска болезни Альцгеймера. [33]
Биологическая функция
[ редактировать ]Хотя нативная биологическая роль АРР представляет очевидный интерес для исследований болезни Альцгеймера, ее полное понимание остается недостижимым. Экспериментальные модели болезни Альцгеймера обычно используются исследователями для лучшего понимания биологической функции АРР в патологии и прогрессировании заболевания.
Синаптическое образование и восстановление
[ редактировать ]Наиболее доказанная роль APP заключается в формировании и восстановлении синапсов; [6] его экспрессия усиливается нейронов и во время дифференцировки после нервного повреждения. Роль в передаче сигналов клеток , долговременной потенциации и клеточной адгезии была предложена и подтверждена пока еще ограниченными исследованиями. [16] В частности, сходство в посттрансляционном процессинге позволило провести сравнение с сигнальной ролью поверхностного рецепторного белка Notch . [34]
APP Мыши с нокаутом жизнеспособны и имеют относительно незначительные фенотипические эффекты, включая нарушение долговременной потенциации и потерю памяти без общей потери нейронов. [35] С другой стороны, также сообщалось, что у трансгенных мышей с повышенным уровнем экспрессии АРР наблюдается нарушение долговременной потенциации. [36]
Логический вывод состоит в том, что, поскольку Aβ чрезмерно накапливается при болезни Альцгеймера, уровень его предшественника, АРР, также будет повышен. Однако тела нейрональных клеток содержат меньше АРР в зависимости от их близости к амилоидным бляшкам. [37] Данные показывают, что этот дефицит APP является результатом снижения производства, а не увеличения катализа. Потеря АРР нейрона может повлиять на физиологические дефициты, которые способствуют деменции.
Соматическая рекомбинация
[ редактировать ]человека В нейронах головного мозга . часто происходит соматическая рекомбинация в гене, кодирующем АРР [38] Нейроны людей со спорадической болезнью Альцгеймера демонстрируют большее разнообразие генов APP из-за соматической рекомбинации, чем нейроны здоровых людей. [38]
Антероградный нейрональный транспорт
[ редактировать ]Молекулы, синтезируемые в телах клеток нейронов, должны быть доставлены наружу к дистальным синапсам. Это достигается за счет быстрого антероградного транспорта . Было обнаружено, что APP может опосредовать взаимодействие между грузом и кинезином и, таким образом, облегчать этот транспорт. В частности, для взаимодействия с моторным белком необходима короткая 15-аминокислотная последовательность пептида на карбокси-конце цитоплазмы. [39]
Кроме того, было показано, что взаимодействие между АРР и кинезином специфично для пептидной последовательности АРР. [40] В недавнем эксперименте, включающем транспортировку цветных шариков , конъюгированных с пептидами , контрольные образцы были конъюгированы с одной аминокислотой, глицином , так что они имели ту же концевую группу карбоновой кислоты, что и АРР, без промежуточной последовательности из 15 аминокислот, упомянутой выше. Контрольные шарики не были подвижными, что продемонстрировало, что концевой СООН- группы пептидов недостаточно для обеспечения транспорта.
Экспорт железа
[ редактировать ]Другой взгляд на болезнь Альцгеймера раскрывается в исследовании на мышах, которое показало, что АРР обладает ферроксидазной активностью, сходной с церулоплазмином , способствуя экспорту железа посредством взаимодействия с ферропортином ; кажется, что эта активность блокируется цинком, захваченным накопленным Aβ при болезни Альцгеймера. [9] Было показано, что однонуклеотидный полиморфизм в 5'-UTR APP мРНК может нарушать ее трансляцию. [41]
Гипотеза о том, что АРР обладает ферроксидазной активностью в своем домене Е2 и облегчает экспорт Fe(II), возможно, неверна, поскольку предполагаемый ферроксидазный сайт АРР, расположенный в домене Е2, не обладает ферроксидазной активностью. [42] [43]
Поскольку АРР не обладает ферроксидазной активностью в своем домене Е2, механизм модулированного АРР оттока железа из ферропортина стал предметом пристального внимания. Одна модель предполагает, что АРР стабилизирует белок оттока железа ферропортин в плазматической мембране клеток, тем самым увеличивая общее количество молекул ферропортина на мембране. Эти переносчики железа затем могут быть активированы известными ферроксидазами млекопитающих (т.е. церулоплазмином или гефестином ). [44]
Гормональная регуляция
[ редактировать ]Белок-предшественник амилоида-β (AβPP) и все связанные с ним секретазы экспрессируются на ранних стадиях развития и играют ключевую роль в эндокринологии репродукции – при этом дифференциальный процессинг AβPP секретазами регулирует эмбриональных стволовых клеток человека (чЭСК). пролиферацию также как их дифференцировка в нейрональные клетки-предшественники (NPC). Гормон беременности хорионический гонадотропин человека (ХГЧ) увеличивает экспрессию AβPP. [45] и пролиферация чЭСК, в то время как прогестерон направляет процессинг AβPP в сторону неамилоидогенного пути, что способствует дифференцировке чЭСК в NPC. [46] [47] [48]
AβPP и продукты его расщепления не способствуют пролиферации и дифференцировке постмитотических нейронов; скорее, сверхэкспрессия либо дикого типа, либо мутантного AβPP в постмитотических нейронах вызывает апоптотическую гибель после их повторного входа в клеточный цикл . [49] Предполагается, что потеря половых стероидов (включая прогестерон), но повышение уровня лютеинизирующего гормона , взрослого эквивалента ХГЧ, в постменопаузе и во время андропаузы стимулирует выработку бета-амилоида. [50] и повторный вход постмитотических нейронов в клеточный цикл.
Взаимодействия
[ редактировать ]Было показано, что белок-предшественник амилоида взаимодействует с:
АРР взаимодействует с рилином , белком, участвующим в ряде заболеваний головного мозга, включая болезнь Альцгеймера. [71]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000142192 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000022892 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Белок-предшественник бета-амилоида» . Проверено 10 января 2021 г.
- ^ Jump up to: а б Приллер С., Бауэр Т., Миттериггер Г., Кребс Б., Кречмар Х.А., Хермс Дж. (июль 2006 г.). «Формирование и функция синапсов модулируются белком-предшественником амилоида» . Журнал неврологии . 26 (27): 7212–21. doi : 10.1523/JNEUROSCI.1450-06.2006 . ПМК 6673945 . ПМИД 16822978 .
- ^ Тернер П.Р., О'Коннор К., Тейт В.П., Авраам В.К. (май 2003 г.). «Роль белка-предшественника амилоида и его фрагментов в регуляции нервной активности, пластичности и памяти». Прогресс нейробиологии . 70 (1): 1–32. дои : 10.1016/S0301-0082(03)00089-3 . ПМИД 12927332 . S2CID 25376584 .
- ^ Мойр Р.Д., Токарный Р., Танци Р.Э. (2018). «Гипотеза антимикробной защиты от болезни Альцгеймера» . Болезнь Альцгеймера и деменция . 14 (12): 1602–1614. дои : 10.1016/j.jalz.2018.06.3040 . ПМИД 30314800 .
- ^ Jump up to: а б Дуче Дж.А., Цацанис А., Катер М.А., Джеймс С.А., Робб Е., Викхе К., Леонг С.Л., Перес К., Йоханссен Т., Гриноф М.А., Чо Х.Х., Галатис Д., Мойр Р.Д., Мастерс CL, Маклин С., Танзи Р.Э., Каппай Р.Д. , Барнэм К.Дж., Чиккотосто Дж.Д., Роджерс Дж.Т., Буш А.И. (сентябрь 2010 г.). «Активность ферроксидазы экспорта железа белка-предшественника β-амилоида ингибируется цинком при болезни Альцгеймера» . Клетка . 142 (6): 857–67. дои : 10.1016/j.cell.2010.08.014 . ПМК 2943017 . ПМИД 20817278 .
- ^ Ван Х., Кулас Дж.А., Ван С., Хольцман Д.М., Феррис Х.А., Хансен С.Б. (17 августа 2021 г.). «Регуляция производства бета-амилоида в нейронах с помощью холестерина, полученного из астроцитов» . Труды Национальной академии наук . 118 (33): e2102191118. Бибкод : 2021PNAS..11802191W . дои : 10.1073/pnas.2102191118 . ПМЦ 8379952 . ПМИД 34385305 .
- ^ Тарп В.Г., Саркар И.Н. (апрель 2013 г.). «Происхождение амилоида-β» . БМК Геномика . 14 (1): 290. дои : 10.1186/1471-2164-14-290 . ПМК 3660159 . ПМИД 23627794 .
- ^ Ёсикай С., Сасаки Х., До-ура К., Фуруя Х., Сакаки Ю. (март 1990 г.). «Геномная организация гена-предшественника бета-амилоидного белка человека». Джин . 87 (2): 257–63. дои : 10.1016/0378-1119(90)90310-Н . ПМИД 2110105 .
- ^ Лэмб Б.Т., Сисодиа С.С., Лоулер А.М., Слант Х.Х., Китт К.А., Кернс В.Г., Пирсон П.Л., Прайс Д.Л., Геархарт Дж.Д. (сентябрь 1993 г.). «Введение и экспрессия гена белка-предшественника амилоида длиной 400 тысяч оснований у трансгенных мышей [исправлено]». Природная генетика . 5 (1): 22–30. дои : 10.1038/ng0993-22 . ПМИД 8220418 . S2CID 42752531 .
- ^ Мацуи Т., Ингельссон М., Фукумото Х., Рамасами К., Кова Х., Фрош М.П., Иризарри М.К., Хайман Б.Т. (август 2007 г.). «Экспрессия мРНК и белков пути APP при болезни Альцгеймера». Исследования мозга . 1161 : 116–23. дои : 10.1016/j.brainres.2007.05.050 . ПМИД 17586478 . S2CID 26901380 .
- ^ Эвальд С.Ю. , Ли С. (1 апреля 2012 г.). «Caenorhabditis elegans как модельный организм для изучения функции АРР» . Экспериментальное исследование мозга . 217 (3–4): 397–411. дои : 10.1007/s00221-011-2905-7 . ISSN 0014-4819 . ПМЦ 3746071 . ПМИД 22038715 .
- ^ Jump up to: а б с д Чжэн Х, Ку Э.Х. (2006). «Белок-предшественник амилоида: за пределами амилоида» . Молекулярная нейродегенерация . 1 (1): 5. дои : 10.1186/1750-1326-1-5 . ПМЦ 1538601 . ПМИД 16930452 .
- ^ Гоут А, Чартье-Харлин MC, Муллан М, Браун Дж, Кроуфорд Ф, Фидани Л, Джуффра Л, Хейнс А, Ирвинг Н, Джеймс Л (февраль 1991 г.). «Сегрегация миссенс-мутации в гене белка-предшественника амилоида при семейной болезни Альцгеймера». Природа . 349 (6311): 704–6. Бибкод : 1991Natur.349..704G . дои : 10.1038/349704a0 . ПМИД 1671712 . S2CID 4336069 .
- ^ Мюррелл Дж., Фарлоу М., Гетти Б., Бенсон, доктор медицинских наук (октябрь 1991 г.). «Мутация белка-предшественника амилоида, связанная с наследственной болезнью Альцгеймера». Наука . 254 (5028): 97–9. Бибкод : 1991Sci...254...97M . дои : 10.1126/science.1925564 . ПМИД 1925564 .
- ^ Чартье-Харлин MC, Кроуфорд Ф, Хоулден Х, Уоррен А, Хьюз Д, Фидани Л, Гоут А, Россор М , Рокес П, Харди Дж (октябрь 1991 г.). «Болезнь Альцгеймера с ранним началом, вызванная мутациями кодона 717 гена белка-предшественника бета-амилоида». Природа . 353 (6347): 844–6. Бибкод : 1991Natur.353..844C . дои : 10.1038/353844a0 . ПМИД 1944558 . S2CID 4345311 .
- ^ Ллойд Г.М., Трехо-Лопес Х.А., Ся Ю., МакФарланд К.Н., Линкольн С.Дж., Эртекин-Танер Н., Гиассон Б.И., Яхнис А.Т., Прокоп С. (12 марта 2020 г.). «Выраженная патология амилоидных бляшек и церебральная амилоидная ангиопатия у носителя APP V717I (Лондон) - фенотипическая изменчивость при аутосомно-доминантной болезни Альцгеймера» . Acta Neuropathologica Communications . 8 (1): 31. дои : 10.1186/s40478-020-0891-3 . ПМК 7068954 . ПМИД 32164763 .
- ^ Цитрон М., Ольтерсдорф Т., Хаас С., МакКонлог Л., Хунг А.Ю., Зойберт П., Виго-Пелфри С., Либербург И., Селькое DJ (декабрь 1992 г.). «Мутация белка-предшественника бета-амилоида при семейной болезни Альцгеймера увеличивает выработку бета-белка». Природа . 360 (6405): 672–4. Бибкод : 1992Natur.360..672C . дои : 10.1038/360672a0 . ПМИД 1465129 . S2CID 4341170 .
- ^ Йонссон Т, Атвал Дж. К., Стейнберг С., Снедал Дж., Йонссон П. В., Бьёрнссон С., Стефанссон Х., Сулем П., Гудбьяртссон Д., Мэлони Дж., Хойт К., Густафсон А., Лю Ю., Лу Ю., Бхангале Т., Грэм Р.Р., Хуттенлохер Дж. , Бьорнсдоттир Г., Андреассен О.А., Йонссон Э.Г., Палоти А., Беренс Т.В., Магнуссон О.Т., Конг А., Торстейнсдоттир Ю., Уоттс Р.Дж., Стефанссон К. (август 2012 г.). «Мутация в APP защищает от болезни Альцгеймера и возрастного снижения когнитивных функций» . Природа . 488 (7409): 96–9. Бибкод : 2012Natur.488...96J . дои : 10.1038/nature11283 . ПМИД 22801501 . S2CID 4333449 .
- ^ Jump up to: а б ПДБ : 1RW6 ; Ван Й, Ха Й (август 2004 г.). «Рентгеновская структура антипараллельного димера домена белка-предшественника амилоида человека E2» . Молекулярная клетка . 15 (3): 343–53. doi : 10.1016/j.molcel.2004.06.037 . ПМИД 15304215 .
- ^ Jump up to: а б Дамс С.О., Хефген С., Розер Д., Шлотт Б., Гюрс К.Х., Тан М.Е. (март 2010 г.). «Структура и биохимический анализ гепарин-индуцированного димера E1 белка-предшественника амилоида» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (12): 5381–6. Бибкод : 2010PNAS..107.5381D . дои : 10.1073/pnas.0911326107 . ПМЦ 2851805 . ПМИД 20212142 . ; см. также идентификатор PDB 3KTM
- ^ Сисодиа С.С., Ку Э.Х., Хоффман П.Н., Перри Г., Прайс Д.Л. (июль 1993 г.). «Идентификация и транспорт полноразмерных белков-предшественников амилоида в периферической нервной системе крыс» . Журнал неврологии . 13 (7): 3136–42. doi : 10.1523/JNEUROSCI.13-07-03136.1993 . ПМК 6576678 . ПМИД 8331390 .
- ^ Россджон Дж., Каппай Р., Фейл С.С., Генри А., МакКинстри В.Дж., Галатис Д., Гессен Л., Мультхауп Г., Бейройтер К., Мастерс К.Л., Паркер М.В. (апрель 1999 г.). «Кристаллическая структура N-концевого фактороподобного домена белка-предшественника амилоида болезни Альцгеймера». Структурная биология природы . 6 (4): 327–31. дои : 10.1038/7562 . ПМИД 10201399 . S2CID 30925432 . ; см. также идентификатор PDB 1MWP.
- ^ Конг Г.К., Адамс Дж.Дж., Харрис Х.Х., Боас Дж.Ф., Curtain CC, Галатис Д., Мастерс CL, Барнхэм К.Дж., МакКинстри В.Дж., Каппай Р., Паркер М.В. (март 2007 г.). «Структурные исследования медьсвязывающего домена белка-предшественника амилоида болезни Альцгеймера показывают, как он связывает ионы меди». Журнал молекулярной биологии . 367 (1): 148–61. дои : 10.1016/j.jmb.2006.12.041 . ПМИД 17239395 . ; См. также идентификаторы PDB 2007 2FJZ , 2FK2 , 2FKL .
- ^ Jump up to: а б Кулатунга, округ Колумбия, Ранараджа У, Ким Э.Ю., Ким РЕ, Ким ДЭ, Джи КБ, Ким МК (27 мая 2024 г.). «Новая маркерная система, зависящая от варианта сплайсинга APP, для точного определения зрелости нейронов, происходящих из клеток SH-SY5Y» . Научные отчеты . 14 (1). дои : 10.1038/s41598-024-63005-y . ПМЦ 11130256 .
- ^ Де Струпер Б., Аннаерт В. (июнь 2000 г.). «Протеолитический процессинг и клеточные биологические функции белка-предшественника амилоида». Журнал клеточной науки . 113 (11): 1857–70. дои : 10.1242/jcs.113.11.1857 . ПМИД 10806097 .
- ^ Чен Ф, Хасегава Х, Шмитт-Ульмс Г, Кавараи Т, Бом С, Катаяма Т, Гу Й, Санджо Н, Глиста М, Рогаева Е, Вакутани Й, Пардосси-Пикард Р, Руан Х, Тандон А, Чеклер Ф, Марамбо П., Хансен К., Вестэуэй Д., Сент-Джордж-Хислоп П., Фрейзер П. (апрель 2006 г.). «TMP21 представляет собой компонент комплекса пресенилина, который модулирует гамма-секретазу, но не активность эпсилон-секретазы». Природа . 440 (7088): 1208–12. дои : 10.1038/nature04667 . ПМИД 16641999 . S2CID 4349251 .
- ^ Эхальт Р., Келлер П., Хаас С., Тиле С., Саймонс К. (январь 2003 г.). «Амилоидогенный процессинг белка-предшественника бета-амилоида болезни Альцгеймера зависит от липидных рафтов» . Журнал клеточной биологии . 160 (1): 113–23. дои : 10.1083/jcb.200207113 . ПМК 2172747 . ПМИД 12515826 .
- ^ Ветривел К.С., Ченг Х., Лин В., Сакурай Т., Ли Т., Нукина Н., Вонг ПК, Сюй Х., Тинакаран Г. (октябрь 2004 г.). «Ассоциация гамма-секретазы с липидными рафтами в пост-Гольджи и эндосомальных мембранах» . Журнал биологической химии . 279 (43): 44945–54. дои : 10.1074/jbc.M407986200 . ПМК 1201506 . ПМИД 15322084 .
- ^ Ридделл Д.Р., Кристи Дж., Хуссейн И., Дингуолл С. (август 2001 г.). «Компартментализация бета-секретазы (Asp2) в некавеолярные липидные рафты низкой плавучести» . Современная биология . 11 (16): 1288–93. Бибкод : 2001CBio...11.1288R . дои : 10.1016/S0960-9822(01)00394-3 . ПМИД 11525745 . S2CID 15502857 .
- ^ Селькое Д., Копан Р. (2003). «Нотч и пресенилин: регулируемый внутримембранный протеолиз связывает развитие и дегенерацию». Ежегодный обзор неврологии . 26 (1): 565–97. дои : 10.1146/annurev.neuro.26.041002.131334 . ПМИД 12730322 .
- ^ Финни А.Л., Калхун М.Е., Вулфер Д.П., Липп Х.П., Чжэн Х., Джакер М. (1999). «Отсутствие потери нейронов гиппокампа или потери синаптических бутонов у пожилых мышей с нарушениями обучения с нулевым белком-предшественником бета-амилоида». Нейронаука . 90 (4): 1207–16. дои : 10.1016/S0306-4522(98)00645-9 . ПМИД 10338291 . S2CID 6001957 .
- ^ Мацуяма С., Тераока Р., Мори Х., Томияма Т. (2007). «Обратная корреляция между белком-предшественником амилоида и синаптической пластичностью у трансгенных мышей». НейроОтчёт . 18 (10): 1083–7. дои : 10.1097/WNR.0b013e3281e72b18 . ПМИД 17558301 . S2CID 34157306 .
- ^ Баргер С.В., ДеВалл К.М., Лю Л., Мрак Р.Э., Гриффин В.С. (август 2008 г.). «Отношения между экспрессией аполипопротеина Е и белком-предшественником бета-амилоида изменяются вблизи бета-амилоидных бляшек болезни Альцгеймера: потенциальные объяснения на основе исследований клеточных культур» . Журнал невропатологии и экспериментальной неврологии . 67 (8): 773–83. дои : 10.1097/NEN.0b013e318180ec47 . ПМЦ 3334532 . ПМИД 18648325 .
- ^ Jump up to: а б Ли М.Х., Сиддоуэй Б., Кэзер Г.Е., Сегота И., Ривера Р., Романов В.Дж., Лю К.С., Парк С., Кеннеди Дж., Лонг Т., Чун Дж. (ноябрь 2018 г.). «Соматическая рекомбинация гена APP при болезни Альцгеймера и нормальных нейронах» . Природа . 563 (7733): 639–645. Бибкод : 2018Natur.563..639L . дои : 10.1038/s41586-018-0718-6 . ПМК 6391999 . ПМИД 30464338 .
- ^ Сатпут-Кришнан П., ДеДжоргис Дж.А., член парламента Конли, Джанг М., Бирер Э.Л. (октябрь 2006 г.). «Почтовый индекс пептида, достаточный для антероградного транспорта внутри белка-предшественника амилоида» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (44): 16532–7. Бибкод : 2006PNAS..10316532S . дои : 10.1073/pnas.0607527103 . ПМК 1621108 . ПМИД 17062754 .
- ^ Симстер П.Е., Левенберг М., Паскаль Дж., Шовьер А., Гонсалес А., Кристини В., Бирер Э.Л. (октябрь 2012 г.). «Количественные измерения и моделирование грузо-моторных взаимодействий при быстром транспорте в живом аксоне» . Физическая биология . 9 (5): 055005. Бибкод : 2012PhBio...9e5005S . дои : 10.1088/1478-3975/9/5/055005 . ПМЦ 3625656 . ПМИД 23011729 .
- ^ Роджерс Дж.Т., Буш А.И., Чо Х.Х., Смит Д.Х., Томсон А.М., Фридлих А.Л., Лахири Д.К., Лидман П.Дж., Хуанг Х., Кэхилл К.М. (декабрь 2008 г.). «Железо и трансляция белка-предшественника амилоида (APP) и мРНК ферритина: риборегуляция против окислительного повреждения нейронов при болезни Альцгеймера» . Труды Биохимического общества . 36 (Часть 6): 1282–7. дои : 10.1042/BST0361282 . ПМК 2746665 . ПМИД 19021541 .
- ^ Эбрахими К.Х., Хагедорн П.Л., Хаген В.Р. (2012). «Синтетический пептид с предполагаемым железосвязывающим мотивом белка-предшественника амилоида (APP) не окисляет железо каталитически» . ПЛОС ОДИН . 7 (8): е40287. Бибкод : 2012PLoSO...740287E . дои : 10.1371/journal.pone.0040287 . ПМК 3419245 . ПМИД 22916096 .
- ^ Хонарманд Эбрахими К., Динеманн С., Хефген С., Тан М.Э., Хагедорн П.Л., Хаген В.Р. (2013). «Белок-предшественник амилоида (APP) не имеет сайта ферроксидазы в своем домене E2» . ПЛОС ОДИН . 8 (8): е72177. Бибкод : 2013PLoSO...872177H . дои : 10.1371/journal.pone.0072177 . ПМЦ 3747053 . ПМИД 23977245 .
- ^ McCarthy RC, Park YH, Kosman DJ (июль 2014 г.). «sAPP модулирует отток железа из эндотелиальных клеток микрососудистых сосудов головного мозга путем стабилизации экспортера двухвалентного железа ферропортина» . Отчеты ЭМБО . 15 (7): 809–15. дои : 10.15252/эмбр.201338064 . ПМК 4196985 . ПМИД 24867889 .
- ^ Порайетт П., Гальего М.Дж., Кальчева М.М., Метал С.В., Этвуд К.С. (декабрь 2007 г.). «Экспрессия и модуляция белка-предшественника бета-амилоида в эмбриональных стволовых клетках человека: новая роль хорионического гонадотропина человека». Связь с биохимическими и биофизическими исследованиями . 364 (3): 522–7. дои : 10.1016/j.bbrc.2007.10.021 . ПМИД 17959150 .
- ^ Порайетт П., Гальего М.Дж., Кальчева М.М., Боуэн Р.Л., Вадаккадат Митал С., Этвуд К.С. (август 2009 г.). «Дифференциальный процессинг белка-предшественника бета-амилоида направляет пролиферацию и дифференцировку эмбриональных стволовых клеток человека в клетки-предшественники нейронов» . Журнал биологической химии . 284 (35): 23806–17. дои : 10.1074/jbc.M109.026328 . ПМК 2749153 . ПМИД 19542221 .
- ^ Гальего М.Дж., Порайетт П., Кальчева М.М., Метал С.В., Этвуд К.С. (июнь 2009 г.). «Передача сигналов опиоидов и прогестерона обязательна для раннего эмбриогенеза человека» . Стволовые клетки и развитие . 18 (5): 737–40. дои : 10.1089/scd.2008.0190 . ПМК 2891507 . ПМИД 18803462 .
- ^ Гальего М.Дж., Порайетт П., Кальчева М.М., Боуэн Р.Л., Вадаккадат Митал С., Этвуд К.С. (2010). «Гормоны беременности хорионический гонадотропин человека и прогестерон индуцируют пролиферацию и дифференцировку эмбриональных стволовых клеток человека в нейроэктодермальные розетки» . Исследования и терапия стволовыми клетками . 1 (4): 28. дои : 10.1186/scrt28 . ПМЦ 2983441 . ПМИД 20836886 .
- ^ Макфи Д.Л., Куперсмит Р., Хайнс-Перальта А., Чен Ю., Айвинс К.Дж., Мэнли С.П., Козловски М.Р., Нив К.А., Нив Р.Л. (июль 2003 г.). «Синтез ДНК и апоптоз нейронов, вызванные семейной болезнью Альцгеймера, мутантами белка-предшественника амилоида, опосредуются активированной р21 киназой PAK3» . Журнал неврологии . 23 (17): 6914–27. doi : 10.1523/JNEUROSCI.23-17-06914.2003 . ПМК 6740729 . ПМИД 12890786 .
- ^ Боуэн Р.Л., Вердил Дж., Лю Т., Парлоу А.Ф., Перри Дж., Смит М.А., Мартинс Р.Н., Этвуд К.С. (май 2004 г.). «Лютеинизирующий гормон, репродуктивный регулятор, который модулирует переработку белка-предшественника бета-амилоида и отложение бета-амилоида» . Журнал биологической химии . 279 (19): 20539–45. дои : 10.1074/jbc.M311993200 . ПМИД 14871891 .
- ^ Jump up to: а б с Бидерер Т., Цао X, Зюдхоф TC, Лю X (сентябрь 2002 г.). «Регуляция APP-зависимых транскрипционных комплексов с помощью Mint/X11s: дифференциальные функции изоформ Mint» . Журнал неврологии . 22 (17): 7340–51. doi : 10.1523/JNEUROSCI.22-17-07340.2002 . ПМК 6757996 . ПМИД 12196555 .
- ^ Jump up to: а б Борг Дж. П., Оой Дж., Леви Э., Марголис Б. (ноябрь 1996 г.). «Домены взаимодействия фосфотирозина X11 и FE65 связываются с разными сайтами мотива YENPTY белка-предшественника амилоида» . Молекулярная и клеточная биология . 16 (11): 6229–41. дои : 10.1128/mcb.16.11.6229 . ПМК 231626 . ПМИД 8887653 .
- ^ Jump up to: а б Араки Ю, Томита С, Ямагути Х, Мияги Н, Сумиока А, Кирино Ю, Сузуки Т (декабрь 2003 г.). «Новые мембранные белки, связанные с кадгерином, алкадины, усиливают опосредованную X11-подобным белком стабилизацию метаболизма предшественников бета-амилоидных белков» . Журнал биологической химии . 278 (49): 49448–58. дои : 10.1074/jbc.M306024200 . ПМИД 12972431 .
- ^ Томита С., Одзаки Т., Тару Х., Огучи С., Такеда С., Яги Ю., Сакияма С., Кирино Ю., Сузуки Т. (январь 1999 г.). «Взаимодействие нейрон-специфического белка, содержащего домены PDZ, с белком-предшественником амилоида болезни Альцгеймера» . Журнал биологической химии . 274 (4): 2243–54. дои : 10.1074/jbc.274.4.2243 . ПМИД 9890987 .
- ^ Танахаши Х., Табира Т. (февраль 1999 г.). «X11L2, новый член семейства белков X11, взаимодействует с белком-предшественником бета-амилоида болезни Альцгеймера». Связь с биохимическими и биофизическими исследованиями . 255 (3): 663–7. дои : 10.1006/bbrc.1999.0265 . ПМИД 10049767 .
- ^ Самбрано Н., Буксбаум Дж.Д., Минополи Дж., Фиоре Ф., Де Кандиа П., Де Ренцис С., Фараонио Р., Сабо С., Читам Дж., Судол М., Руссо Т. (март 1997 г.). «Взаимодействие доменов Fe65, связанных со взаимодействием фосфотирозина/связыванием фосфотирозина, с белками-предшественниками бета-амилоида дикого типа и мутантной болезни Альцгеймера» . Журнал биологической химии . 272 (10): 6399–405. дои : 10.1074/jbc.272.10.6399 . ПМИД 9045663 .
- ^ Генетт С.Ю., Чен Дж., Хондро П.Д., Танзи Р.Э. (октябрь 1996 г.). «Ассоциация нового человеческого FE65-подобного белка с цитоплазматическим доменом белка-предшественника бета-амилоида» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (20): 10832–7. Бибкод : 1996PNAS...9310832G . дои : 10.1073/pnas.93.20.10832 . ПМЦ 38241 . ПМИД 8855266 .
- ^ Танахаши Х., Табира Т. (февраль 1999 г.). «Молекулярное клонирование человеческого Fe65L2 и его взаимодействие с белком-предшественником бета-амилоида болезни Альцгеймера». Письма по неврологии . 261 (3): 143–6. дои : 10.1016/S0304-3940(98)00995-1 . ПМИД 10081969 . S2CID 54307954 .
- ^ Троммсдорф М., Борг Дж.П., Марголис Б., Герц Дж. (декабрь 1998 г.). «Взаимодействие цитозольных адаптерных белков с нейрональными рецепторами аполипопротеина Е и белком-предшественником амилоида» . Журнал биологической химии . 273 (50): 33556–60. дои : 10.1074/jbc.273.50.33556 . ПМИД 9837937 .
- ^ Чоу Н., Коренберг-младший, Чен С.Н., Нив Р.Л. (май 1996 г.). «APP-BP1, новый белок, который связывается с карбоксильной областью белка-предшественника амилоида» . Журнал биологической химии . 271 (19): 11339–46. дои : 10.1074/jbc.271.19.11339 . ПМИД 8626687 .
- ^ Чжэн П., Истман Дж., Ванде Пол С., Пимпликар С.В. (декабрь 1998 г.). «PAT1, белок, взаимодействующий с микротрубочками, распознает сигнал базолатеральной сортировки белка-предшественника амилоида» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (25): 14745–50. Бибкод : 1998PNAS...9514745Z . дои : 10.1073/pnas.95.25.14745 . ПМК 24520 . ПМИД 9843960 .
- ^ Ван Б., Нгуен М., Брекенридж Д.Г., Стоянович М., Клемонс П.А., Куппиг С., Шор GC (апрель 2003 г.). «Нерасщепленный BAP31 в сочетании с белком А4 в эндоплазматическом ретикулуме является ингибитором Fas-инициируемого высвобождения цитохрома с из митохондрий» . Журнал биологической химии . 278 (16): 14461–8. дои : 10.1074/jbc.M209684200 . ПМИД 12529377 .
- ^ Лефтеров И.М., Колдамова Р.П., Лазо Ю.С. (сентябрь 2000 г.). «Человеческая блеомицингидролаза регулирует секрецию белка-предшественника амилоида» . Журнал ФАСЭБ . 14 (12): 1837–47. дои : 10.1096/fj.99-0938com . ПМИД 10973933 . S2CID 44302063 .
- ^ Араки Ю, Мияги Н, Като Н, Ёсида Т, Вада С, Нисимура М, Комано Х, Ямамото Т, Де Струпер Б, Ямамото К, Сузуки Т (июнь 2004 г.). «Скоординированный метаболизм алкадеина и предшественника бета-амилоидного белка регулирует FE65-зависимую трансактивацию генов» . Журнал биологической химии . 279 (23): 24343–54. дои : 10.1074/jbc.M401925200 . ПМИД 15037614 .
- ^ Икезу Т., Трапп Б.Д., Сонг К.С., Шлегель А., Лисанти М.П., Окамото Т. (апрель 1998 г.). «Кавеолы, микродомены плазматической мембраны для опосредованной альфа-секретазой обработки белка-предшественника амилоида» . Журнал биологической химии . 273 (17): 10485–95. дои : 10.1074/jbc.273.17.10485 . ПМИД 9553108 .
- ^ Хашимото Т., Вакабаяши Т., Ватанабэ А., Кова Х., Хосода Р., Накамура А., Канадзава И., Араи Т., Такио К., Манн Д.М., Ивацубо Т. (апрель 2002 г.). «CLAC: новый компонент амилоидных бляшек болезни Альцгеймера, полученный из трансмембранного предшественника CLAC-P/коллагена типа XXV» . Журнал ЭМБО . 21 (7): 1524–34. дои : 10.1093/emboj/21.7.1524 . ПМЦ 125364 . ПМИД 11927537 .
- ^ Осава И., Такамура С., Косака С. (март 2001 г.). «Фибулин-1 связывает аминоконцевую головку белка-предшественника бета-амилоида и модулирует его физиологическую функцию» . Журнал нейрохимии . 76 (5): 1411–20. дои : 10.1046/j.1471-4159.2001.00144.x . ПМИД 11238726 . S2CID 83321033 .
- ^ Чаухан В.П., Рэй И., Чаухан А., Вишневский Х.М. (май 1999 г.). «Связывание гельзолина, секреторного белка, с бета-амилоидным белком». Связь с биохимическими и биофизическими исследованиями . 258 (2): 241–6. дои : 10.1006/bbrc.1999.0623 . ПМИД 10329371 .
- ^ Ян С.Д., Фу Дж., Сото С., Чен Х., Чжу Х., Аль-Моханна Ф., Коллисон К., Чжу А., Стерн Э., Сайдо Т., Тохьяма М., Огава С., Рохер А., Стерн Д. (октябрь 1997 г.). «Внутриклеточный белок, который связывает пептид бета-амилоида и опосредует нейротоксичность при болезни Альцгеймера». Природа . 389 (6652): 689–95. Бибкод : 1997Natur.389..689D . дои : 10.1038/39522 . ПМИД 9338779 . S2CID 4343238 .
- ^ Тарр П.Е., Ронкарати Р., Пеличчи Дж., Пеличчи П.Г., Д'Адамио Л. (май 2002 г.). «Фосфорилирование тирозина цитоплазматического хвоста белка-предшественника бета-амилоида способствует взаимодействию с Shc» . Журнал биологической химии . 277 (19): 16798–804. дои : 10.1074/jbc.M110286200 . ПМИД 11877420 .
- ^ Хо Х.С., Ли К.Дж., Карни Р.С., Ли Дж., Маркова А., Ли Дж.Ю., Хауэлл Б.В., Хайман Б.Т., Пак Д.Т., Бу Дж., Ребек Г.В. (июнь 2009 г.). «Взаимодействие рилина с белком-предшественником амилоида способствует росту нейритов» . Журнал неврологии . 29 (23): 7459–73. doi : 10.1523/JNEUROSCI.4872-08.2009 . ПМЦ 2759694 . ПМИД 19515914 .
Дальнейшее чтение
[ редактировать ]- Бейройтер К., Поллвайн П., Мультауп Г., Меннинг У., Кениг Г., Диркс Т., Шуберт В., Мастерс CL (сентябрь 1993 г.). «Регуляция и экспрессия предшественника амилоидного белка бета / А4 болезни Альцгеймера в здоровье, болезнях и синдроме Дауна». Анналы Нью-Йоркской академии наук . 695 (1 Трансдукция): 91–102. дои : 10.1111/j.1749-6632.1993.tb23035.x . ПМИД 8239320 . S2CID 22058428 .
- Штрауб Дж. Э., Гевара Дж., Хо С., Ли Дж. П. (июнь 2002 г.). «Длительное динамическое моделирование: исследование путей сворачивания амилоидного абета-пептида болезни Альцгеймера». Отчеты о химических исследованиях . 35 (6): 473–81. дои : 10.1021/ar010031e . ПМИД 12069633 .
- Аннаерт В., Де Струпер Б. (2003). «Клеточный биологический взгляд на болезнь Альцгеймера». Ежегодный обзор клеточной биологии и биологии развития . 18 (1): 25–51. doi : 10.1146/annurev.cellbio.18.020402.142302 . ПМИД 12142279 .
- Ку Э.Х. (ноябрь 2002 г.). «Белок-предшественник бета-амилоида (APP) и болезнь Альцгеймера: хвост виляет собакой?» . Трафик . 3 (11): 763–70. дои : 10.1034/j.1600-0854.2002.31101.x . ПМИД 12383342 . S2CID 40411806 .
- Ван Ностранд В.Е., Мельчор Дж.П., Романов Г., Зейглер К., Дэвис Дж. (ноябрь 2002 г.). «Патогенные эффекты мутаций церебральной амилоидной ангиопатии в предшественнике бета-амилоидного белка». Анналы Нью-Йоркской академии наук . 977 (1): 258–65. Бибкод : 2002NYASA.977..258N . дои : 10.1111/j.1749-6632.2002.tb04824.x . ПМИД 12480759 . S2CID 22567664 .
- Линг Ю., Морган К., Калшекер Н. (ноябрь 2003 г.). «Белок-предшественник амилоида (APP) и биология протеолитического процессинга: значение для болезни Альцгеймера». Международный журнал биохимии и клеточной биологии . 35 (11): 1505–35. дои : 10.1016/S1357-2725(03)00133-X . ПМИД 12824062 .
- Керр М.Л., Small DH (апрель 2005 г.). «Цитоплазматический домен бета-амилоидного белка-предшественника болезни Альцгеймера: функция, регуляция протеолиза и значение для разработки лекарств». Журнал нейробиологических исследований . 80 (2): 151–9. дои : 10.1002/мл.20408 . ПМИД 15672415 . S2CID 31985212 .
- Мейнард CJ, Буш AI, Мастерс CL, Каппай Р., Ли QX (июнь 2005 г.). «Металлы и бета-амилоид при болезни Альцгеймера» . Международный журнал экспериментальной патологии . 86 (3): 147–59. дои : 10.1111/j.0959-9673.2005.00434.x . ПМК 2517409 . ПМИД 15910549 .
- Тиклер А.К., Уэйд Дж.Д., Сепарович Ф. (август 2005 г.). «Роль пептидов Абета в болезни Альцгеймера». Буквы о белках и пептидах . 12 (6): 513–9. дои : 10.2174/0929866054395905 . ПМИД 16101387 .
- Рейнхард С., Эберт СС, Де Струпер Б (декабрь 2005 г.). «Белок-предшественник бета-амилоида: интегрирующая структура с биологической функцией» . Журнал ЭМБО . 24 (23): 3996–4006. дои : 10.1038/sj.emboj.7600860 . ПМЦ 1356301 . ПМИД 16252002 .
- Уотсон Д., Кастаньо Э., Кокджон Т.А., Куо Ю.М., Любченко Ю., Пински Д., Коннолли Э.С. , Эш С., Люэрс Д.С., Стайн В.Б., Роуз Л.М., Эммерлинг М.Р., Роэр А.Е. (декабрь 2005 г.). «Физико-химические характеристики растворимого олигомерного бета-бета и их патологическая роль при болезни Альцгеймера». Неврологические исследования . 27 (8): 869–81. дои : 10.1179/016164105X49436 . hdl : 11336/43663 . ПМИД 16354549 . S2CID 25687818 .
- Калинисан В., Гравем Д., Чен Р.П., Бриттин С., Мохандас Н., Лекомт М.С., Гаскар П. (2006). «Новое понимание потенциальных функций суперсемейства белков 4.1 в эпителии почек» . Границы бионауки . 11 (1): 1646–66. дои : 2741.10.1911 . PMID 16368544 . S2CID 26325962 .
- Ветривел К.С., Тинакаран Г. (январь 2006 г.). «Амилоидогенный процессинг белка-предшественника бета-амилоида во внутриклеточных компартментах». Неврология . 66 (2 Приложение 1): S69–73. дои : 10.1212/01.wnl.0000192107.17175.39 . ПМИД 16432149 . S2CID 35965729 .
- Галло С., Орлассино Р., Винейс С. (февраль 2006 г.). «[Рецидивирующие внутрипаренхимальные кровоизлияния у больного церебральной амилоидотической ангиопатией: описание одного случая аутопсии]». Патологика . 98 (1): 44–7. ПМИД 16789686 .
- Коулсон Э.Дж. (август 2006 г.). «Опосредует ли рецептор нейротрофина p75 токсичность, вызванную Абетой, при болезни Альцгеймера?» . Журнал нейрохимии . 98 (3): 654–60. дои : 10.1111/j.1471-4159.2006.03905.x . ПМИД 16893414 . S2CID 20879380 .
- Менендес-Гонсалес М., Перес-Пинера П., Мартинес-Ривера М., Калатаюд М.Т., Бласкес Менес Б. (2006). «Обработка APP и участие домена APP-KPI в амилоидном каскаде». Нейродегенеративные заболевания . 2 (6): 277–83. дои : 10.1159/000092315 . ПМИД 16909010 . S2CID 45002038 .
- Нив Р.Л., Макфи Д.Л. (апрель 2007 г.). «Дисфункция передачи сигналов белка-предшественника амилоида в нейронах приводит к синтезу ДНК и апоптозу» . Biochimica et Biophysica Acta (BBA) - Молекулярные основы болезней . 1772 (4): 430–7. дои : 10.1016/j.bbadis.2006.10.008 . ПМЦ 1862818 . ПМИД 17113271 .
- Чен X, Стерн Д., Ян С.Д. (декабрь 2006 г.). «Митохондриальная дисфункция и болезнь Альцгеймера». Текущие исследования болезни Альцгеймера . 3 (5): 515–20. дои : 10.2174/156720506779025215 . ПМИД 17168650 .
- Кальтагароне Дж., Цзин З., Баузер Р. (апрель 2007 г.). «Фокальные спайки регулируют передачу сигналов бета-клеток и гибель клеток при болезни Альцгеймера» . Biochimica et Biophysica Acta (BBA) - Молекулярные основы болезней . 1772 (4): 438–45. дои : 10.1016/j.bbadis.2006.11.007 . ПМК 1876750 . ПМИД 17215111 .
- Вулф М.С. (февраль 2007 г.). «Когда потеря становится приобретением: снижение протеолитической функции пресенилина приводит к увеличению Abeta42/Abeta40. Тема для разговора о роли мутаций пресенилина в болезни Альцгеймера» . Отчеты ЭМБО . 8 (2): 136–40. дои : 10.1038/sj.embor.7400896 . ПМК 1796780 . ПМИД 17268504 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW о семейной болезни Альцгеймера с ранним началом
- Амилоид + белок + предшественник Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Ген Entrez: белок-предшественник бета-амилоида APP (A4) (пептидаза нексин-II, болезнь Альцгеймера)
- человека Местоположение генома APP и страница сведений о гене APP в браузере генома UCSC .