Пресенилин
| Пресенилин | |||
|---|---|---|---|
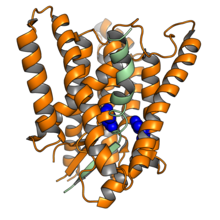 Криоэлектронная микроскопия: структура человеческого пресенилина-1 (оранжевый) в комплексе с фрагментом одного из его белковых субстратов Notch (зеленый). Два каталитических центра показаны синим цветом. Визуализация из PDB : 6IDF . [1] | |||
| Идентификаторы | |||
| Символ | Пресенилин | ||
| Пфам | PF01080 | ||
| Пфам Клан | CL0130 | ||
| ИнтерПро | IPR001108 | ||
| МЕРОПС | А22 | ||
| TCDB | 1.А.54 | ||
| Суперсемейство OPM | 244 | ||
| белок OPM | 4hyg | ||
| |||
| пресенилин 1 (болезнь Альцгеймера 3) | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | СОБАКА1 | ||
| Альт. символы | AD3 | ||
| ген NCBI | 5663 | ||
| HGNC | 9508 | ||
| МОЙ БОГ | 104311 | ||
| RefSeq | НМ_000021 | ||
| ЮниПрот | P49768 | ||
| Другие данные | |||
| Номер ЕС | 3.4.23.- | ||
| Локус | Хр. 14 q24.3 | ||
| |||
| пресенилин 2 (болезнь Альцгеймера 4) | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | PSEN2 | ||
| Альт. символы | AD4 | ||
| ген NCBI | 5664 | ||
| HGNC | 9509 | ||
| МОЙ БОГ | 600759 | ||
| RefSeq | НМ_000447 | ||
| ЮниПрот | P49810 | ||
| Другие данные | |||
| Номер ЕС | 3.4.23.- | ||
| Локус | Хр. 1 q31-q42 | ||
| |||
Пресенилины представляют собой семейство родственных многопроходных трансмембранных белков , которые составляют каталитические субъединицы внутримембранной гамма-секретазы протеазы белкового комплекса . при скрининге мутаций, вызывающих ранние формы семейной болезни Альцгеймера Впервые они были идентифицированы Питером Сент-Джорджем-Хислопом . [2] пресенилина У позвоночных есть два гена , называемые PSEN1 (расположенный на хромосоме 14 у человека), который кодирует пресенилин 1 (PS-1), и PSEN2 (на хромосоме 1 у человека), который кодирует пресенилин 2 (PS-2). [3] Оба гена демонстрируют консервативность между видами, с небольшой разницей между пресенилинами крысы и человека. Нематодный червь C. elegans имеет два гена, которые напоминают пресенилины и, по-видимому, функционально схожи: sel-12 и hop-1 . [4]
Пресенилины подвергаются расщеплению в альфа-спиральной области одной из цитоплазматических петель с образованием большого N-концевого и меньшего С-концевого фрагмента, которые вместе образуют часть функционального белка. [5] Расщепление пресенилина 1 можно предотвратить с помощью мутации , которая вызывает потерю экзона 9 и приводит к потере функции. Пресенилины играют ключевую роль в модуляции внутриклеточного кальция. 2+ участвует в пресинаптическом высвобождении нейротрансмиттеров и индукции долгосрочной потенциации . [6]
Структура
[ редактировать ]Пресенилины — трансмембранные белки с девятью альфа-спиралями . Структуры собранного гамма-секретазы комплекса были определены с помощью криоэлектронной микроскопии , что продемонстрировало значительную конформационную гибкость в структуре пресенилиновой субъединицы комплекса в ответ на связывание лиганда или ингибитора. [7] [1] Пресенилины подвергаются автокаталитическому протеолитическому процессингу после экспрессии, расщепляя область цитоплазматической петли между шестой и седьмой спиралями с образованием большого N-концевого и меньшего C-концевого фрагмента. Два фрагмента остаются в контакте друг с другом в зрелом белке. Два остатка каталитического аспартатного активного центра, необходимые для активности аспартилпротеазы, расположены в шестой и седьмой спиралях. [8]
Структура и топология мембран пресенилинов изначально были спорными, когда они были впервые обнаружены. Было предсказано, что ген PSEN1 будет содержать десять трансмембранных доменов; модели согласились с ожидаемой топологией N-концевого фрагмента, но структура C-концевого фрагмента была спорной. Исследование 2006 года предложило девятипроходную трансмембранную топологию с расщеплением и сборкой в комплекс гамма-секретазы перед внедрением в плазматическую мембрану . [9] Исследования ЯМР раствора С-концевого фрагмента показали, что три спирали могут пересекать мембрану. [5] [10] в то время как рентгеновская кристаллография изучает архейного гомолога, [11] а также криоэлектронная микроскопия комплекса гамма-секретазы человека выявила девять трансмембранных спиралей. [7] [1]
Функция
[ редактировать ]Каталитический
[ редактировать ]Пресенилины являются каталитическим компонентом гамма-секретазы внутримембранной протеазы , четырехчленного белкового комплекса, состоящего из пресенилина, никастрина , APH-1 и PEN-2 . Он имеет очень широкий спектр субстратов для своей протеолитической активности . Его субстратами являются гидрофобные однопроходные трансмембранные спирали с относительно небольшими внеклеточными участками. [12] [13] Эти субстраты возникают в результате отторжения эктодоменов . [13] более 100 различных интегральных мембранных белков . Гамма-секретазой обрабатывается [8] Наиболее изученными субстратами гамма-секретазы являются рецептор Notch и белок-предшественник амилоида (APP). [7] [13] Роль пресенилинов в сигнальном пути Notch важна для развития; [14] мыши, у которых нокаутирован ген PS1, умирают на ранних стадиях развития от аномалий развития, аналогичных тем, которые обнаруживаются при нарушении вырезки. [15] У условно нокаутных мышей , у которых пресенилин инактивируется только после раннего развития, есть доказательства того, что пресенилины в своей роли компонентов гамма-секретазы важны для выживания нейронов во время старения. [14]
Существуют тонкие и видоспецифичные различия в роли пресенилина-1 и пресенилина-2 в собранных комплексах гамма-секретазы, при этом многие исследования предполагают основную роль пресенилина-1. [13] У человека два пресенилина различаются субклеточной локализацией , а также могут быть клеточными и тканеспецифичными . [8]
Некаталитический
[ редактировать ]Пресенилины также играют дополнительную некаталитическую роль в других клеточных сигнальных процессах, включая гомеостаз кальция , лизосомальное закисление, аутофагию и транспортировку белков . [16] [17] [18] Роль белков в гомеостазе кальция в нейронах представляет собой предмет интереса. [19] Генетическая инактивация пресенилинов в синапсах гиппокампа показала, что это избирательно влияет на долговременную потенциацию, вызванную тета- активацией, причем инактивация в пресинапсе, но не в постсинапсе, нарушает кратковременную пластичность и синаптическое облегчение. [6] Высвобождение глутамата также снижается в пресинаптических окончаниях за счет процессов, включающих модуляцию внутриклеточного кальция. 2+ выпускать. [6] Было высказано предположение, что это «представляет собой общий конвергентный механизм, ведущий к нейродегенерации». [6]
Гомологи были идентифицированы и охарактеризованы у различных эукариотических организмов, включая модельные организмы Drosophila melanogaster и Caenorhabditis elegans , такие растения, как Arabidopsis thaliana и Physcomitrella patens , а также слизевиков Dictyostelium discoideum . [17] [18] Считается, что в этих функциях пресенилины играют роль каркасных белков , что, вероятно, является наследственной ролью семейства белков. [18]
Выражение и распространение
[ редактировать ]Оба пресенилина человека широко экспрессируются в мозге . Эти два белка различаются по субклеточной локализации : PS1 экспрессируется более широко и присутствует на клеточной мембране , тогда как PS2 присутствует главным образом в поздних эндосомах и лизосомах . [8] [20]
Связь с болезнью Альцгеймера
[ редактировать ]Большинство случаев болезни Альцгеймера не являются наследственными. Однако существует небольшая группа случаев, которые начинаются в более раннем возрасте и имеют сильный генетический элемент. У пациентов с болезнью Альцгеймера ( аутосомно-доминантное пресенилина мутации в белках (PSEN1; PSEN2) или белке-предшественнике амилоида наследственное заболевание) могут обнаруживаться (APP). В большинстве этих случаев наблюдаются мутантные гены пресенилина. Важной частью патологического процесса при болезни Альцгеймера является накопление белка бета-амилоида (Aβ). Чтобы образовать Aβ, APP должен расщепляться двумя ферментами : бета-секретазой и гамма-секретазой . Пресенилин является субкомпонентом гамма-секретазы, который отвечает за расщепление АРР.
Гамма-секретаза может разрезать APP в нескольких точках небольшого участка белка, в результате чего образуется Aβ различной длины. Длина, связанная с болезнью Альцгеймера, составляет 40 и 42 аминокислоты. Aβ 42 с большей вероятностью агрегирует с образованием бляшек в головном мозге, чем Aβ 40. Мутации пресенилина приводят к увеличению соотношения продуцируемого Aβ 42 по сравнению с Aβ 40, хотя общее количество продуцируемого Aβ остается постоянным. [21] Это может произойти в результате различных эффектов мутаций на гамма-секретазу. [22]
Открытие
[ редактировать ]Гены пресенилинов были открыты в 1995 году в ходе исследований сцепления с использованием мутаций , присутствующих в случаях семейной болезни Альцгеймера . [2] Примерно в то же время гомолог пресенилина у Caenorhabditis elegans , sel-12 , был независимо идентифицирован как участник передачи сигналов Notch . [23] Хотя функция белковых продуктов этих генов не была сразу очевидна, в ходе последующих работ стало ясно, что мутации связаны с более высоким содержанием Aβ 42 по сравнению с менее амилоидогенным Aβ40. Роль пресенилинов как каталитического компонента белкового комплекса гамма-секретазы была установлена к началу 2000-х годов. [24] [25]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Ян Г, Чжоу Р, Чжоу Q, Го X, Ян С, Кэ М и др. (январь 2019 г.). «Структурные основы распознавания Notch человеческой γ-секретазой». Природа . 565 (7738): 192–197. дои : 10.1038/s41586-018-0813-8 . ПМИД 30598546 . S2CID 57189683 .
- ^ Перейти обратно: а б Шеррингтон Р., Рогаев Е.И., Лян Ю., Рогаева Е.А., Левеск Г., Икеда М. и др. (июнь 1995 г.). «Клонирование гена, несущего миссенс-мутации при ранней семейной болезни Альцгеймера». Природа . 375 (6534): 754–60. Бибкод : 1995Natur.375..754S . дои : 10.1038/375754a0 . ПМИД 7596406 . S2CID 4308372 .
- ^ Леви-Лахад Э., Васко В., Пуркадж П., Романо Д.М., Осима Дж., Петтингелл В.Х. и др. (август 1995 г.). «Ген-кандидат на хромосому 1 семейного локуса болезни Альцгеймера». Наука . 269 (5226): 973–7. Бибкод : 1995Sci...269..973L . дои : 10.1126/science.7638622 . ПМИД 7638622 . S2CID 27296868 .
- ^ Смеловская А., Баумайстер Р. (2006). «Функция пресенилина у Caenorhabditis elegans». Нейродегенеративные заболевания . 3 (4–5): 227–32. дои : 10.1159/000095260 . ПМИД 17047361 . S2CID 9695127 .
- ^ Перейти обратно: а б Собханифар С., Шнайдер Б., Лёр Ф., Готтштейн Д., Икея Т., Млинарчик К. и др. (май 2010 г.). «Структурное исследование С-концевого каталитического фрагмента пресенилина 1» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (21): 9644–9. Бибкод : 2010PNAS..107.9644S . дои : 10.1073/pnas.1000778107 . ПМЦ 2906861 . ПМИД 20445084 .
- ^ Перейти обратно: а б с д Чжан С., Ву Б., Беглопулос В., Уайнс-Самуэльсон М., Чжан Д., Драгацис И. и др. (июль 2009 г.). «Пресенилины необходимы для регуляции высвобождения нейротрансмиттеров» . Природа . 460 (7255): 632–6. Бибкод : 2009Natur.460..632Z . дои : 10.1038/nature08177 . ПМЦ 2744588 . ПМИД 19641596 .
- ^ Перейти обратно: а б с Бай XC, Раджендра Э, Ян Г, Ши Ю, Шерес Ш. (декабрь 2015 г.). «Отбор проб конформационного пространства каталитической субъединицы γ-секретазы человека» . электронная жизнь . 4 : е11182. дои : 10.7554/eLife.11182 . ПМЦ 4718806 . ПМИД 26623517 .
- ^ Перейти обратно: а б с д Гюнер Г, Лихтенталер СФ (сентябрь 2020 г.). «Субстратный репертуар γ-секретазы/пресенилина» . Семинары по клеточной биологии и биологии развития . 105 : 27–42. дои : 10.1016/j.semcdb.2020.05.019 . ПМИД 32616437 .
- ^ Спасич Д., Толия А., Диллен К., Баерт В., Де Струпер Б., Вриенс С., Аннаерт В. (сентябрь 2006 г.). «Пресенилин-1 поддерживает девятитрансмембранную топологию на протяжении всего секреторного пути» . Журнал биологической химии . 281 (36): 26569–77. дои : 10.1074/jbc.M600592200 . ПМИД 16846981 .
- ^ ВВП : 2KR6 ; Дётч В. (2010). «Структура раствора субъединицы CTF пресенилина-1». Всемирный банк данных по белкам . дои : 10.2210/pdb2kr6/pdb .
- ^ Ли Х, Данг С., Ян С., Гонг Икс, Ван Дж., Ши Ю. (январь 2013 г.). «Структура внутримембранной аспартатпротеазы семейства пресенилинов». Природа . 493 (7430): 56–61. Бибкод : 2013Natur.493...56L . дои : 10.1038/nature11801 . ПМИД 23254940 . S2CID 4429356 .
- ^ Струл Г., Адачи А. (сентябрь 2000 г.). «Требования к пресенилин-зависимому расщеплению notch и других трансмембранных белков» . Молекулярная клетка . 6 (3): 625–36. дои : 10.1016/S1097-2765(00)00061-7 . ПМИД 11030342 .
- ^ Перейти обратно: а б с д Станга С., Вранкс С., Тасио Б., Маринангели С., Карлстрем Х., Кинлен-Кампард П. (февраль 2018 г.). «Специфичность пресенилин-1- и пресенилин-2-зависимых γ-секретаз к обработке субстрата» . Журнал клеточной и молекулярной медицины . 22 (2): 823–833. дои : 10.1111/jcmm.13364 . ПМЦ 5783875 . ПМИД 28994238 .
- ^ Перейти обратно: а б Шен Дж (2 октября 2013 г.). «Функция и дисфункция пресенилина» . Нейродегенеративные заболевания . 13 (2–3): 61–3. дои : 10.1159/000354971 . ПМК 4000081 . ПМИД 24107444 .
- ^ Шен Дж., Бронсон Р.Т., Чен Д.Ф., Ся В., Селкое Д.Д., Тонегава С. (май 1997 г.). «Дефекты скелета и ЦНС у мышей с дефицитом пресенилина-1» . Клетка . 89 (4): 629–39. дои : 10.1016/S0092-8674(00)80244-5 . ПМИД 9160754 . S2CID 8252011 .
- ^ Перич А., Аннаерт В. (март 2015 г.). «Ранняя этиология болезни Альцгеймера: склонение чаши весов в сторону аутофагии или эндосомальной дисфункции?» . Акта Нейропатологика . 129 (3): 363–81. дои : 10.1007/s00401-014-1379-7 . ПМК 4331606 . ПМИД 25556159 .
- ^ Перейти обратно: а б Дагган СП, СП Маккарти (январь 2016 г.). «Помимо активности γ-секретазы: многофункциональная природа пресенилинов в клеточных сигнальных путях». Сотовая сигнализация . 28 (1): 1–11. дои : 10.1016/j.cellsig.2015.10.006 . ПМИД 26498858 .
- ^ Перейти обратно: а б с Отто ГП, Шарма Д., Уильямс Р.С. (апрель 2016 г.). «Некаталитическая роль пресенилина на протяжении всей эволюции» . Журнал болезни Альцгеймера . 52 (4): 1177–87. дои : 10.3233/JAD-150940 . ПМЦ 4927835 . ПМИД 27079701 .
- ^ Хонарнежад К., Хермс Дж. (ноябрь 2012 г.). «Пресенилины: роль в гомеостазе кальция». Международный журнал биохимии и клеточной биологии . 44 (11): 1983–6. doi : 10.1016/j.biocel.2012.07.019 . ПМИД 22842534 .
- ^ Барте Дж., Мулле К. (ноябрь 2020 г.). «Пресинаптическая недостаточность при болезни Альцгеймера» (PDF) . Прогресс нейробиологии . 194 : 101801. doi : 10.1016/j.pneurobio.2020.101801 . ПМИД 32428558 . S2CID 218655934 .
- ^ Цитрон М., Вестэуэй Д., Ся В., Карлсон Г., Диль Т., Левеск Г. и др. (январь 1997 г.). «Мутантные пресенилины болезни Альцгеймера увеличивают выработку бета-амилоидного белка из 42 остатков как в трансфицированных клетках, так и в трансгенных мышах». Природная медицина . 3 (1): 67–72. дои : 10.1038/nm0197-67 . ПМИД 8986743 . S2CID 10834438 .
- ^ Бентахир М., Ньяби О., Верхамм Дж., Толия А., Хорре К., Вилтфанг Дж. и др. (февраль 2006 г.). «Клинические мутации пресенилина могут влиять на активность гамма-секретазы по разным механизмам» . Журнал нейрохимии . 96 (3): 732–42. дои : 10.1111/j.1471-4159.2005.03578.x . ПМИД 16405513 .
- ^ Левитан Д., Гринвальд I (сентябрь 1995 г.). «Облегчение передачи сигналов, опосредованной lin-12, с помощью sel-12, гена Caenorhabditis elegans S182 болезни Альцгеймера». Природа . 377 (6547): 351–4. Бибкод : 1995Natur.377..351L . дои : 10.1038/377351a0 . ПМИД 7566091 . S2CID 4314257 .
- ^ Де Струпер Б., Ивацубо Т., Вулф М.С. (январь 2012 г.). «Пресенилины и γ-секретаза: структура, функции и роль при болезни Альцгеймера» . Перспективы Колд-Спринг-Харбора в медицине . 2 (1): а006304. doi : 10.1101/cshperspect.a006304 . ПМК 3253024 . ПМИД 22315713 .
- ^ Вулф М.С. (февраль 2007 г.). «Когда потеря становится приобретением: снижение протеолитической функции пресенилина приводит к увеличению Abeta42/Abeta40. Тема для разговора о роли мутаций пресенилина в болезни Альцгеймера» . Отчеты ЭМБО . 8 (2): 136–40. дои : 10.1038/sj.embor.7400896 . ПМЦ 1796780 . ПМИД 17268504 .
Внешние ссылки
[ редактировать ]- Онлайн-база данных MEROPS 15 февраля 2006 по пептидазам и их ингибиторам: Presenilin 1 A22.001. Архивировано г. в Wayback Machine , Presenilin 2 A22.002. [ постоянная мертвая ссылка ]
- Сеть доминантно наследуемой болезни Альцгеймера (DIAN)
- Расширенный реестр сети доминантно наследуемой болезни Альцгеймера (DIAN)
- Пресенилины Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)